免疫亲和柱结合液相色谱串联质谱法测定蜂花粉中黄曲霉毒素*
郭伟华,李熠
(中国农业科学院蜜蜂研究所农业部蜂产品质量安全风险评估实验室,北京,100093)
蜂花粉是蜜蜂从植物花蕊中精心挑选的食物,并作为其生存和生产蜂王浆的重要蛋白来源。它富含蛋白质、碳水化合物、矿物质、维生素和其他活性物质,既是极好的天然营养食品,同时也是一种理想的滋补品,并具有一定的医疗作用[1]。然而,蜂花粉在采集、储存和销售过程中的不适当操作(如未充分干燥)则很容易滋生霉菌而有可能产生其有毒代谢物,如黄曲霉毒素(Aflatoxins,AFs)。AFs是由真菌类如黄曲霉菌(Aspergillusflavus)、寄生曲霉菌(Aspergillusparasiticus)产生的一类有毒的次级代谢产物,主要包括AFB1、AFB2、AFG1和AFG2,其中AFB1的毒性最大。AFs被认为是食品和饲料的最危险污染物之一[3],并且可通过食品或饲料进入人和动物体内造成危害,如肝肾毒性、中枢神经系统异常、雌激素异样反应,甚至可造成人与动物急性中毒死亡[2],因此许多国际组织及贸易组织对大部分农产品中的AFs含量都规定了限量值,如食品法典委员会(CAC)推荐食品、饲料中AFs最大允许量标准为总量(B1+B2+G1+G2)小于15 μg/kg。但目前,蜂花粉产品还没有相应的限量标准规定。因此,建立蜂花粉中AFs的测定方法,对于蜂花粉中生物毒素的安全性评价和安全限量的制定有着重要的研究意义。
目前文献中报道的食物中真菌毒素的分析方法通常是用乙腈水[4-5]、甲醇水[6-7]或三氯甲烷[8]进行提取,之后净化并采用液相色谱结合不同的检测器来对其进行测定[9]。由于AFs具有显著的荧光特征,因此液相色谱结合荧光检测器曾是测定AFs的首选方法。但近几年来液相色谱串联质谱法(LC-MS/MS)因其能缩短运行时间并具有较高的选择性和灵敏度而成为测定AFs的一种普遍方法[10-11]。考虑到花粉中的AFs研究很少,而摄食受AFs污染的花粉具有潜在的健康风险,因此有必要对花粉中的AFs进行定性定量分析。本研究即采用免疫亲和柱结合LC-MS/MS来对花粉中的超痕量的 AFB1,AFB2,AFG1,AFG2进行分析测定。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器和设备
高效液相色谱仪(Agilent 1200,美国Agilent公司);三重四极杆串联质谱(6460,美国 Agilent公司);分析天平(Mettler-Toledo公司);高速冷冻离心机(CR22GⅡ,日本日立公司);多用途旋转摇床(QB-206,海门市其林贝尔仪器制造有限公司);超声波清洗器(KQ-100E,昆山市超声仪器有限公司);氮吹装置(N-EVAP 112,美国Labnet公司);Milli-Q纯水发生器(美国Millipore公司)。
1.1.2 试剂和耗材
标准品:AFs混标5mg/L(Trilogy分析实验室,美国华盛顿)。其中 AFB1、AFG1为 2 mg/L,AFB2、AFG2为0.5 mg/L。标准品于-20℃密闭保存。
甲醇、乙腈和甲酸均为色谱级,乙酸铵(Fisher公司);微纤维滤纸(PriboLab,110mm,北京泰乐琪科技有限公司);定性滤纸(47 mm,杭州特种纸业有限公司);超纯水由Milli-Q纯水发生器制备。
AFs总量免疫亲和柱(ToxinFast,北京华安麦科生物技术有限公司);多功能净化柱(PriboFast,100 mg,3 mL,北京泰乐琪科技有限公司)。分散固相萃取柱(北京维康公司),阳离子交换柱(100 mg,3 mL,北京泰乐琪科技有限公司)。
蜂花粉样品:从市场随机抽样20个,人为培养发霉样品10个。
1.2 实验方法
1.2.1 标准溶液的配制
基于本研究检测灵敏度和线性范围配制标准工作溶液,使用前用乙腈将AFs混标溶液配制成50,500 μg/L的混合工作溶液并于4℃冰箱密闭保存。
1.2.2 样品前处理过程
准确称取10g蜂花粉样品(精确到0.01 g)于50 mL具塞聚四氟乙烯离心管中,加入20mL提取液[V(乙腈)∶V(水)=60∶40],25℃超声辅助提取 10 min,均匀振荡15 min,-4℃高速离心(12 000 r/min)15 min,将上清液过定性滤纸,取8 mL滤液用水定容至40 mL,-20℃冷冻12h。样品解冻后,-4℃高速离心(12 000 r/min)15 min,上清液经微纤维滤纸过滤,取10 mL滤液过AFT免疫亲和柱,流速为1 d/s,10 mL超纯水淋洗,抽干后,2 mL甲醇洗脱。洗脱液于50℃下氮气吹干,1 mL提取液定容,过0.2 μm滤膜于自动进样瓶中,待LC-MS/MS检测。
1.3 液质联用仪分析条件
1.3.1 色谱条件
色谱柱:Agilent ZORBAX SB-C18(50 mm×2.1 mm,1.8 μm);柱温:35℃;进样量:10 μL;流速:0.2 mL/min;流动相A:1 mmol/L乙酸铵水溶液(0.1%甲酸),流动相B:1 mmol/L乙酸铵甲醇溶液(0.1%甲酸);流动相梯度洗脱,洗脱比例见表1。

表1 流动相洗脱梯度Table 1 The elution gradient of mobile phase
1.3.2 质谱条件
电喷雾离子源(ESI),正离子模式扫描;监测方式:多反应监测模式(multiple reaction monitoring,MRM);干燥气温度:50℃;干燥气流速:6 L/min;鞘流气温度:350℃;鞘流气流速:10 L/min;雾化器压力:40 psi;毛细管电压 4 000 V。AFB1、AFB2、AFG1和AFG2的其他质谱分析条件参数见表2。

表2 AFB1、AFB2、AFG1、AFG2 的质谱参数Table 2 MS/MS parameters of AFB1,AFB2,AFG1 and AFG2
2 结果与讨论
2.1 液相色谱条件的优化
以乙腈-水为流动相时,乙腈能够抑制AFs化合物的离子化而导致质谱信号降低,并且色谱峰出现拖尾现象。因此本研究采用1mmol/L的乙酸铵甲醇溶液(0.1%甲酸)和1mmol/L乙酸铵水溶液(0.1%甲酸)作为流动相来对花粉中的 AFB1、AFB2、AFG1、AFG2进行分离。
2.2 提取溶剂的优化
AFs中的 B1、B2、G1、G2 化学结构类似,基本结构中都含有二呋喃环和氧杂萘邻酮(又名香豆素),易溶于有机溶剂。采用乙酸乙酯和乙醚作为提取液时,操作复杂,需增加一步旋转蒸发的操作,而乙腈和甲醇作为提取液时可以减去这步操作,缩短实验时间,并且降低实验成本。本实验考察了不同体积比的乙腈-水(5∶5、6∶4、7∶3)的提取效果如图 1。

图1 不同提取溶剂与回收率关系图(n=3)Fig.1 Comparison of recoveries of different extraction solvents for AFB1,AFB2,AFG1,AFG2
结果表明随着乙腈-水的体积比增大,提取回收率变化不大,但B1和G1在乙腈-水体积比为6∶4时的回收率最好。而考虑到有机相继续增加会降低目标物在净化柱上的保留效果,因此综合考虑本研究选择体积比为6∶4的乙腈-水作为提取液,这与已有的报道结果相一致[12]。不同提取溶剂与回收率关系见图1。
2.3 净化条件的选择
本研究比较了免疫亲和柱(IAC)、多功能净化柱(MFC)、分散固相萃取柱(d-SPE)和阳离子交换柱(PCX)提取4种毒素的效果。通过比较发现,d-SPE、MFC和PCX的提取回收率很差,而免疫亲和柱由于其抗体的特异性结合而表现出了最佳的净化效果。图2显示了3种固相萃取方法的回收率比较。
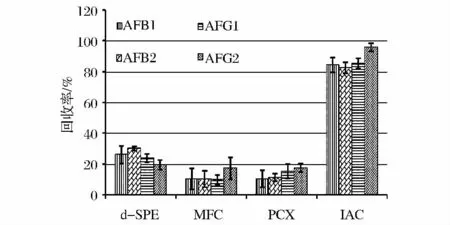
图2 四种不同的萃取柱的提取回收率比较Fig.2 Comparison of the recoveries of fourcleanup procedures for 4 aflatoxins(AFB1,AFB2,AFG1,AFG2)
此外,在样品前处理过程中,当滤液用水稀释定容时会出现很严重的乳化现象,而且过免疫亲和柱时会堵塞柱子,影响实验结果。但是将定容好的混合液冷冻过夜后再解冻离心,则可以很好的破乳,从而解决柱子堵塞问题[13]。
2.4 基质效应、线性、检出限(LOD)与定量限(LOQ)
由于在串联质谱中,样品基质通常对分析物的离子化具有增强或抑制效应[14],因此采用空白蜂花粉样品提取液对AFs混标液进行稀释,即配置与蜂花粉空白基质匹配的不同浓度的AFB1、AFB2、AFG1、AFG2的标准溶液,以各组分的质量浓度(μg/kg)为横坐标(x),相应的色谱峰面积为纵坐标(y)绘制标准曲线。结果显示:4种组分均成良好线性关系,相关系数(r2)在0.997~0.999之间。以线性的最低浓度作为检出限(LOD),得出 B1、B2、G1、G2 的定量限分别为 0.05,0.1,0.013,0.025 μg/kg,见表 3。其定量限水平的基质校正标准色谱图见图3。

图3 4种黄曲霉毒素定量限水平的基质校正标准色谱图Fig.3 Typical LC-MS/MS chromatogram of the matrix-matched standard at LOQ level

表3 4种黄曲霉毒素的标准曲线参数,检出限及定量限Table 3 The standard curve parameters,LODs and LOQs of AFB1,AFB2,AFG1,AFG2
2.5 回收率与相对标准偏差(RSD)
选择不含黄曲霉毒素 B1、B2、G1、G2的蜂花粉作空白样品,分别在3个添加浓度下按照1.2.2和1.3所述步骤进行回收率和精密度实验。结果表明黄曲霉毒素(B1、B2、G1、G2)的平均回收率为74% ~97%,RSD为3.6% ~10%(见表4)。
2.6 实际样品测定
用建立的方法分析20个从市场随机抽取的蜂花粉(包括油菜,茶花和荷花花粉)样品,均未检出4种黄曲霉毒素;分析人为培养的10个发霉的花粉样品,也未检出4种毒素;对检测结果进行分析,推测可能是花粉中的霉菌并未产生孢子,所以未生成毒素。

表4 AFB1,AFB2,AFG1,AFG2 的添加回收率与精密度(n=5)Table 4 Therecoveries and precisions of AFB1,AFB2,AFG1,AFG2

图4 空白样品色谱图Fig.4 Typical LC-MS/MS chromatogram of the blank bee pollen sample
3 结论
目前我国及欧盟对很多农产品中的AFs限量都有规定,但蜂花粉中限量还未制定。本实验利用免疫亲和柱结合高效液相色谱串联质谱,建立了一种同时测定蜂花粉中的黄曲霉毒素 B1、B2、G1、G2含量的方法。该法简单、准确、快速、灵敏,并且回收率高、重现性好,为蜂花粉中AFs的检测方法和限量制定提供了参考。
[1] 刘建涛,赵利,苏伟,等.蜂花粉生物活性物质的研究进展[J].食品科学,2006,27(12):909-912.
[2] 吴肖,刘通讯,林勉.花生粕酶水解液中黄曲霉毒素脱毒定性研究[J].粮油食品科技,2003,11(1):32-33.
[3] Bennett J W,Klich M.Mycotoxins[J].Clinical Microbiology Reviews,2003,16(3):497-516.
[4] Chan D,MacDonald S J,Boughtflower V,et al.Simultaneous determination of aflatoxins and ochratoxin A in food using a fully automated immunoaffinity column clean-up and liquid chromatography-fluorescence detection[J].Journal of Chromatography A,2004,1 059:13-16.
[5] Beltrána E,Ibá ez M,Sancho J V,et al.UHPLC-MS/MS highly sensitive determination of aflatoxins,the aflatoxin metabolite M1 and ochratoxin A in baby food and milk[J].Food Chemistry,2011,126(2):737-744.
[6] Trucksess M W,Stack M E,Nesheim S,et al.Immunoaffinitycolumn coupled with solution fluorimetry or liquid chromatography post-column derivatization for determination of anatoxins in corn,peanuts and peanut butter:collaborative Study[J].Journal of AOAC International,1991,74(1):81-88.
[7] Ozbey F,Kabak B.Natural co-occurrence of aflatoxins and ochratoxin A in spices[J].Food Control,2012,28(2):354-361.
[8] Castellari M,Fabbri S,Fabiani A,et al.Comparison of different immunoaffinity clean-up procedures for high-performance liquid chromatographic analysis of ochratoxin A in wines[J].Journal of Chromatography A,2000,888(1-2):129-136.
[9] Songsermsakul P,Razzazi-Fazeli E.A review of recent trends in applications of liquid chromatography-mass spectrometry for determination of mycotoxins[J].Journal of Liquid Chromatography& Related Technologies,2008,31(11-12):1 641-1 686.
[10] Di Mavungu J D,Monbaliu S,Scippo M L,et al.LCMS/MS multi-analyte method for mycotoxin determination in food supplements[J].Food Additives & Contaminants,2009,26(6):885-895.
[11] Monbaliu S,Poucke CV,Detavernier C,et al.Occurrence of mycotoxins in feed as analyzed by a multi-mycotoxin LC-MS/MS method[J].Journal of Agricultural and Food Chemistry,2010,58(1):66-71.
[12] Garcia-Villanova R J,Cordón C,González Paramás A M,et al.Simultaneous immunoaffinity column cleanup and HPLC analysis of aflatoxins and ochratoxin A in Spanish bee pollen[J].Journal of Agricultural and Food Chemistry,2004,52(24):7 235-7 239.
[13] LI L,XU Y J,PAN CP,et al.Simplified pesticide multiresidue analysis of soybean oil by low-temperature cleanup and dispersive solid-phase extraction coupled with gas chromatography/mass spectrometry[J].Journal of AOAC International,2007,90(5):1387-1 394.
[14] 向平,沈敏,卓先义.液相色谱-质谱分析中的基质效应[J].分析测试学报,2009,28(6):753-756.

