原子吸收分光光度法测定人凝血因子Ⅷ中铝残留量
高红琴(山西康宝生物制品股份有限公司,长治 046000)
人凝血因子Ⅷ是由健康人血浆蛋白经过分离、提纯获得的血液制品,是内源性凝血途径中的关键性凝血因子,临床上主要用于甲型血友病的治疗,也用于平时的临床使用中,如在大出血或大手术时输注给患者可以补充或提高血浆Ⅷ水平,以保持正常的凝血功能[1]。
在人凝血因子Ⅷ生产过程中,采用氢氧化铝凝胶吸附去除凝血酶原复合物和部分变性的纤维蛋白原,收集离心上清液,并经S/D病毒灭活、超滤浓缩、透析、离子交换层析(Q-sepharoes FF)纯化、冷冻干燥、干热灭活病毒等步骤。虽然经离心和离子交换层析等步骤可去除掉氢氧化铝,但成品中有可能残存微量的氢氧化铝。人体摄入过多的铝将直接破坏神经细胞内遗传物质脱氧核糖核酸的功能,不仅使人易患老年痴呆,还会引发肾功能损伤[2]。因此为保证制剂对人体的安全,应建立准确有效的测定人凝血因子Ⅷ中铝残留量的方法。经过查找相关资料,人凝血因子Ⅷ中铝残留量测定方法未见报道。我们参考《中国药典》[3]2010年版三部附录ⅦK“人血白蛋白铝残留量测定法”和相关文献[4]建立了人凝血因子Ⅷ中铝残留量测定方法,并进行了方法学研究。
1 仪器与试剂
1.1 仪器
AA-6300C原子吸收分光光度计(日本岛津);铝空心阴极灯(日本岛津);AE240电子天平(梅特勒-托利多仪器有限公司)。
1.2 试剂
硝酸(aladdin chemistry,批号:11306011);铝元素(1 000 μg/ml,唯一标识:14357-2,定值日期:2014年3月。国家有色金属及电子材料分析测试中心);纯化水(山西康宝生物制品股份有限公司);人凝血因子Ⅷ样品批号:20140601(山西康宝生物制品股份有限公司)。
2 结果
2.1 人凝血因子Ⅷ铝残留量测定方法
2.1.1 仪器条件 参考相关文献[5]设定检测波长309.3 nm;狭缝宽 0.7 nm;灯电流 10 mA;进样量 10 μl;石墨炉升温程序见表1。
2.1.2 测定方法 样品处理:取人凝血因子Ⅷ样品(批号:20140601),平衡至25-37℃,加入25-37℃灭菌注射用水10 ml,轻轻摇动至完全溶解。
0.15 mol/L硝酸溶液的制备:精密量取浓度为63.01% 的硝酸 9.38 ml,用纯化水定容至 1 000 ml,摇匀即得。
100 ng/ml标准铝溶液的制备:精密量取100 μg/ml标准铝溶液0.1 ml置于100 ml容量瓶中,用0.15 mol/L硝酸溶液稀释至刻度。
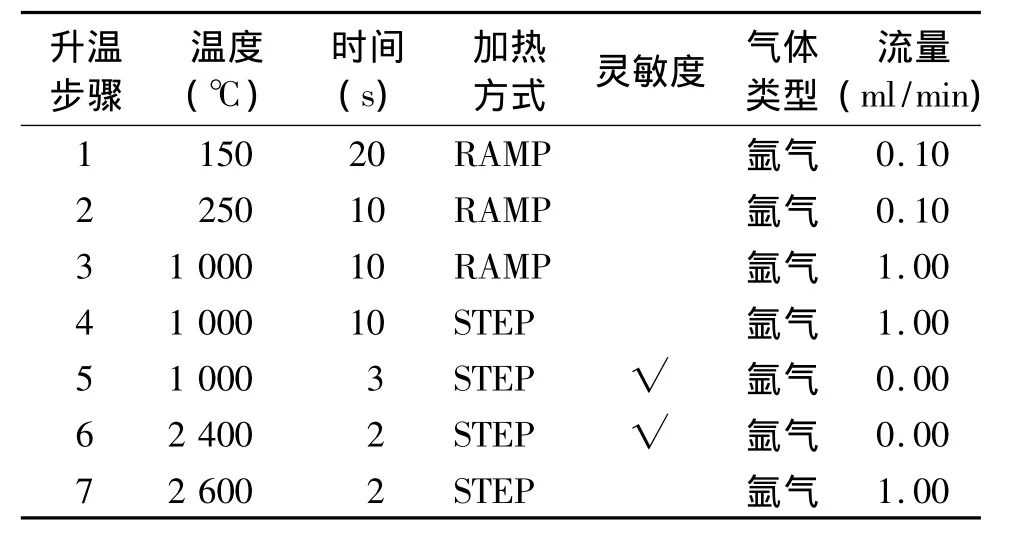
表1 石墨炉升温程序Table 1 Graphite furnace temperature program
按表2分别制备空白对照溶液、供试品溶液和标准铝加供试品的混合溶液,按2.1.1项设定原子吸收分光光度计条件,精密量取空白对照溶液、供试品溶液和标准铝加供试品的混合溶液各10 μl,分别注入仪器,读数,按下式计算:
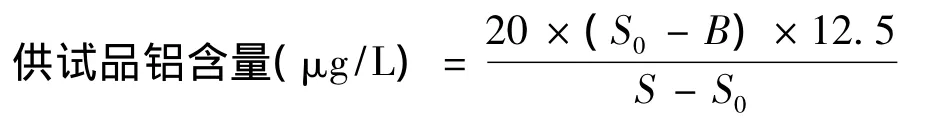
公式中,B为空白对照溶液读数;S0为供试品溶液读数;S为标准铝加供试品的混合溶液读数;20为标准铝加供试品的混合溶液中标准铝的含量:12.5为供试品稀释倍数。
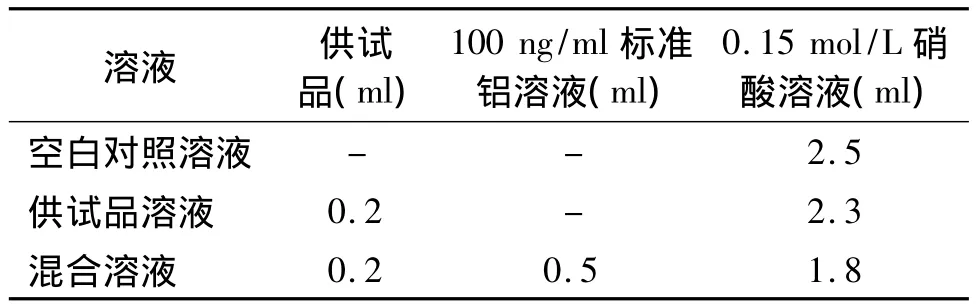
表2 空白对照、供试品及混合溶液的制备Table 2 Preparation of blank control,test solution and mixed solution
2.2 方法学研究
2.2.1 检测限度 取试剂空白溶液(0.15 mol/L HNO3溶液)连续测量10次,记录吸光度值分别为0.086 5,0.079 2,0.084 4,0.086 8,0.083 9,0.087 1,0.081 6,0.083 2,0.079 5,0.082 4,平均值为 0.083 5,吸光度的SD值为0.002 71。
再取标准铝溶液(100 ng/ml)适量,用 0.15 mol/L HNO3溶液分别稀释成浓度为 50.0,20.0,10.0,5.0,2.0,1.0 μg/L 的铝标准溶液,依次测定吸光度值分别为 0.549 6,0.217 4,0.104 4,0.062 3,0.041 6,0.025 3,当铝标准溶液浓度为 1.0 μg/L时,吸光度值(0.025 3)和空白溶液10次吸光度值的10倍标准偏差(0.027 1)接近,所以检测限度为1.0 μg/L。
2.2.2 线性关系及线性范围考察 分别精密量取标准铝溶液(100 ng/ml)适量,用0.15 mol/L HNO3溶液稀释制成铝含量为 2.0,5.0,10.0,20.0,30.0 μg/L的溶液,按上述测试条件进样,记录吸光度值。以每一浓度3次吸光度读数的平均值为纵坐标,相应浓度为横坐标,回归计算。回归方程:A=0.010 2C+0.015 3,R2=0.997 3。式中:A 为吸光度值;C 为铝浓度,单位为μg/L。铝浓度对吸光度的线性关系结果结果表明:铝含量在2.0-30.0 μg/L范围内线性关系良好(见表3,图1)。
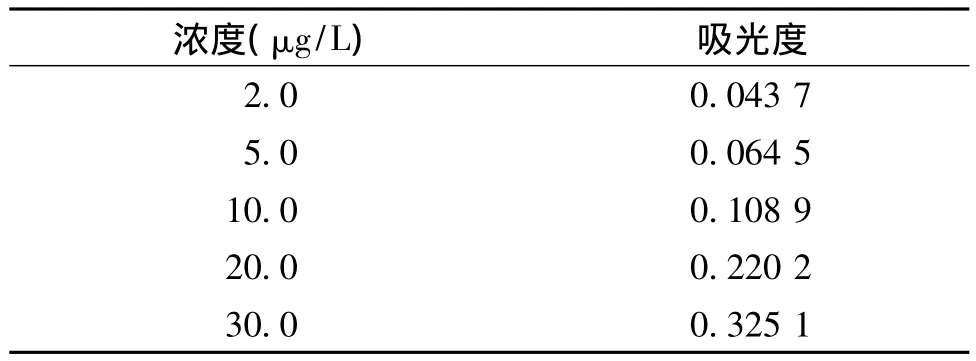
表3 铝浓度对吸光度线性关系结果Table 3 Relationship between concentration of aluminum and absorbance
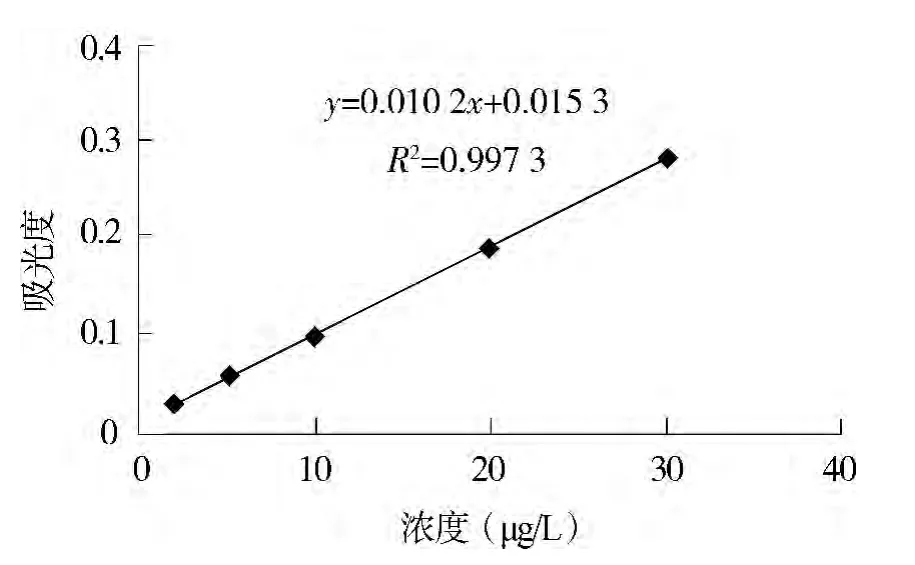
图1 铝浓度对吸光度线性关系Figure 1 Relationship between concentration of aluminum and absorbance
2.2.3 精密度试验 精密量取标准铝溶液(100 ng/ml)适量,用0.15 mol/L HNO3溶液配制成铝含量为20.0 μg/L的溶液,按上述测试条件,连续进样10次,测定吸光度,记录吸光度值分别为0.197 8,0.201 2,0.201 4,0.193 7,0.199 1,0.204 3,0.201 1,0.198 3,0.192 7,0.195 9,平均值为 0.198 9,吸光度的RSD值为1.84%,符合测定要求,表明实验方法精密度良好。
2.2.4 重复性试验 取人凝血因子Ⅷ样品,配制6份供试品溶液,按照上述仪器条件进样,计算铝残留量测定结果分别为 61.7,58.4,53.8,52.1,52.1,59.8 μg/L,平均铝残留量为 56.3 μg/L,6 份供试品溶液的RSD值为7.48%,说明该方法重复性较好。
2.2.5 回收率试验 取人凝血因子Ⅷ样品(批号:20140601,重复性试验平均铝残留量为56.3 μg/L),平衡至25-37℃,按标示量加入25-37℃灭菌注射用水10 ml,轻轻摇动至完全溶解。
按表4配制标准铝加入量分别为15.0,20.0,25.0 ng/ml的样品各 3 份,每份进样 10 μl。按铝残留量测定方法进行测定,每个样品测3次吸光度,用平均值计算铝测得总量,然后计算回收率。样品回收率测定结果显示,铝含量平均回收率97.4%,RSD为2.11%(见表5)。结果表明:该方法具有良好的回收率。
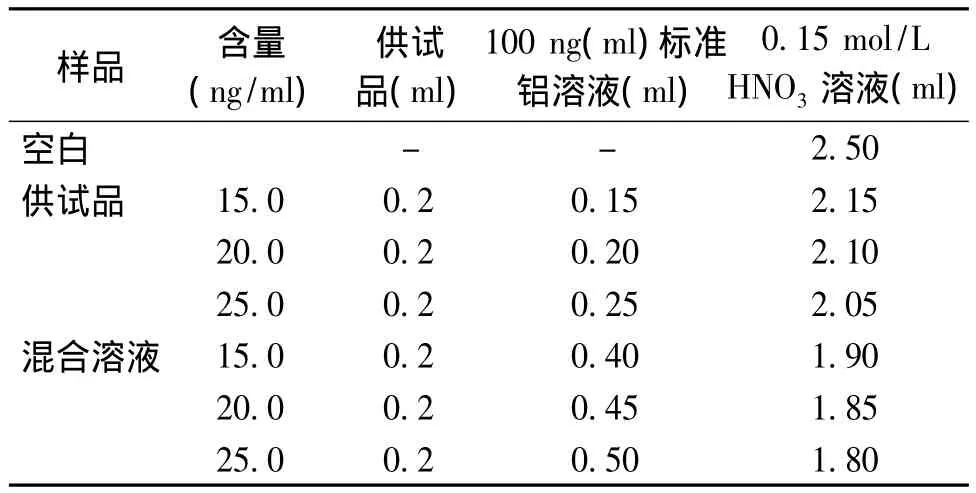
表4 样品制备Table 4 The sample preparation
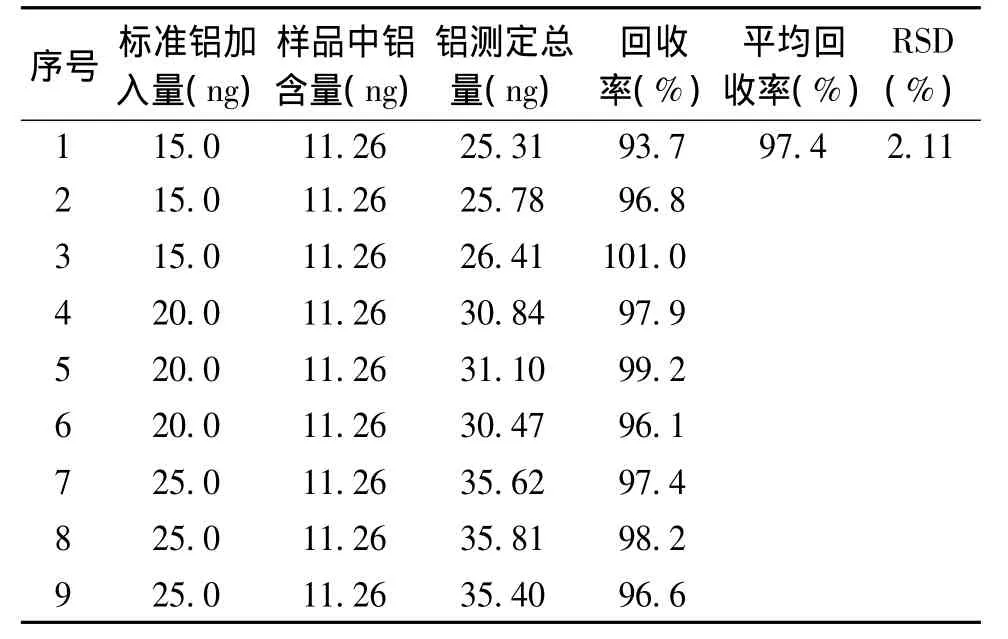
表5 回收率测定结果 (n=9)Table 5 Results of recovery test (n=9)
3 讨论
采用原子吸收分光光度法测定血液制品中铝残留量国内已有报道[4],并且中国药典也是采用该方法检测人血白蛋白中铝残留量。该方法属于痕量法,测定过程中易于受到干扰,主要影响因素有两方面,一是玻璃中含有Al2O3,在pH值较低时,铝离子更易溶出,造成污染,所以试验中尽量使用惰性塑料器皿;二是因铝大量存在于空气颗粒中,因此所有器皿洗净后应保存在洁净的密闭盒中,尽量用小口器皿,试验中随时盖紧。该原子吸收分光光度法与分光光度比色法相比,具有明显的灵敏度高,操作过程简便、快速[6],并且该方法准确度好,精密度高,完全能够满足人凝血因子Ⅷ中铝残留量的测定。
[1]邓靖,尹惠琼,胡吉军,等.干热法对人凝血因子Ⅷ制品中指示病毒灭活效果验证[J].中国输血杂志,2014,27(2):168-171.
[2]蒋炜,唐洪,李春华,等.塞曼-石墨炉原子吸收光谱法测定膨化食品中的铝[J].中国卫生检验杂志,2008,18(1):85-86.
[3]国家药典委员会.中国药典三部[S].2010年版.北京:中国医药科技出版社,2010:附录ⅦK.
[4]肖林,程雅琴.检测人血白蛋白中铝含量的石墨炉原子吸收分光光度法的建立[J].中国生物制品学杂志,2001,14(3):178-180.
[5]高红琴,付强.磺基水杨酸沉淀蛋白法测定人血白蛋白铝含量[J].山西医科大学学报,2014,45(12):1163-1165.
[6]李秀娟,王丽,刘召金,等.食品中铝含量测定的研究进展[J].广东化工,2012,39(14):76-77.

