人脂肪干细胞复合富血小板血浆治疗裸鼠放射性皮肤损伤的实验研究
张 琳 富泽龙 冯 锐
放射治疗是治疗恶性肿瘤的重要手段,随着放疗的普遍应用,放射性皮肤损伤给很多肿瘤患者带来额外的痛苦。传统治疗方法治疗放射性皮肤损伤包括药物治疗和外科手术治疗,效果均不理想,使其成为整形外科的难愈性疾病之一。皮肤组织工程是解决这一难题的新希望。文献研究证实,脂肪干细胞( adipose-derived stem cells,ASCs) 可减轻炎性反应,促进肉芽组织沉积,促进再上皮化、血管重建及创面收缩,并可分化为表皮细胞、血管内皮细胞,因而可促进创面愈合[1~5]。本研究以人来源ASCs 作为种子细胞,以人来源PRP 作为载体,观察ASCs-PRP 复合物对裸鼠放射性皮肤损伤创面愈合的影响。
资料与方法
1.实验动物及主要试剂、仪器:8 周龄健康雌性裸鼠24只,体重250 ~300g,由中国医学科学院放射医学研究所实验动物中心提供。高糖DMEM 培养基、胎牛血清( 美国GIBCO公司) ; Ⅰ型胶原酶、胰酶( 美国Sigma 公司) ; CD29、CD44、CD105 荧光标记抗体( 美国BD Bioscience 公司) 。脂肪组织:人脂肪组织来源于健康成年人腹部及股部吸脂手术抽吸物。
2.ASCs 的提取、培养及鉴定: 笔者采用稍加改动的Zuk法通过脂肪抽吸手术获得健康成年人脂肪组织: 首先用D -hanks 液洗涤,去除脂肪抽吸物中的血细胞和麻醉药,然后0.2%Ⅱ型胶原酶消化1h,之后用D-Hanks 再次洗涤2 遍,去除其中残留的胶原酶[6]。1200r/min 离心5min,离心后收集细胞。将细胞以2 ×106个/毫升的密度接种于T75 中,培养液含58% DMEM/F12 +40%MCDB-201、2%胎牛血清、10ng/ml EGF、10ng/ml PDGF,1 ×胰岛素-转铁蛋白-亚硒酸( insulin-transferrin-selenium,ITS) 、1 ×亚油酸-牛血清白蛋白( linoleic acid-bovine serum albumin,LA -BSA) 、50μmol/L β巯基乙醇、2mmol/L L-谷氨酰胺、100μg/ml 青霉素和100U/ml 硫酸链霉素( 传代培养时不用双抗) 的培养基中,在温度37℃、湿度95%、CO2浓度为5%的培养箱培养。24h 后将培养液及其中未贴壁的细胞吸出,重新种到新的T75 中,原瓶更换新鲜培养液,以后每3 天换液。当细胞培养至80% ~90%融合时,用0.25%胰蛋白酶-0.02%EDTA 常规消化,细胞按照1∶3 进行传代。取第3 代的ASCs 以2 ×104/ml 的密度接种于T25 培养瓶,12h 后,将培养基改为脂肪诱导培养基( 高糖DMEM 培养基中加入10% FBS、1 × 10-6mol/L 地塞米松、50μg/ml 抗坏血酸和100μg/ml IBMX) ,每隔2 天半量换液1次。倒置显微镜下观察脂肪滴的形成( 图1) 。
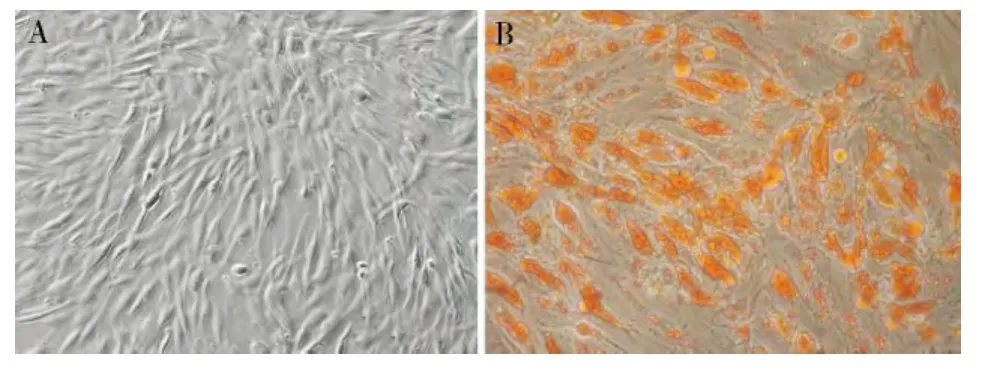
图1 ASCs 的培养及鉴定
3.PRP 的制备: 大量研究证明,二次离心法提取的PRP 质量最高,其在临床上的应用也最广,因此笔者采用Landesberg 二次离心法[7]。(1) 将外周血20ml 抽入含抗凝剂(100g/L 枸橼酸钠,1ml) 的无菌试管中。(2) 第1 次离心,离心后血液分为3 层:上层为贫血小板血浆,主要成分是纤维蛋白原等;中层为高度浓缩的血小板,下层为红细胞。吸取全部的上清液直达交界面下3mm( 上层、中层以及邻近中层的部分红细胞) ,将其移入另一无菌试管中。( 3) 再次离心,离心后血浆分为3 层:下层为少许红细胞,上层为贫血小板血浆,两层之间便为富血小板血浆层。吸弃上清液,留适量血浆以容纳并稀释高浓度的血小板。( 4) 将PRP 与凝血酶( 1ml 10%CaCl2溶液+1000U 凝血酶) 按9∶1比例混匀,常温放置1h后,置于4℃冰箱内过夜。次日以5000r/min 速度离心10min,吸取上清液,0.22μm 滤器过滤除菌,置-80℃冰箱保存备用。
4.实验分组及方法:根据修复方法不同,将24 只裸鼠随机分为4 组,每组6 只。以铅砖遮蔽创面以外部位,在裸鼠背部行直径为2cm 的圆形区域的60Co 照射,照射条件:剂量20Gy,照射时间368s,剂量率326.1r/min。照射后即刻在裸鼠背部制备直径为1cm 的皮肤全层缺损创面( 图2) 。模型完成后即刻,各组分别予以以下干预:ACSs+PRP 组创面滴加ASCs -PRP 复合物0.2ml( 含ACSs 1 × 107个细胞/毫升) ,ASCs 组创面滴加ASCs 0.2ml( 含ACSs 1 ×107个细胞/毫升) ,PRP 组创面滴加PRP 凝胶0.2ml,空白组创面不加干预,直接覆盖敷料。术后7、14 天各创面愈合情况,并拍照,计算愈合曲线; 组织学观察炎性反应,免疫组织化学染色计数CD31 阳性细胞的分布情况。
5.统计学方法:应用SPSS 13.0 统计软件,计数资料以均数±标准差(±s) 表示,行多因素方差分析。以P <0.05 为差异有统计学意义。
结 果
1.创面大体观察: ASCs + PRP 组: 术后7 天,创面渗出不多,较为干燥,肉芽组织新鲜,创面约60%愈合;术后11 天,创面完全愈合,新生上皮外观与正常皮肤相似,但颜色较周围皮肤稍红,稍显凹陷。PRP组:术后7 天,创面有少量渗出,边缘开始有新生上皮爬行,肉芽组织新鲜,色鲜红;术后14 天,创面渗出不多,约70%愈合,但愈合质量不如实验组。ASCs 组:术后7 天,创面少量渗出,创面可见皮岛形成; 术后14天,创面少量渗出,没有完全愈合。空白组( sham 组) :术后7 天,创面可见渗出,散在皮岛形成,肉芽组织新鲜,色红,触之易出血。术后14 天,创面没有完全愈合。Image J 软件测定各时点残留创面面积并绘制创面愈合曲线。如图3 所示,ASCs +PRP 组愈合速度最快,与其余组差异均有统计学意义( P <0.05),PRP 及ASCs 组愈合速度次之,与sham 组差异有统计学意义( P <0.05) ,而PRP 组与ASCs 组差异无统计学意义( P >0.05) 。
2.HE 染色观察创面炎性反应:各组分别术后14天行创面组织切片,行HE 染色( 图4) 。ASCs +PRP组创面愈合良好,创面新生血管密度较大,可见炎性细胞浸润。PRP 组: 仍有部分创面未能愈合,肉芽组织生长良好,新生血管密度较为丰富,肉芽组织及创面表面可见较多炎性细胞浸润。ASCs 组: 部分创面未能愈合,肉芽组织中新生血管数量较为丰富,并可见较多炎性细胞浸润。sham 组: 相当一部分创面未能愈合,存在较为明显的炎性细胞浸润,肉芽组织中可见新生血管。
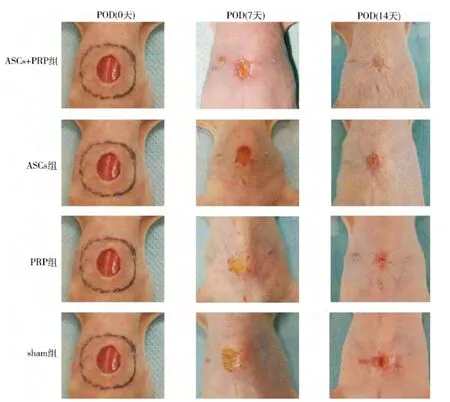
图2 创面模型制作及大体观察

图3 创面愈合曲线
3.CD31 染色观察创面微血管密度: 术后第14天,各组创面CD31 染色如图5 所示。ASCs +PRP 组与其他3 组比较,差异有统计学意义( P <0. 05) ,ASCs 组差异与PRP 组无统计学意义,但均与sham组比较差异有统计学意义( P <0.05,图6) 。

图4 术后第14 天,各组HE 染色( ×100)
讨 论

图5 术后第14 天,各组CD31 染色( ×100)
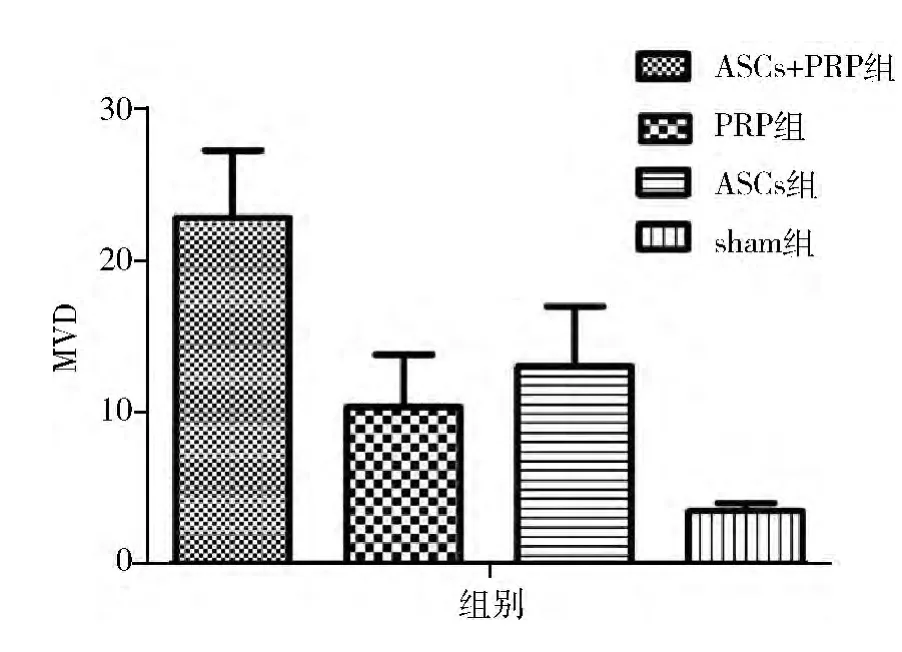
图6 术后第14 天,各组微血管计数
放射性皮肤损伤早期表现为急性放射性皮肤炎症,这是一种以红斑、水肿、表皮增厚、瘙痒及脱屑为特征的急性炎症。急性炎症期过后,逐渐进入慢性纤维化时期,这一时期以组织弹性下降,创面迁延不愈,色素加深,甚至形成放射性坏死和放射性溃疡。放射损伤的本质在于创面的微血管数量减少和纤维化的增加。伴随分子生物学的不断发展,关于放射性皮肤损伤的机制研究,已经从形态学和病理生理学水平逐步深入到了蛋白和基因等分子水平。目前研究认为,辐射产生的活性氧和自由基可以损伤上皮细胞基底层,使基底层细胞分裂、增殖以及向表层的迁移和角化受阻,导致皮肤损伤,并延缓创面修复过程;大剂量射线照射可引起p53 和Bax 蛋白高表达,导致皮肤组织内正常细胞凋亡,血管内皮细胞、成纤维细胞及表皮细胞数量减少,影响新生血管形成、创缘收缩以及创面表皮化过程抑制,因而造成肉芽组织形成不良、创面延迟愈合[8]。研究发现,放射线照射可抑制局部血管内皮细胞及成纤维细胞等合成与分泌VEGF、TGF-β 及BFGF 等细胞因子,而这些细胞是创面愈合重要的始动因素和促进因素[9]。放射性溃疡一旦发生,则难以愈合,如不及时治疗,局部感染加上放射效应的作用,极易引起创面加深,可能继发骨坏死、骨髓炎、急性出血、全身感染等危急重症。传统治疗方法包括药物治疗和外科手术治疗,效果均不理想,已成为整形外科的难治性疾病之一。皮肤组织工程是解决这一难题的新的希望。文献研究证实,ASCs 可减轻炎性反应,促进肉芽组织沉积,促进再上皮化、血管重建及创面收缩,并可分化为表皮细胞、血管内皮细胞,因而可促进创面愈合[1~5]。但是,缺乏有效的细胞输入方法和微环境中缺血和炎性反应均可导致细胞存活和繁殖率的下降[10~12]。
PRP 是通过离心全血而得到的含有高浓度血小板的血浆。PRP 中含有多种生长因子,如血小板衍生生长因子( platelet derivedgrowth factor,PDGF) ,转化生长因子β( TGF -β1、TGF -β2) ,胰岛素样生长因子1( insulin-like growth factor -1,IGF -1) 、表皮生长因子( EGF) 和血管内皮细胞生长因子( vascular endothelial growth factor,VEGF) 等[13,14]。1984 年,Okuda 等[15]于首次PRP 可以促进骨缺损修复,此后PRP 一直是再生医学领域的研究热点,RP 已经被应用于骨科、普通外科、心胸外科和整形美容等多种学科。
本实验将ASCs 作为种子细胞,以PRP 作为载体,观察ASCs-PRP 复合物对放射性复合损伤创面愈合的影响。ASCs + PRP 组创面愈合速度最快,且最终愈合效果亦最佳。单纯ASCs 组与单纯PRP 组愈合速度快于空白对照组,这与既往研究结果相符,说明ASCs 与PRP 均具有很好的促伤口愈合作用,但本次实验结果未能发现二者之间差异有统计学意义。在创面血管新生方面,ASCs +PRP 组新生微血管数量明显较其余各组丰富,而单纯ASCs 组及单纯PRP组的微血管数量多于空白对照组,这也与其他研究结果相符和。研究表明,单纯ASCs 与单纯PRP 均具有促血管新生,促创面修复作用,但二者合用,效果更好。分析其原因,单用ASCs 效果欠佳可能与放射性皮肤损伤局部,促血管新生、促创面修复因子数量减少有关,因而影响细胞治疗的效果,而PRP 的加入,恰恰矫正了局部微环境的不足,可以促进ASCs 在创面局部的存活和繁殖,并进一步发挥其自身的促旁分泌作用。而PRP 本身的胶体性质,理论上也有助于减少细胞在注射过程中的损伤。
本研究结果显示,将ASCs 与PRP 合用,具有良好的促进放射性皮肤损伤创面修复的作用,为创面修复的临床应用提供了新的思路。但这种促修复作用的具体机制如何,除了促进血管新生外,有无其他促进途径,细胞因子和基因表现层次的变化,都需要进一步研究。
1 Kim WS,Park BS,Sung JH. The wound - healing and antioxidant effects of adipose-derived stem cells[J]. Expert Opinion on Biological Therapy,2009,9(7) :879 -887
2 Maharlooei MK,Bagheri M,Solhjou Z,et al. Adipose tissue derived mesenchymal stem cell ( AD-MSC) promotes skin wound healing in diabetic rats[J].Diabetes Res Clin Pract,2011,93(2) :228 -234
3 Teng M,Huang Y,Zhang H. Application of stems cells in wound healing-an update[J]. Wound Repair and Regeneration,2014,22(2) :151 -160
4 You HJ,Han SK. Cell therapy for wound healing[J]. Journal of Korean Medical Science,2014,29(3) :311 -319
5 杨超,邢新,徐达圆,等. 脂肪干细胞-透明质酸复合物促进放射性复合损伤创面愈合的初步研究[J]. 中国修复重建外科杂志,2011,25(12) :1499 -1503
6 Zuk PA,Zhu M,Mizuno H,et al. Multilineage cells from human adipose tissue: implications for cell-based therapies[J]. Tissue engineering,2001,7(2) :211 -228
7 Landesberg R,Roy M,Glickman RS. Quantification of growth factor levels using a simplified method of platelet-rich plasma gel preparation[J]. J Oral Maxillofac Surg,2000,58(3) :297 -300
8 Dormand EL,Banwell PE,Goodacre TE. Radiotherapy and wound healing[J]. International wound journal,2005,2(2) : 112 -127
9 Morgan K. Radiotherapy - induced skin reactions: prevention and cure[J]. Br J Nurs,2014,23(16) :S24,S26 -32
10 Heikh AY,Lin SA,Cao F,et al.Molecular imaging of bone marrow mononuclear cell homing and engraftment in ischemic myocardium[J]. Stem Cells,2007,25(10) :2677 -2684
11 Hofmann M,Wollert KC,Meyer GP,et al. Monitoring of bone marrow cell homing into the infarcted human myocardium[J]. Circulation,2005,111(17) :2198 -2202
12 Segers VF,Lee RT. Stem-cell therapy for cardiac disease[J]. Nature,2008,451(7181) :937 -942
13 Weibrich G,Kleis WKG,Hafner G,et al. Growth factor levels in platelet -rich plasma and correlations with donor age,sex and platelet count[J]. Craniomaxillofac Surg,2002,30(2) : 97 -102
14 Marx RE,Carlson ER,Eichstaedt RM,et al. Platelet-rich plasma:Growth factor enhancement for bone grafts[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod,1998,85(6) :638 -646
15 Okuda K,Kawase T,Momose M,et al. Platelet -rich plasma contains high levels of platelet derived growth factor and transforming growth factor-beta and modulates the proliferation of periodontally related cells in vitro[J]. J Periodontol,2003,74(6) :849 -857

