5,5′-联四唑-1,1′-二氧二羟胺的热分解动力学
王俊峰,杨云峰,张春园,王小军,张晓鹏
(1.中北大学理学院,山西太原030051;2.北京理工大学材料科学与工程学院,北京100081;3.甘肃银光化学工业集团有限公司,甘肃白银730900)
引 言
近年来,随着武器平台的变化和战争模式的改变,不敏感含能材料逐渐成为国内外含能材料领域重要的研究方向。唑类化合物含有大量的N-N和N-C键,具有较高的氮含量及正生成焓,作为一类新型不敏感含能材料,引起了相关研究人员的普遍关注[1]。其中最受关注的是四唑类化合物,其氮含量超过80.0%,是目前能够稳定存在的含氮量最高的一种环结构单元。四唑化合物特别是双环四唑及其衍生物,以其高密度、高生成焓、大的环张力及稳定性好的特点,得到各国研究人员的极大重视和广泛研究[2-3]。2012年,Niko Fischer等[4]在一种不含典型致爆基团的四唑类化合物1,1′-二羟基-5,5′-联四唑[5]的基础上合成出了一系列双环四唑的含能离子盐,其中5,5′-联四唑-1,1′-二氧二羟胺(TKX-50)的性能最佳[6],密度为1.918g/cm3,理论爆速可达9 698m/s,能量水平与CL-20相当,对热和机械作用不敏感,感度低于RDX 和HMX,不含卤素,且合成工艺较为简单,是一种高能量、低感度、综合性能极佳的含能化合物,有望成为新型高能量密度化合物的研究重点[7]。
本研究利用热重和差热分析技术研究了TKX-50的热分解行为,并研究了其非等温热分解动力学,以期为其在含能材料领域的应用提供参考。
1 实 验
1.1 试剂与仪器
TKX-50,自制,纯度大于99.5%。
DTG-60型差热-热重同步分析仪,日本岛津公司。
1.2 测试方法
采用热重-差热法在升温速率分别为2.0、5.0、10.0和20.0K/min条件下,测试TKX-50的热分解,流动氮气气氛,流速50mL/min,样品量约0.7mg,样品池为氧化铝坩埚。
2 结果与讨论
2.1 TKX-50的热分解行为
采用差热-热重同步分析仪对TKX-50 的热分解行为进行了研究。在升温速率10.0K/min时TKX-50的TG-DTA 曲线见图1。由图1 可以看出,TKX-50热分解由两个阶段构成,第一阶段的峰值温度为239.65℃,第二阶段的峰值温度为260.57℃,从DTA 曲线上可以看出,两个分解阶段部分重叠,在此过程中质量损失约为84.2%。
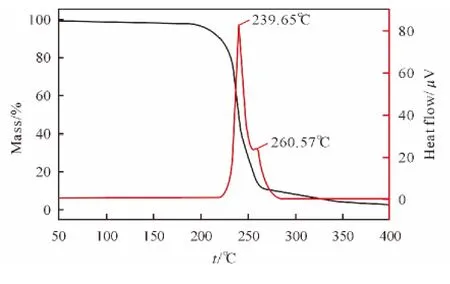
图1 升温速率10.0K/min时TKX-50的TG-DTA 曲线Fig.1 TG-DTA curves of TKX-50at a heating rate of 10.0K/min
不同升温速率时TKX-50的DTA、TG 和DTG曲线见图2。从图2可以看出,随着升温速率的提高,TKX-50的热分解峰温逐渐升高。升温速率为2.0、5.0、10.0K/min时可明显看到第二分解阶段的峰温,升温速率为20.0K/min时第二分解阶段的峰温不明显。
2.2 TKX-50的非等温热分解动力学
根据图2,通过Ozawa[8]法(式(1))和Kissinger[9]法(式(2))计算了TKX-50热分解第一阶段的动力学参数,获得的表观活化能(E)、线性相关系数(r)和指前因子(A)分别列于表1。
由表1结果可知,由Kissinger法和Ozawa法计算的第一阶段活化能E 分别为143.64 和144.66kJ/mol,两个E 值非常接近,且r值均大于0.97,说明计算结果比较准确。
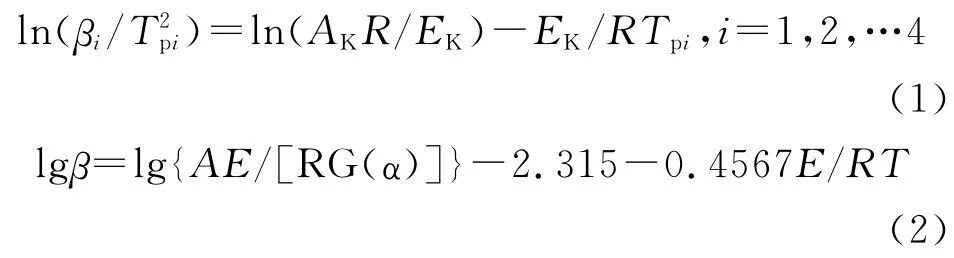
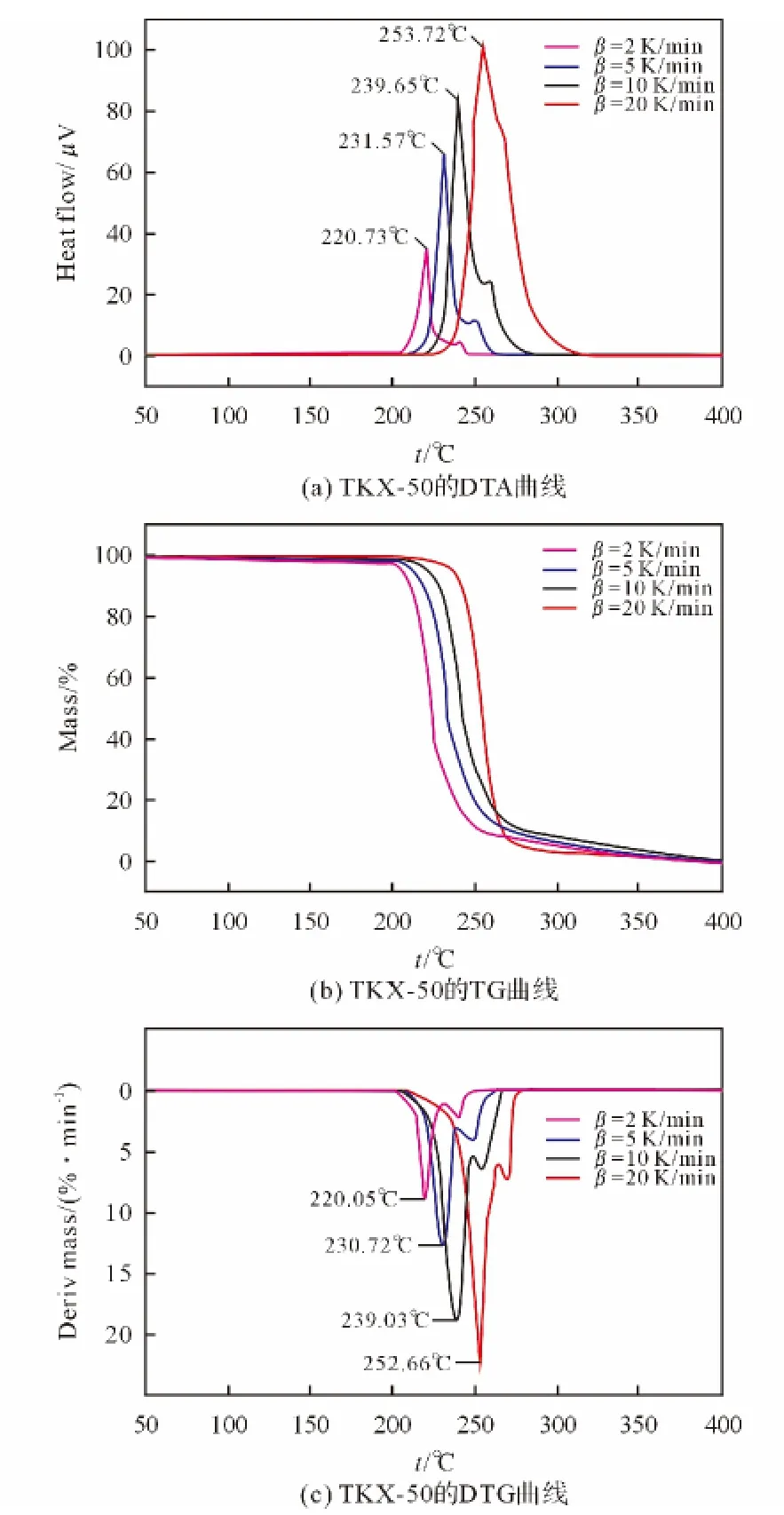
图2 不同升温速率下TKX-50的DTA、TG 和DTG 曲线Fig.2 DTA,TG and DTG curves of TKX-50at different heating rates

表1 TKX-50热分解第一阶段的动力学参数Table 1 Kinetic parameters of the exothermic decomposition reaction for the first stage of TKX-50
含能材料热分解的第一阶段对其安定性以及在加工、运输和贮存过程中安全性的影响较大,本实验对TKX-50热分解的第一阶段进行研究。根据TKX-50分解曲线,将不同升温速率下获得的不同反应深度(α)时的温度Ti数据列于表2,并代入Ozawa方程,得到不同反应深度下的活化能变化曲线,见图3。由图3可知,TKX-50的活化能变化同样可分为两个阶段,当α 为0.05~0.65时,其表观活化能变化较小,为TKX-50分解的第一阶段,故选用这段数值进一步计算TKX-50热分解第一阶段的非等温反应动力学参数。
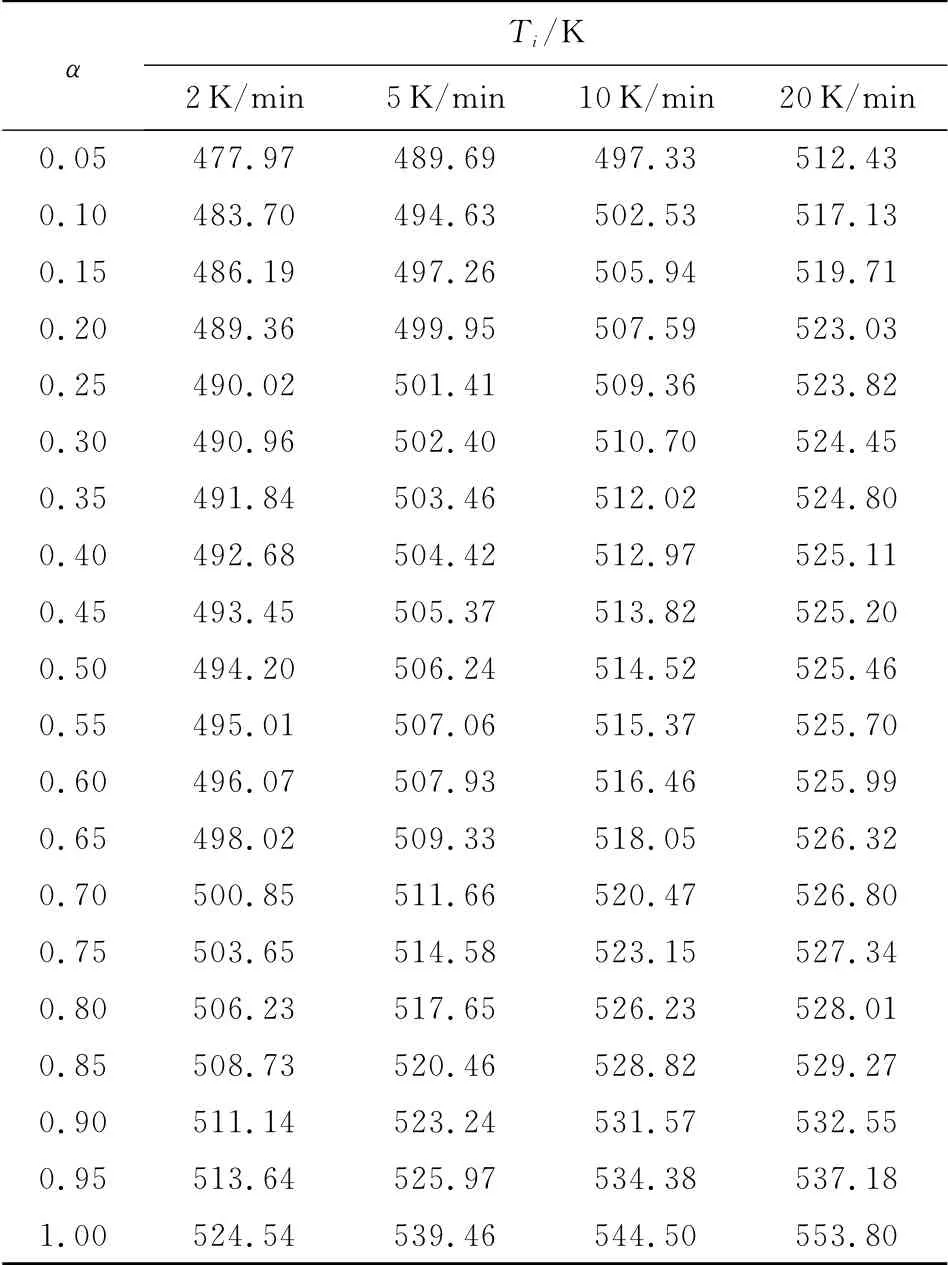
表2 由TG曲线得到的不同升温速率下TKX-50热分解数据Table 2 Data for the decomposition of TKX-50at different heating rates from TG curves
将表3中反应深度为0.05~0.65之间的αi和Ti(i=1,2,3,4)数据与41种机理函数[10]分别代入积分方程式(3)~(6)[11-14],由线性最小二乘法求得41种机理函数在相应升温速率下自对应的E、A 以及r。
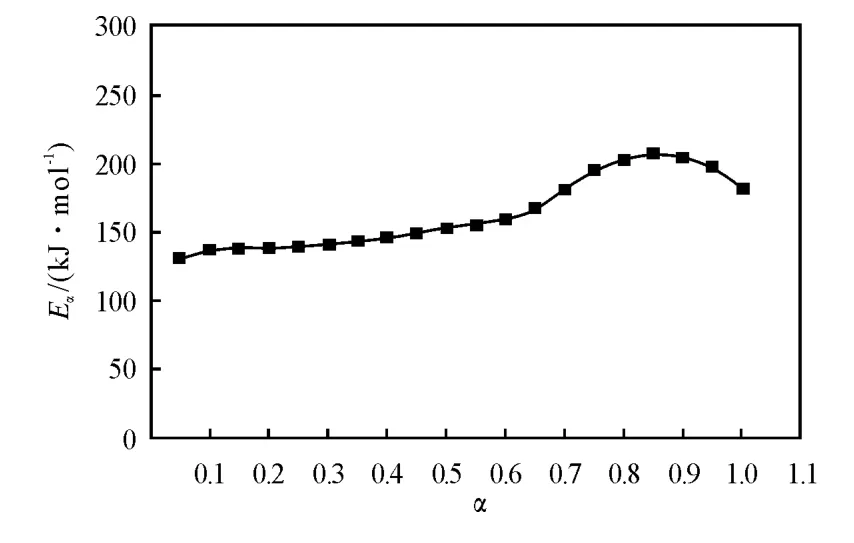
图3 TKX-50热分解的Eα-α曲线Fig.3 Eα-αcurve for the decomposition of TKX-50
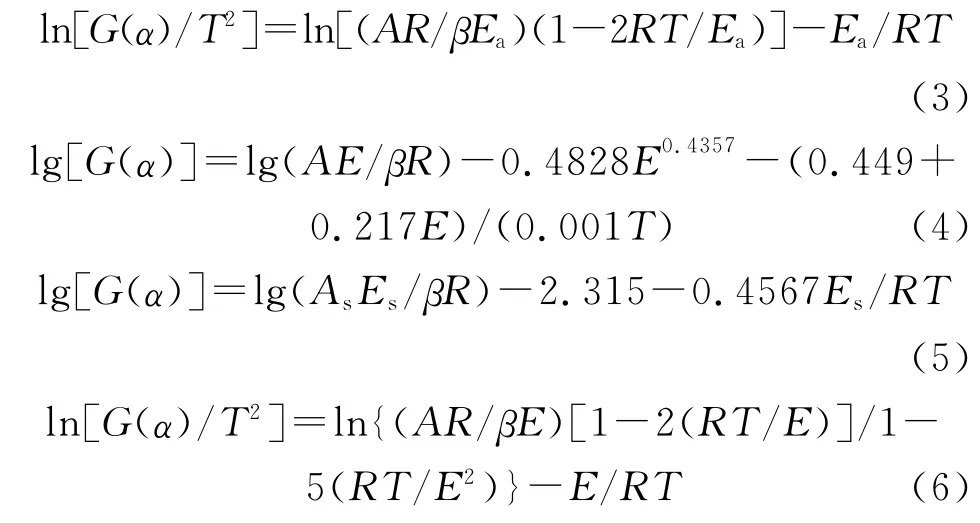
通过比较41种机理函数计算得到的E、A 和r值(80kJ/mol<E<250kJ/mol,|(Ek-E)/Ek|≤0.1,7<lg(A/s-1)<30,|r|≥0.98)[15],并与Ozawa法计算值进行对比,获得了TKX-50热分解第一阶段的最概然机理函数积分式为:
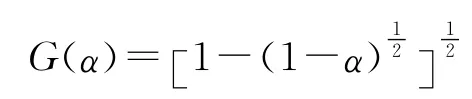
由上述机理函数计算得到TKX-50在不同升温速率下热分解第一阶段的动力学参数,结果见表3。
由表3可知,计算得到的不同升温速率下的E和lgA 值有小幅度偏差,但其平均值与Flynn-Wall-Ozawa法和Kissinger法所得结果基本一致。
因此,TKX-50热分解第一阶段的最概然机理函数的积分式为,相应微分式为,表明TKX-50热分解第一阶段受二维扩散机理控制,反应机理服从的Jander方程。将第一阶段的E 和lgA 值代入方程式(7),得到TKX-50热分解第一阶段的反应动力学方程(见式(8)):
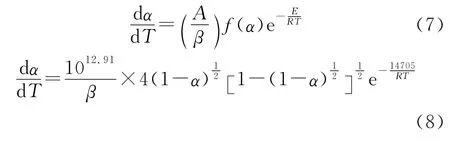
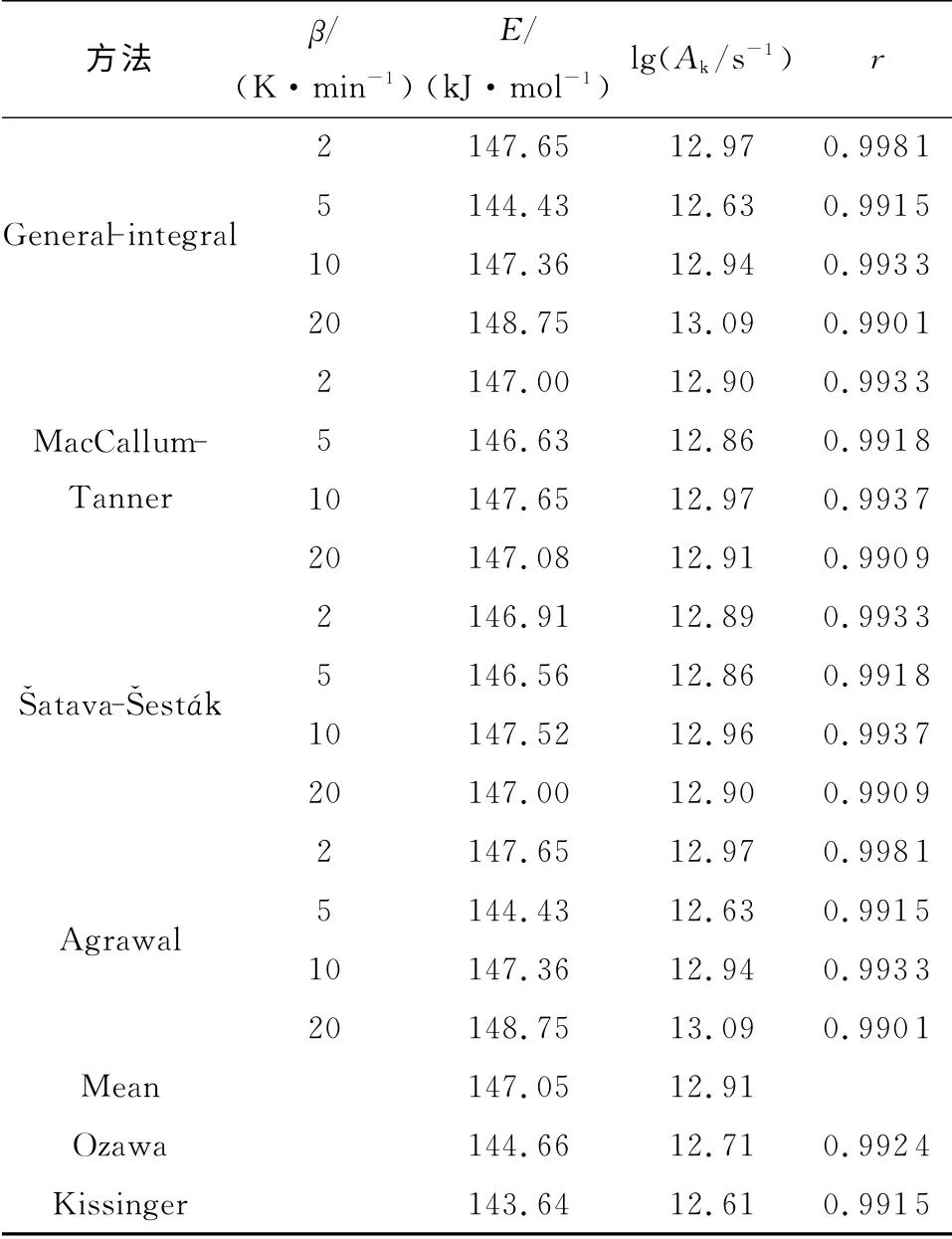
表3 TKX-50热分解第一阶段反应动力学参数的计算值Table 3 Calculated values of kinetic parameters of thermal decomposition reaction for the first stage of TKX-50
3 结 论
(1)TKX-50的热分解可分为两个阶段,升温速率为10.0K/min时,第一阶段的峰值温度为239.65℃,第二阶段的峰值温度为260.57℃,两阶段质量损失约为84.2%。
(2)TKX-50热分解第一阶段的动力学参数为:E 和lg(A/s-1)分别为147.05kJ/mol和12.91,热分解反应动力学方程可表示为:
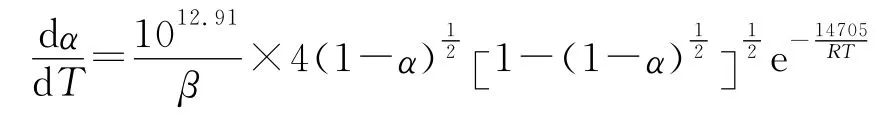
[1] 刘晓建,张慧娟,林秋汉,等.唑类含能离子化合物的合成研究进展[J].火炸药学报,2010,33(1):6-10.LIU Xiao-jian,ZHANG Hui-juan,LIN Qiu-han,et al.Progress of study on the synthesis of azole energetic ionic compounds[J].Chinese Journal of Explosives and Propellants,2010,33(1):6-10.
[2] Gao H,Shreeve J M.Azole-based energetic salts[J].Chemical Review,2011,111:7377-7426.
[3] 彭蕾,李玉川,杨雨璋,等.双环和多环四唑含能化合物的合成研究进展[J].有机化学,2012,32:667-676.PENG Lei,LI Yu-chuan,YANG Yu-zhang,et al.Research progress in synthesis of energetic compounds of bicyclo-and multicyclo-tetrazoles[J].Chinese Journal of Organic Chemistry,2012,32:667-676.
[4] Fischer N,Fischer D,Klapoteke T M,et al.Pushing the limits of energetic materials-the synthesis and characterization of dihydroxylammonium 5,5-bistetrazole-1,1-diolate[J].J Mater Chem,2012,22:20418-20422.
[5] Tselinskii I V,Mel′nikova S F,Romanova T V.Synthesis and reactivity of carbohydroximoyl azides:aliphatic and aromatic carbohydroximoyl azides and 5-substituted 1-hydroxytetrazoles based thereon[J].Russian Journal of Organic Chemistry,2001,37(3):430-436.
[6] Fischer N,Klapoteke T M,Reymann M.Nitrogenrich salts of 1H,1′H-5,5′-bitetrazole-1,1′-diol:energetic materials with high thermal stability[J].Eur J Inorg Chem,2013:2167-2180.
[7] 毕福强,付小龙,邵重斌,等.高能单元推进剂TKX-50能量特性计算研究[J].化学推进剂与高分子材料,2013,11(5):70-73.BI Fu-qiang,FU Xiao-long,SHAO Chong-bin,et al.Calculation of energy characteristics of high energy monopropellant TKX-50[J].Chemical Propellants and Polymeric Materials,2013,11(5):70-73.
[8] Ozawa T.A new method of analyzing thermogravimetric data[J].Bul Chem Soc Jpn,1965,38:1881-1886.
[9] Kissnger H E.Reaction Kinetics in differential thermal analysis[J]. Anal Chem,1957,29 (11):1702-1706.
[10]胡荣祖,史启祯.热分析动力学[M].北京:科学出版社,2001:127-131.
[11]Coats A W,Redfern J P.Kinetic parameters from thermogravimetric data[J].Nature,1975,201:68-69.
[12]MacCallum J R,Tanner J.The kinetics of thermogravimtry[J].Eur Polymer J,1970,6(7):1033-1039.
[13]Šatava F,Šesták J.Computer calculation of the mechanism and associated kinetic data using anon-isothermalintegralmethod[J].J ThermAnal,1975,8(3):477-489.
[14]Agrawal R K.A new equation for modeling nonisothermal reactions[J].J Therm Anal,1987,32(1):149-156.
[15]Sharp J H ,Wendworth S A.Kinetic analysis of thermogravimetric data[J].Anal Chem,1969,41(14):2060-2062.

