SCCmec遗传元件及其在耐甲氧西林金黄色葡萄球菌分子分型中的应用
杨延成,程航,周人杰,饶贤才
SCC遗传元件及其在耐甲氧西林金黄色葡萄球菌分子分型中的应用
杨延成1,程航1,周人杰2,饶贤才1
1. 第三军医大学基础部微生物学教研室,重庆 400038;2. 第三军医大学新桥医院急救部,重庆 400038
携带基因簇的葡萄球菌盒式染色体(Staphylococcal chromosome cassette, SCC)遗传元件的获得是耐甲氧西林金黄色葡萄球菌(Methicillin-resistant, MRSA)耐药的主要原因。SCC由一个基因簇、一个染色体重组酶()基因簇及3个J区组成。基因簇含有及其调控基因,基因编码的耐药决定簇使MRSA对β-内酰胺类抗生素耐药;基因簇编码的重组酶负责SCC元件的整合与切离;J区差异大,导致不同来源MRSA菌株携带SCC的大小不一,在组成上也具有多样性。这些特征为利用SCC元件进行MRSA分型创造了条件。文章介绍了SCC元件的结构和功能,综述了基于SCC的MRSA分型研究。
金黄色葡萄球菌;耐药性;SCC元件;分子分型
金黄色葡萄球菌()简称金葡菌,是医院内获得性感染的重要病原菌,同时在社区获得性感染中,金葡菌也是引起皮肤和软组织等感染的主要原因[1,2]。1961年在英国首次发现耐甲氧西林的金葡菌 (Methicillin-resistant, MRSA)感染以后,MRSA便迅速传播和蔓延,20世纪70年代后期已遍布世界各个角落,成为全球感染性病原微生物[3]。在医院获得感染的MRSA被称为医院获得性MRSA(Hospital-acquired MRSA, HA-MRSA),常通过接触传播,感染年龄较大、免疫力低下、皮肤有伤口或有导管植入的患者,健康人很少被感染。反之,在社区环境中获得感染的被称为社区获得性MRSA (Community-acquired MRSA, CA-MRSA),被感染者通常为健康人,无相关HA-MRSA感染的危险因素,如住院、羁患慢性病等[4~6]。
CA-MRSA和HA-MRSA另一个不同点是,前者主要对甲氧西林等β-内酰胺类耐药,而HA-MRSA除耐受β-内酰胺类抗生素外,还表现为对氨基糖苷类、大环内酯类等多种抗生素耐药,常常具有多重耐药性[7~10]。MRSA耐药性的发生主要是甲氧西林敏感金葡菌(Methicillin-sensitive, MSSA)从其他未知宿主中获得了携带基因簇的葡萄球菌盒式染色体(Staphylococcal cassette chromosome, SCC)元件,该元件具有移动性能,可在金葡菌染色体间进行转移,且具有高度多态性,大小不一,既有共性,又有个性。对金葡菌SCC的分析,不仅可为区分CA-MRSA和HA-MRSA提供分子水平的证据,为临床治疗提供重要参考,而且可将各地的菌株分成不同的型和亚型,追溯MRSA的蔓延与传播[11]。本文对金葡菌SCC元件的基本特性、结构以及该元件在MRSA分型中的应用进行了综述。
1 SCCmec元件的特点
目前对MRSA中SCC元件的来源还不清楚,但作为遗传元件,SCC可在葡萄球菌属内菌株间转移。如在凝固酶阴性葡萄球菌中发现的SCC被认为是从MRSA中获得的[12]。虽然MRSA SCC元件的结构具有多态性,但通常具有几个共同特点(图1):(1)包含一个基因簇,拥有编码对β-内酰胺类抗生素耐药的决定簇基因及其调控基因;(2)包含一个负责SCC元件移动的染色体重组酶编码基因簇(Cassette chromosome recombinases,);(3)保守的末端重复序列;(4)整合于一保守的核糖体RNA(rRNA)甲基转移酶编码基因()的3'端,SCC元件的插入对rRNA甲基转移酶的表达和功能没有影响[13~15]。
2 SCCmec的结构与功能
基因簇和基因簇是SCC元件中两个重要的组分,前者负责SCC元件所携带的耐药表型,后者负责SCC元件与金葡菌染色体的整合与切离。
2.1 mec基因簇
完整的基因簇由基因、调节基因()和插入序列组成。根据调节基因的完整性、是否有插入序列等将基因簇分为A、B、C、D 4种类型。A型(class A)为原型,包括基因、上游的激活基因()和阻遏基因(),下游的高变区(HVR)和插入序列IS431;class B包括基因、截短的基因(因插入IS1272所致)、高变区和下游的IS431序列,无基因;class C包括、截短的(因插入IS431而产生)、高变区和下游的IS431序列;class D包含一个基因,基因则发生截短突变或缺失,其下游不含插入序列[13,14,16]。根据插入序列的方向,class C又可分为2种亚型:class C1的上游的IS431序列与下游的IS431序列有相同的方向,而class C2中基因上、下游的IS431序列方向则相反。
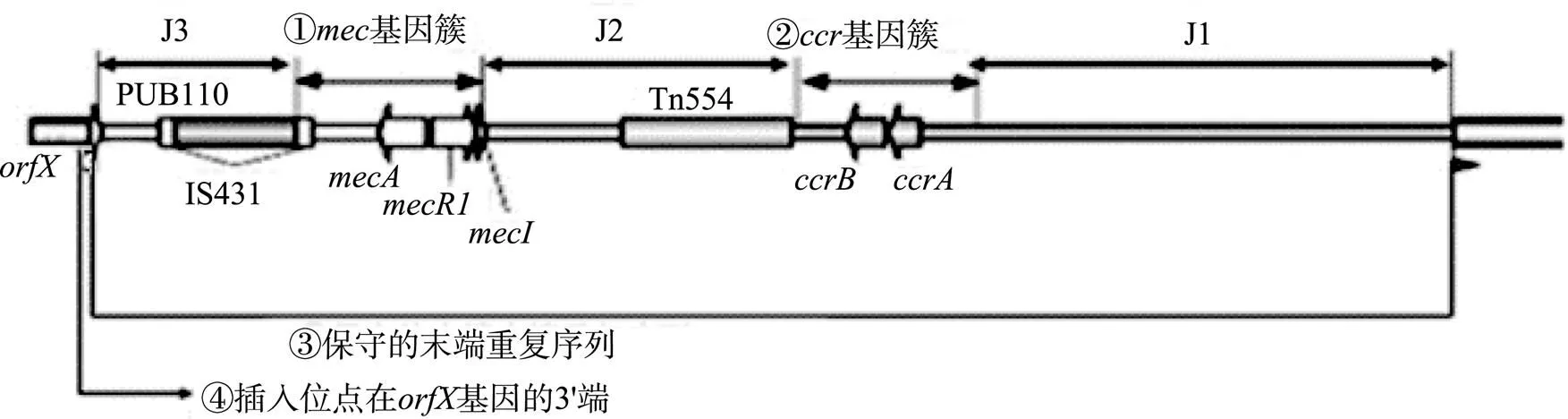
图1 MRSA SCCmec元件的基本结构和特点
尽管基因簇有不同的型别,但目前仅发现MRSA中存在该基因簇,甲氧西林敏感菌MSSA中缺乏[13],这表明基因簇与MRSA的耐药表型密切相关。通常在没有药物选择压力下,MRSA SCC上耐药基因的表达受到严格的控制[17]。基因簇的编码的阻遏蛋白MecI结合在的启动子区,使表达处于抑制状态;当有抗生素(如青霉素、苯唑西林等)存在时,抗生素一方面攻击正常细胞壁肽聚糖合成酶,即青霉素结合蛋白2(Penicillin-binding protein 2, PBP2)的转肽酶功能域,使其失活而丧失合成细胞壁的能力,另一方面可作为诱导剂,与分布在细菌胞膜上的诱导分子MecR1蛋白结合,使其发生自裂解而发挥肽酶活性,分解结合在启动子上的阻遏蛋白MecI,从而启动的表达,产生PBP2a,代替PBP2的转肽酶活性,继续细菌肽聚糖的合成,维持MRSA耐药性(图2),MecR1-MecI组成的二组份调控系统对表达起着关键作用。然而MecR1对抗生素的应答敏感性不一,对头孢西丁敏感,而对甲氧西林和苯唑西林的敏感性较低[18]。2012年,Arede等[19]报道了在基因的下游存在一个基因,其产物MecR2可与阻遏蛋白MecI直接相互作用,降低MecI的稳定性,阻扰其与基因的启动子结合,并有利于MecI被细菌胞浆蛋白酶降解,促进金葡菌PBP2a的产生和耐药性表现。因此MecR2又称为抗阻遏因子(anti-repressor)。之后,Arede等[20]又通过定点突变方法证实MecR2是金葡菌对甲氧西林耐药所必须的调节因子,从而建立了MRSA菌基因调控的三元(MecR1-MecI-MecR2)学说。
此外,金葡菌产青霉素酶(BlaZ)基因受的调控,其阻遏蛋白BlaI也能识别的启动子,调控的表达,但BlaI的解离仅能由BlaR1完成,MecR1对MecI有裂解作用,而对BlaI没有作用[18]。
基于上述基因簇的结构和调控特点,如果在调节基因不完整或缺失时(如Class B, C, D),的表达将不受控制,即的表达由调节型转变为组成型持续表达,在此状态下,MRSA菌耐药表型的变化是值得关注的。
2.2 ccr基因簇
基因簇由基因和其两边的编码框(s)组成。基因编码的重组酶具有位点特异性,即通过位点特异的DNA重组作用,能将许多外源的耐药基因整合到SCC元件中,使SCC元件呈现多重耐药性;同样这些重组酶也能识别相对应的SCC元件,使之从葡萄球菌染色体中精确地切离,通过转移,并整合到其他葡萄球菌的菌株中,实现葡萄球菌菌株之间的信息交换,以适应不同环境条件,尤其是不同抗生素压力下的生存需求[21]。目前,在MRSA中已鉴定的基因有3种,称为、及。通过对不同地区来源的MRSA菌株分析发现,和分别拥有4种以上的变异型,而仅发现一种[22]。基于基因型的不同将基因簇分为7型,用数字表示:如1型拥有和基因(type-1);2型携带和基因(type-2);3型由和基因构成(type-3);4型则携带和基因(type-4);5型比较特殊,仅含基因(type-5);6型携带和基因(type-6);7型则携带和基因(type-7)[16]。研究表明,不同类型的SCC元件至少含有一个基因,至于携带2个基因是否会增加外源耐药基因在SCC中的整合,或者增加SCC元件从MRSA染色体上的切离?目前尚无直接证据。探索SCC元件的切离机制,寻找SCC元件从MRSA染色体上的消除手段,对控制MRSA蔓延有意义。
图2 MRSA SCC耐药基因的表达调控
2.3 J区
除了和基因簇外,SCC元件还包含3个“junkyard”(J)区(图1),这些区域虽然不是构成SCC元件所必需,但这些区域常常携带一些抗生素耐药决定簇,可赋予SCC元件表达更多的耐药表型。J区内编码耐药性的整合性质粒序列的存在或缺失可以作为SCC元件亚型分类的标准[14,17,23]。
3 SCCmec元件的分类
迄今为止,从MRSA分离株中已发现11种SCC类型(图3)。最初的Ⅰ型SCC元件于1961年在英国发现,也是全球第1株MRSA,代表菌株为NCTC10442;Ⅱ型SCC则于1982年在日本发现,N315为代表菌株;1985年,在新西兰流行的MRSA中发现了Ⅲ型SCC,代表株为MRSA 85/2082[24]。20世纪90年代,Oliveira等(MRSA HDE288)及Ma等(MRSA CA05,8/6-3P)从各自的代表菌株中发现2种不同的IV型SCC元件[14],进一步研究后,将前者重新定义为VI型SCC元件。Deurenberg等[25]于2004年在澳大利亚发现V型SCC元件,代表菌株MRSA WIS。VII型SCC元件于2007年在台湾发现[26],2008年在加拿大由Zhang等[27]发现VIII型SCC元件;2011年日本学者Li等[28]在CC398克隆群金葡菌中发现IX型(JCSC6943)和X型(JCSC6945)SCC元件;2011年英国科学家又发现XI型(LGA251) SCC元件[29,30]。其中,IX、X和XI型SCC元件主要存在于动物MRSA分离株中,也可存在于人源分离株中。人源MRSA菌株中主要携带SCCⅠ~VIII型元件,Ⅰ~V型为常见,占分离株的90%以上。本课题组曾对2009~2012年间收集于北京、上海、重庆、广州、沈阳、乌鲁木齐等6城市9所医院的517株金葡菌进行了分型研究,鉴定出MRSA 309株(阳性率59.8%),并对这些MRSA菌株进行分子分型研究,发现SCCⅠ~V型的比例分别为6.2%(19/309)、22.0%(68/309)、57.6%(178/309)、8.7%(27/309)、4.2%(13/309),另有4株未分型(占1.3%)[31]。表明我国流行的MRSA菌株以SCCIII型为主,其次为II型,SCCI~V型占绝对优势(98.7%)。
综上所述,金葡菌SCC遗传元件的分类是按它们被发现的顺序使用罗马体数字来命名的。各型SCC遗传元件中的和基因簇的组成也有区别,通常使用数字来区分基因簇,使用大写字母来区分基因簇的组成。如Ⅰ型SCC元件包含Type-1和class B基因簇,人类流行MRSA菌株的主要SCC元件之基因簇构成见表1所示。在各不同类型的SCC元件中,除主要组分基因簇和基因簇外,在J区也发现存在结构多样性,包含不同类型的转座子和插入序列。因此,根据J区的多态性,SCC元件还可以更深入地分为不同的亚型[32]。SCC元件亚型的区分主要根据J区上特征性遗传序列确定,例如是否含有特定功能的基因,有否假基因,以及是否含有可移动的遗传因子及其类型,例如转座子、插入序列和质粒的种类和数量等。通常,SCC元件携带的遗传因子多数含有耐药决定簇的编码基因,故SCC元件中携带的遗传因子愈多,耐药谱就会愈广,当然SCC元件中携带的遗传因子愈多,元件也就愈大。
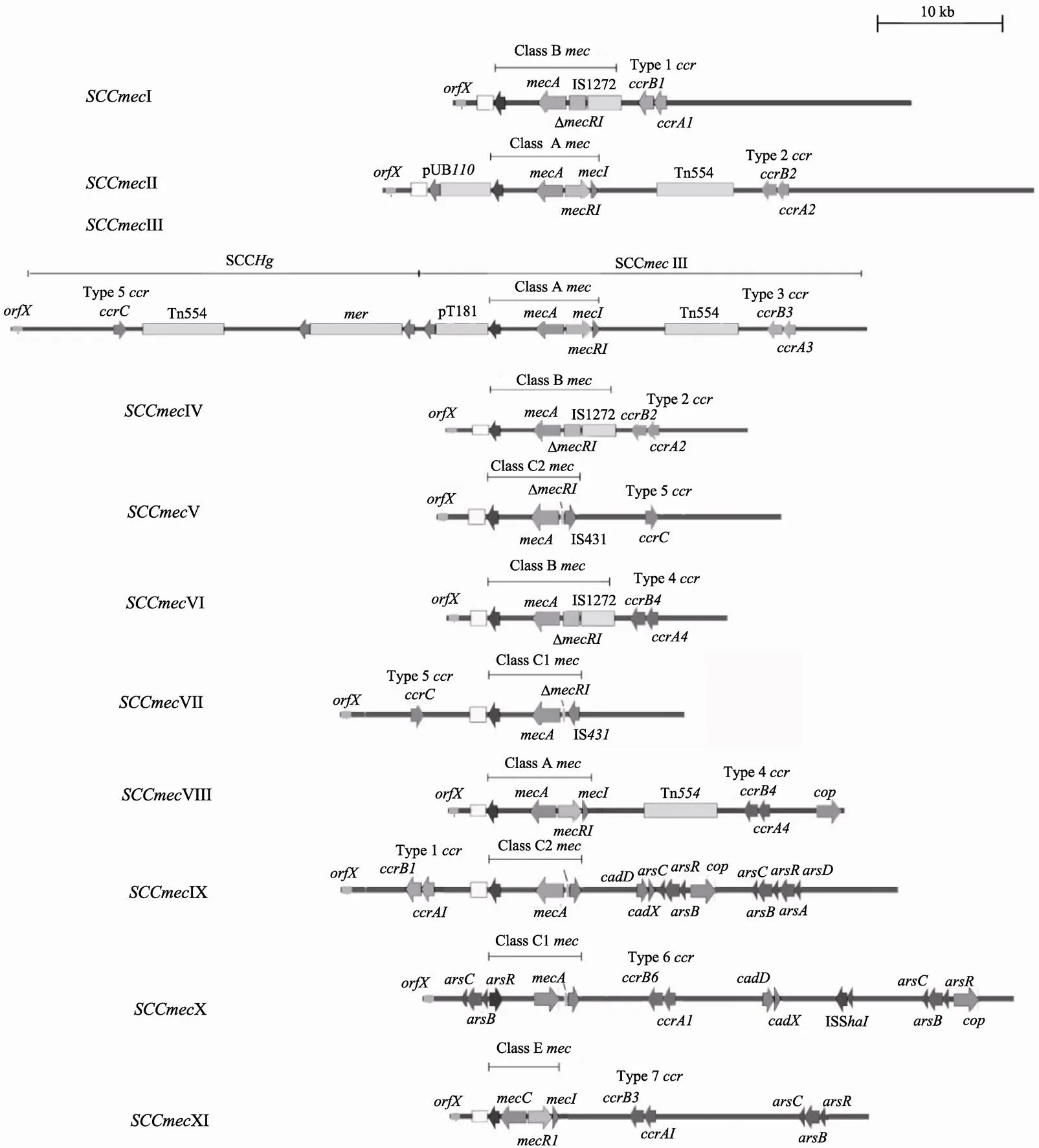
图3 11种SCCmec元件的结构
在已发现的SCC元件中,Ⅲ型最大,约67 kb,由SCC元件和一个Ⅲ型SCC元件整合后形成[16]。从临床耐药表型上看,Ⅰ型、IV型、V型、VI型、VII型MRSA菌株通常只对β-内酰胺类抗生素耐药,而Ⅱ型和Ⅲ型分离株通常表现为多重耐药,这可能与较大的SCC元件中整合了除之外的耐药基因有关[32,33]。例如,II型MRSA菌株通常携带的耐药基因会比Ⅰ型多,除基因外,Ⅱ型菌携带的PUB110质粒可编码对氨基糖苷类抗生素的耐药性,携带的Tn554型转座子则含有红霉素耐药基因。在目前发现的SCC元件中,III型是含耐药基因种类最多者,该型元件中整合的前噬菌体φTn554可编码对重金属镉的抗性,基因可编码汞抗性,质粒pT181能编码对四环素抗性,转座子Tn554则携带红霉素和大观霉素的抗性基因。故Ⅱ型和Ⅲ型MRSA菌株通常表现为多重耐药性,也是我国的主要流行株[34,35]。新发现的VIII型SCC元件携带有红霉素等耐药基因[27]。从目前已有的分子流行病学证据来看,Ⅰ型、Ⅱ型和Ⅲ型SCC元件主要存在于医院获得型MRSA(HA-MRSA)分离株中;IV型、V型SCC元件则主要存在于CA-MRSA中。由于IV型和V型元件的长度相对较短,移动更为轻便,故相对容易在不同遗传背景的流行菌株间转移,每一次成功转移,往往造成新耐药菌的出现和流行,甚至造成暴发流行[25]。
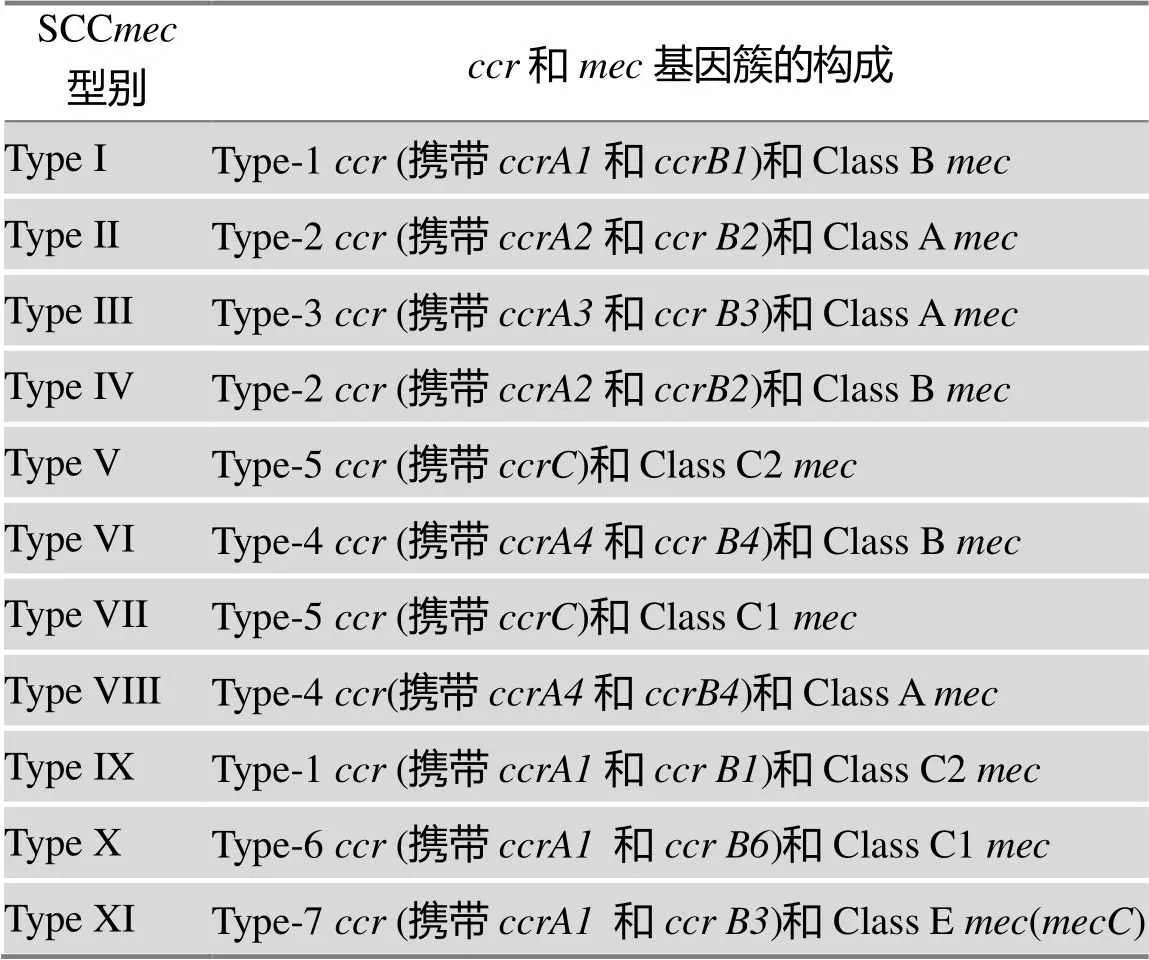
表1 MRSA中已发现的SCCmec类型
4 异型SCCmec元件
经典的SCC元件含有一个基因簇、一个基因簇和3个J区。近年来,发现少数特殊的SCC元件可携带2个基因簇,称为异型SCC(SCCvariant)。例如,金黄色葡萄球菌ZH47株携带的SCC元件是由1个5型的基因簇()、1个2型的基因簇(和)、1个Class B2基因簇和1个与IV型SCC元件有同源性的J1区共同组成[23]。当1个SCC元件携带2个基因簇时,通常怀疑该元件是否隐藏了某个或某些SCC元件的组成元素,如基因簇,其形成过程也许是复杂的。有研究者推测,当一个SCC元件与另外一个类似元件发生整合时,部分同源序列发生重组交换,而基因簇却保留了下来,进而在一个SCC元件中出现了2个基因簇;也有可能这两个基因簇是由2个含有正向重复序列的SCC元件在整合时缺失了包含一个基因簇的起始结合区而产生[34]。基因簇的主要功能是负责SCC元件的整合与切离,至于含两个基因簇的SCC元件的形成,以及两个基因簇是否会增加元件的切离和重组效率均有待进一步进行深入探讨。
5 SCCmec元件在MRSA分子分型中的应用
病原菌的分子分型是进行流行病学调研和菌株溯源的重要手段。目前,针对MRSA菌株的分子分型方法主要包括SCC分型、脉冲场凝胶电泳分型(Pulsed-field gel electrophoresis, PFGE)、多位点序列分型(Multilocus sequence typing, MLST)和葡萄球菌A蛋白基因(Staphylococcal protein A gene,)分型等[31]。在这些常用的分子分型方法中,MLST和均是基于对MRSA菌株特定靶基因的序列分析,有公共的数据库做参考(http:\www.mlst.net,http:\server.ridom.de),有利于世界范围内不同实验室间的结果比较,因此被广泛应用;PFGE分型法则对全基因组进行分析,分辨率高,需要脉冲场电泳仪,操作较繁琐,费时,仅限于对本实验室检测结果的分析;SCC检测是MRSA分型的基本方法之一,分辨率中等,操作相对简便、快速,便于规模化分型分析[36]。金葡菌常用分子分型方法的比较见表2。一般而言,有条件的实验室,往往可采用2种以上方法对MRSA进行检测分型,这对于揭示MRSA的进化路线、确定暴发流行菌株间关系、追踪基因的水平转移与播散有重要意义。
针对MRSA菌株SCC元件进行分型的基本方法是:首先利用一对PCR扩增引物检测菌株是否存在基因簇的关键结构基因;然后再依据SCC元件中两个基因簇(和)的结构和型别设计特异性PCR引物进行扩增鉴定,通过PCR扩增产物的有无以及大小来区分不同的SCC元件类型。在人源MRSA分离株中,8种主要的SCC元件型别的PCR检测引物如表3所示(共9对引物)[37],这些PCR产物对待检基因组DNA扩增产物的有和无,以及扩增片段的大小均对MRSA菌SCC型别的鉴定有实际意义(表4)。

表2 金葡菌不同分子分型方法的优劣比较
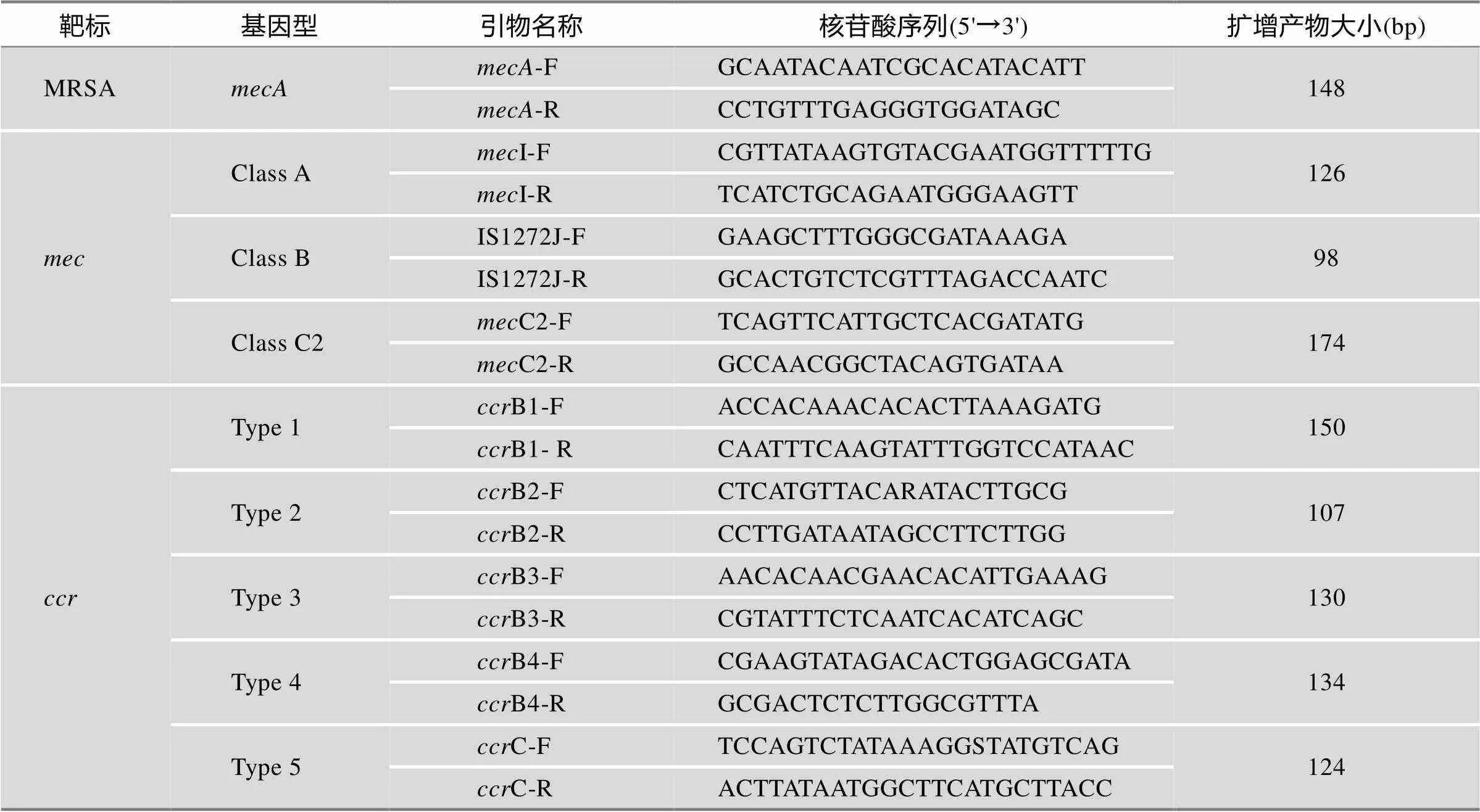
表3 SCCmec元件基本型别PCR鉴别引物
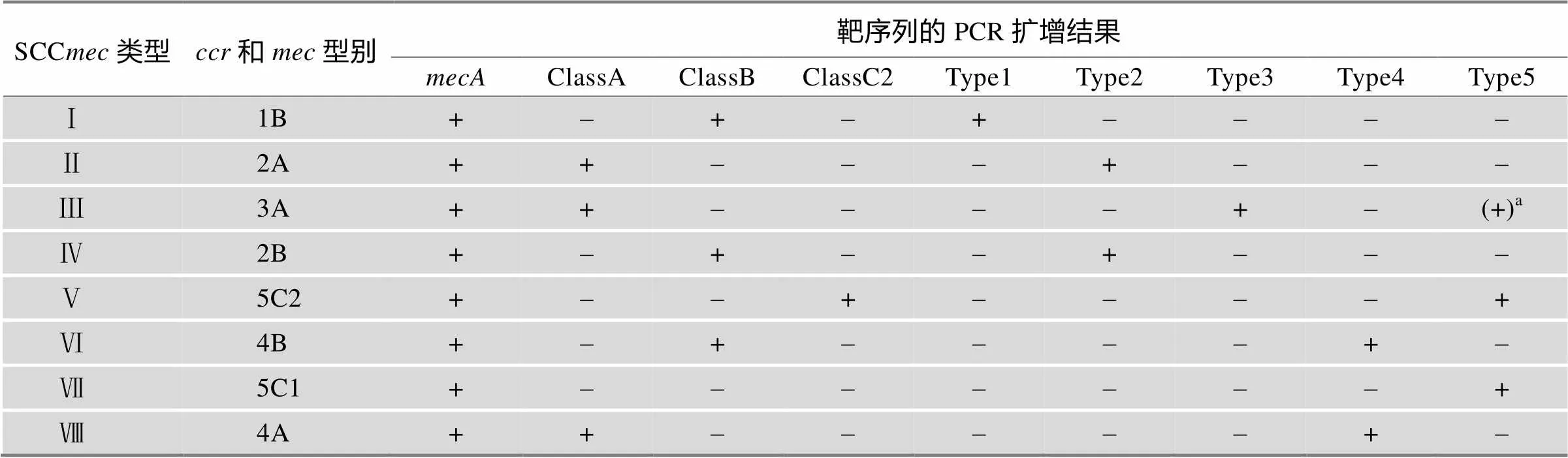
表4 耐甲氧西林金黄色葡萄球菌SCCmec基本型别的PCR鉴定结果
注:a(+)表示也存在于SCCⅢ元件的SCC组件中。
基于HA-MRSA和CA-MRSA在菌株致病性、流行特征及耐药性方面的明显差异,正确区分HA-MRSA和CA-MRSA对临床MRSA感染的治疗和疾病预后有重要指导意义。目前,国际上对HA-MRSA和CA-MRSA的区分主要采用美国CDC的标准[38],即对有下列医院MRSA感染危险因素之一的患者体内分离的菌株定义为HA-MRSA,这些因素包括:(1)在就诊或入院时,体内至少有一种植入性医疗器具,如导管、支架、固定架等;(2)有MRSA感染和定植的病史;(3)在获得培养菌株的前一年内有过住院、手术、透析等记录;(4)在入院48 h之后从正常无菌部位采集的标本中分离出MRSA菌。反之,从入院48 h之内,且不具有上述MRSA感染危险因素的患者体内分离的菌株定义为CA-MRSA。从定义可以看出,详细而准确的记录是判断HA-MRSA和CA-MRSA的关键,然而在临床实践中,很多菌株会因病历资料不全而难以区分。通过对MRSA进行SCC分型的研究,发现全球范围内HA-MRSA菌株主要为SCCI、II和III型,而CA-MRSA主要为SCCIV和V型,这种特定的SCC型别特征为临床HA-MRSA和CA-MRSA的区分提供了重要的分子水平证据,相对更客观。因此,有研究者提议对HA-MRSA和CA-MRSA的区分采用临床资料加SCC分型相结合的方法[39]。
对MRSA进行SCC分型的研究还发现,不同地区存在特定遗传背景的主要流行克隆,包括HA-MRSA和CA-MRSA,这为MRSA的流行病学监控提供了重要证据。如在欧洲,德国和比利时主要流行的HA-MRSA为Iberian和Southern Germany克隆,均为SCCI型[40];英国流行的EMRSA-16克隆为SCCII型[41];在亚洲,韩国和日本主要流行的New York/Japan克隆为SCCII型,而在印度及我国流行的Brazilian/Hungarian克隆为SCCIII型[42]。对CA-MRSA流行克隆而言,美国流行的USA300、荷兰流行的USA1000和USA300、韩国流行的USA700以及我国香港流行的USA1100和USA1000均为SCCIV型,而英国流行的EMRSA-15克隆为SCCV型[41]。
6 结 语
SCC染色体盒是在耐甲氧西林金葡菌中普遍存在的一种可移动遗传元件,大小在21~67 kb之间,和基因簇是该元件的两个重要组分。依据两个基因簇的组成不同,目前已发现11种SCC型别,其中人源分离株以SCCI~VIII型为主。SCC元件可自主从染色体上切离、环化,以一定的方式在葡萄球菌菌株间转移,通过在受体菌染色体上的成功重组,使受体菌获得新的耐药性,是金葡菌耐药性传递的重要方式之一。SCC元件的转移、重组与整合,以及与外源插入序列、转座子、质粒的序列交换是SCC元件具有高度多态性的重要原因,也正因为这些遗传事件的存在,不断会有新的SCC型别产生,需要建立MRSA监测网络,对各地流行的菌株进行持续的SCC分型分析,同时联合已有的MRSA分子分型方法,以达到探索菌株变迁、进化及溯源的目的,为MRSA感染性疾病控制措施的制定提供重要借鉴。
[1] Holland TL, Arnold C, Fowler VG Jr. Clinical management ofbacteremia: a review., 2014, 312(13): 1330–1341.
[2] Hepburn L, Prajsnar TK, Klapholz C, Moreno P, Loynes CA, Ogryzko NV, Brown K, Schiebler M, Hegyi K, Antrobus R, Hammond KL, Connolly J, Ochoa B, Bryant C, Otto M, Surewaard B, Seneviratne SL, Grogono DM, Cachat J, Ny T, Kaser A, Török ME, Peacock SJ, Holden M, Blundell T, Wang L, Ligoxygakis P, Minichiello L, Woods CG, Foster SJ, Renshaw SA, Floto RA. A Spaetzle-like role for nerve growth factor β in vertebrate immunity to., 2014, 346(6209): 641–646.
[3] Wan MT, Chou CC. Spreading of β-lactam resistance gene () and methicillin-resistantthrough municipal and swine slaughterhouse wastewaters., 2014, 64: 288–295.
[4] Wilcox MH. MRSA new treatments on the horizon: current status., 2011, 42(Suppl 5): S42–S44.
[5] Deurenberg RH, Stobberingh EE. The evolution of., 2008, 8(6): 747–763.
[6] David MZ, Cadilla A, Boyle-Vavra S, Daum RS. Replacement of HA-MRSA by CA-MRSA infections at an academic medical center in the midwestern United States, 2004–5 to 2008., 2014, 9(4): e92760.
[7] Byrne FM, Wilcox MH. MRSA prevention strategies and current guidelines., 2011, 42( Suppl 5): S3–S6.
[8] Rossolini GM, Arena F, Pecile P, Pollini S. Update on the antibiotic resistance crisis., 2014, 18: 56–60.
[9] Reardon S. Antibiotic resistance sweeping developing world.,2014, 509(7499): 141–142.
[10] Hede K. Antibiotic resistance: An infectious arms race.,2014, 509(7498): S2–S3.
[11] International Working Group on the Classification of Staphylococcal Cassette Chromosome Elements (IWG-SCC). Classification of staphylococcal cassette chromosome(SCC): guidelines for reporting novel SCCelements., 2009, 53(12): 4961–4967.
[12] Garza-González E, Morfín-Otero R, Llaca-Díaz JM, Rodriguez-Noriega E. Staphylococcal cassette chromosome(SCC) in methicillin-resistant coagulase-negative staphylococci. A review and the experience in a tertiary-care setting., 2010, 138(5): 645–654.
[13] Haque N, Bari MS, Bilkis L, Haque S, Sultana S. Methicillin resistant- an overview., 2011, 20(1): 159–164.
[14] Oliveira DC, de Lencastre H. Methicillin-resistance inis not affected by the overexpression in trans of thegene repressor: a surprising observation., 2011, 6(8): e23287.
[15] 孙丹丹, 马笑雪, 胡建, 罗恩杰. 耐甲氧西林金黄色葡萄球菌染色体盒的研究进展. 微生物学杂志, 2011, 31(3): 73–80.
[16] Berglund C, Ito T, Ikeda M, Ma XX, Söderquist B, Hiramatsu K. Novel type of staphylococcal cassette chromosomein a methicillin-resistantstrain isolated in Sweden., 2008, 52(10): 3512–3516.
[17] Leski TA, Tomasz A. Role of penicillin-binding protein 2 (PBP2) in the antibiotic susceptibility and cell wall cross- linking of: evidence for the cooperative functioning of PBP2, PBP4, and PBP2A., 2005, 187(5): 1815–1824.
[18] Berger-Bächi B, Rohrer S. Factors influencing methicillin resistance in staphylococci., 2002, 178(3): 165–171.
[19] Arêde P, Milheiriço C, de Lencastre H, Oliveira DC. The anti-repressorpromotes the proteolysis of therepressor and enables optimal expression of β-lactam resistance in MRSA., 2012, 8(7): e1002816.
[20] Arêde P, Oliveira DC. Proteolysis ofrepressor is essential for expression of methicillin resistance by Staphylococcus aureus., 2013, 57(4): 2001–2002.
[21] Rolo J, de Lencastre H, Miragaia M. High frequency and diversity of cassette chromosome recombinases (ccr) in methicillin-susceptible Staphylococcus sciuri., 2014, 69(6): 1461–1469.
[22] Lindsay JA. Genomic variation and evolution of., 2010, 300(2–3): 98–103.
[23] Heusser R, Ender M, Berger-Bachi B, McCallum N. Mosaic staphylococcal cassette chromosomecontaining two recombinase loci and a newcomplex, B2., 2007, 51(1): 390–393.
[24] Malachowa N, DeLeo FR. Mobile genetic elements of., 2010, 67(18): 3057–3071.
[25] Deurenberg RH, Stobberingh EE. The molecular evolution of hospital- and community-associated methicillin-resistant., 2009, 9(2): 100–115.
[26] Takano T, Higuchi W, Zaraket H, Otsuka T, Baranovich T, Enany S, Saito K, Isobe H, Dohmae S, Ozaki K, Takano M, Iwao Y, Shibuya M, Okubo T, Yabe S, Shi D, Reva I, Teng LJ, Yamamoto T. Novel characteristics of community- acquired methicillin-resistantstrains belonging to multilocus sequence type 59 in Taiwan., 2008, 52(3): 837–845.
[27] Zhang K, McClure JA, Elsayed S, Conly JM. Novel staphylococcal cassette chromosometype, tentatively designated type VIII, harboring class Aand type 4 ccr gene complexes in a Canadian epidemic strain of methicillin-resistant., 2009, 53(2): 531–540.
[28] Li S, Skov RL, Han X, Larsen AR, Larsen J, Sørum M, Wulf M, Voss A, Hiramatsu K, Ito T. Novel types of staphylococcal cassette chromosomeelements identified in clonal complex 398 methicillin-resistantstrains., 2011, 55(6): 3046–3050.
[29] García-Álvarez L, Holden MTG, Lindsay H, Webb CR, Brown DFJ, Curran MD, Walpole E, Brooks K, Pickard DJ, Teale C, Parkhill J, Bentley SD, Edwards GF, Girvan EK, Kearns AM, Pichon B, Hill RLR, Larsen AR, Skov RL, Peacock SJ, Maskell DJ, Holmes MA. Meticillin-resistantwith a novelhomologue in human and bovine populations in the UK and Denmark: a descriptive study., 2011, 11(8): 595–603.
[30] Harrison EM, Paterson GK, Holden MTG, Morgan FJE, Larsen AR, Petersen A, Leroy S, De Vliegher S, Perreten V, Fox LK, Lam TJGM, Sampimon OC, Zadoks RN, Peacock SJ, Parkhill J, Holmes MA. Aisolate with a newallotype., 2013, 57(3): 1524–1528.
[31] Cheng H, Yuan WC, Zeng FY, Hu QW, Shang WL, Tang DH, Xue WC, Fu JF, Liu J, Liu N, Zhu JM, Yang J, Hu Z, Yuan JZ, Zhang X, Li S, Chen ZJ, Hu XM, Rao XC. Molecular and phenotypic evidence for the spread of three major methicillin-resistantclones associated with two characteristic antimicrobial resistance profiles in China., 2013, 68(11): 2453–2457.
[32] Milheirico C, Oliveira DC, de Lencastre H. Multiplex PCR strategy for subtyping the staphylococcal cassette chromosometype Ⅳ in methicillin-resistant: 'SCCⅣ multiplex'., 2007, 60(1): 42–48.
[33] Mohammadi S, Sekawi Z, Monjezi A, Maleki MH, Soroush S, Sadeghifard N, Pakzad I, Azizi-Jalilian F, Emaneini M, Asadollahi K, Pourahmad F, Zarrilli R, Taherikalani M. Emergence of SCCtype Ⅲ with variable antimicrobial resistance profiles andtypes among methicillin-resistantisolated from healthcare- and community-acquired infections in the west of Iran., 2014, 25: 152–158.
[34] Zong ZY, Lü XJ. Characterization of a new SCCelement in., 2010, 5(11): e14016.
[35] Turlej A, Hryniewicz W, Empel J. Staphylococcal cassette chromosome(Scc) classification and typing methods: an overview., 2011, 60(2): 95–103.
[36] Struelens MJ, Hawkey PM, French GL, Witte W, Tacconelli E. Laboratory tools and strategies for methicillin-resistantscreening, surveillance and typing: state of the art and unmet needs., 2009, 15(2): 112–119.
[37] Chen L, Mediavilla JR, Oliveira DC, Willey BM, de Lencastre H, Kreiswirth BN. Multiplex real-time PCR for rapid Staphylococcal cassette chromosometyping., 2009, 47(11): 3692–3706.
[38] Klevens RM, Morrison MA, Nadle J, Petit S, Gershman K, Ray S, Harrison LH, Lynfield R, Dumyati G, Townes JM, Craig AS, Zell ER, Fosheim GE, McDougal LK, Carey RB, Fridkin SK, Active Bacterial Core Surveillance (ABCs) MRSA Investigators. Invasive methicillin-resistantinfections in the United States., 2007, 298(15): 1763–1771.
[39] Hu QW, Cheng H, Yuan WC, Zeng FY, Shang WL, Tang DH, Xue WC, Fu JF, Zhou RJ, Zhu JM, Yang J, Hu Z, Yuan JZ, Zhang X, Rao Q, Li S, Chen ZJ, Hu XM, Wu XG, Rao XC. Panton—valentine leukocidin (PVL)-positive healthcare-associated methicillin-resistantisolates are associated with skin and soft tissue infections and colonized mainly by infective PVL-encoding bacteriophages.–.
[40] Schulte B, Bierbaum G, Pohl K, Goerke C, Wolz C. Diversification of clonal complex 5 methicillin-resistantstrains (Rhine-Hesse clone) within Germany., 2013, 51(1): 212–216.
[41] Miller RR, Price JR, Batty EM, Didelot X, Wyllie D, Golubchik T, Crook DW, Paul J, Peto TEA, Wilson DJ, Cule M, Ip CLC, Day NPJ, Moore CE, Bowden R, Llewelyn MJ. Healthcare-associated outbreak of meticillin-resistantbacteraemia: role of a cryptic variant of an epidemic clone., 2014, 86(2): 83–89.
[42] Khokhlova O, Tomita Y, Hung WC, Takano T, Iwao Y, Higuchi W, Nishiyama A, Reva I, Yamamoto T. Elderly infection in the community due to ST5/SCCⅡ methicillin-resistant(the New York/Japan clone) in Japan: Panton-Valentine leukocidin-negative necrotizing pneumonia.,, 2012, doi: 10.1016/j.jmii.2012.09.004. (in Press)
(责任编委: 谢建平)
Application of the SCCelement in the molecular typing of methicillin-resistant
Yancheng Yang1, Hang Cheng1, Renjie Zhou2, Xiancai Rao1
Acquisition of the staphylococcal chromosome cassette(SCC) is one of the key reasons for the resistance of methicillin-resistant(MRSA). SCCis composed of agene complex encoding the PBP2a determinant that is responsible for the β-lactam resistance of MRSA, and agene complex encoding recombinases that mediate the integration of SCCinto and its excision from the recipient chromosome, and so-called three junkyard (J) regions of different sizes. The SCCelements carried by MRSA from different geographic locations are diverse, and each type contains characteristic DNA fragments in size. These characteristics of SCCelement may facilitate the usage of SCCin the molecular typing of MRSA strains. In this review, we summarize the structure and function of SCCelecments, and discuss the application of SCCelements in the molecular typing of MRSA.
; drug resistance; SCCelement; molecular typing
2014-11-14;
2014-12-04
国家自然科学基金项目(编号:81171622)和重庆市自然科学基金项目(编号:CSTC 2012jjA10066)资助
杨延成,硕士研究生,专业方向:金黄色葡萄球菌的分子分型研究。Tel:023-68771915; E-mail: yancheng.y@163.com
饶贤才,教授,博士导师,研究方向:金葡菌耐药性与致病机理。E-mail: raoxiancai@126.com
10.16288/j.yczz.14-397
2015-2-9 11:46:19
http://www.cnki.net/kcms/detail/11.1913.R.20150209.1146.001.html

