不同种源/家系的细叶桉苗期叶脉密度比较
杨桂丽,罗建中,林 彦
不同种源/家系的细叶桉苗期叶脉密度比较
杨桂丽,罗建中*,林 彦
(国家林业局桉树研究开发中心,广东湛江 524022)
本文以3个种源、14个家系的细叶桉苗木为试验材料,研究了其种源、家系叶脉密度的差异以及各级叶脉密度之间的相关性。结果表明:种源间总叶脉密度和次级叶脉密度的差异极显著,2°主叶脉密度差异不显著,次级叶脉密度与总叶脉密度的比值在88.07%以上;种源地China Dongmen家系间的总叶脉密度、次级叶脉密度、2°主叶脉密度之间差异极显著,2°主叶脉密度与次级叶脉密度和总叶脉密度呈极显著负相关,次级叶脉密度与总叶脉密度呈极显著正相关;其他种源内家系间叶脉密度的差异较小。
细叶桉;种源;家系;叶脉密度
叶脉系统类似于人体的血管,除了对叶片起支撑作用外,在水分与养分运输方面也起到很重要的作用[1]。叶脉通过对叶肉组织的支撑,使叶片得以最大化地展开,增加了叶片进行光合作用的面积。叶脉密度和叶脉直径等除了用来表征叶脉系统的机械支撑功能外,还可用来表征叶脉系统的水分、养分等物质运输能力,它们共同决定着叶脉系统的水力导度[2-3]。而叶脉系统的等级特征则导致了不同级别的叶脉承担着不同的功能。叶脉系统具有等级化的网络结构,直径较大的叶脉称为主叶脉(1°叶脉和2°叶脉),它们主要负责水分和养分的长距离集体流动以及对叶片的机械支撑[4]。直径较小的叶脉称为次级叶脉(3°及3°以上叶脉),它们会构成网眼状空隙,或者末端自由地伸入叶片基本组织。由于次级叶脉长度占总长度的比例极高(通常>80%)[3],因此次级叶脉在水分等物质运输上起主要作用[5]。次级叶脉密度是叶片水分供给能力的重要指标,次级叶脉密度越大,叶片蒸腾水分的能力也就越大[6-8]。同时,叶脉是植物在各种环境因素共同作用的结果,短期内受环境的影响不大,通常可代表种间及种内的差异[9]。
细叶桉()主要分布在澳大利亚维多利亚东部沿海、新南威尔士州沿海及台地、昆士兰州沿海至分水岭台地,在我国广东、广西、福建、四川、云南及江西南部均有栽培[10]。细叶桉存在丰富的遗传差异,其速生、耐旱、抗风等优良特性已经得到充分证明,其杂交种亦具有速生、抗逆、材质优良的特点,是培育桉树高耐旱品种的重要遗传材料[11]。为了分析细叶桉种源、家系间叶脉系统的差异,本研究以源自澳大利亚及我国3个种源地14个家系的细叶桉优良种质为材料,研究了种源、家系间叶脉密度的差异性,以及各级叶脉密度间的相关性,为进一步研究细叶桉叶片的水分吸收及利用途径提供基础。
1 材料和方法
1.1 试验材料和试验设计
试验在广东省湛江市南方国家级林木种苗示范基地高新温室内进行,供试材料为源自澳大利亚和我国3个种源地的14个家系细叶桉优良家系(表1)。本试验材料于2011年11月播种,12月移入基质段,2012年2月炼苗,10月移苗至装有相同基质(过筛黄心土:过筛高州细泥炭=1:1)的BF 170 × 170培养盆中。将移入培养盆各家系的苗木按4个重复、每个重复5个单株进行随机放置。适宜条件下对苗木进行同等培养、施肥等,并于2013年7月开始指标测定。

表1 细叶桉种源、家系信息
1.2 叶脉的制取及叶脉密度测定
选取每株苗木第2对完全展开成熟叶,剪下1片标记后装入密封袋带回,用腐蚀法制成叶脉标本。待标本平整晾干后用体视显微镜(SZM45T1)在10倍放大下分别摄取同一侧叶片上、中、下3个部位的叶脉照片。将照片修剪为同一规格后,使用winRHIZO软件处理,并换算得出各照片上的实际叶脉长度和实际叶片面积,按以下公式计算各图片的总叶脉密度(Total Vein Density, TVD)、2°叶脉密度(2°VD)和次级叶脉密度(Minor Vein Density, MVD)。
叶脉密度(mm·mm-2)=叶脉长度(mm)/被分析叶片面积(mm2)
1.3 数据统计处理
运用Excel进行数据统计,并用SPSS 16.0软件进行方差分析、相关性分析及Duncan多重比较。
2 结果与分析
2.1 叶脉密度种源间差异分析
对细叶桉3个种源间的TVD、2°VD及MVD的分析表明(表2),TVD及MVD的差异极显著(<0.01),而2°VD差异不显著。其中,TVD的表现为:AUS Burdekin River (3.176 mm·mm-2)>AUS Normenby River(3.068 mm·mm-2) > China Dongmen(2.941 mm·mm-2),且两两之间均差异极显著。对比3个种源地的年平均降雨量可知,细叶桉苗期的总叶脉密度可能与种源地的平均降雨量有关。
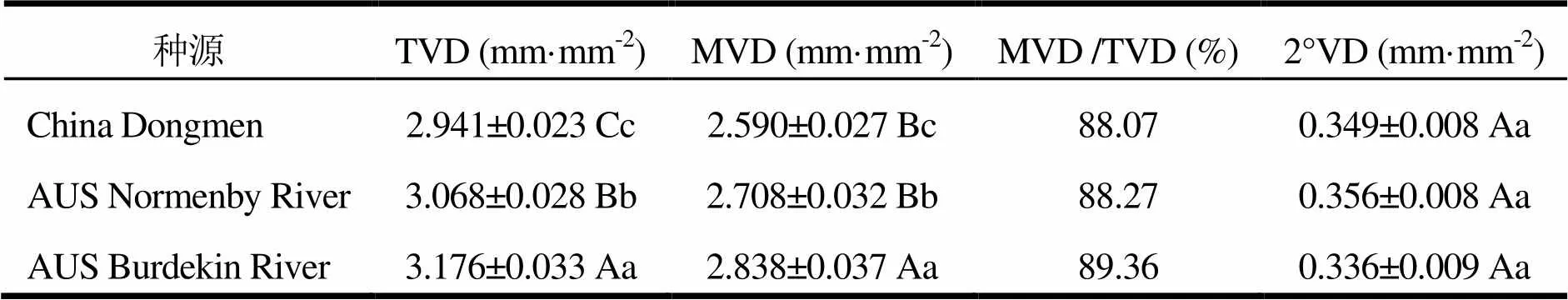
表2 种源间叶脉密度分析
注:同列字母小写表示差异显著,大写表示差异极显著。数据为:平均值±标准误。下同。
MVD与TVD较一致,AUS Burdekin River的MVD最大,与AUS Normenby River和China Dongmen间差异极显著(<0.01),而AUS Normenby River与China Dongmen之间仅显著差异(<0.05)。另外,MVD 与TVD的比值在88.07%以上,次级叶脉可能是叶脉的主要组成部分(不考虑1°叶脉)。
2.2 叶脉密度种源内家系间差异分析
对于种源内家系间的叶脉密度分析结果表明(表3),3个种源间的结果不一致。种源地AUS Normenby River家系间的差异为:TVD、MVD差异不显著,2°VD差异极显著(<0.01)。种源地AUS Burdekin River家系间的差异则为:TVD差异显著(<0.05),而MVD、2°VD差异不显著。而China Dongmen的细叶桉各家系间的TVD、MVD、2°VD均达到极显著差异水平。对China Dongmen的具体分析为(表4),To63的TVD和MVD均为最大,与To57和To55均存在极显著差异(<0.01),且与To54存在显著差异(<0.05)。其中,To55的TVD最小,与To45、To52、To63间的差异均达到了极显著水平(<0.01);To57的MVD最小,与To45、To52、To63均存在显著差异(<0.05),但仅与To63的差异达到了极显著水平(<0.01)。对于2°VD,则为To57的最大,与To54、To55、To63均存在极显著差异(<0.01),且与To45、To52存在显著差异(<0.05)。各家系MVD /TVD的比值均在85.29%以上,说明China Dongmen种源的家系苗木的次级叶脉也可能是叶脉的主要组成部分(不考虑1°叶脉)。

表3 种源内家系间方差分析
注:*表示差异显著(<0.05);**表示差异极显著 (<0.01)。
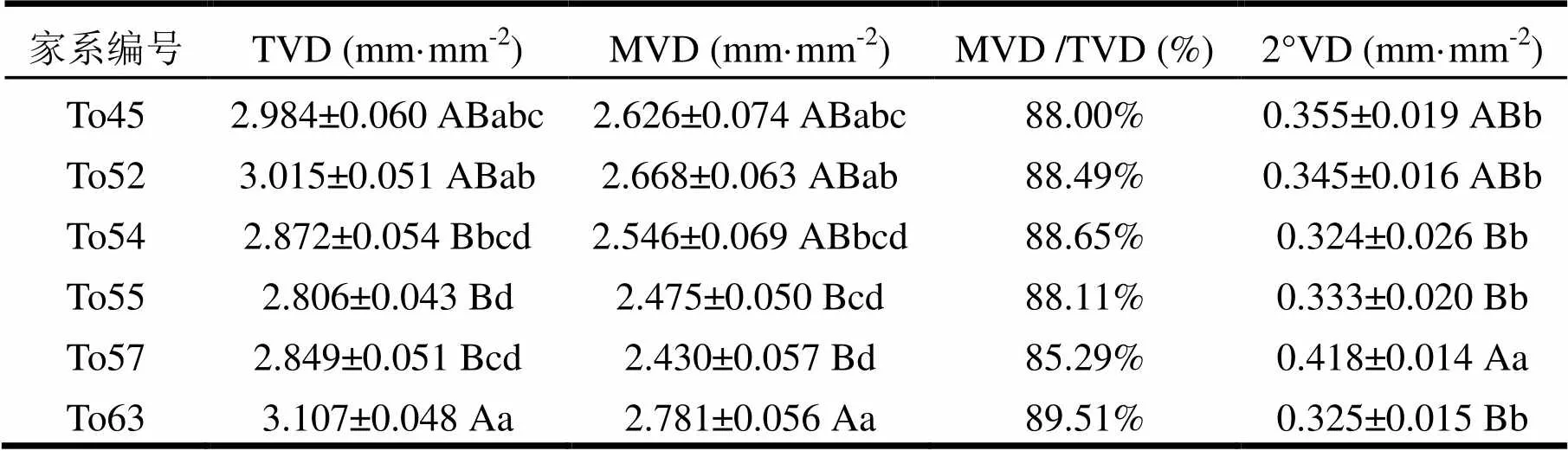
表4 China Dongmen家系间叶脉密度分析
2.3 叶脉密度间相关性分析
叶脉密度间相关性分析表明(表5):MVD与TVD之间存在极显著正相关关系,且相关性达到了0.97,进一步说明次级叶脉是叶脉的主要组成部分(不考虑1°叶脉);而2°VD与TVD间的相关性则为极显著负相关,可能是由于2°叶脉直径较大,单位面积内2°叶脉长度越大,叶脉的总长度反而越小。由于TVD是MVD与2°VD之和,所以MVD与2°VD间也呈极显著负相关,相关性为0.591,大于2°VD与TVD间的相关性。

表5 叶脉密度与其他指标间的相关性
注:*表示显著相关(<0.05);**表示极显著相关(<0.01)。
3 讨论
叶脉密度的大小与叶脉的功能直接相关。朱燕华等[12]对栓皮栎()种群的研究认为:叶脉密度是由基因型决定的,而不是对暂时生长环境的响应。Sack等[13]也认为叶脉对周围环境的变化不敏感,是一项比较保守的性状。本研究中,种源间叶脉密度的差异极显著,3个种源两两之间的TVD和MVD均达到了极显著差异水平。与种源间相比,种源内家系间叶脉密度的差异较小。China Dongmen家系间的TVD、MVD、2°VD均差异极显著,但这可能与桉树引入我国仅仅120余年,种源地China Dongmen原本为多个种源混合群体有关,其变异可能来自原有种源间的差异,不能充分说明种源内家系间叶脉密度的变异水平。总体来看,细叶桉叶脉密度在种源水平变异较大,而种源内家系水平则变异较小。
Brodribb等[14]的研究中,叶脉网络是被子植物水分利用的一个限制因素,叶脉密度与叶片水分利用率有很强的相关性。一般来说,叶片的叶脉密度较大,在很短的叶肉距离内即可达到较大的水分传导率[15]。本研究中,种源地AUS Burdekin River的叶脉密度最大,AUS Normenby River次之,China Dongmen最小。这3个种源地的平均降雨量则为China Dongmen最多,AUS Normenby River次之,AUS Burdekin River最少,即年降雨量较大的种源地细叶桉的叶脉密度反而较小。虽然本研究仅对3个种源地进行了研究,样本较少,但与Sack等[3]的研究结果一致,他们对796个来自全球不同生态系统物种的叶脉网络进行比较时发现植物叶脉密度与年降水量呈负相关。Sporck等[16]也认为,土壤水分影响叶脉密度,生长在较干旱地区的夏威夷车前属类群具有较高的叶脉密度。因此,可以认为生长在年平均降雨量较高种源地细叶桉的叶脉密度反而较小,即水分可利用量较多时,叶脉密度较小。同时,也有研究证实蒸散量的增加及水分可利用量的减少也都会导致叶脉密度的增加[17]。另外,叶脉密度与气孔密度、最大水分导度及水分利用率也有一定的关系,可作为反映叶片水环境及水分利用与消耗的既定条件。因此可在此基础上进一步分析桉树的叶脉网络系统,研究其与桉树水分基础及水分利用的关系,以便更准确简单地选择耐旱种质。
[1] Roth-Nebelsick A,Uhl D,Mosbrugger V,et al.Evolution and function of leaf venation architecture: A review[J]. Annals of Botany,2001,87(5):553‒566.
[2] Sack L,Holbrook N M.Leaf hydraulics[J].Annual Review of Plant Biology,2006(57):361‒381.
[3] Sack L,Scoffoni C.Leaf venation: structure, function, development, evolution, ecology and applications in the past, present and future[J].New Phytologist,2013,198(4): 983‒1000.
[4] McKown A D,Dengler N G.Key innovations in the evolution of Kranz anatomy and C4vein pattern in(Asteraceae)[J].American Journal of Botany, 2007,94(3):382‒399.
[5] Tyree M T,Zimmermann M H.Xylem Structure and the Ascent of Sap[M].New York :Springer Verlag,2002.
[6] Beerling D J,Franks P J.Plant science:The hidden cost of transpiration[J].Nature,2010,464(7288):495‒496.
[7] Brodribb T J,Feild T S,Sack L.Viewing leaf structureand evolution from a hydraulic perspective[J].FunctionalPlant Biology,2010,37(6):488‒498.
[8] McKown A D,Cochard H,Sack L.Decoding leaf hydraulics with a spatially explicit model: principles of venation architecture and implications for its evolution[J]. The American Naturalist,2010,175(4):447‒460.
[9] Boyce C K, Brodribb T J,Feild T S,et al.Angiosperm leaf vein evolution was physiologically and environmentally transformative[J].Proceedings of the Royal Society B: Biological Sciences,2009,276(1663):1771‒1776.
[10] 祁述雄.中国桉树(第2版)[M].北京:中国林业出版社, 2002.
[11] 罗建中,曹加光.桉树栽培中的良种选定[J].桉树科技,2006,23(2):41‒45.
[12] Zhu Y H,Kang H Z,Xie Q,et al.Pattern of leaf vein density and climate relationship ofvariabilis populations remains unchanged with environmental changes[J].Trees,2012,26(2):597‒607.
[13] Sack L,Dietrich E M,Streeter C M,et al.Leaf palmate venation and vascular redundancy confer tolerance of hydraulic disruption[J].Proceedings of the National Academy of Sciences,2008,105(5):1567‒1572.
[14] Brodribb T J,Feild T S,Jordan G J.Leaf maximum photosynthetic rate and venation are linked by hydraulics [J].Plant Physiology,2007,144(4):1890‒1898.
[15] Brodribb T J,Feild T S.Leaf hydraulic evolution led a surge in leaf photosynthetic capacity during early angiosperm diversification[J].Ecology Letters,2010,13(2): 175‒183.
[16] Sporck M J,Sack L.Leaf trait diversification and design in seven rare taxa of the Hawaiianradiation[J]. International Journal of Plant Sciences,2009,170(1):61‒75.
[17] Uhl D,Mosbrugger V.Leaf venation density as a climate and environmental proxy: a critical review and new data [J].Palaeogeography Palaeoclimatology Palaeoecology, 1999,149(1‒4):15‒26.
Comparison of the Vein Density inSeedling of Different Provenances and Families
YANG Gui-li, LUO Jian-zhong, LIN Yan
(,524022,,)
The differences for vein density among 14 families from 3 provenances ofwas evaluated, and correlations between the traits of total vein density, minor vein density and 2° vein density were estimated. Total vein density and minor vein density varied significantly among provenances, but 2° vein density did not. The ratio of minor vein density to total vein density was greater than 80%. The genetic variation among families within provenances for vein density proved somewhat smaller than that among provenances, and the only significant among family differences were found among those from the China Dongmen provenance. Significant negative correlations were found between 2° vein density and both total vein density and minor vein density, and there was also a significant negative correlation between total vein density and minor vein density.
; provenance; family; vein density
S718.43
A
2015-03-03
引进国际先进林业科学技术项目(948)“耐旱桉树种质资源及其定向选育技术引进”(2012-4-50)
杨桂丽(1987— ),女,在读硕士研究生,主要从事桉树耐旱性选育研究.E-mail: guiliyang@163.com
罗建中(1969— ),男,博士,研究员,硕导,主要从事桉树遗传育种研究.E-mail:luojz69@hotmail.com

