荧光原位杂交技术在尿路上皮肿瘤诊断中的临床应用*
周怡 方强 陈志文 季惠翔 潘进洪
(第三军医大学西南医院·全军泌尿外科研究所,重庆 400038)
荧光原位杂交技术在尿路上皮肿瘤诊断中的临床应用*
周怡 方强 陈志文 季惠翔 潘进洪
(第三军医大学西南医院·全军泌尿外科研究所,重庆 400038)
目的 探讨通过荧光原位杂交检测3、7和17号染色体及p16位点异常在预测尿路上皮肿瘤的临床应用价值。方法 收集尿路上皮肿瘤患者和健康成人作正常对照组尿液,同时行尿脱落细胞学及FISH检测3、7、17号染色体及p16位点异常。采用正常对照组各染色体异常数据设定阈值用于肿瘤患者的实验室诊断。分别计算FISH和尿脱落细胞对尿路上皮肿瘤诊断的敏感度和特异度。分析各染色体畸变与尿路上皮肿瘤病理分级的关系。结果 ①尿脱落细胞学检查的肿瘤阳性检出率为11.5%,FISH为97.1%,两者差异有统计学意义(P<0.01) ②各染色体及区带均呈现较高的畸变发生率,其中多体畸变发生率由高到低依次为82.6%(7号)、71.7%(17号)、 66.6%(3号)和49.2%( p16位点),单体畸变发生率由高到低依次为53.6%(p16位点)、 36.9%(7号)、34.7%(3号) 和28.9%(17号),单体缺失畸变p16位点17.3%。③7号染色体的多体畸变与肿瘤的病理分级间呈正相关(r=18.632,P<0.001), 其余三种染色体畸变与肿瘤的病理分级无相关性。结论 对尿路上皮肿瘤患者进行FISH检侧是一种无创、有效的检测方法。尿路上皮肿瘤在3、7 和17 号染色体及p16位点同时存在多种畸变类型,7号染色体多体畸变可预测尿路上皮肿瘤的进展。
荧光原位杂交; 尿路上皮肿瘤; 染色体畸变
尿路上皮肿瘤包括肾盂癌、输尿管癌、膀胱癌以及尿道上皮癌, 以膀胱癌最为常见。膀胱癌是全世界第五大常见癌症之一,其发病率且复发率高,早期诊断对于提高患者生存率有着非常重要意义[1]。常规的诊断方法为尿脱落细胞学检查和膀胱镜、输尿管镜检查,前者的敏感性较低,而后者为有创检查,增加患者痛苦。近年来,通过荧光原位杂交(fluorescence in situ hybridization, FISH)技术检测尿液中脱落细胞染色体异常从而早期诊断膀胱癌已成为热点,Skacel等[2]研究显示FISH在膀胱癌的诊断中有较高的敏感性,且为无创检查。本研究采用FISH技术检测3、7、17号染色体及p16区带位点的畸变情况,并对尿路上皮肿瘤的分级分期进行相关研究。
1 资料与方法
1.1 一般资料 选取2010年10月至2014年4月我科收治的尿路上皮肿瘤的患者共138例,其中膀胱尿路上皮癌111例、肾盂尿路上皮癌17例、输尿管尿路上皮癌6例、低度恶性倾向尿路上皮乳头状瘤2例、肾盂癌并发输尿管癌2例。男性100例, 女性38例,年龄31~87岁,平均62.3岁。按2004WHO肿瘤病理分级标准分类,低度恶性倾向尿路上皮乳头状瘤2例,低分级尿路上皮乳头状癌44例,高分级尿路上皮乳头状癌92例。所有患者均行尿FISH检测、尿脱细胞学检测、腹部超声、泌尿系CT或膀胱镜、输尿管镜检查。同时设对照组20例,男性15例,女性5例,计算FISH检测阈值。
1.2 仪器和试剂 荧光原位杂交操作平台(OLYMPUS BX51系统显微镜,OLYMPUS BX-UCB通道转换系统,荧光灯,DELL微型计算机,Progres Capture Pro2.5摄像系统,VIDEOTEST-FISH2.0 图像分析处理系统),水浴锅和电热恒温培养箱,离心机,烤片机,试剂盒-探针来自北京金菩嘉医疗科技有限公司,分为两组CSP3/CSP7 绿色/ 红色)和GLP16/CSP17(红色/绿色)。
1.3 FISH检测技术 将预先收集的晨尿50~100ml,离心10min,1500 r/ min, 去上清,加胶原酶消化,37℃ 消化20 min。 1500 r/ min 离心10 min, 去上清, 加5 ml 预热的0.075 mol/ L KCl 低渗溶液,37℃ 低渗15 min,固定:加2 ml 固定液( 甲醇∶冰醋酸3∶1), 混匀, 1500 r/ min离心10 min, 去上清;加入5 ml 固定液,1500r/ min 离心10 min,重复固定1 次, 离心去上清后滴片,56℃中老化玻片60min。玻片处理:将玻片置于2×SSC中漂洗2次,每次5 min,玻片再置于预热胃蛋白酶粉中浸泡5 min,再次放入于2×SSC中漂洗2次,每次5 min,最后依次置于70% 、85% 、100% 乙醇中脱水每次3 min。变性杂交:暗处:将玻片在变性液中浸泡5 min,梯度脱水。玻片自然干燥后, 试剂滴在杂交区域,封片置于预热的湿盒中, 42℃恒温箱中过夜。杂交后洗涤:移去盖玻片,甲酰胺/ 2×SSC 溶液洗涤玻片,每次10 min,置于2×SSC、2×SSC、NP-40溶液中,每次5 min。梯度脱水后暗处干燥。加DAPI于杂交区域复染,10 min后观察结果。
1.4 FISH阈值建立 FISH阈值来自20例健康成人尿液,FISH检测结果,具体方法如下:每例样本随机计数细胞至少100个,3号、7号及17号染色体各需要建立两个阈值(1个信号点,大于和等于3个信号点),P16需要建立3个阈值(0个信号点,1个信号点,大于和等于3个信号点)。以公式 “阈值=平均值 + 3×标准差(SD)”。
1.5 FISH结果及判断 荧光显微镜下观察,选择杂交信号均匀的区域,分析大的、不典型的、细胞核不规则的细胞,细胞重叠、破损、未去除细胞质的细胞核不计数,微弱杂交信号不计数。上下调节焦距,以免遗失信号,细胞内杂交信号互相靠近且两杂交信号之间距离小于1个杂交点大小者计为1个信号。记录信号类型即每个细胞核中红绿信号点的个数,正常细胞的CSP3、CSP7、CSP17着丝粒探针及GLPp16位点探针均表现为二倍体,即细胞核分别可以看到2红2绿为正常信号,见图1。
图1 正常成人尿液样本FISH检测结果
Figure 1 FISH detection of CSP3,CSP7,GLP16 and CSP17 in the urine samples of healthy adult
注:图A CSP3为绿色荧光、CSP7为红色荧光,图BGLP16为红色荧光、CSP17为绿色荧光
阳性结果判断标准: 记录信号类型即每个细胞核中红绿信号点的个数,每例标本每种探针分析100个细胞核。见图2。CSP3为绿色/CSP7为红色可见3、
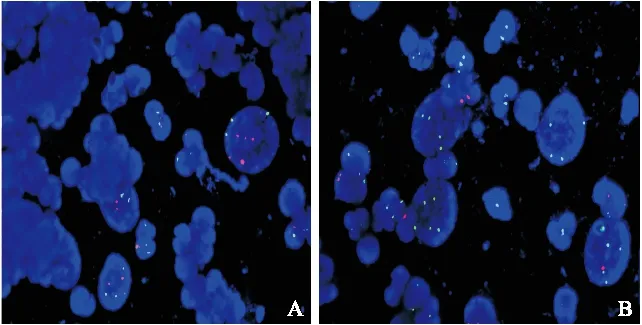
图2 尿路上皮肿瘤患者尿液样本FISH检测信号图
Figure 2 FISH detection of CSP3,CSP7,GLP16 and CSP17 in the urine samples of urothelial cancer patient
注:图A CSP3为绿色荧光、CSP7为红色荧光,图BGLP16为红色荧光、CSP17为绿色荧光
CSP3/CSP7号染色体组杂交后信号点荧光信号为绿色/红色,可见3号、7号染色体扩增。GLP16/CSP17均表现为红色/绿色,可见P16位点缺失、17号染色体扩增。
7号染色体有不同程度扩增均多于2个信号点,GLPp16为红色/CSP17为绿色,17号染色体不同程度扩增多于2个信号点,P16基因缺失1个或0个信号点。①任意两个以上位点(含两个)出现异常,如3号和7号染色体出现非整倍增加,可判断为阳性。②一个位点有两种以上(含两种)异常,如P16有0个信号点和3个信号点异常,可判断为阳性。③若只有一个位点出现异常,扩大计数细胞后再重新判断。
1.6 尿脱落细胞学检查 标本采集(留取尿液)-涂片固定-HE染色-镜检-结果(阳性或阴性)。尿脱落细胞学检测由两位固定的高年资病理科医师进行诊断。
1.7 病理结果 取患者活检或术后组织标本行常规病理检查,由两名以上专业的病理医师共同阅片诊断。
1.8 统计学处理 采用SPSS 13.0统计分析软件进行χ2检验,采用spearman分析各染色体畸变检出率与临床病理分级、分期之间的相关性,P<0.05为差异有统计学意义。
2 结果
2.1 阈值结果 各染色体畸变的临界值称之为阈值。正常成人尿液样本FISH检测阈值,见表1。
2.2 FISH与尿脱落细胞学检查肿瘤阳性检出率比较 138例尿路上皮癌患者中,FISH检测结果阳性者为134例,阴性者为4例。得出FISH灵敏度为97.1%(134/138),特异度为100%。尿脱落细胞学结果中仅有6例尿液中发现癌细胞,灵敏度为11.5%(16/138),特异度为100%。FISH 检测膀胱尿路上皮癌的灵敏度高于尿脱落细胞学检查(P<0.01),而两者的特异度差异无显著统计学意义(P>0.05)。
2.3 FISH检测结果及各染色体畸变率分析 根据建立阈值,判断各染色体及区带畸变发生率。多体畸变发生率由高到低依次为82.6%(7号)、71.7%(17号)、66.6%(3号)和49.2%(p16位点)。单体畸变发生率由高到低依次为53.6% (p16位点)、36.9%(7号) 、34.7% (3号)和28.9% (17号)。单体缺失畸变p16位点17.3%。
2.4 各染色体畸变与肿瘤病理分级的关系 在138例患者中病理结果证实为尿路上皮肿瘤,按照2004年WHO肿瘤病理分级标准,低度恶性倾向尿路上皮乳头状瘤2例,低分级尿路上皮乳头状癌44例,高分级尿路上皮乳头状癌92例。本组资料显示,仅7号染色体的多体畸变与肿瘤的病理分级间呈正相关(r=18.632,P<0.001),其余三种染色体及区带不同类型的畸变情况均未显示出与病理分级间无相关性,见表2。
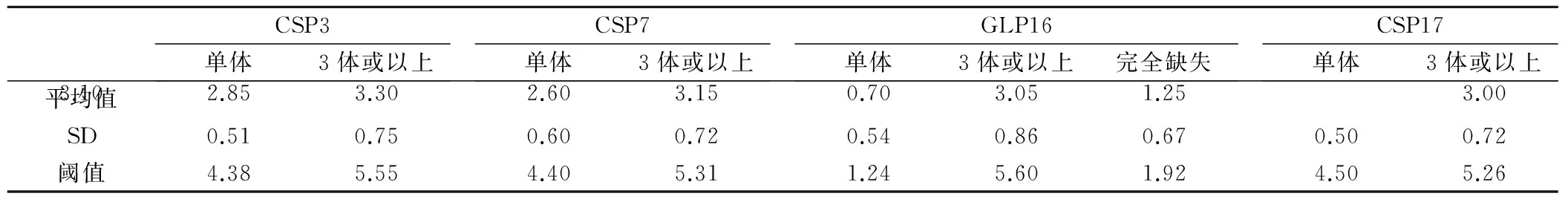
表1 正常成人尿液样本 FISH 检测阈值
注: CSP3、CSP7、CSP17 分别表示3、7 和17 号染色体着丝粒荧光探针, GLP16 表示9p21位点特异性荧光探针。
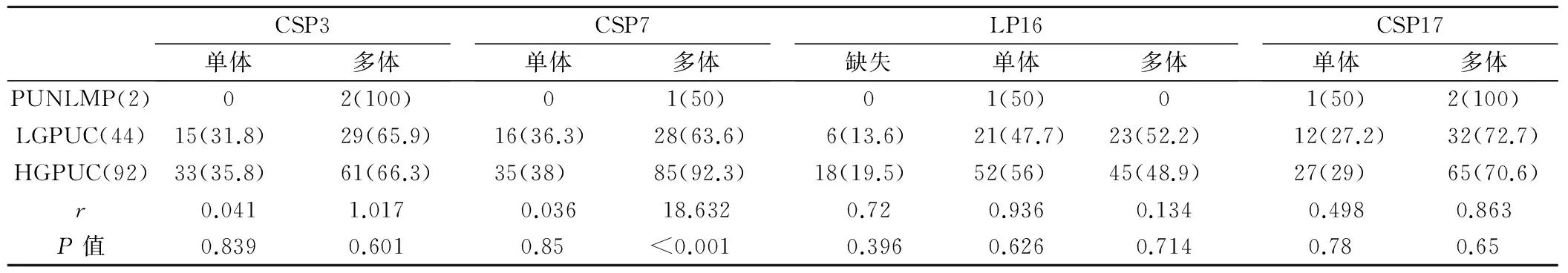
表3 CSP3、CSP7、GLP16和CSP17染色体畸变与肿瘤病理分级的关系
注:PUNLMP(低度恶性潜能尿路上皮乳头状瘤)、LGPUC(低分级尿路上皮乳头状癌)、LGPUC(高分级尿路上皮乳头状癌)
3 讨论
FISH是应用已知荧光染料单链核酸为探针,按照碱基互补原则,与待检标本中核酸特异性结合,形成可被测的杂交双链核酸。从而对待检标本在荧光显微镜下进行染色体数目或结构异常分析。自2000年Sokolova等[3]建立首个膀胱尿路上皮癌FISH探针以来,目前基本确立将3、7、17号染色体及9号染色体P16位点探针作为常规检测目标,结果显示FISH的敏感性高达74.68%,这对于尿路上皮癌的早期诊断十分重要。本研究对138例尿路上皮肿瘤患者的尿液脱落细胞和FISH检测显示,两种方法特异度均为100%,但FISH的灵敏度(97.1%)明显高于尿脱落细胞学检查(11..5%)。由此,FISH在尿路上皮肿瘤的诊断中优于尿脱落细胞学检测。
2001年7月被FDA批准用于膀胱肿瘤的检测,其主要研究染色体数目和结构畸变。Sandberg 等[4]在1994年对泌尿肿瘤染色体研究认为,尿路上皮癌易发生染色体改变,其中包括结构畸变和染色体数目异常,常见结构畸变染色体有3、9、1、5、11、21、17 号染色体,染色体数异常见于3、9、7、10、11、Y、1、8、17、15 号染色体。目前临床上用于诊断尿路上皮癌的常用染色体主要有: 3、7、9、17 号染色体。3号染色体多倍体表达与膀胱尿路上皮癌的病达76.00%,定位于3p25的RAFI基因过理分级相关[5,6]。7号染色体多倍体发生率大约为76.20%[7]。其多倍体与病理分期、分级显著相关, 7号染色体畸变可能在膀胱尿路上皮癌发生、发展中起重要作用[8]。
尿路上皮癌,尤其是膀胱尿路上皮癌的发病率在人群中可高达0.1%,其中约70%为非肌层浸润性肿瘤,30%为肌层浸润性膀胱肿瘤,有报道[9]称Ta、Tis、T1期肿瘤进展为肌层浸润的比率分别为5%、54%和46%。此外肿瘤的分级也与肿瘤进展有关,G1、G2、G3 肿瘤进展为肌层浸润的比率分别为2%、11%和45%[10]。因此,浅表性膀胱癌患者需术后随访以便及时发现肿瘤的复发。
4 结论
FISH技术具有敏感度高、特异性强、无创性等优点,在尿路上皮肿瘤早期诊断及术后监测中具有较高的应用价值。尤其在各染色体及区带畸变发生率中,以多体畸变为主。此外,7号染色体的多体畸变与尿路上皮肿瘤的病理分级间呈正相关,有望成为尿路上皮肿瘤进展和侵袭的标记物。
[1]Parkin DM, Bray F, Ferlay J,etal. Global cancer statistics, 2002 [J]. CA Cancer J Clin, 2005, 55( 2) :74-108.
[2]Skacel M,Fahmy M, Brainard JA,etal.Multitarget fluorescence in situ hybridization assay detects transitional cell carcinoma in the majority of patients with bladder cancer and atypical or negative urine cytology [J]. J Urol, 2003,169:2101-2105.
[3]Sokolova IA,Halling KC, Jenkings RB,etal.The development of a multitarget,muiticolor fluorescence in situ hybridization assay for the detection of urothelial carcinoma in urine [J].J Mol Diagn,2000,2:116-123.
[4]Sandberg AA,Berger CS.Review of chromosome studies in urological tumors.Ⅱ.Cytogenetics and molecular genetics of bladder cancer [J]. J Urol, 1994, 15l( 3) : 545-560.
[5]Veeramachaneni R, Nordberg M L, Shi R,etal. Evaluation of fluorescence in situ hybridization as an ancillary tool to urine cytology in diagnosing urothelial carcinoma[J]. Diagn Cytopatho1 2003, 28( 6):301- 307.
[6]Mhawech-Fauceglia P, Fischer G, Beck A,etal. Raf1, Aurora-A /STK15 and E-cadherin biomarkers expression in patients with pTa/pT1 urothelial bladder carcinoma; a retrospective TMA study of 246 patients with long-term follow-up [J]. Eur J Surg Ongol, 2006, 32( 4): 439-444.
[7]Kruger S, Mess F, Bohle A,etal. Numerical aberrations of chromosome 17 and the 9p21 locus are independent predictors of tumor recurrence in non-invasive transitional cell carcinoma of the urinary bladder [J]. Int Oncol,l 2003, 23( 1 ): 41-48.
[8]Sauter G, Haley J, Chew K,etal. Epidermal-growth-factor-receptor expression is associated with rapid tumor proliferation in bladder cancer [J]. Int J cancer, 1994, 57( 4 ): 508-514.
[9]Ferlay J,Autier P,Boniol LM,etal. Estimates of the cancer incidence and mortality in Europe in 2006 [J].Ann Oncol,2007,18:681-592.
[10] Baffa R,Letko J,McClung C,etal. Molecular genetics of bladder cancer: targets for diagnosis and therapy[J].J Exp Clin Cancer Res,2006,25( 2) : 145-160.
Application of fluorescence in situ hybridization technique in diagnosis of urothelial tumor
ZHOU Yi,FANG Qiang,CHEN Zhi-wen,etal
(InstituteofUrinarySurgery,SouthwestHospital,TheThirdMilitaryMedicalUniversity,Chongqing400038,China)
Objective To investigate the role of fluorescence in situ hybridization technician in the diagnosis of urothelial tumors.Methods FISH diagnostic threshold was established by 20 cases of healthy adults. 138 cases of urothelial cancer patients were performed urine cytology and FISH detection of chromosome 3, 7 and 17 and abnormal p16 locus, the diagnostic value of two methods and the relationships between chromosomal aberrations and pathological grade were analyzed. Results The sensitivity of Urine cytology and FISH was 11.5% and 97.1% respectively, the difference was statistically significant (P<0.01). Each chromosome and zone showed a higher incidence of distortion. The incidence of multiple aberrations were 82.6% (7), (17) 71.7%, 66.6% (3) and 49.2% (p16). The incidence of monomer distortion were 53.6% (p16), 36.9% (7), 34.7% (3) and 28.9% (17). The incidence of p16 locus monomer distortion rate was 17.3%. The 7th chromosome multi-body aberrations was positively correlated with tumor pathological grade (r=18.632,P<0.001). Conclusion FISH is a noninvasive and effective detection method for urothelial tumors. The multi-body aberration of 7th chromosome is predictable for progress of urothelial tumors.
Fluorescence in situ hybridization; Urothelial tumors; Chromosome aberration
国家自然科学基金(81172441)
方强,E-mail:fangqiang@tmmu.edu.cn
R 737.15
A
10.3969/j.issn.1672-3511.2015.02.008
2014-11-03; 编辑: 张文秀)

