Follistatin表达抑制促进BMP-2诱导人类骨髓间充质干细胞成骨分化的实验研究
耿家金 程加峰 赵 平 杨 名 张永强
Follistatin是Robertson和Ueno于1987年分别从牛和猪卵泡液中分离出的一种富含半胱氨酸的糖基化单链多肽,又称为促卵泡生成素抑制蛋白(FSP)[1]。实验研究[2-3]显示,Follistatin可通过与BMP相互作用来阻止BMP与其受体结合,从而阻断下游信号转导,阻断BMP的生物学作用,所以Follistatin是BMP的细胞外拮抗剂。Follistatin通过与骨形态发生蛋白 (BMP)-2、BMP-4、BMP-6、BMP-7结合来抑制其作用,但它的抑制方式却不同于其他抑制剂,有其独特的方式。它与BMP及其受体结合,通过形成三聚体结构来阻碍BMP与其受体结合,阻断Smad信号转导,使BMP不能发挥成骨作用。而在比例为1∶1的Follistatin-BMP复合物中,BMP能通过它的第2个Ⅰ型受体结合部位与Ⅰ型受体发生作用[4]。BMP信号转导可能受Follistatin-BMP-BMP受体复合物和包含BMPⅠ型受体的 Follistatin-BMP复合物(比例为1∶1)抑制[5],因此Follistatin对BMP配体的抑制作用更强。由于这些复合物的影响,BMP信号转导可能因Ⅱ型受体招募阻断而受抑制,从而直接或间接影响骨吸收与骨新生的平衡过程。然而,Follistatin对人类BMSC成骨分化的影响目前尚未明确,本研究旨在探索Follistatin表达抑制对人类BMSC活性及BMP-2诱导人类BMSC成骨分化的影响。
1 资料与方法
1.1 人类BMSC分离与培养
骨髓样本由5名施行髋关节置换术患者提供,已获得患者知情同意书,并通过本院伦理委员会的批准。骨髓样本采用Ficoll分离液(美国Sigma公司)经密度梯度离心分离出单核细胞,以4×105个/cm2的密度接种于DMEM成骨诱导培养基(高糖)(美国 Hyclone公司),培养基中含10%胎牛血清(FBS)(美国 Hyclone公司)、100 U/mL的青霉素(美国Invitrogen公司)、100μg/mL的链霉素(美国Invitrogen公司)、0.29 mg/mL的 Glutamax(美国Invitrogen公司)、4 ng/mL的碱性成纤维细胞生长因子(bFGF)(美国PeproTech公司),所有单核细胞均于37℃、含有5%CO2的恒温培养箱中培养。
1.2 BMP-2诱导培养
先以1×105个/孔的密度将人类BMSC接种于6孔培养板中。24 h后,将DMEM生长培养基(高糖)换成DMEM成骨诱导培养基(高糖)(美国Hyclone公司),培养基中含10%FBS(美国Hyclone公 司)、100 U/mL 的 青 霉 素 (美 国Invitrogen 公 司)、100μg/mL 的 链 霉 素 (美 国Invitrogen公司)、0.29 mg/mL的 Glutamax(美国Invitrogen公司)及0~50μg/mL的重组人类BMP-2(美国PeproTech公司)。在 BMP-2诱导培养72 h后,采用Trizol试剂盒(美国Invitrogen公司)裂解收集细胞。采用逆转录-聚合酶链式反应(RT-PCR)检测Follistatin mRNA表达量。以同样的方式将人类BMSC接种于培养皿中,分别加入或不加入BMP-2 0.1μg/mL。细胞样品在BMP-2处理即刻、24 h、48 h、72 h 及 96 h 后 收 集,检 测Follistatin mRNA的表达。
1.3 逆转录与qRT-PCR
采用 NanoDrop ND-1000分光光度计(美国Thero Scientific公司)测定Follistatin总RNA含量,采用反转录试剂盒(中国Tiangen公司)将mRNA反转录成cDNA。对20μL的Follistatin进行逆转录,步骤为25℃下放置5 min,42℃下放置30 min,85℃下放置5 min。进行3次定量逆转录-聚合酶链式反应(qRT-PCR),由罗氏诊断产品(上海)有限公司LightCycler 480系统完成。
1.4 Follistatin siRNA效率评估
设计合成4个siRNA,用来靶向人类Follistatin(基因ID:10468)mRNA(德国 Qiagen公司)不同区域,其排序信息见表1。
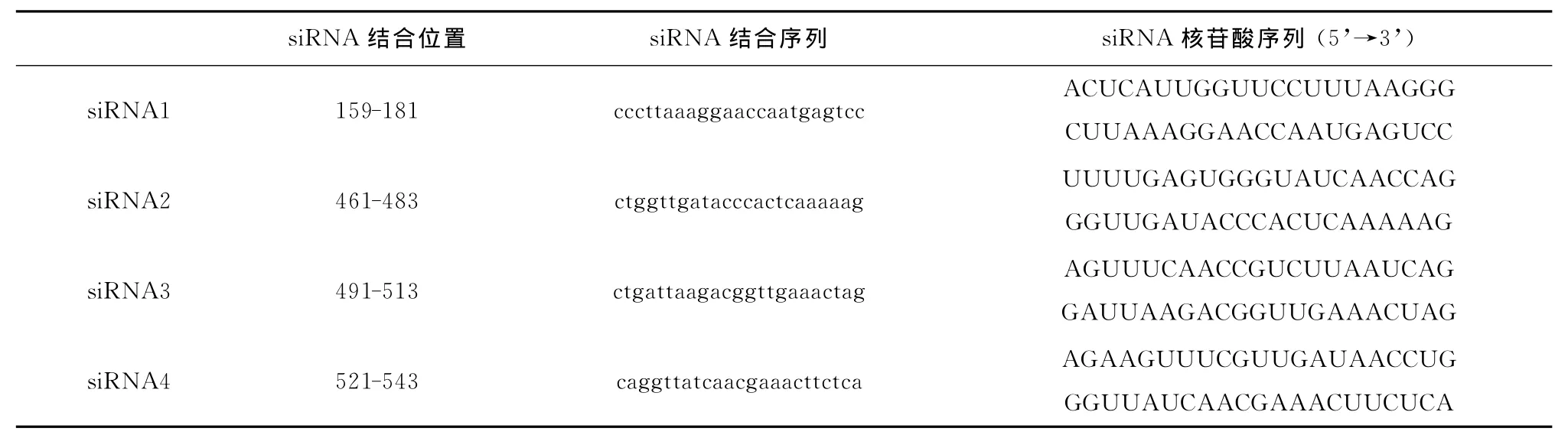
表1 siRNA靶向人类Follistatin mRNA不同区域排序信息
以 BLOCK-iT siRNA(美国Invitrogen公司)作为对照siRNA。为验证这些Follistatin特异性siRNA的敲除效率,利用Lipofectamine(美国Life Technologies 公 司)将 BLOCK-iT siRNA 和Follistatin特异性siRNA转染入人类BMSC。转染24 h后,BMSC 置于含有0.1μg/mL BMP-2的基础培养基中培养。经BMP-2处理72 h后,将总RNA抽离,应用qRT-PCR分析Follistatin mRNA表达。此 外,BMP-2 处 理 后 72 h,采 用 人 类Follistatin Elisa试剂盒(美国R&D公司)检测培养基上清液中Follistatin蛋白含量。选择对Follistatin mRNA和蛋白质表达抑制效率最高的siRNA进行下一步实验。
在BMP-2存在的情况下,转染Follistatin siRNA后会抑制Follistatin表达,为进一步检测抑制持续时间,需针对siRNA转染后Follistatin不同时间点的表达进行研究。在转染前(0d),收集样品以确定Follistatin表达水平。根据转染情况,将样品分为3组,即未转染(Mock)组、对照转染siRNA(NC siRNA)组、头蛋白siRNA转染组,并进行3次重复实验。转染24 h后,培养基换成DMEM成骨诱导培养基(含有0.1μg/mL的BMP-2),培养基每3天换1次。在培养后3、7、10 d分别收集细胞样品,并抽取总RNA,进行qRT-PCR分析,检测Follistatin表达水平。
1.5 人类BMSC增殖活性分析
将人类BMSC接种于48孔培养板进行培养,密度为5×104个/孔。接种24 h后,人类BMSC分别用对照siRNA和抑制效率最高的Follistatin siRNA进行转染。转染24 h后,将DMEM生长培养基换为 DMEM 成骨诱导培养基(含有0.1μg/mL的BMP-2)进行培养。在培养后0、3、7 d检测人类BMSC代谢活性。采用2-(2-甲氧基-4-硝苯基)-3-(4-硝 苯 基)-5-(2,4-二 磺 基 苯)-2H-四 唑 单 钠 盐(WST-8)试剂检测人类BMSC线粒体脱氢酶活性。在波长450 nm处采用微孔盘吸收仪(美国BioTek公司)读取吸光值,对照波长为650 nm。
1.6 人类BMSC DNA含量分析
将人类BMSC接种于96孔培养板进行培养,密度为3×103个/孔。接种24 h后,人类BMSC分别用对照siRNA和抑制效率最高的Follistatin siRNA进行转染。转染24 h后,将DMEM生长培养基换成DMEM成骨诱导培养基(含有0.1μg/mL的BMP-2)进行培养。在培养后0、3、7 d,溶解细胞并收集样品。采用CyQUANT细胞增殖分析试剂盒(美国Invitrogen公司)进行DNA含量检测。
1.7 人类BMSC成骨诱导
利用siRNA抑制人类BMSC中的Follistatin表达,然后使用DMEM成骨诱导培养基(含10%FBS、100 U/mL的青霉素、100μg/mL的链霉素、0.29 mg/mL的 GlutaMAX-L、1×105mol/m3的地塞米松、5 mol/m3的甘油磷酸盐、0.1μg/mL 的BMP-2及50 mg/L的维生素C磷酸酯镁)诱导人类BMSC成骨分化。
1.8 成骨相关基因表达分析
在成骨诱导14 d,收集细胞样品并抽取总RNA,按照以上表述进行逆转录。应用qRT-PCR检测成骨细胞基因如碱性磷酸酶(ALP)、IBSP、MSX2、OC、OPN及 RUNX2基因表达水平。以GAPDH为内参基因。
1.9 ALP染色和活性分析
在成骨诱导14 d,分别采用固紫B染色试剂盒(美国Sigma公司)和ALP分析试剂盒(美国BioAssay Systems公司)进行染色和ALP活性分析。
1.1 0 茜素红染色和钙含量测定
在成骨诱导28 d,分别采用茜素红S(美国Sigma公司)和QuantiChrom钙分析试剂盒(美国BioAssay Systems公司)进行染色和钙含量分析。
1.1 1 统计学分析
采用PASW Statistics 18.0统计软件进行统计学分析,数据用平均值±标准差表示,并采用t检验与单因素方差分析进行分析,必要时使用Bonferroni事后检验法进行检验。P<0.05认为具有统计学差异。
2 结果
2.1 BMP-2诱导Follistatin mRNA表达
BMP-2诱导Follistatin mRNA表达呈剂量依赖性,浓度为1μg/mL的BMP-2诱导产生的Follistatin mRNA表达水平最高(图1a)。BMP-2浓度为0~1μg/mL时,Follistatin表达随BMP-2浓度升高而逐渐增加;BMP-2浓度为1~50μg/mL时,Follistatin表达则随BMP-2浓度升高而逐渐受到抑制。未经BMP-2 处 理 组 与 经 50 μg/mL BMP-2 处 理 组Follistatin表达水平无统计学差异(图1a)。
BMP-2诱导Follistatin mRNA表达呈时间依赖性。以浓度为1μg/mL的BMP-2进行诱导时,Follistatin mRNA水平随时间增加而逐渐升高,在BMP-2处理后48、72、96 h增加最为显著(图1b)。
2.2 Follistatin siRNA 抑 制 BMP-2 诱 导 的Follistatin mRNA表达升高
与 Mock组相比,NC siRNA 组 Follistatin mRNA及蛋白水平未改变(图 2a、b)。然而,Follistatin siRNA1与siRNA2转染显著减少了人类BMSC头蛋白mRNA的表达水平(图2a)和培养液上清液中Follistatin蛋白水平(图2b)。而Follistatin siRNA3与siRNA4转染对于Follistatin mRNA表达水平的影响并不显著(图2a),仅轻微增加培养液上清液中头蛋白表达水平(图2b)。由于Follistatin siRNA1对Follistatin表达起到最佳的抑制效果(图2a、b),我们仅使用头蛋白siRNA3进行以下实验。
BMP-2诱导后0~7 d Mock组与 NC siRNA组Follistatin mRNA表达增加。siRNA转染后3、7 d,Follistatin siRNA1转染能显著抑制Follistatin表达,而siRNA转染后10 d,抑制效果则不明显(图2c)。
2.3 Follistatin表达抑制提高人类BMSC活性
经 WST-8 分 析 显 示,siRNA 转 染 后 3、7 d Follistatin siRNA1可显著提高人类BMSC代谢(图3a)。在 DNA分析中亦出现同样情况。Follistatin siRNA1使得总DNA含量在siRNA转染后3、7 d显著增加(图3b)。此外,siRNA转染后14 d,Follistatin siRNA1转染组总蛋白含量显著高于NC siRNA组总蛋白含量(图3c)。
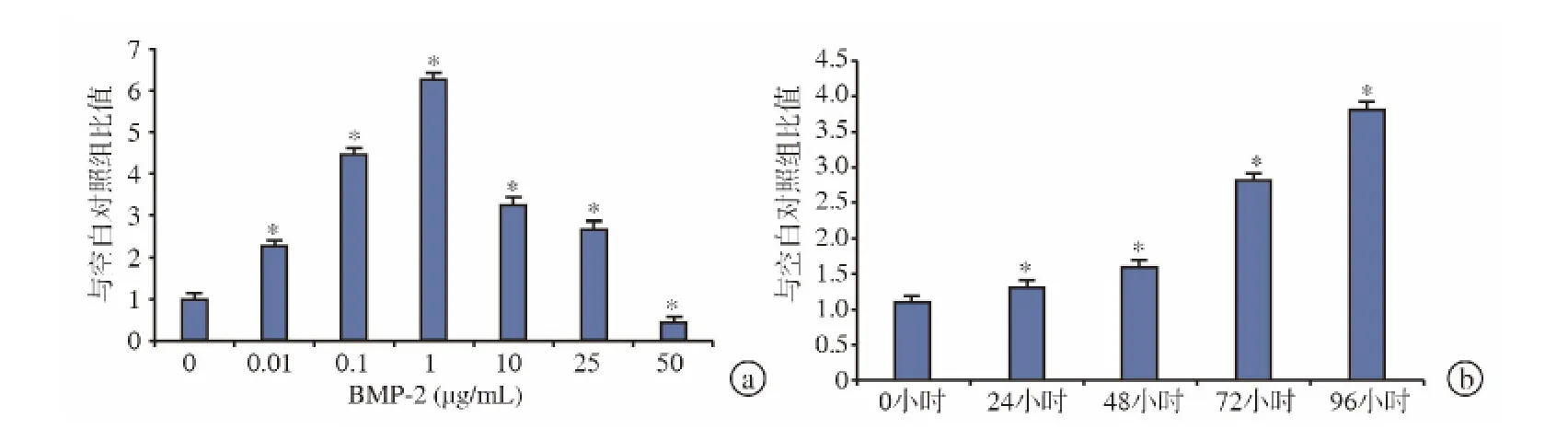
图1 BMP-2诱导Follistatin mRNA表达 a.BMP-2诱导后Folliatatin mRNA表达呈剂量依赖性 b.BMP-2(1μg/mL)诱导后Folliatatin mRNA表达呈时间依赖性
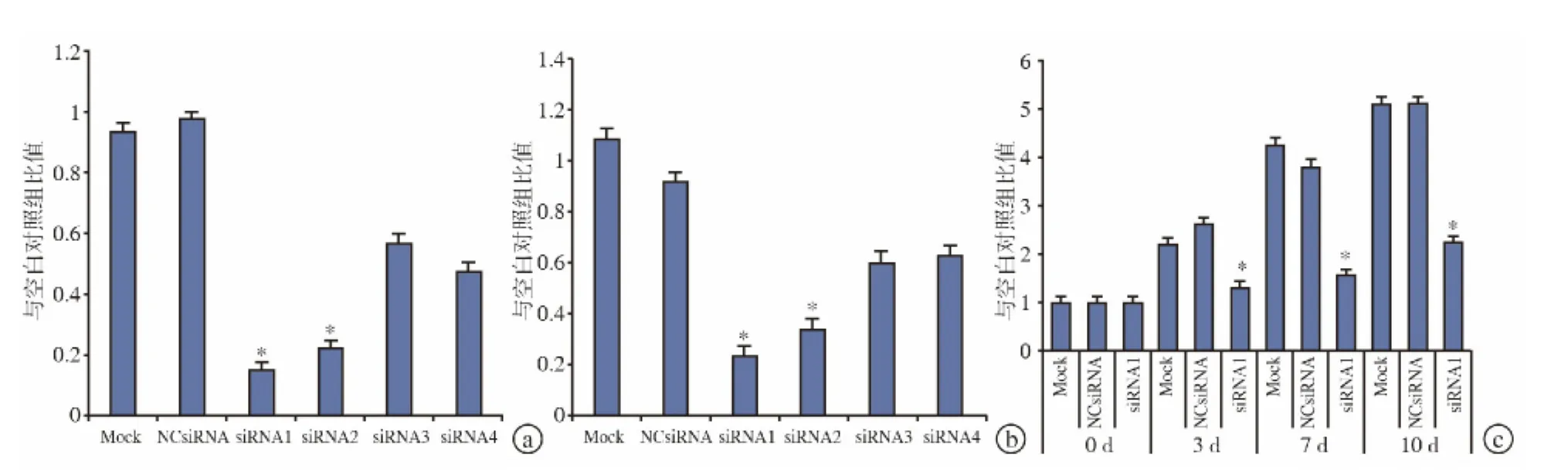
图2 Follistatin siRNA抑制效率 a.不同siRNA转染后72 h Follistatin mRNA表达 b.不同siRNA转染后72 h培养基上清液中Follistatin蛋白浓度 c.人类BMSC中Follistatin RNA表达,转染后细胞经0.1μg/mL BMP-2处理
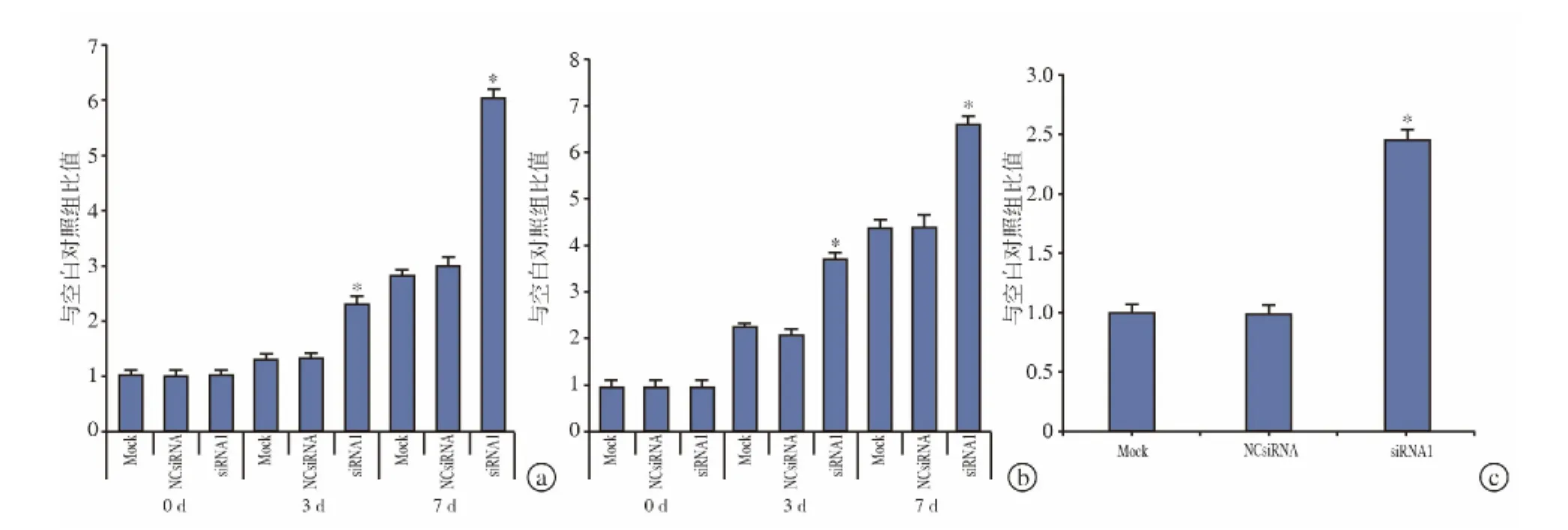
图3 Follistatin表达抑制时人类BMSC活性增强。在siRNA1转染后3、7 d,由于Follistatin表达抑制,人类BMSC代谢(a)和DNA含量(b)增加;在siRNA1转染后14 d,由于Follistatin表达抑制,人类BMSC总蛋白含量(c)增多
2.4 Follistatin表达抑制提高人类BMSC成骨分化能力
由于Follistatin siRNA1单次转染的抑制作用最长持续7 d(图2c),故我们在人类BMSC成骨分化期间,每7天进行1次siRNA转染。同时,头蛋白siRNA1可显著提高成骨相关基因如ALP、OCN、OSX、OC、OPN和RUNX2表达水平(图4a~f)。
成骨诱导后14 d,ALP染色表明Follistatin siRNA1转染增强了细胞ALP活性(图5a)。定量ALP活性检测也出现类似结果,表明Follistatin siRNA1转染可显著增强细胞ALP活性(图5b)。
定量茜素红染色显示,与 Mock组和NC siRNA组相比,Follistatin siRNA2转染组钙素沉淀产生增多(图6a)。定量钙含量检测也表明在细胞培养中Follistatin siRNA2可增加钙沉降(图6b)。
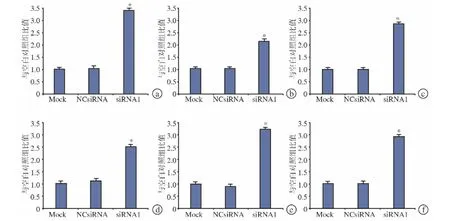
图4 Follistatin表达抑制时人类BMSC成骨相关基因表达。在含有0.1μg/mL BMP-2的DMEM成骨诱导培养基中进行成骨诱导时,成骨相关基因如 ALP(a)、OCN(b)、OSX(c)、OC(d)、OPN(e)及 RUNX2(f)表达水平增高
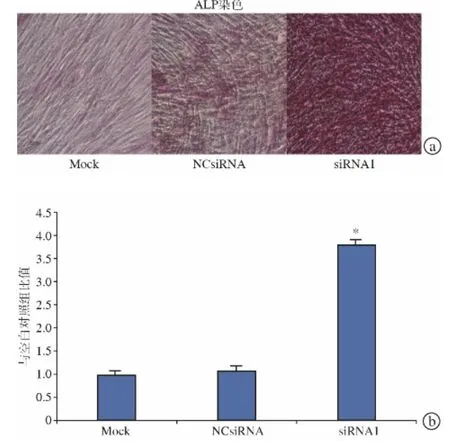
图5 Follistatin表达抑制时人类BMSC成骨分化ALP检测。在含有0.1μg/mL BMP-2的DMEM 成骨诱导培养基中进行成骨诱导,14 d后ALP染色(a)和定量ALP活性检测(b)显示ALP活性因Follistatin表达抑制而增强
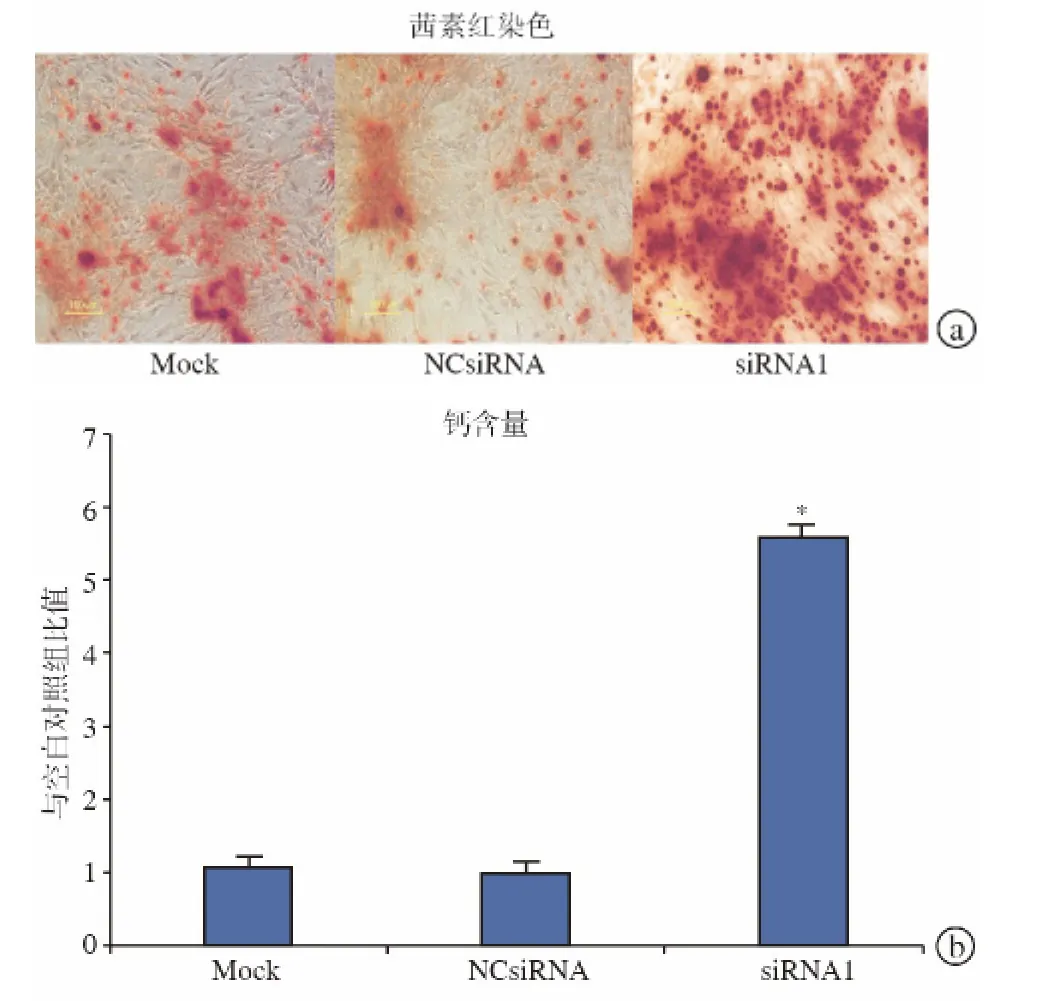
图6 Follistatin表达抑制时人类BMSC成骨分化钙沉积检测。在含有0.1μg/mL BMP-2的DMEM 成骨诱导培养基中进行成骨诱导,28 d后茜素红染色(a)与钙含量分析(b)显示钙沉降因Follistatin表达抑制而增加
3 讨论
3.1 BMP促进BMSC成骨分化
骨折后,BMSC在多种生长因子的诱导下迁移至骨折处骨表面,分化为成骨细胞,合成大量细胞外基质,修复受损骨骼[6-9]。多种细胞生长因子参与调控BMSC修复受损骨骼[10],其中BMP起了至关重要的作用[11-12]。研究[13-14]表明,BMP-2、BMP-4、BMP-6、BMP-7和BMP-9均可在体内外诱导人类BMSC向成骨细胞方向分化。BMP发挥作用时,先与细胞表面BMPⅠ型、Ⅱ型受体结合,并激活细胞内Smad蛋白复合体,继而激活的Smad蛋白复合体与各种转录因子相互作用,调节成骨细胞基因表达[15-17]。
3.2 BMP拮抗剂作用机制
BMP诱导的成骨分化受细胞外BMP拮抗剂如Noggin、Chordin、Gremlin 及 Follistatin 等 调节[18-19]。BMP拮抗剂通过与BMP结合阻止BMP与细胞膜上的相应受体结合,从而阻碍BMP下游信号转导通路的激活,减弱BMP生物学活性,间接调控BMP生物学作用,同时BMP拮抗剂也可直接作用于细胞膜上的受体。每种BMP拮抗剂都与BMP超家族中的成员有不同程度的亲和力。BMP拮抗剂在细胞分化及生物发育中起了至关重要的作用。
3.3 BMP-2诱导人类BMSC表达Follistatin
BMP对人类BMSC具有促成骨分化作用。在BMP-2诱导作用下人类BMSC会表达一些与成骨相关的标志基因如ALP、RUNX2等。但我们的研究显示,BMP-2浓度从0.01μg/mL升至1μg/mL过程中,它对Follistatin诱导逐渐增强,而浓度从1μg/mL升至50μg/mL时,它对Follistatin表达的诱导作用则逐渐减弱;表明在BMP-2诱导作用下人类BMSC中Follistatin表达与BMP-2呈浓度和时间依赖性。但对于BMP-2浓度进一步升高至大于1μg/mL后会导致Follistatin蛋白诱导减少,我们尚不清楚原因,推测可能是高浓度的BMP-2对细胞产生毒性的缘故。在我们的研究中浓度为50μg/mL的BMP-2未能诱导Follistatin表达,而Follistatin表达抑制则增强了人类BMSC成骨分化能力,表明高浓度BMP-2可能对新骨形成并无益处。BMP-2在促进了人类BMSC成骨分化的同时也促进BMP-2抑制剂表达,通过降低BMP-2生物学活性来负反馈调节BMP-2生物学活性,以防体内过度骨化。
3.4 Follistatin对BMP-2诱导人类BMSC成骨分化的影响
BMSC成骨分化在骨折修复过程中起了至关重要的作用,BMP对BMSC的成骨分化有促进作用,但BMP在细胞外受到多种细胞因子的影响,Follistatin可与BMP形成复合物,阻碍BMP对BMSC成骨分化信号转导通路的激活。有研究报道Follistatin通过与BMP相互作用来调控细胞分化及生物发育,而我们的研究亦显示了Follistatin在人类BMSC成骨分化方面的作用及Follistatin对BMSC活性的影响。以上研究表明,Follistatin表达抑制可增加人类BMSC活性,增强BMP-2对BMSC成骨分化的影响,从而进一步认识了Follistatin在人类BMSC成骨分化中扮演重要角色。Follistatin表达抑制可增强人类BMSC的细胞代谢、DNA和蛋白含量。有研究认为,Follistatin可抑制肿瘤增殖速度。我们的研究表明,在BMP-2存在的情况下,Follistatin对于人类BMSC成骨分化具有抑制作用。其可能机制为Follistatin结合BMP-2,使得BMP-2不易与人类BMSC膜受体结合,导致BMP-2生物学活性减弱,从而抑制下游信号转导。通过检测BMP-2下游的Smad信号转导通路来验证我们的假设,是我们下一步所要进行的研究。BMP-2信号减弱可能导致下游Smad信号减弱,Smad1/5/8 复 合 体 磷 酸 化 降低,磷 酸化Smad1/5/8入核减少,相关靶基因表达减弱,从而影响BMSC成骨分化及细胞活性。我们现有的数据显示,Follistatin表达抑制可增强RUNX2、MSX2及成骨细胞分化中关键转录因子的表达。此外,成骨细胞标记物如ALP、IBSP、OC及OPN的表达水平也随Follistatin表达抑制而升高。
我们得出结论是,BMP-2可呈剂量依赖性和时间依赖性地正调节Follistatin表达。Follistatin表达抑制可增强人类BMSC细胞活性及BMP-2诱导的人类BMSC成骨分化作用,表明Follistatin在人类BMSC成骨分化中起到了抑制作用。Follistatin通过胞内信号转导通路调节人类BMSC成骨分化,目前其胞内信号转导通路作用机制尚未明确,需进一步研究。
[1] Chlenski A,Liu S,Baker LJ,et al. Neuroblastoma angiogenesis is inhibited with a folded synthetic molecule corresponding to the epidermal growth factor-like module of the follistatin domain of SPARC[J].Cancer Res,2004,64(20):7420-7425.
[2] Dudaric L,Cvek SZ,Cvijanovic O,et al.Expression of the BMP-2,-4 and-7 and their antagonists gremlin,chordin,noggin and follistatin during ectopic osteogenesis[J].Coll Antropol,2013,37(4):1291-1298.
[3] Stafford DA,Monica SD,Harland RM.Follistatin interacts with Noggin in the development of the axial skeleton[J].Mech Dev,2014,131:78-85.
[4] Beites CL, Hollenbeck PL, Kim J,et al.Follistatin modulates a BMP autoregulatory loop to control the size and patterning of sensory domains in the developing tongue[J].Development,2009,136(13):2187-2197.
[5] Kashimada K,Pelosi E,Chen H,et al.FOXL2 and BMP2 act cooperatively to regulate follistatin gene expression during ovarian development[J].Endocrinology,2011,152(1):272-280.
[6] Komaki M,Iwasaki K,Morita I.Bone and Stem Cells.Mesenchymal stem cells and bone regeneration[J].Clin Calcium,2014,24(4):565-573.
[7] Gao X,Usas A,Tang Y,et al.A comparison of bone regeneration with human mesenchymal stem cells and muscle-derived stem cells and the critical role of BMP [J].Biomaterials,2014,35(25):6859-6870.
[8] Knight MN,Hankenson KD.Mesenchymal stem cells in bone regeneration[J].Adv Wound Care (New Rochelle),2013,2(6):306-316.
[9] Manassero M,Viateau V,Deschepper M,et al.Bone regeneration in sheep using acropora coral, a natural resorbable scaffold,and autologous mesenchymal stem cells[J].Tissue Eng Part A,2013,19(13-14):1554-1563.
[10] Kang Y,Kim S,Khademhosseini A,et al.Creation of bony microenvironment with CaP and cell-derived ECM to enhance human bone-marrow MSC behavior and delivery of BMP-2[J].Biomaterials,2011,32(26):6119-6130.
[11] Skarzynska J, Damulewicz M, Filipowska J, et al.Modification of Smad1 linker modulates BMP-mediated osteogenesis of adult human MSC[J].Connect Tissue Res,2011,52(5):408-414.
[12] Alfaro MP, Vincent A,Saraswati S,et al.sFRP2 suppression of bone morphogenic protein (BMP)and Wnt signaling mediates mesenchymal stem cell(MSC)self-renewal promoting engraftment and myocardial repair[J].J Biol Chem,2010,285(46):35645-35653.
[13] Sammons J,Ahmed N,El-Sheemy M,et al.The role of BMP-6,IL-6,and BMP-4in mesenchymal stem cell-dependent bone development:effects on osteoblastic differentiation induced by parathyroid hormone and vitamin D(3)[J].Stem Cells Dev,2004,13(3):273-280.
[14] Kang Q,Song WX,Luo Q,et al.A comprehensive analysis of the dual roles of BMPs in regulating adipogenic and osteogenic differentiation of mesenchymal progenitor cells[J].Stem Cells Dev,2009,18(4):545-559.
[15] Cook BD,Evans T.BMP signaling balances murine myeloid potential through SMAD-independent p38MAPK and NOTCH pathways[J].Blood,2014,124(3):393-402.
[16] Kwak YD,Hendrix BJ,Sugaya K.Secreted type of amyloid precursor protein induces glial differentiation by stimulating the BMP/Smad signaling pathway[J].Biochem Biophys Res Commun,2014,447(3):394-399.
[17] Hegarty SV,Collins LM,Gavin AM,et al.Canonical BMP-Smad signalling promotes neurite growth in rat midbrain dopaminergic neurons[J].Neuromolecular Med,2014,16(2):473-489.
[18] Yeung CY,Gossan N,Lu Y,et al.Gremlin-2 is a BMP antagonist that is regulated by the circadian clock[J].Sci Rep,2014,4:5183.
[19] Schneider H,Sedaghati B,Naumann A,et al.Gene silencing of chordin improves BMP-2 effects on osteogenic differentiation of human adipose tissue-derived stromal cells[J].Tissue Eng Part A,2014,20(1-2):335-345.

