ABCB1、CES1和CYP2C19基因多态性与氯吡格雷抵抗的相关性研究进展
李嘉欣,刘凯旋,李岩,高杰,张雨佳,邹建军(. 中国药科大学药学院, 江苏 南京 298; 2. 南京医科大学附属南京医院临床药理实验室,江苏 南京 20006)
ABCB1、CES1和CYP2C19基因多态性与氯吡格雷抵抗的相关性研究进展
李嘉欣1,刘凯旋1,李岩1,高杰1,张雨佳1,邹建军2*
(1. 中国药科大学药学院, 江苏 南京 211198; 2. 南京医科大学附属南京医院临床药理实验室,江苏 南京 210006)
[摘要]氯吡格雷是目前全球临床使用最为广泛的血小板受体抑制剂,但其抗血小板效应存在明显个体差异,部分病人服用常规剂量氯吡格
雷后存在抵抗现象,甚至发生不良临床事件。多项研究表明,ABCB1、CES1和CYP2C19基因多态性对氯吡格雷抵抗的产生发挥重要作用。
简介氯吡格雷体内吸收与代谢机制和氯吡格雷抵抗的定义,综述ABCB1、CES1和CYP2C19基因多态性对氯吡格雷抵抗的影响。
[关键词]氯吡格雷抵抗;ABCB1基因;CES1基因; CYP2C19基因;基因多态性
接受日期:2015-10-12
项目资助:国家自然科学基金 (No. 30901830)
研究方向:基因多态性和临床个体化给药研究;
Tel:025-52271449;E-mail: zoujianjun100@126.com
Research Progress in the Correlation between ABCB1, CES1 and CYP2C19 Gene Polymorphisms and Clopidogrel Resistance
LI Jiaxin1, LIU Kaixuan1, LI Yan1, GAO Jie1, ZHANG Yujia1, ZOU Jianjun2
(1. School of Pharmacy, China Pharmaceutical University, Nanjing 211198, China; 2. Clinical Pharmacology Laboratory, Nanjing Hospital Affiliated to Nanjing Medical University, Nanjing 210006, China)
[Abstract] Clopidogrel is one of the most widely clinically used platelet receptor inhibitors in the world, but there exists significant individual difference in its anti-platelet effect. Clopidogrel resistance, even adverse clinical events, could be presented in some patients taking common doses of clopidogrel. Several studies have shown that ABCB1, CES1 and CYP2C19 gene polymorphisms play a key role in clopidogrel resistance. the mechanisms ofin vivo clopidogrel absorption and metabolism and the definition of clopidogrel resistance were introduced. The impacts of ABCB1, CES1 and CYP2C19 gene polymorphisms on clopidogrel resistance were reviewed.
[Key words] clopidogrel resistance; ABCB1 gene; CES1 gene; CYP2C19 gene; gene polymorphism
血小板激活、聚集是急性冠状动脉综合征(ACS)和经皮冠状动脉介入治疗(PCI)术后动脉血栓形成的关键因素,而氯吡格雷(clopidogrel)是目前世界范围内使用最广泛的血小板受体抑制剂,它和阿司匹林的双联抗血小板治疗,已成为心脑血管疾病治疗金标准。然而,氯吡格雷的抗血小板效应存在明显个体差异,其用于部分病人时存在抗血小板效应降低或无抗血小板效应现象,这种现象被称为氯吡格雷抵抗。导致氯吡格雷抵抗的因素有很多,包括年龄、吸烟、糖尿病、药物间相互作用、用药依从性、遗传因素等,其中基因多态性起着决定性作用。目前关于三磷酸腺苷结合盒转运体超家族B1(ABCB1)基因和羧酸酯酶1(CES1)基因的研究较少且零碎,但其在氯吡格雷吸收、代谢中有着极其重要的作用,而细胞色素P450酶2C19 (CYP2C19)基因更是氯吡格雷在体内活化并发挥药效的关键。因此,本文主要就这3种基因多态性对氯吡格雷抵抗的影响作一综述。
1 氯吡格雷体内吸收与代谢机制
氯吡格雷是二磷酸腺苷(ADP) 受体抑制剂,本身并无活性,需经过代谢转化为活性形式,才能发挥抗血小板作用。它在小肠的吸收受到编码P-糖蛋白的ABCB1基因的调控,进入肝脏后只有15%通过CYP系统代谢为活性产物,约85%经酯酶(主要受CES1基因调控)代谢转化为无活性的物质排出体外,酯酶不仅可以将吸收的氯吡格雷迅速水解为无活性的羧酸代谢物,也可将2-O-氯吡格雷和活性代谢物水解为羧酸代谢物。
在经历CYP系统代谢时,氯吡格雷先由CYP1A2、CYP2B6和CYP2C19代谢转化为2-O-氯吡格雷,再经CYP2C19、CYP2C9、CYP3A4和CYP2B6催化生成具有药物活性的硫醇衍生物。此衍生物能不可逆地拮抗血小板膜上的ADP受体P2Y12,使纤维蛋白原无法与其受体糖蛋白Ⅱb/Ⅲa结合,抑制血小板的活化和聚集(见图1)。
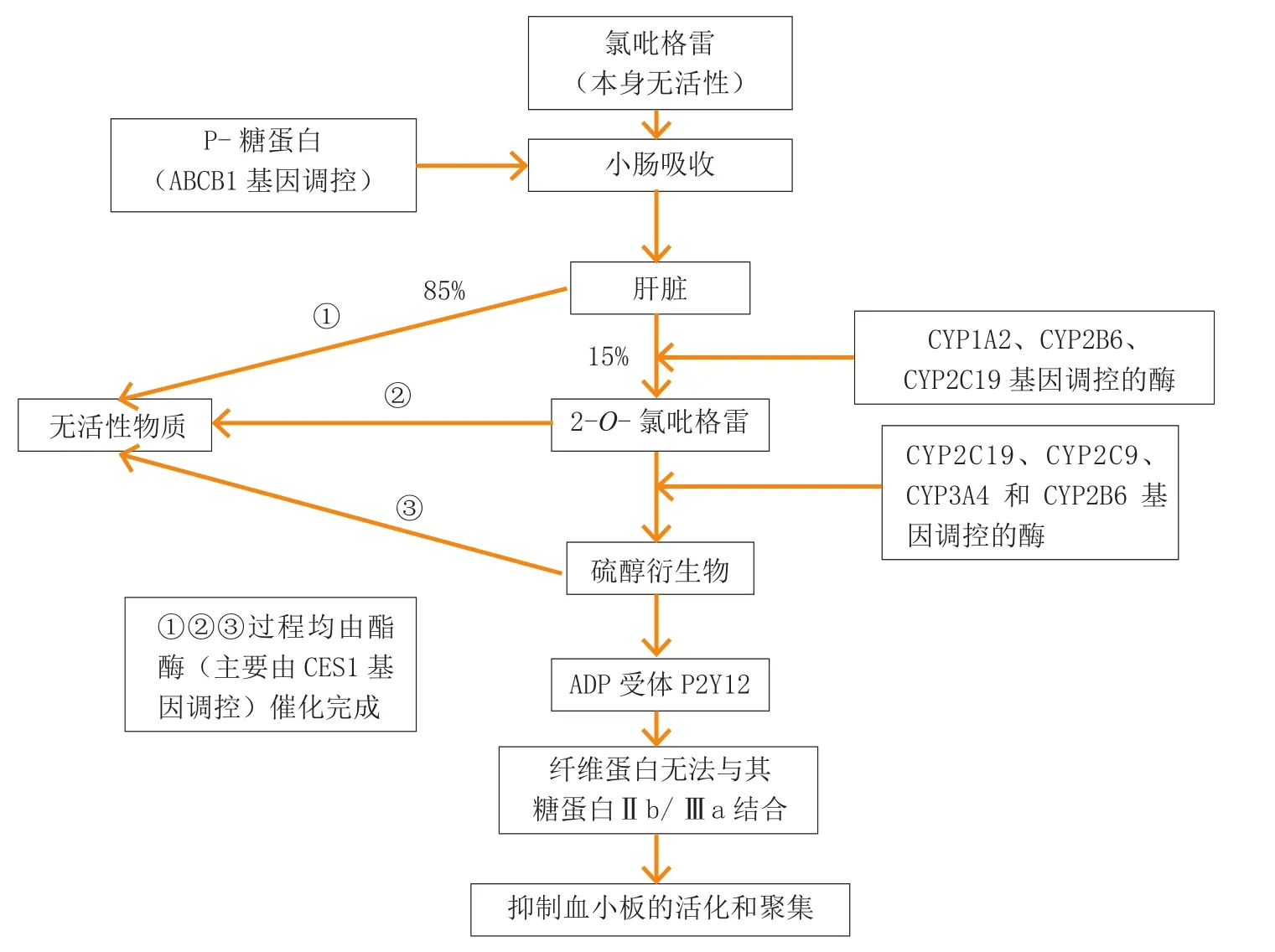
图1 氯吡格雷的吸收和代谢机制图解Figure 1 Schematic diagram of the intestinal absorption and metabolic mechanisms of clopidogrel
2 氯吡格雷抵抗的定义
关于氯吡格雷抵抗,目前尚无统一的标准定义。大多数学者将其分为实验室氯吡格雷抵抗及临床氯吡格雷抵抗。对于实验室氯吡格雷抵抗,即基于实验室检测的血小板活性,一般认为,在服药前后测定由ADP诱导的血小板聚集率差值为10%,即为氯吡格雷抵抗[1];但Müller等[2]认为,给予600 mg氯吡格雷后4 h,与基线值相比,由ADP(5和20 μmol·L-1)诱导的血小板聚集减少10%或以下,则为氯吡格雷抵抗,而血小板聚集抑制率达10%~30%时,为药物反应不完全,当抑制率大于30%时,为药物反应良好。临床氯吡格雷抵抗是由Wiviott等[3]提出,即氯吡格雷治疗不能达到预期疗效,患者在长期服用有效剂量的氯吡格雷治疗后,仍不能完全防止临床不良血管事件的发生。
3 ABCB1基因多态性对氯吡格雷抵抗的影响
P-糖蛋白在小肠上皮细胞中表达,能影响氯吡格雷在小肠和胆小管中的吸收,从而影响血浆中药物浓度。该蛋白由ABCB1基因编码,ABCB1基因在人类多药耐药基因族中起主导作用,其表达受多种因素的影响,属于可调控基因。ABCB1基因C3435T、G2677T/A 和C1236T的多态性具有重要的功能意义,三者存在连锁不平衡关系。
目前,对ABCB1基因C3435T多态性的研究较多。根据3435位点(C→T)的多态性,ABCB1基因可分为CC(野生型)、CT(突变型杂合子)、TT(突变型纯合子)3种基因型。临床研究发现,与CC基因型患者相比,CT和TT基因型患者在PCI术前服用300或600 mg氯吡格雷后,氯吡格雷生物利用度明显降低;而且,TT基因型个体的P-糖蛋白表达量仅为野生型个体的49%,而CT基因型个体的P-糖蛋白表达量是CC基因型个体的75%[4]。名为TRITON–TIMI 38的临床试验显示,在接受氯吡格雷治疗后,TT基因型携带者,发生心血管病死亡、心肌梗死、卒中的风险比CC基因型携带者高(12.9% vs 7.8%,危害比1.72,95%置信区间:1.22 ~ 2.44,P = 0.002)[5]。而另一些研究却得到了相反的结论。Wallentin等[6]在名为PLATO的临床试验的基因研究中发现,携带CC等位基因型患者心血管事件发生率最高。Su等[7]对ACS患者的ABCB1基因C3435T多态性及氯吡格雷反应所作的一项meta分析发现,ABCB1基因C3435T多态性与服用负荷剂量(300 mg·d-1)氯吡格雷的患者早期主要不良血管事件相关;同时,TT基因型患者的出血的风险较低。因此,ABCB1基因C3435T多态性对氯吡格雷抵抗的影响,还需更进一步研究。
对于ABCB1基因G2677T/A和C1236T的多态性在氯吡格雷抵抗中的影响,国内外的研究仍较少。据李国标等[8]在2013年对中国汉族人群的调研显示,ABCBl基因G2677T/A的基因型频率和等位基因分布频率在氯吡格雷抵抗组和非氯吡格雷抵抗组之间的差异无统计学意义(P > 0.05),ABCBl基因G2677T/A多态性与氯吡格雷抵抗的发生不存在相关性。但此项研究并未对3个位点基因多态性连锁不平衡关系进行多因素分析,尚需增加样本量,做更系统的分析。
4 CES1基因多态性对氯吡格雷抵抗的影响
目前已发现羧酸酯酶至少存在6种同工酶,即CES1~CES6[9],其中CES1是目前为止已被发现的唯一对氯吡格雷疗效出现个体差异有重要影响的酯酶。人体肝脏内的CES1由两种基因CES1A1和CES1A2编码,它们的不同只在于启动子部分及外显子1部分,但最终经过翻译,可成为相同的成熟蛋白[10]。
Lewis等[11]研究发现,CES1基因外显子4上发生的突变(rs71647871,c.428G>A)与氯吡格雷治疗后ADP诱导的血小板聚集存在显著相关性。在506名接受氯吡格雷治疗的患者中,7名CES1 143E携带者体内氯吡格雷活性产物的浓度明显高于499名CES1 143G纯合子携带者[(30.3±6.1) vs (19.0±0.4)μg·L-1,P = 0.001],CES1 143E等位基因携带者体内ADP诱导的血小板聚集率明显低于CES1 143G纯合子携带者,表明氯吡格雷对CES1 143E携带者的作用效果优于对CES1 143G纯合子携带者,二者的最大血小板聚集率(MPA)分别为25%和45%(独立检验,P = 0.03)。并且,一年的随访调查显示,有13.7%的CES1 143G纯合子携带者再发心血管疾病,而CES1 143E等位基因携带者的心血管疾病再发率则为0%,但这一数据的统计学差异并不显著(P = 0.44)。此外,CYP2C19*2基因携带者体内ADP诱导血小板聚集率的β系数绝对值只有7.4,而CES1 143E携带者体内此值则达11.6,说明CES1基因多态性对氯吡格雷疗效产生重大影响,有进一步研究价值。Tarkiainen等[12]的研究数据也支持该项研究结果。
Zou等[13]研究发现,CES1A2-816A/ C突变可能和氯吡格雷诱导抗血小板作用存在关联。此实验研究在249 名CYP2C19野生型(排除有CYP2C19 *2、*3和*17突变)携带患者中进行,这些患者均在PCI术前服用氯吡格雷300 mg,术后继续服用氯吡格雷75 mg·d-1,持续12个月,并同时服用阿司匹林100 mg·d-1。结果显示,分别携有CES1A2-816A/A、A/C、C/C的受试者体内ADP诱导的MPA中位数为31.7%、23.6%和14.6%,存在明显统计学差异,其中CES1A2-816C携带者的MPA明显更低。
5 CYP2C19基因多态性对氯吡格雷抵抗的影响
氯吡格雷在肝脏代谢过程中,CYP2C19酶(由CYP2C19基因编码)起重要作用。氯吡格雷在形成中间代谢产物及最终活性代谢产物的2步氧化过程中分别有45%和20%是由CYP2C19介导的。有研究指出,CYP2C19是氯吡格雷抵抗的独立预测因素[14]。
5.1CYP2C19功能缺失等位基因的影响
2006年,Hulot等[15]在研究中首先提出CYP2C19基因多态性可能影响氯吡格雷的疗效:携带CYP2C19*2功能缺失基因的人群服用氯吡格雷后体内氯吡格雷活性代谢产物的生成减少,伴有ADP诱导的血小板聚集抑制率的降低。Mega等[16]的研究也表明,至少携带一个CYP2C19功能缺失等位基因的健康受试者其血浆氯吡格雷活性代谢产物浓度,比非携带者降低32.4%(P < 0.001)。2012年有报道在综合检索了42 016例心血管事件后,也概括得出相同的结论[17]。
由于CYP2C19功能缺失基因使氯吡格雷对血小板聚集的抑制作用降低,易发生氯吡格雷抵抗,使得接受氯吡格雷治疗的患者发生ACS及严重不良心血管事件的风险升高[18]。Simon等[19]开展的研究和TRITONTIMI 38试验[5]也均表明,携带CYP2C19功能缺失等位基因的患者其心血管事件的发生率比非携带者显著升高。Wallentin等[6]的实验研究说明,携带CYP2C19功能缺失基因的患者接受氯吡格雷治疗30 d的复合终点事件(包括心血管死亡,心肌梗死及卒中)发生率高于非携带患者(5.7% vs 3.8%,P = 0.028)。2013年Mao 等[20]通过一项基于23 035受试患者的meta分析总结得出,CYP2C19基因多态性与使用氯吡格雷治疗的患者发生不良临床事件的风险显著相关。
针对我国患者的临床研究也证实,携带CYP2C19功能缺失等位基因的患者更易发生高血小板反应,且发生氯吡格雷抵抗的风险增加[21-22]。Liu等[23]和Qiu等[24]对中国患者的研究都表明CYP2C19功能缺失等位基因的存在对氯吡格雷的治疗效果有显著影响,且更易引发心脑血管疾病[25]。对于韩国[26]、日本[27]等亚洲国家患者的研究也得出了相同的结论。
5.2CYP2C19*2基因的影响
CYP2C19*2为CYP2C19基因的主要突变体,是氯吡格雷形成活性代谢产物并产生抗血小板作用的决定因素[28]。
Trenk等[29]和Kreutz等[30]在研究中发现,CYP2C19*2等位基因携带者体内对氯吡格雷的代谢活性较非携带者降低,具有更高的血小板活性。Giusti等[31]和Shuldiner 等[32]研究显示,接受抗血小板治疗的CYP2C19*2突变者对血小板抑制水平降低,更易发生心血管缺血事件甚至死亡。Singh等[33]的研究也指出,CYP2C19*2基因多态性与增加心血管不良事件发生风险显著相关。然而,有研究表明,CYP2C19*2基因多态性,虽然影响氯吡格雷的抗血小板反应,但并不影响ACS的临床治疗结果[34]。
中国患者的CYP2C19*2基因与血小板聚集率同样密切相关(P = 0.001)[35]。李海蓬[36]和陈菲[37]在中国患者中进行的实验表明,CYP2C19*2基因多态性与氯吡格雷抵抗存在相关性,是氯吡格雷抵抗的独立危险因素。孙文竹[38]和彭利等[39]的研究表明,携带CYP2C19*2基因的病人服用氯吡格雷进行抗血小板治疗后,更易发生心脑血管缺血事件。
5.3CYP2C19*3和CYP2C19*17基因的影响
2009年,Lee等[40]对韩国冠心病患者进行的研究发现,CYP2C19*3基因是氯吡格雷抵抗发生的独立预测因素。
有研究表明,氯吡格雷在体内的活性还受到CYP2C19*17等位基因的遗传调控[41];携带CYP2C19*17的患者使用氯吡格雷后,可提高其在体内对血小板聚集的抑制率[42],且不易发生氯吡格雷抵抗,但出血风险增加[43]。Sibbing等[44]在1 524名PCI术后患者中进行的实验研究发现,经氯吡格雷治疗后,携带CYP2C19*17基因的患者血小板活性被显著抑制,其中CYP2C19*17等位基因杂合子和纯合子携带者的出血风险分别是未携带者的1.85倍和3.41倍。Tiroch等[45]在研究中发现,接受氯吡格雷治疗后,携带CYP2C19*7基因的患者发生心肌梗死等临床不良事件的概率降低。Carlquist等[46]的实验研究也发现,CYP2C19*17基因的存在可以使患者接受氯吡格雷治疗1年后心肌梗死发病率从11.1%降至7.0%(P = 0.045)。
6 结语与展望
目前,氯吡格雷已经成为用于临床防治缺血性事件的重要药物,但氯吡格雷抵抗所导致的临床不良事件,不仅危害患者的身心健康,也给病人及家庭带来巨大的经济损失,并带来一定的社会负担。
关于氯吡格雷抵抗的药物基因组学研究,已经取得较大进展,但由于没有相对公认的规范,以及实验结果易受研究对象的性别、年龄、种族等非遗传因素影响,国内外对于基因多态性在氯吡格雷抵抗中的影响仍存在分歧,还需要更多、更规范的实验数据给予支持,并有待进一步深入探究。
随着基因多态性在氯吡格雷抵抗中的作用逐渐清晰,待快速、准确、性价比高的检测仪器研制成功,必将推进基因检测的普及,而根据基因型分析指导个体抗血小板治疗,将成为现实,准确有效的个体化给药也将不再遥远。
[参 考 文 献]
[1] Gurbel P A, Bliden K P, Samara W, et al. Clopidogrel effect on platelet reactivity in patients with stent thrombosis: results of the CREST Study[J]. J Am Coll Cardiol, 2005, 46(10): 1827-1832.
[2]Müller I, Besta F, Schulz C, et al. Prevalence of clopidogrel non-responders among patients with stable angina pectoris scheduled for elective coronary stent placement[J]. Thromb Haemost, 2003, 89(5): 783-787.
[3]Wiviott S D, Antman E M. Clopidogrel resistance: a new chapter in a fast-moving story[J]. Circulation, 2004, 109(25): 3064-3067.
[4]Hoffmeyer S, Burk O, von Richter O, et al. Functional polymorphisms of the human multidrug-resistance gene: multiple sequence variations and correlation of one allele with P-glycoprotein expression and activity in vivo[J]. Proc Natl Acad Sci USA, 2000, 97(7): 3473-3478.
[5]Mega J L, Close S L, Wiviott S D, et al. Genetic variants in ABCB1 and CYP2C19 and cardiovascular outcomes after treatment with clopidogrel and prasugrel in the TRITON-TIMI 38 trial: a pharmacogenetic analysis[J]. Lancet, 2010, 376(9749): 1312-1319.
[6]Wallentin L, James S, Storey R F, et al. Effect of CYP2C19 and ABCB1 single nucleotide polymorphisms on outcomes of treatment with ticagrelor versus clopidogrel for acute coronary syndromes: a genetic substudy of the PLATO trial[J]. Lancet, 2010, 376(9749): 1320-1328.
[7]Su J, Xu J, Li X, et al. ABCB1 C3435T polymorphism and response to clopidogrel treatment in coronary artery disease (CAD) patients: a metaanalysis[J]. PLoS One, 2012, 7(10): 463-466.
[8]李国标, 苏启表, 李宏标, 等. ABCB1基因位点G2677T/A单核苷酸多态性与氯吡格雷抵抗的相关性研究[J]. 广州药学院学报, 2013, 29(5): 552-556.
[9]Merali Z, Ross S, Paré G. The pharmacogenetics of carboxylesterases: CES1 and CES2 genetic variants and their clinical effect[J]. Drug Metabol Drug Interact, 2014, 29(3): 143-151.
[10]Fukami T, Nakajima M, Maruichi T, et al. Structure and characterization of human carboxylesterase 1A1, 1A2, and 1A3 genes[J]. Pharmacogenet Genomics, 2008, 18(10): 911-920.
[11]Lewis J P, Horenstein R B, Ryan K, et al. The functional G143E variant of carboxylesterase 1 is associated with increased clopidogrel active metabolite levels and greater clopidogrel response[J]. Pharmacogenet Genomics, 2013, 23(1): 1-8.
[12]Tarkiainen E K, Holmberg M T, Tornio A, et al. Carboxylesterase 1 c.428G>A single nucleotide variation increases the antiplatelet effects of clopidogrel by reducing its hydrolysis in humans[J]. Clin Pharmacol Ther, 2015, 97(6): 650-658.
[13]Zou J J, Chen S L, Fan H W, et al. CES1A -816C as a genetic marker to predict greater platelet clopidogrel response in patients with percutaneous coronary intervention[J]. J Cardiovasc Pharmacol, 2014, 63(2): 178-183.
[14]Jia D M, Chen Z B, Zhang M J, et al. CYP2C19 polymorphisms and antiplatelet effects of clopidogrel in acute ischemic stroke in China[J]. Stroke, 2013, 44(6): 1717-1719.
[15]Hulot J S, Bura A, Villard E, et al. Cytochrome P450 2C19 lossof-function polymorphism is a major determinant of clopidogrel responsiveness in healthy subjects[J]. Blood, 2006, 108(7): 2244-2247.
[16]Mega J L, Close S L, Wiviott S D, et al. Cytochrome p-450 polymorphisms and response to clopidogrel[J]. N Engl J Med, 2009, 360(4): 354-362.
[17]Holmes M V, Perel P, Shah T, et al. CYP2C19 genotype, clopidogrel metabolism, platelet function, and cardiovascular events: a systematic review and meta-analysis[J]. JAMA, 2011, 306(24): 2704-2714.
[18]Scott S A, Sangkuhl K, Gardner E E, et al. Clinical Pharmacogenetics Implementation Consortium guidelines for cytochrome P450-2C19 (CYP2C19) genotype and clopidogrel therapy[J]. Clin Pharmacol Ther, 2011, 90(2): 328-332.
[19]Simon T, Verstuyft C, Mary-Krause M, et al. Genetic determinants of response to clopidogrel and cardiovascular events[J]. N Engl J Med, 2009, 360(4): 363-375.
[20]Mao L, Jian C, Changzhi L, et al. Cytochrome CYP2C19 polymorphism and risk of adverse clinical events in clopidogrel-treated patients: a meta-analysis based on 23,035 subjects[J]. Arch Cardiovasc Dis, 2013,106(10): 517-527.
[21]Tsantes A E, Ikonomidis I, Papadakis I, et al. Impact of the proton pump inhibitors and CYP2C19*2 polymorphism on platelet response to clopidogrel as assessed by four platelet function assays[J]. Thromb Res, 2013, 132(2): 105-111.
[22]谭洁, 刘彦, 林琳, 等. 经皮冠状动脉介入术后患者CYP2C19基因多态性与氯毗格雷抵抗的相关性研究[J]. 临床心血管病杂志, 2013, 29(2): 108-111.
[23]Liu Y, Liu N, Li W, et al. Relationship of CYP2C19*2 and CYP2C19*3 gene polymorphism with clopidogrel response variability and recurrent cardiovascular events in Chinese patients undergoing percutaneous coronary intervention[J]. Pharmacology, 2013, 91(3/4): 165-172.
[24]Qiu L N, Sun Y, Wang L, et al. Influence of CYP2C19 polymorphisms on platelet reactivity and clinical outcomes in ischemic stroke patients treated with clopidogrel[J]. Eur J Pharmacol, 2015, 747: 29-35.
[25]Sun W, Li Y, Li J, et al. Variant recurrent risk among stroke patients with different CYP2C19 phenotypes and treated with clopidogrel[J]. Platelets, 2015, 26(6): 558-562.
[26]Jeong T D, Kim S M, Kim H J, et al. CYP2C19 genotype and early ischemic lesion recurrence in stroke patients treated with clopidogrel[J]. J Stroke Cerebrovasc Dis, 2015, 24(2): 440-446.
[27]Nakata T, Miyahara M, Nakatani K, et al. Relationship between CYP2C19 loss-of-function polymorphism and platelet reactivities with clopidogrel treatment in Japanese patients undergoing coronary stent implantation[J]. Circ J, 2013, 77(6): 1436-1444.
[28]Wang X Q, Shen C L, Wang B N, et al. Genetic polymorphisms of CYP2C19 2 and ABCB1 C3435T affect the pharmacokinetic and pharmacodynamic responses to clopidogrel in 401 patients with acute coronary syndrome[J]. Gene, 2015, 558(2): 200-207.
[29]Trenk D, Hochholzer W, Fromm M F, et al. Cytochrome P450 2C19 681G>A polymorphism and high on-clopidogrel platelet reactivity associated with adverse 1-year clinical outcome of elective percutaneous coronary intervention with drug-eluting or bare-metal stents[J]. J Am Coll Cardiol, 2008, 51(20): 1925-1934.
[30]Kreutz R P, Nystrom P, Kreutz Y, et al. Influence of paraoxonase-1 Q192R and cytochrome P450 2C19 polymorphisms on clopidogrel response[J]. Clin Pharmacol, 2012, 4: 13-20.
[31]Giusti B, Gori A M, Marcucci R, et al. Cytochrome P450 2C19 loss-offunction polymorphism, but not CYP3A4 IVS10 + 12G/A and P2Y12 T744C polymorphisms, is associated with response variability to dual antiplatelet treatment in high-risk vascular patients[J]. Pharmacogenet Genomics, 2007, 17(12):1057-1064.
[32]Shuldiner A R, O'Connell J R, Bliden K P, et al. Association of cytochrome P450 2C19 genotype with the antiplatelet effect and clinical efficacy of clopidogrel therapy[J]. JAMA, 2009, 302(8): 849-857.
[33]Singh M, Shah T, Adigopula S, et al. CYP2C19*2/ABCB1-C3435T polymorphism and risk of cardiovascular events in coronary artery disease patients on clopidogrel: is clinical testing helpful?[J]. Indian Heart J, 2012, 64(4): 341-352.
[34]Cano P, Consuegra-Sánchez L, Conesa P, et al. Relevance of CYP2C19 2 regarding platelet reactivity in patients with acute coronary syndrome treated with clopidogrel[J]. Med Clin (Barc), 2014, 143(1): 6-12.
[35]唐晓芳, 何晨, 袁晋青, 等. 细胞色素P450 2C19基因多态性对介入术后服用氯毗格雷冠心病患者临床预后的影响[J]. 中华心血管杂志, 2011, 39(7): 617-620.
[36]李海蓬. CYP2C19基因多态性与氯吡格雷抵抗相关性研究[D]. 天津: 天津医科大学研究生院, 2013.
[37]陈菲. 细胞色素P4502C19*2基因多态性与氯吡格雷抵抗及再发心血管事件的临床研究[D]. 太原: 山西医科大学第二临床医学院, 2014.
[38]孙文竹. 氯吡格雷药物基因在缺血性卒中和急性冠脉综合征病人中的观察性研究[D]. 上海: 复旦大学生命科学学院, 2013.
[39]彭利, 张蓝宁, 陈曦, 等. CYP2C19功能缺失性等位基因与老年冠心病患者支架植入术后氯毗格雷抗血小板反应性和疗效的药物基因组学研究[J]. 中华老年多器官疾病杂志, 2014, 13(10): 721-726.
[40]Lee J M, Park S, Shin D J, et al. Relation of genetic polymorphisms in the cytochrome P450 gene with clopidogrel resistance after drug-eluting stent implantation in Koreans[J]. Am J Cardiol, 2009 , 104(1): 46-51.
[41]Grosdidier C, Quilici J, Loosveld M, et al. Effect of CYP2C19*2 and *17 genetic variants on platelet response to clopidogrel and prasugrel maintenance dose and relation to bleeding complications[J]. Am J Cardiol, 2013, 111(7): 985-990.
[42]Pedersen R S, Nielsen F, Stage T B, et al. CYP2C19*17 increases clopidogrel-mediated platelet inhibition but does not alter the pharmacokinetics of the active metabolite of clopidogrel[J]. Clin Exp Pharmacol Physiol, 2014, 41(11): 870-878.
[43]Li Y, Tang H L, Hu Y F, et al. The gain-of-function variant allele CYP2C19*17: a double-edged sword between thrombosis and bleeding in clopidogrel-treated patients[J]. J Thromb Haemost, 2012, 10(2): 199-206.
[44]Sibbing D, Koch W, Gebhard D, et al. Cytochrome 2C19*17 allelic variant, platelet aggregation, bleeding events, and stent thrombosis in clopidogrel-treated patients with coronary stent placement[J]. Circulation, 2010, 121(4): 512-518.
[45]Tiroch K A, Sibbing D, Koch W, et al. Protective effect of the CYP2C19 *17 polymorphism with increased activation of clopidogrel on cardiovascular events[J]. Am Heart J, 2010, 160(3): 506-512.
[46]Carlquist J F, Knight S, Horne B D, et al. Cardiovascular risk among patients on clopidogrel anti-platelet therapy after placement of drugeluting stents is modified by genetic variants in both the CYP2C19 and ABCB1 genes[J]. Thromb Haemost, 2013, 109(4): 744-754.

[专家介绍]邹建军:副主任药师,硕士生导师,现为南京医科大学附属南京医院临床药理实验室技术负责人,从事药物基因组学、药物代谢动力学和PK/PD模型化研究,2011年度被评为南京市卫生青年人才。近年来以第一作者或通讯作者发表论文50余篇,其中31篇发表在CT、EJCP、PT等SCI刊物上,主要研究领域为抗血小板药物的遗传药理学研究、基于群体PK/PD模型和药物基因组学与个体化药物治疗。
·新药注册审评·
DRUG REGISTRATION AND EVALUATION
*通讯作者:邹建军,博士,副主任药师;
[中图分类号]R973.2
[文献标志码]A
[文章编号]1001-5094(2015)11-0817-06

