鲍鱼肌原纤维结合型蛋白酶的初步鉴定
陶志鹏,张凌晶,翁 凌,刘光明,曹敏杰
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.福建省水产品深加工工程研究中心,福建 厦门 361021)
鲍鱼肌原纤维结合型蛋白酶的初步鉴定
陶志鹏1,2,张凌晶1,2,翁凌1,2,刘光明1,2,曹敏杰1,2
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.福建省水产品深加工工程研究中心,福建 厦门 361021)
[摘要]研究了皱纹盘鲍腹足肌肉中肌原纤维结合型蛋白酶对肌原纤维蛋白的降解作用.SDS-PAGE结果显示,肌原纤维在55~60 ℃下,肌球蛋白重链(Myosin Heavy Chain,MHC)和副肌球蛋白(Paramyosin,PM)会发生明显的降解.金属蛋白酶抑制剂EDTA、1,10-phenathroline能够有效抑制MHC和PM的分解.EDTA以及丝氨酸蛋白酶抑制剂benzamidine共同作用几乎可完全抑制蛋白质降解,揭示鲍鱼肌肉中存在肌原纤维结合型金属蛋白酶(Metalloproteinase,MP)和丝氨酸蛋白酶 (Serine proteinase,SP).通过加热、强离子浓度溶液抽提相结合的方式,从肌原纤维蛋白中初步分离出这两种酶.分别利用这两种酶对肌原纤维蛋白进行降解,发现最适温度均在60 ℃左右,与肌原纤维蛋白自身降解的最适温度(55~60 ℃)相吻合.对SP的底物特异性分析结果表明,制备的丝氨酸蛋白酶对P1位为Arg残基的荧光底物有较高的分解作用,而对P1位为Lys残基的底物分解较弱.
[关键词]鲍鱼;肌原纤维; 降解;金属蛋白酶;丝氨酸蛋白酶
0引言
鲍鱼属软体动物门、腹足纲、前腮亚纲、原始腹足目、鲍科、鲍属,以其较高的营养价值和药学价值而位列“海产八珍”之一[1].迄今为止,全世界各海区已命名的鲍鱼有216种,常见种类约有30种,在我国沿海分布主要有7种,比较重要的经济种类约有3个:皱纹盘鲍(Haliotis discus hannai)、杂色鲍(Haliotis diversicolor)和九孔鲍(Haliotis diversicolor supertexta).随着经济社会发展,人们对高品质食品需求的增加,鲍鱼以其浓厚的传统文化背景、独特的风味口感和较高的营养价值,越来越受到大众的青睐.需求的增加带动了鲍鱼养殖、加工产业的快速发展.据统计,2012年我国鲍鱼养殖总产量达到9.1万t,较2011年增长18.1%,而当年福建省的鲍鱼产量达到6.5万t[2].皱纹盘鲍为我国北部沿海最主要的渔获种类,也是该地区最优良的浅海增养殖贝类之一.由于福建等南方海域冬季水温较高,适合鲍鱼生长,并且随着水产养殖技术的进步,皱纹盘鲍的“北鲍南养”养殖方式得到广泛的实施,这不仅提高了鲍鱼的成活率,也降低了养殖成本.目前,鲍鱼加工产品主要有罐头、干制品和冷冻品.鲍鱼肌肉中的蛋白质主要包括肌原纤维蛋白和胶原蛋白,其中,胶原蛋白与肌原纤维蛋白紧密结合,使得鲍鱼肌肉具有紧致的结构和良好的咀嚼性.研究发现,软体类动物如鱿鱼肌肉中存在活力较强的酶类,能够降解稳定性较好的副肌球蛋白[3].研究者已从鱿鱼肌肉中纯化出能够降解肌球蛋白重链的金属蛋白酶[4].同样,鲍鱼在热加工过程中,肌肉蛋白会发生结构变化,从而对鲍鱼最终制品的质构产生影响[5].通过电泳及透射式扫描电镜观察鲍鱼在热加工过程中蛋白质的变化情况,发现肌原纤维蛋白在受热条件下会发生降解,超微结构发生显著破坏[6].
迄今为止,国内外对引起鱼类肌原纤维蛋白降解的酶类及其内源性抑制剂研究较多[7- 10].然而,对鲍鱼等贝类水产品在热加工过程中肌原纤维蛋白的降解,以及引起这一现象的酶类的研究,报道甚少.本文旨在研究引起鲍鱼肌原纤维蛋白降解的蛋白酶类,探讨它们的理化性质,揭示热加工过程中这些酶类对蛋白质的影响,为鲍鱼加工提供一定的理论参考.
1材料与方法
1.1 材料与仪器
鲜活皱纹盘鲍(质量80~90 g/只)购于福建省厦门市高崎水产品批发市场,即杀后去内脏取肌肉放置于冰上,备用;各种荧光合成底物购于日本Peptide Institute公司;蛋白酶抑制剂1,10-phenathroline,benzamidine,Pefabloc SC, Aprotinin购于美国Sigma公司;E64,Leupeptin购自德国Roche公司;蛋白标准分子量购于美国Bio-Rad公司;其他试剂均为国产分析纯.
Avanti J-26S XP 高速冷冻离心机(Beckman,美国);Lamda 35型紫外可见分光光度计(Perkin Elmer,美国);FP-6200荧光分光光度计 (Jasco,日本);G:Box 凝胶成像仪 (Syngene,英国);组织捣碎机(Kinematica,瑞士);WB-14恒温水浴锅(Memmert,德国);蛋白质电泳装置(Bio-Rad,美国).
1.2 实验方法
1.2.1丝氨酸蛋白酶活力测定
丝氨酸蛋白酶活力测定方法主要参考Guo等[8]的方法并作适当修改.以 Boc-Phe-Ser-Arg-MCA 为荧光底物,在850 μL 50 mmol/L Tris-HCl (pH= 8.0) 缓冲液中,分别加入100 μL 适量的酶液,50 μL荧光底物在55 ℃孵育30 min,立即加入1.5 mL终止液(V(甲醇)∶V(异丙醇)∶V(水)=35∶30∶35)终止反应,用荧光分光光度计在激发光波长为380 nm 和发射光波长为450 nm下测定反应释放出的7-氨基-4-甲基香豆素 (7-amino-4-methycoumarin,AMC) 的含量.酶活力单位定义为每分钟内分解荧光底物释放出1 nmol AMC 为1个单位.
1.2.2鲍鱼肌肉肌原纤维蛋白的制备
肌原纤维蛋白提取主要参考Cao等[9]从狗母鱼中制备肌原纤维蛋白的方法.新鲜的鲍鱼腹足肌肉用刀切成小块剁碎后与4 倍体积的20 mmol/L Tris-HCl(pH= 8.0)缓冲液一起经组织捣碎机捣碎.捣碎后的匀浆液在 4 ℃下8000 r/min 离心15 min,弃除上清液,将下层沉淀取出用上述缓冲液搅匀,组织匀浆后,在4 ℃ 下8000 r/min离心15 min,取出沉淀.再重复以上步骤3次,将最后得到的沉淀取出并溶解于含有0.5 mol/L NaCl 的20 mmol/L Tris-HCl(pH=8.0)缓冲液中,即为鲍鱼肌肉肌原纤维蛋白.制备的肌原纤维蛋白立即使用或冻存于-70 ℃ 冰箱中备用.
1.2.3灭活肌原纤维蛋白的制备
为消除内源性金属蛋白酶和丝氨酸蛋白酶的影响,在制备好的鲍鱼肌原纤维蛋白中加入5 mmol/L EDTA、10 mmol/L benzamidine 和1 mmol/L Leupeptin终浓度,充分混合,4 ℃ 静置2 h,然后用9000 r/min离心20 min,将所得沉淀与4倍体积蒸馏水混匀搅拌,离心.重复洗涤4次,将最后所得沉淀溶解于含0.5 mol/L NaCl 的20 mmol/L Tris-HCl(pH =8.0)缓冲液中.
1.2.4鲍鱼肌原纤维蛋白在不同温度下的自身降解
取肌原纤维100 μL 置于0.5 mL Eppendorf 管中,分别在30、40、50、55、60、70 ℃下加热2 h.加热完成后,样品经SDS化后,95 ℃加热10 min后,上样于质量分数8%~20%梯度的SDS-PAGE,电泳结束后,电泳胶经考马斯亮蓝染色后分析蛋白质的降解情况.
1.2.5各种蛋白酶抑制剂对肌原纤维蛋白降解的抑制作用
取肌原纤维100 μL置于0.5 mL的Eppendorf 管中,加入蛋白酶抑制剂至不同终浓度,在室温下反应30 min后转入55 ℃恒温水浴继续反应2 h.蛋白酶抑制剂包括:金属蛋白酶抑制剂(EDTA,1,10-phenathroline),丝氨酸蛋白酶抑制剂(benzamidine,Pefabloc SC,Aprotinin),半胱氨酸蛋白酶抑制剂(E-64,Leupeptin).样品经SDS化后上样于质量分数8%~20%梯度的SDS-PAGE.电泳结束后,将胶以考马斯亮蓝染色,分析各种抑制剂对由结合型蛋白酶引起的肌原纤维蛋白降解的抑制效果,从而判断蛋白酶的性质.
1.2.6结合型蛋白酶的解离
重复鲍鱼肌肉肌原纤维蛋白提取过程中的洗涤步骤,将最后的沉淀与含0.5 mol/L KCl,1 mmol/L MgCl2的20 mmol/L Tris-HCl(pH= 8.0)缓冲液混匀,经组织捣碎后,匀浆液立即置于沸水浴中,不断搅拌直至中心温度达到45,50,55,60 ℃,然后置于不同温度的恒温水浴中继续加热1~30 min后,将样品在9000 r/min 下离心20 min,所得上清液即为粗酶液,用于酶活力测定.
1.2.7结合型蛋白酶对灭活肌原纤维蛋白降解的比较
在以上解离得到的酶液中加入终浓度为5 mmol/L的EDTA作为丝氨酸蛋白酶(SP)粗酶液;在酶中加入终浓度为5 mmol/L benzamidine和1 mmol/L Leupeptin 作为金属蛋白酶(MP)粗酶液.分别将50 μL SP和MP加入到100 μL肌原纤维蛋白中,在30、40、50、55、60、70 ℃恒温水浴下加热2 h.样品经SDS化后上样于质量分数8%~20%梯度的SDS-PAGE,电泳结束后,将胶以考马斯亮蓝染色,分析两种酶对肌原纤维蛋白降解的最适温度以及降解强度.
1.2.8SP底物特异性分析
以不同类型的荧光底物为目标分解物,不改变酶活力测定的其他条件,测定相应的酶活力.将底物 Boc-Phe-Ser-Arg-MCA 活性作为100%,其他底物活性换算成相应的百分数.
2结果与讨论
2.1 肌原纤维蛋白降解的最适温度
鲍鱼肌肉在反复清洗去除可溶性蛋白质中所含的水溶性蛋白酶之后,仍然存在肌球蛋白重链(MHC)和副肌球蛋白(PM)降解的现象,结果见图1.表明在鲍鱼肌原纤维蛋白中存在与肌原纤维蛋白结合的酶类,该酶能够对肌原纤维蛋白产生明显的降解.在较低温度(30 ℃)和较高温度(70 ℃)条件下,肌原纤维蛋白降解不明显,而在55~60 ℃条件下降解最为显著,表明该酶最适温度为55~60 ℃.当在55 ℃下反应2 h后,MHC 几乎完全降解,PM大部分被降解,而肌动蛋白(Actin)没有明显的变化.有研究表明,在加热过程中鲍鱼肌原纤维蛋白的提取率会降低[5],主要是由于软体动物特有的副肌球蛋白(PM)会发生热聚集,肌肉硬度、弹性等质构指标均发生不利于产品质量的变化[6].日本学者发现软体动物鱿鱼在热加工过程中,类胰蛋白酶的丝氨酸蛋白酶对肌原纤蛋白降解是导致鱿鱼品质下降的主要原因[3].西班牙学者的研究发现,丝氨酸蛋白酶抑制剂(PMSF)能够有效抑制鱿鱼热加工过程中粘性和弹性等质量指标下降[11].这些结果提示,软体动物中存在与肌原纤维蛋白降解密切相关的丝氨酸蛋白酶.

2.2 不同抑制剂对肌原纤维蛋白降解的影响
为了进一步明确引起肌原纤维蛋白降解的酶的种类,在肌原纤维蛋白中加入了不同酶类的抑制剂,考察它们对肌原纤维蛋白降解的抑制效果,结果如图2a所示.由图2a可见,金属蛋白酶抑制剂(EDTA、1,10-phenathroline)对肌原纤维蛋白自身降解抑制效果较为明显,丝氨酸蛋白酶抑制剂(benzamidine、Aprotinin)对MHC的降解有一定的抑制效果,但Pefabloc SC的抑制效果不明显,半胱氨酸蛋白酶抑制剂(E64,Leupeptin)则没有抑制效果.同时添加金属蛋白酶抑制剂EDTA和丝氨酸蛋白酶抑制剂benzamidine,能够完全抑制肌原纤维蛋白的降解(见图2b).以上结果表明,在鲍鱼肌原纤维蛋白中同时存在能够降解肌原纤维蛋白的金属蛋白酶(MP)和丝氨酸蛋白酶(SP).

2.3 结合型蛋白酶的解离
以Boc-Phe-Ser-Arg-MCA为底物,测定解离得到的丝氨酸蛋白酶活力为指标,判断解离效果,结果如图3所示,可见,在60 ℃加热5 min,解离效果最好.然而,在45~55 ℃条件下,加热不同时间,都不能很好地将丝氨酸蛋白酶从肌原纤维蛋白中解离出来.原因可能是温度低时,肌原纤维蛋白的变性程度较低,使得肌原纤维结合型蛋白酶不能从肌原纤维中解离出来.当温度达到60 ℃时,肌原纤维蛋白的变性程度提高,同时,蛋白酶在该温度下对肌原纤维蛋白产生强烈降解,使酶从肌原纤维蛋白中解离出来.但在60 ℃下,解离时间超过5 min后,丝氨酸蛋白酶活力会降低,可能是由于加热时间过长,蛋白质变性导致酶液失活.研究报道,淡水鱼和小鼠肌原纤维结合型丝氨酸蛋白酶(MBSP)主要通过离子键和肌原纤维蛋白结合,可以通过增加离子强度将MBSP从肌原纤维蛋白中抽提出来[7,12].然而,对海水鱼如狗母鱼(Saurida wanieso)和白姑鱼(Pennahia argentata)的MBSP,利用类似的方法则不能将它们解离出来.通过对肌原纤维蛋白进行短暂的加热处理,成功从狗母鱼肌原纤维中抽提出MBSP[9].因此,推测海水鱼MBSP 和肌原纤维蛋白以其他的作用力方式结合在一起.本研究中,单独采用加热抽提或强离子浓度缓冲液抽提均未成功提取MBSP(结果未给出),而将两种方法结合则获得成功.因此,推测在鲍鱼肌肉中,SP和肌原纤维蛋白的结合除离子键外还存在其他的作用力.
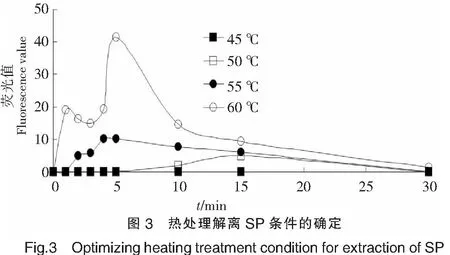
2.4 MP和 SP 对肌原纤维蛋白降解效果的比较
利用制备的MP和SP粗酶对鲍鱼肌原纤维蛋白的分解作用进行研究,结果见图4.从图4可以看出,MP和SP均在40 ℃开始降解肌原纤维蛋白,它们的最适温度都在60 ℃左右.在60 ℃反应2 h后,MP能够完全降解MHC,PM也大量被降解(图4a).添加SP组,MHC有部分降解,PM降解则很微弱,但在60 ℃和70 ℃下可发现有分子质量为60 ku左右的分解产物,但不确定是否来源于MHC或PM(图4b).表明在肌原纤维蛋白降解过程中,MP发挥的作用比SP要显著.

对鱼类肌原纤维蛋白自身降解酶类的研究,主要集中在MBSP[9,13].金属蛋白酶是一类金属离子依赖型的内肽酶,能够降解细胞外基质的胶原蛋白和非胶原蛋白成分[14].对海水鲷鱼(Pagrus major)、淡水鲤鱼(Cyprinus carpio)、草鱼(Ctenopharyngodon idellus)等的研究报道证实,金属蛋白酶通过降解胶原蛋白导致鱼肉软化[15-17].然而,关于水产动物金属蛋白酶对肌原纤维蛋白降解的研究甚少.日本学者从鱿鱼肌肉中纯化出两种能够降解MHC的金属蛋白酶,并通过N-端测序的方法研究了这两种酶对MHC的特异性酶切位点[4].结果表明,降解MHC的两种金属蛋白酶酶切位点存在差异,Myosinase I酶切位点主要在Ala-1161和Thr-1162,而Myosinase II酶切位点主要在Glu-1381和Thr-1382之间.因此推测,两种金属蛋白酶在对肌原纤维蛋白的降解过程中,先后发挥着不同的作用,共同对其进行分解.
2.5 SP的底物特异性
对解离后制备的丝氨酸蛋白酶的底物特异性研究表明,SP对P1位为Arg的底物有较高的分解作用,对P1和P2位含有两个Arg的荧光底物酶切活性更高,而对P1位为Lys的底物活性较低.对半胱氨酸蛋白酶底物Z-Phe-Arg-MCA、Z-Arg-Arg-MCA则没有分解(见表1).这与从狗母鱼中纯化的MBSP类似[9],表明制备的酶为一种肌原纤维结合型丝氨酸蛋白酶.
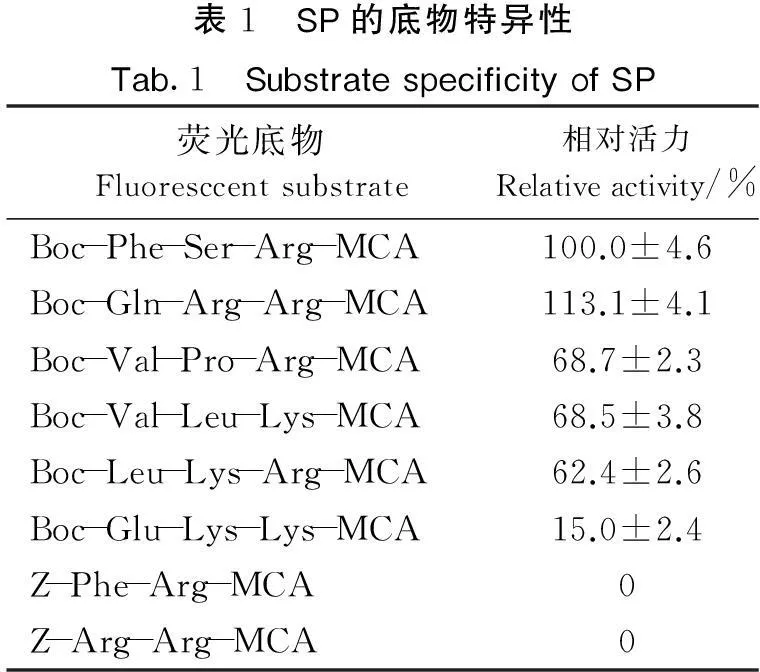
表1 SP的底物特异性Tab.1 SubstratespecificityofSP荧光底物Fluoresccentsubstrate相对活力Relativeactivity/%Boc-Phe-Ser-Arg-MCA100.0±4.6Boc-Gln-Arg-Arg-MCA113.1±4.1Boc-Val-Pro-Arg-MCA68.7±2.3Boc-Val-Leu-Lys-MCA68.5±3.8Boc-Leu-Lys-Arg-MCA62.4±2.6Boc-Glu-Lys-Lys-MCA15.0±2.4Z-Phe-Arg-MCA0Z-Arg-Arg-MCA0
3结论
鲍鱼肌原纤维蛋白在60 ℃能够发生明显的降解,蛋白酶抑制剂对降解的抑制效果证明,引起肌原纤维蛋白降解的酶类主要是金属蛋白酶和丝氨酸蛋白酶.通过加热、强离子溶液抽提相结合的方式,从鲍鱼肌原纤维中初步分离了金属蛋白酶和丝氨酸蛋白酶.这两种酶对肌原纤维蛋白的最适降解温度均在60 ℃左右.SDS-PAGE结果显示,在降解肌原纤维蛋白过程中,金属蛋白酶的活力高于丝氨酸蛋白酶.丝氨酸蛋白酶的底物特异性表明,该酶类似于海水鱼MBSP.
[参考文献]
[1]朱蓓薇.海珍品加工理论与技术的研究[M].北京:科学出版社,2010:149.
[2]农业部渔业局.中国渔业年鉴[M].北京:中国农业出版社,2013:29.
[3]EBINA H,NAGASHIMA Y,ISHIZAKI S,et al.Myosin heavy chain-degrading proteinase from spear squid muscle[J].Food Research International,1995,28(1):31-36.
[4]OKAMATO Y,OTSUKA-FUCHINO H,HORIUCHI S,et al.Purification and characterization of two metalloproteinases from squid mantle muscle,myosinase I and myosinase II[J].Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology,1993,1161(1):97-104.
[5]肖桂华,朱蓓薇,董秀萍,等.热加工条件对鲍鱼腹足部分加工特性的影响[J].大连工业大学学报,2012,31(1):1-7.
[6]ZHU B,DONG X,SUN L,et al.Effect of thermal treatment on the texture and microstructure of abalone muscle(Haliotis discus)[J].Food Science and Biotechnology,2011,20(6):1467-1473.
[7]CAO M J,WU L L,HARA K,et al.Purification and characterization of a myofibril-bound serine proteinase from the skeletal muscle of silver carp[J].Journal of Food Biochemistry,2005,29(5):533-546.
[8]GUO C,CAO M J,LIU G M,et al.Purification,characterization,and cDNA cloning of a myofibril-bound serine proteinase from the skeletal muscle of crucian carp(Carassius auratus)[J].Journal of Agricultural and Food Chemistry,2005,55(4):1510-1516.
[9]CAO M J,OSATOMI K,HARA K,et al.Identification of a myofibril-bound serine proteinase (MBSP) in the skeletal muscle of lizard fish Saurida wanieso which specifically cleaves the arginine site[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2000,125(2):255-264.
[10]SUN L C,ZHOU L G,DU C H,et al.Glucose-6-phosphate isomerase is an endogenous inhibitor to myofibril-bound serine proteinase of crucian carp(Carassius auratus)[J].Journal of Agricultural and Food Chemistry,2009,57(12):5549-5555.
[11]GOMEZ G M,HURTADO J,MONTERO P.Autolysis and protease inhibition effects on dynamic viscoelastic properties during thermal gelation of squid muscle[J].Journal of Food Science,2002,67(7):2491-2496.
[12]SANGORRIN M P,MARTONE C B,SANCHEZ J J.Myofibril-bound serine protease and its endogenous inhibitor in mouse:extraction,partial characterization and effect on myofibrils[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2002,131(4):713-723.
[13]吴海龙,陈雪芳,王诚,等.章鱼内脏胰蛋白酶抑制剂的分离纯化与性质分析[J].集美大学学报:自然科学版,2013,18(4):246-252.
[14]MANDAL M,MANDAL A,DAS S,et al.Identification,purification and partial characterization of tissue inhibitor of matrix metalloproteinase-2 in bovine pulmonary artery smooth muscle[J].Molecular and Cellular Biochemistry,2003,254(1/2):275-287.
[15]WU G P,CHEN S H,LIU G M,et al.Purification and characterization of a collagenolytic serine proteinase from the skeletal muscle of red sea bream(Pagrus major)[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2010,155(3):281-287.
[16]WU J L,LU B J,DU M H,et al.Purification and characterization of gelatinase-like proteinases from the dark muscle of common carp(Cyprinus carpio)[J].Journal of Agricultural and Food Chemistry,2008,56(6):2216-2222.
[17] WU J L,GE S Y,CAI Z X,et al.Purification and characterization of a gelatinolytic matrix metalloproteinase from the skeletal muscle of grass carp(Ctenopharyngodon idellus)[J].Food Chemistry,2014,145:632-638.
[18]LIANG X,YOSHIDA A,OSATOMI K,et al.Degradation of myofibrils in cultured yellowtail Seriola quinqueradiata burnt meat:effects of a myofibril-bound EDTA-sensitive protease[J].Fisheries Science,2012,78(1):147-153.
(责任编辑马建华英文审校曹敏杰)
Characterization of Myofibril-bound Proteinasesfrom the Muscle of AbaloneTAO Zhi-peng1,2,ZHANG Ling-jing1,2,WENG Ling1,2,LIU Guang-ming1,2,CAO Min-jie1,2
(1.College of Food and Biological Engineering,Jimei University,Xiamen 361021,China;
2.Engineering Research Center for High Utilization of Aquatic Products,Xiamen 361021,China)
Abstract:The effect of myofibril-bound proteinases on the degradation of myofibrillar proteins of abalone(Haliotis discus hannai) was studied.Myosin heavy chain (MHC) and paramyosin (PM) degraded obviously at 55~60 ℃ as indicated on SDS-PAGE,suggesting the existence of myofibril-bound proteinases in abalone muscle.Metalloproteinase inhibitors (EDTA,1,10-phenathroline)effectively inhibited the degradation of MHC and PM.EDTA together with serine proteinase inhibitor benzamidine could completely suppress the degradation of MHC and PM,indicating the existence of metalloproteinase (MP) and serine proteinase (SP) in myofibrillar proteins.By heating treatment together with high ion concentration buffer treatment,MP and SP were extracted from myofibrillar proteins and both effectively degraded MHC and PM at optimal temperature of 60 ℃.Substrate specificity analysis of SP indicated that it hydrolyzed substrates containing arginine residue at P1 while those with lysine residue at P1 were slightly hydrolyzed.
Key words:abalone;myofibrillar proteins;degradation;metalloproteinase;serine proteinase
[文献标志码]A
[中图分类号]TS 254.1
[文章编号]1007-7405(2015)02-0098-07
[作者简介]陶志鹏(1989—),男,硕士生,从事食品生物化学研究.通讯作者:曹敏杰(1964—),男,教授,博士,主要从事蛋白质化学及生物技术研究,E-mail:mjcao@jmu.edu.cn.
[基金项目]十二五国家科技支撑计划项目(2012BAD38B09);国家自然科学基金资助项目(31271838)
[收稿日期]2014-03-21[修回日期]2014-04-14

