姜黄素对Aβ诱导的AD大鼠β—APP和BACE1基因表达的影响
韩玉生等

摘要:目的 探讨姜黄素(curcumin)对老年性痴呆(Alzhelmer'sdisease,AD)大鼠海马区β-淀粉样前体蛋白(amyloid protein precursor,APP)和β-分泌酶(amyloidβsecretase1,BACE1)基因表达的影响。方法 采用Aβ1-40右侧海马区注射,制备AD大鼠模型,腹腔注射姜黄素给予治疗,采用RT-PCR法检测海马组织中β-APP和BACE1mRNA表达。结果 与正常组相比,模型组大鼠海马区神经元中β-APPmRNA和BACE1mRNA表达明显升高;与模型组相比较,姜黄素各剂量组β-APPmRNA和BACE1mRNA表达有不同程度降低,差异均有显著性。结论 姜黄素可通过对BACE1mRNA调控作用,阻断β-APP裂解进程,抑制Aβ在脑内生成与沉积,从而减少Aβ对神经元毒性作用。
关键词:姜黄素;老年性痴呆;β-APPmRNA;BACE1mRNA
研究表明,Aβ沉积是AD病理机制的中心环节和治疗靶点, AD治疗的关键在于如何抑制Aβ的生成和代谢。姜黄素能够有效地抑制Aβ的生成和聚集,从而改善AD学习记忆能力A减退和认知功能障碍 [1-2] ,但其具体机制仍然不明确,因此我们进行如下研究。
1 资料与方法
1.1 实验动物与分组 雄性SD大鼠,体重(250±20)g,清洁级,由黑龙江中医药大学实验动物中心提供,实验动物许可证号:SCXK黑2008004。给予充足水和食物常规饲养1w后进行实验。实验前经Morris水迷宫筛选,将大鼠随机分成正常组、假手术组、模型组、姜黄素组低剂量组和姜黄素高剂量组,每组10只。
1.2 主要试剂与仪器 纯度99%的姜黄素和Aβ1-40由Sigma公司生产;RT-PCR引物、Trizol RNA抽提试剂盒(Invitrogen);逆转录试剂盒及PCR试剂和DNA marker(AKARA公司);琼脂糖和溴化乙啶(美国Amresco公司)。
淮北正华生产的大鼠脑立体定位仪和Morris水迷宫;上海安亭TGL-16G台式离心机;德国Eppendorf公司5331型PCR扩增仪;美国UVP公司GDS-8000型凝胶成像分析系统;日本岛津紫外分光光度计。
1.3 模型制备 Aβ1-40用无菌生理盐水稀释后在37℃恒温箱中孵育7d,置于-20℃冰箱中保存备用。大鼠经10%的水合氯醛麻醉,固定在大鼠脑立体定位仪上,剪去头部毛发,常规消毒。参考《大鼠脑立体定位图谱》[3]沿大脑矢状线切开皮肤暴露出颅骨,注射点选择:前囟后3mm,中线向右旁开2mm,垂直进针3.5mm,缓慢注射Aβ1-40溶液2ul(10ug),5min内注射完,留针5min。颅骨孔用牙科泥封堵后,常规缝合头部的皮肤和局部消毒。假手术组除注入等量无菌双蒸水外其余处置同模型组。术后大鼠分别单笼饲养直至完全清醒。
1.4给药方法 在术后24h动物清醒后开始给药。姜黄素用二甲基亚砜(DMSO)溶解,低剂量组和高剂量组分别按150 mg/kg 、300 mg/kg浓度腹腔注射,正常组、假手术组、模型组大鼠分别腹腔注射等体积的二甲基亚砜,连续给药14d 。
1.5指标检测 各组大鼠在给药14d后麻醉,心脏灌注生理盐水后取出大脑,在冰上分离海马组织用于RT-PCR法检测大鼠海马区脑组织β-APPmRNA和BACE1mRNA表达。具体操作用严格按试剂盒说明书进行。
1.6 RT-PCR引物设计 β-APPmRNA引物序列:上游5-CCCATCAGGGACCAAAACC3',下游5'GAAGGGCATCGCTTACAAACT3',长度218bp;BACE1mRNA引物序列:上游5'TTCGTTTGCCCAAGAAA GTAT3',下游5'GTAGGTATTGCTGAGGAAGGA3',长度219 bp;β-actin引物序列:上游5-CTCGCTGTCCACCTTCCA-3下游5'GCTGTCACCTTCACCGTTC 3',长度256 bp。由大连宝生物设计合成。
1.8 数据统计 实验数据以均数±标准差(x±s)来表示,用SPSS18.0进行统计,采用单因素方差分析,各组间比较t检验,以P<0.05为有统计学意义。
2 结果
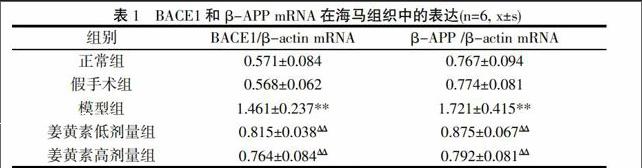
2.1 BACE1mRN和β-APP mRNA在各组大鼠海马组织中表达 正常组和假手术组BACE1和β-APP mRNA表达呈现出较暗的条带,模型组大鼠海马区BACE1和β-APP mRNA表达明显增强,表现为高亮强度的条带。姜黄素低、高剂量组在不同程度上降低BACE1和β-APP mRNA的表达。结果见表1与图。
图1
3 讨论
AD最基本的病理改变是老年斑(senile plaque,SP),"β淀粉样蛋白级联假说"认为,由β-APP经BACE1等裂解产生的Aβ异常增加是形成SP的主要原因[4]。动物研究表明:敲除BACE1基因后,Aβ产生显著减少,在抑制BACE1的表达时,AD模型动物的认知功能障碍明显得到改善[5-6]。
正常情况下,大量APP代谢主要通过α途径,不产生Aβ;少量APP经β途径,由β-分泌酶(BACE1)裂解APP,生成可溶性片段sAPPβ和含膜成分的C99,再经γ-分泌酶裂解C99产生Aβ[7-8]。在病理状态下,APP代谢主要经过β途径,产生大量的Aβ,导致AD发生。因此,BACE1是Aβ的生成是限速酶,在AD发病机制中处于核心地位,通过抑制BACE1的表达来调节Aβ的代谢,是治疗AD的一种有效策略[9]。
在本实验中,我们发现姜黄素能降低AD大鼠血清及海马组织中Aβ水平,在抑制海马中β-APP蛋白和基因表达同时,也使BACE1mRNA水平明显降低。因此我们推测:姜黄素可通过对BACE1mRNA调控作用,阻断β-APP裂解进程,抑制Aβ在脑内生成与沉积,从而减少Aβ对神经元毒性作用。
参考文献:
[1]Ono K,Naiki H,YamadaM,et al.The devolepment of preventives and therapeutics for Alzheimer′s disease that inhibite the for mation of beta-amyloid fibrils(fAbeta),as well as destabize preformed fAbta[J].Curr Pham Des,2006,12(33):4357-4375.
[2]尹红蕾,秦新月,王运良,等.姜黄素对海马内注射Aβ1-40后大鼠认知功能障碍的影响[J].中国实用神经疾病杂志,2009,12(9):6-8.
[3]诸葛启钏,大鼠脑立体定位图谱[M].版.北京:人民卫生出版社,2005.
[4]Blennow K,de Leon MJ,Zetterberg H.Alzheimer's disease[J].Lancet,2006,368:387-403.
[5]Ohno M,Sametsky EA,Younkin LH et al.BACE1 deficiency rescues memorydeficits and cholinergic dysfunction in a mouse model of Alzheimer's disease[J].Neuron,2004,41:27-33.
[6]Chiocco MJ,Lamb BT.Spatial and temporal control of age-related APP processingin genomic-based beta-secretase transgenic mice[J].Neurobiol Aging,2007,28:75-84.
[7]Müller T,Meyer H E,Egensperger R,et al.The amyloid precursor proteinintracellular domain(AICD)as modulator of gene expression,apoptosis,andcytoskeletaldynamics-Relevance for Alzheimer's disease[J].Prog Neurobiol,2008,85:393-406.
[8]Volbracht C,Penzkofer S,Mansson D,et al.Measurement of cellular b-site of APPcleaving enzyme 1 activity and its modulation in neuronal assay systems[J].AnalBiochem,2009,387:208-220.
[9]Hardy J,Selkoe DJ.The amyloid hypothesis of Alzheimer's disease:progress andproblems on the road to therapeutics[J].Science,2002,297:353-356.编辑/王敏

