β-Conglycinin酶解肽对仔猪空肠上皮细胞通透性及紧密连接蛋白表达的影响
刘丹丹,赵 元,韩 蕊,张诗尧
(吉林农业大学动物科技学院,动物生产及产品质量安全教育部重点实验室,吉林省动物营养与饲料科学重点实验室,长春130118)
β-Conglycinin酶解肽对仔猪空肠上皮细胞通透性及紧密连接蛋白表达的影响
刘丹丹,赵 元*,韩 蕊,张诗尧
(吉林农业大学动物科技学院,动物生产及产品质量安全教育部重点实验室,吉林省动物营养与饲料科学重点实验室,长春130118)
本研究通过测定大豆抗原β-Conglycinin酶解肽(52 ku)对仔猪空肠上皮细胞(IPEC)通透性及紧密连接蛋白Occludin与ZO-1 基因mRNA表达的影响,为探索其对肠道损伤的相关机制提供依据。本试验分别采用不同浓度(0、0.125、0.25、0.5、1、2 mg·mL-1)52 ku酶解肽处理IPEC 2、4、6、8、12、24 h后,通过测定细胞存活力(MTT值)、跨上皮细胞电阻值(TEER)以及细胞培养液中碱性磷酸酶(AP)的活性,检测52 ku酶解肽对细胞膜通透性的影响。并选取0.5 mg·mL-152 ku酶解肽处理IPEC 24 h后,用实时荧光定量PCR方法检测Occludin与ZO-1基因 mRNA表达量的变化情况。结果表明,52 ku酶解肽处理仔猪空肠上皮细胞后,MTT值和TEER呈时间-剂量依赖性降低(P<0.05)。24 h处理后,AP活性呈显著升高趋势(P<0.05)。与对照组相比,52 ku酶解肽可使Occludin和ZO-1 基因mRNA相对表达量均呈显著下降趋势(P<0.05)。总之,52 ku酶解肽使仔猪空肠上皮细胞通透性增加,并降低Occludin或ZO-1的 mRNA表达。
大豆抗原β-Conglycinin;52 ku酶解肽;仔猪;IPEC;紧密连接
大豆因其蛋白质含量丰富而成为机体主要的蛋白质来源之一,但与此同时也是人和动物的重要过敏原之一,使得大豆的食用和饲用价值受到了极大的影响[1]。其中β-伴大豆球蛋白(β-Conglycinin)是主要致敏原之一。近些年研究发现,β-Conglycinin进入机体消化道后,即使经过消化酶降解后仍存在抗酶解的肽段。其中52 ku酶解肽是经胃蛋白酶酶解后仍含量较多的酶解肽段,其上存有胃蛋白酶和胰蛋白酶酶切位点[2-3],有完整的IgG和IgE抗体结合表位,并具有免疫活性,对仔猪过敏起着重要作用。
肠上皮细胞之间主要通过紧密连接进行连接的,紧密连接对维持和调节肠道机械屏障的通透性起重要作用。紧密连接蛋白主要包括跨膜蛋白(如:Occludin蛋白)和胞质蛋白(如:ZO-1蛋白)。Occludin蛋白对肠道屏障功能起到维持和调节作用。ZO-1蛋白不仅与肠道屏障功能和通透性功能的变化情况有关,还在细胞物质转运和细胞增殖分化过程中起着重要作用。研究表明,胆汁的淤积会导致肠上皮细胞间的紧密连接蛋白ZO-1和Occludin减少,从而使肠上皮细胞间紧密连接的完整性受到破坏,上皮屏障及其防护功能受到了损伤[4]。
因此,本试验研究了52 ku酶解肽对仔猪空肠上皮细胞活性和细胞屏障通透性的影响,同时通过对Occludin和ZO-1基因mRNA表达量的影响来探讨52 ku酶解肽对肠黏膜机械屏障损伤的机制。
1 材料与方法
1.1 主要试验材料
DMEM/F12培养基、胎牛血清和胰蛋白酶(Gibco,美国),青霉素和链霉素(Sigma,美国),0.4 μm Millicell插入式培养皿(Millipore,美国),AP试剂盒(南京建成生物制品有限公司,中国),总RNA提取试剂盒(OMEGA,美国),逆转录试剂盒、实时荧光定量试剂盒(Applied Biosystems,美国),荧光探针:ZO-1 Assay ID:Ss 03373514;Occludin Assay ID:Ss03377507;β-actin Assay ID:Ss03376081(由美国Applied Biosystems公司设计合成)。
1.2 仔猪空肠上皮细胞培养
仔猪空肠上皮细胞(美国德州农工大学)由中国农业大学提供,DMEM/F12高糖培养基中添加7%胎牛血清,1%双抗。在5% CO2饱和湿度,37 ℃条件下培养,待同代细胞生长良好至单层后进行试验。
1.3 52 ku酶解肽提纯方法
β-Conglycinin由本实验室参照I.Setsuko等[5]的免疫法从大豆中分离提纯,经SDS-PAGE鉴定纯度达95%以上,并从纯化的β-Conglycinin中分离提纯得到52 ku酶解肽,经SDS-PAGE鉴定纯度达90.03%以上,且具有免疫活性[6],可用做本试验刺激物。
1.4 52 ku酶解肽对仔猪空肠上皮细胞活性的影响
仔猪空肠上皮细胞的活性利用MTT比色法检测。将细胞接种于96孔细胞培养板上,待细胞融合达95%以上时,分别用不同浓度(0、0.125、0.25、0.5、1、2 mg·mL-1)的52 ku酶解肽刺激仔猪空肠上皮细胞,经不同时间(2、4、6、8、12、24 h)处理后,加入20 μL MTT溶液,37 ℃继续培养4 h。最后每孔加入150 μL DMSO,并置摇床上低速振荡10 min以致结晶物质充分溶解。采用酶联免疫检测仪在570 nm处测定各孔的吸光值。每个处理6个重复。
1.5 TEER值的测定
将同代生长良好的仔猪空肠上皮细胞接种于插入式培养皿中,上层分别加入400 μL不同设定浓度(0、0.125、0.25、0.5、1、2 mg·mL-1)的52 ku酶解肽的完全DMEM/F12培养液,下层均加入800 μL新鲜无52 ku酶解肽添加的完全培养液。用跨上皮电阻仪测定培养2、4、6、8、12、24 h的TEER值,每个测定孔均取不同方向的3个点,并取其均值乘以插入式培养皿的膜面积(0.6 cm2),为待测样品的TEER值,以Ω×cm2表示。每个处理4个重复。
1.6 AP活性的测定
将生长状态良好的仔猪空肠上皮细胞接种于96孔细胞培养板中,同上分别加入不同浓度(0、0.125、0.25、0.5、1、2 mg·mL-1)的52 ku酶解肽培养液,培养24 h后,分别收集每孔中的培养上清液,并对细胞培养液中AP活性进行测定。细胞AP活性的测定步骤参照试剂盒说明书进行。每个处理4个重复。
1.7 荧光定量PCR
1.7.1 RNA的提取 在仔猪空肠上皮细胞中加入不同浓度52 ku酶解肽处理24 h后,进行总RNA提取,每个处理设3个重复。小肠上皮细胞总RNA的提取按照OMEGA总RNA提取试剂盒说明书进行,提取后经检测RNA的完整性良好,可进行下步试验。
1.7.2 目的基因cDNA的合成和实时荧光定量PCR cDNA合成采用逆转录试剂盒,反应体系为20 μL:2 μL 10×RT Buffer,0.8 μL 25×dNTP Mix,2 μL 10×RT Random Primers,1 μL MultiScribeTM Reverse Transcriptase,2 μg Total RNA,Nuclease-free H2O补至20 μL。反转录反应条件:25 ℃ 10 min;37 ℃ 120 min;85 ℃ 5 min。反应所得到的cDNA于-80 ℃保存备用。
实时荧光定量PCR法分别测定紧密连接蛋白Occludin与ZO-1基因 mRNA相对表达量。参照实时荧光定量试剂盒,反应体系为20 μL:10 μL TaqMan Gene Expression Master Mix(2×),1 μL TaqMan Gene Expression Assay(20×),7 μL Nuclease-free H2O,2 μL cDNA模板。反应程序:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,共40个循环。
1.8 数据统计分析
采用SPSS17.0分析软件对数据进行分析,所有数据以“mean±SD”表示,以P<0.05为有统计学差异。
2 结 果
2.1 52 ku酶解肽对IPEC活性的影响
相同培养时间,随着52 ku酶解肽浓度的增加,MTT值呈现下降趋势。0.25 mg·mL-152 ku酶解肽浓度处理仔猪空肠上皮细胞8 h后,MTT值显著降低(P<0.05)。相同浓度52 ku酶解肽处理仔猪空肠上皮细胞,随着培养时间的延长,MTT值呈现下降趋势。0.50 mg·mL-152 ku处理仔猪空肠上皮细胞 6 h 后,MTT值显著降低(P<0.05)(图1)。
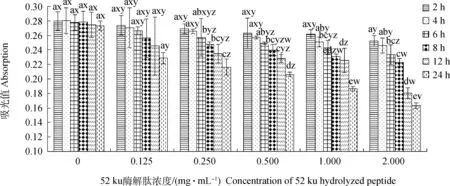
每个处理各个时间测定的样本数为6 (n=6)。a、b、c、d、e表示处理相同浓度,不同时间下52 ku酶解肽对IPEC MTT值的变化,相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05);v、w、x、y、z表示处理相同时间,不同浓度下52 ku酶解肽对IPEC MTT值的变化,相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)Number of samples treated by different concentrations and different times is 6 (n=6). a, b, c, d, e. P<0.05 under the same concentration and different times; v, w, x, y, z. P<0.05 under the same time and different concentrations图1 不同浓度52 ku酶解肽处理不同时间IPEC膜MTT值的变化Fig.1 The variation of MTT in IPEC membrane treated with different concentrations of 52 ku hydrolyzed peptide for different time
2.2 52 ku酶解肽细胞TEER值的影响

每个处理各个时间测定的样本数为4(n=4)Number of samples treated by different concentrations and different times is 4(n=4)图2 不同浓度52 ku酶解肽处理不同时间IPEC膜TEER值的变化Fig.2 The variation of TEER in IPEC membrane treated with different concentrations of 52 ku hydrolyzed peptide for different times
细胞的TEER值呈剂量和时间依赖性的降低趋势,如图2所示。同一处理浓度,随着处理时间的延长,TEER值呈现降低趋势(P<0.05),浓度为0.5 mg·mL-152 ku酶解肽处理6、8、12、24 h后,细胞TEER较对照组相比分别降低了5.31%、5.94%、7.53%和10.07%(P<0.05)。相同浓度条件下,各个处理时间的TEER值较对照组均显著性降低(P<0.05)。随着浓度的增加,浓度为0.5、1、2 mg·mL-152 ku酶解肽处理6 h后,各处理组之间差异显著,且较对照组相比,TEER值分别降低了5.31%、7.52%和11.73%(P<0.05),而0、0.125与0.25 mg·mL-1处理组之间以及0.25与0.5 mg·mL-1处理组间差异不显著(P>0.05)。24 h时,0.25、0.5、1、2 mg·mL-1与对照组差异显著(P<0.05)。所以也将24 h作为检测仔猪空肠上皮细胞AP活性与紧密连接蛋白基因表达的刺激时间。2.3 52 ku酶解肽对IPEC AP分化的影响
细胞AP活性随着52 ku酶解肽浓度的增加呈现显著性增长趋势,如图3所示。随着浓度的增加,52 ku酶解肽24 h处理仔猪空肠上皮细胞培养液AP值呈现明显上升趋势(P<0.05)。用0.125、0.25 mg·mL-1的52 ku处理24 h后AP活性较对照组相比差异显著(P<0.05),但0.5、1.0 mg·mL-1处理组之间以及1.0与2 mg·mL-1处理组之间差异不显著(P>0.05)。
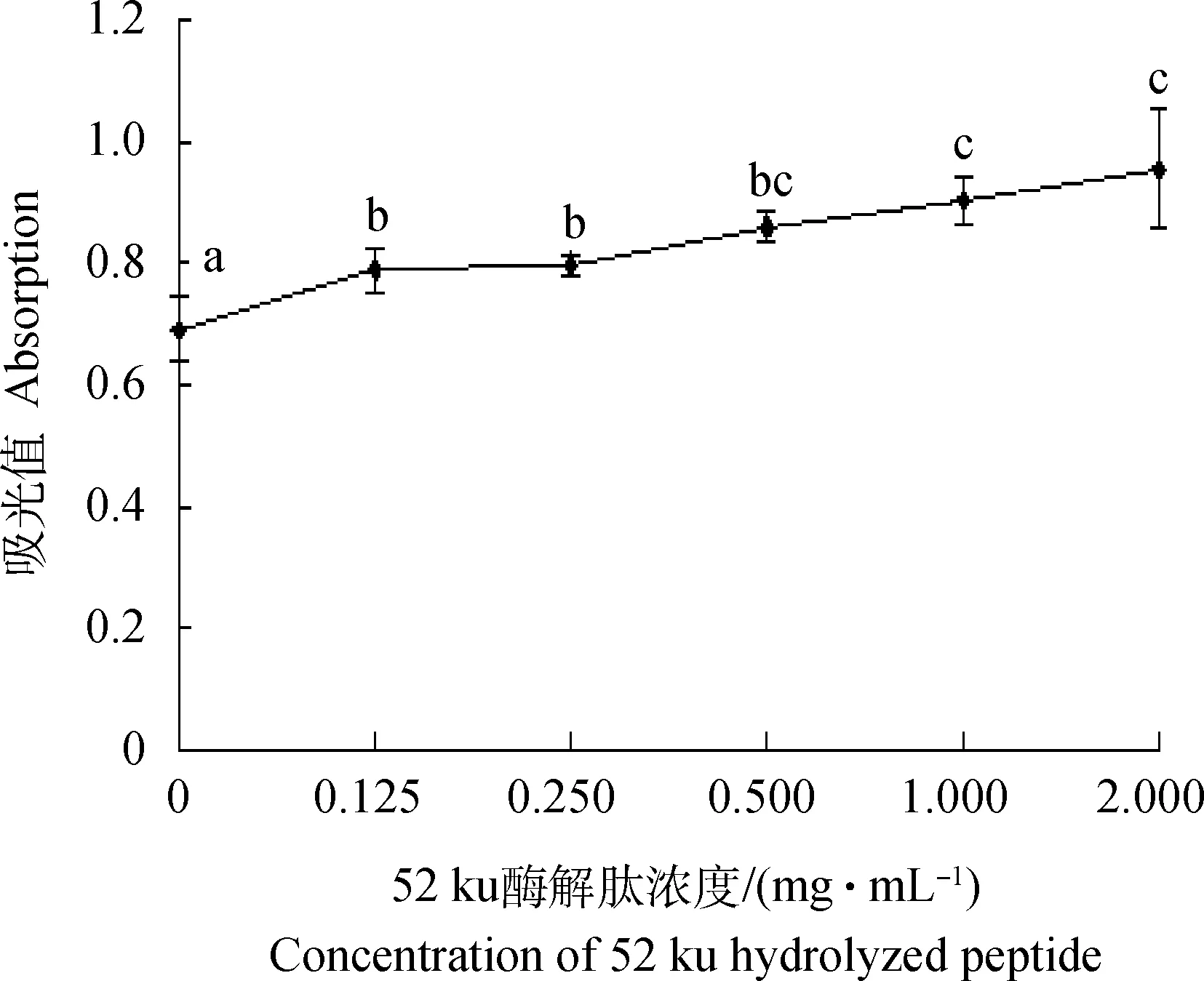
图柱上的不同小写字母表示差异显著(P<0.05),图4同The different small letters on columns indicate the significant difference(P<0.05),the same as Figure4图3 不同浓度52 ku酶解肽处理24 h IPEC培养液中AP的变化(n=4)Fig.3 The variation of AP in IPEC culture medium treated with different concentrations of 52 ku hydrolyzed peptide for 24 h(n=4)
2.4 52 ku酶解肽对仔猪空肠上皮细胞Occludin和ZO-1 mRNA相对表达量的影响
不同浓度52 ku酶解肽处理24 h后,仔猪空肠上皮细胞紧密连接蛋白Occludin和ZO-1 mRNA相对表达量结果如图4显示,随52 ku酶解肽添加浓度的增大,Occludin和ZO-1 mRNA相对表达量成下降趋势。1 mg·mL-1OccludinmRNA相对表达量与对照组差异不显著(P>0.05),其他浓度与对照组均达到极显著水平(P<0.05)。随52 ku酶解肽添加浓度的增大,ZO-1 mRNA表达量均与对照组相比,差异显著(P<0.05)。
3 讨 论
健康状态下的肠上皮细胞旁间隙是封闭的,紧密连接对相邻细胞的相互连接起着重要作用。大豆是饲粮中主要的植物蛋白源,但即使经过相应酶类的酶解,仍会有一些具有免疫活性的酶解肽段会进入肠道,影响动物对营养物质的消化与吸收。因此推测,52 ku酶解肽是通过影响紧密连接蛋白的表达,从而使紧密连接的完整性遭到破坏,进而增加了肠黏膜屏障的通透性。为了验证这一假设,本研究检测了52 ku酶解肽对仔猪空肠上皮细胞通透性和紧密连接蛋白中最重要的跨膜蛋白ZO-1和Occludin基因mRNA表达的影响。首先通过不同时间、不同浓度52 ku酶解肽刺激细胞,通过检测MTT、TEER、AP来验证其细胞膜完整性。结果表明,52 ku酶解肽对仔猪小肠上皮细胞活性有一定程度的影响,并随52 ku浓度升高细胞存活率下降。随着52 ku酶解肽浓度的提高,培养液中MTT值也逐渐降低。结果说明,52 ku酶解肽不同程度上抑制了仔猪空肠上皮细胞增殖。徐君研究报道证明,用大豆抗原蛋白提取物处理小鼠IEC,随着提取物浓度的提高,不同程度的抑制了小鼠IEC的增殖[7]。这说明一定浓度的52 ku酶解肽导致动物肠上皮细胞减少,本试验结果与其一致。本试验对刺激24 h的培养液进行AP活力测定,结果表明,随着52 ku酶解肽浓度的提高,培养液中AP值也逐渐升高。研究者也通常用AP活力来反映鼠、鲤鱼等动物的肠上皮细胞完整性[7-8],AP值随52 ku酶解肽浓度的增加也逐渐升高,其结果与本试验研究结果一致。
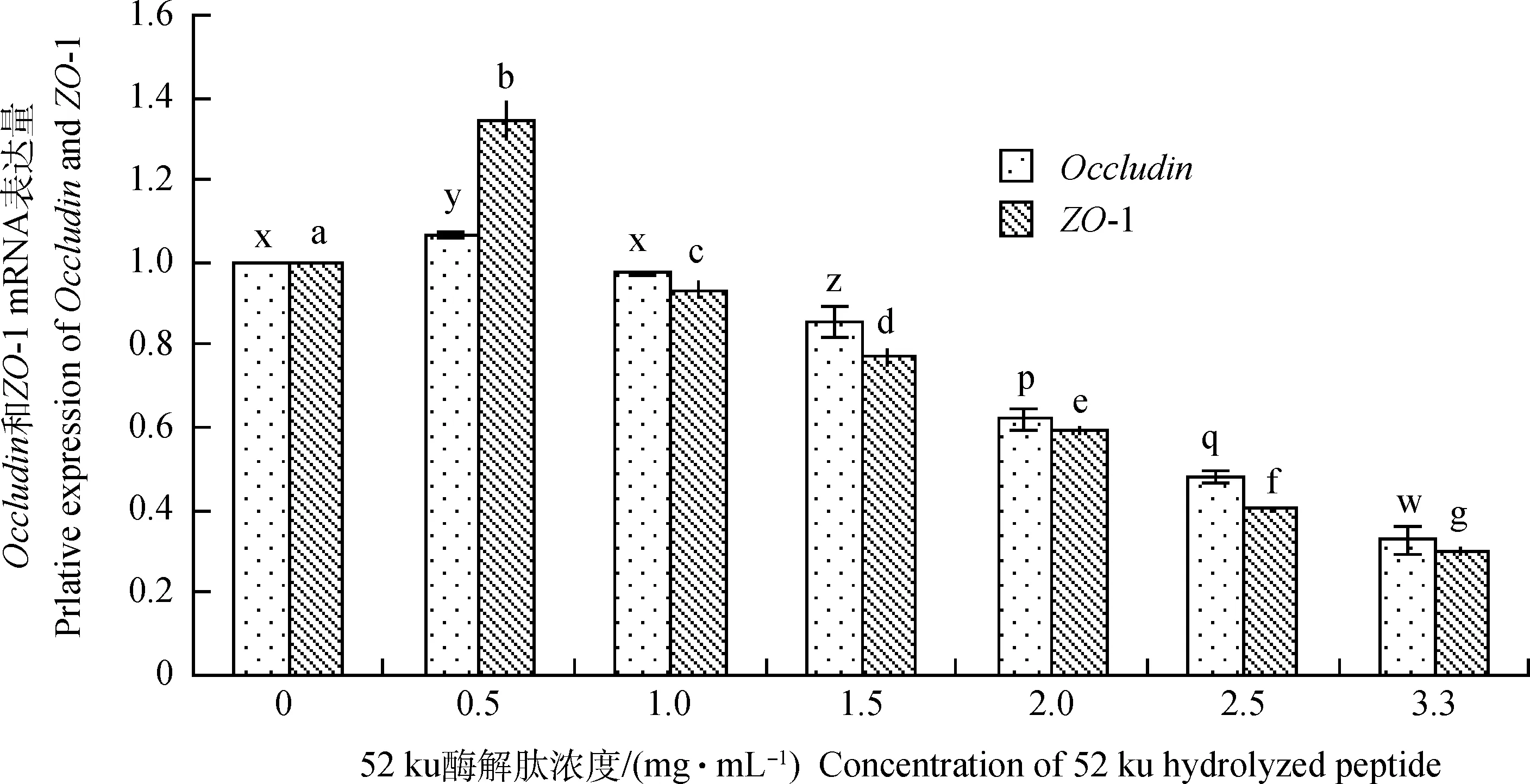
图4 不同浓度52 ku酶解肽处理24 h对IPEC Occludin和ZO-1 mRNA相对表达量的变化(n=3)Fig.4 The variation of Occludin or ZO-1 mRNA relative expression in IPEC culture medium treated with different concentrations of 52 ku hydrolyzed peptide for 24 h(n=3)
TEER能够反映细胞的完整性和通透性。本试验发现,0.50 mg·mL-152 ku酶解肽处理仔猪空肠上皮细胞培养液TEER值明显低于对照组(P<0.05)。同时,随着52 ku酶解肽浓度的提高,培养液中TEER值也逐渐降低。试验表明,52 ku酶解肽损伤了仔猪空肠上皮细胞的屏障功能,导致其通透性增加;随着培养时间的延长细胞屏障功能逐渐降低。TEER值的降低与细胞膜通透性的升高揭示紧密连接蛋白复合物的改变。有研究证明,随着大豆球蛋白浓度的增加TEER值下降,这会造成仔猪空肠上皮细胞通透性增加,使抗原更容易进入血液中导致仔猪过敏[9]。
目前有研究表明,断奶仔猪容易产生肠易激综合症,导致肠上皮紧密连接蛋白破坏及表达量降低[10],肠道通透性增强,仔猪腹泻。本试验发现,除52 ku酶解肽浓度为1 mg·mL-1时紧密连接蛋白OccludinmRNA相对表达量无明显变化,其他各浓度肠上皮细胞紧密连接蛋白Occludin或ZO-1 mRNA相对表达量也显现下降趋势,且差异显著,ZO-1或OccludinmRNA相对表达量下降引发肠黏膜屏障破坏,与R.Yang等[11]的结果一致。也有学者用β-Conglycinin刺激细胞,结果导致ZO-1和Occludin表达量下降,破坏了肠道屏障[12]。这些都证明,蛋白表达量下降反映了食物致敏原对仔猪肠道屏障造成了一定程度的损伤。
4 结 论
52 ku β-Conglycinin酶解肽能破坏仔猪空肠上皮细胞紧密连接的完整性,加大肠道通透性,破坏屏障功能,降低肠上皮紧密连接蛋白Occludin或ZO-1 基因mRNA的表达。
[1] GRANT G S,BARDOCZ D S,BROWN W B,et al.Involvement of polyamines in pancreatic growth induced by dietary soybean,lectin or trypsin inhibitors[J].BiochemSocTrans,1990,18:1009-1010.
[2] MALEKI S M,KOPPER R A,SHIN D S,et al.Structure of the major peanut allergen Ara h1 may protect IgE-binding epitopes from degradation[J].Immunol,2000,164:5844.
[3] SEN M,KOPPER R,PONS L.Effect of protein source in calf replacers on morphology and absorptive ability of the small intestine[J].DairySci,1986,69:460-464.
[4] 刘圣烜,黄志华,林 莉.急性肝内胆汁淤积大鼠小肠上皮紧密连接蛋白ZO-1和Occludin表达的变化[J].实用儿科临床杂志,2011,26(1):45-47. LIU S X,HUANG Z H,LIN L.Changes of expressions of intestinal mucosal tight junction proteins ZO-1 and occludinin rats with acute intrahepatic cholestasis[J].ChineseJournalofAppliedClinicalPediatrics,2011,26(1):45-47.(in Chinese)
[5] SETSUKO I,FUMIO Y.Determination of glycinin and β-conglycinin in soybean protein by immunological methods[J].JAgricFoodChem,1987,35:200-205.[6] 王 俊,潘 丽,赵 元,等.大豆抗原蛋白β-伴大豆球蛋白抗酶解肽的分离纯化及其免疫活性鉴定[J].中国畜牧杂志,2012,48(23):53-56. WANG J,PAN L,ZHAO Y,et al.Isolation and identification of immunoreactive activity of soybean antigen protein β-Conglycinin and its Enzymatic Peptide[J].ChineseJournalofAnimalScience,2012,48(23):53-56.(in Chinese)
[7] 徐 君.大豆球蛋白和β-伴大豆球蛋白对小鼠肠上皮细胞营养生理功能的影响与分子机理研究[D].雅安:四川农业大学,2009. XU J.The Influence of the extracted soybean glycinin and β-conglycinin on the function and molecular mechanism of mice intestinal-epithelial cells in primary cultivation[D].Ya’an:Sichuan Agricultural University,2009.(in Chinese)
[8] SEN M,KOPPER R,PONS L,et al.Protein structure plays a critical role in peanut allergen stability and may determine immunodmin at IgE binding epitopes[J].Immunol,2002,169:882-887.
[9] 韩 蕊,赵 元,潘 丽,等.大豆球蛋白对仔猪小肠上皮细胞Occludin mRNA表达的影响[J].畜牧兽医学报,2013,44(8):1258-1262. HAN R,ZHAO Y,PAN L,et al.Effects of glycinin on occludin mRNA expression in piglet intestinal epithelial cells[J].ActaVeterinariaetZootechnicaSinica,2013,44(8):1258-1262.(in Chinese)
[10] BRUEWER M,LUEGERING A,KUCHARZIK T,et al.Proinfiammatory cytokines disrupt epithelial barrier function by apoptosis-independent mechanisms[J].JImmunol,2003,171(61):64-72.
[11] YANG R,HARAD T,LI J,et al.Bile modulates intestinal epithelial barrier function via an extracellular signal related kinase 1/2 dependent mechanism[J].IntensiveCareMed,2005,31(5):709-717.
[12] ZHAO Y,QIN G X,HAN R,et al.β-Conglycinin Reduces the Tight Junction Occludin and ZO-1 Expression in IPEC-J2[J].IntJMolSci, 2014,15(2):1915-1926.
(编辑 郭云雁)
Effects of β-conglycinin Hydrolyzed Peptide on the Permeability and Expression of Tight Junction Protein in Piglet Intestinal Epithelial Cells
LIU Dan-dan,ZHAO Yuan*,HAN Rui,ZHANG Shi-yao
(KeyLaboratoryofAnimalProduction,ProductQualityandSecurityofMinistryofEducation,KeyLaboratoryofAnimalNutritionandFeedsScienceinJilinProvince,CollegeofAnimalScienceandTechnology,JilinAgriculturalUniversity,Changchun130118,China)
The objective of this study was to evaluate the effects of β-Conglycinin hydrolyzed peptide(52 ku) on the permeability and expression of tight junction proteinOccludinandZO-1 in piglet intestinal epithelial cells(IPEC),which would provide a basis for exploring the mechanisms of intestinal damage.IPEC were treated with different concentrations(0,0.125,0.25,0.5,1 and 2 mg·mL-1) hydrolyzed peptide for 2,4,6,8,12,24 h.The effects of hydrolyzed peptide(52 ku) on cell membrane permeability were determined by measuring the cell viability(MTT values),transepithelial resistance values(TEER) and alkaline phosphatase(AP) activity in cell culture medium.The mRNA expression ofOccludinandZO-1 were detected by real-time PCR after IPEC treated with 0.5 mg·mL-1hydrolyzed peptide for 24 h.The results showed that MTT and TEER of intestinal epithelial cells treated with hydrolyzed peptide(52 ku) with 0.5 mg·mL-1were decreased by a time-dose dependent manner(P<0.05).With the increase concentration of hydrolyzed peptide(52 ku),AP activity in 24 h treatment group had a significant increased trend(P<0.05) by dose dependent manner.Also,hydrolyzed peptide(52 ku) could decrease the relative expression ofOccludinandZO-1 mRNA in IPEC(P<0.05).In conclusion,hydrolyzed peptide(52 ku) destructed the permeability and reducedOccludinorZO-1 mRNA expression of tight junction protein in IPEC.
soybean allergic β-Conglycinin;52 ku hydrolyzed peptide;piglets;IPEC;tight junctions
10.11843/j.issn.0366-6964.2015.05.012
2014-07-08
国家自然科学基金青年资金项目(31101719);省科技发展计划项目青年科研基金(201201098);吉林省教育厅“十二五”科学技术研究规划项目
刘丹丹(1988-),女,吉林松原人,硕士生,主要从事饲料抗营养因子研究,E-mail:ddliu19880922@163.com
*通信作者:赵 元,博士,副教授,E-mail:zhaoyuan4CL52@126.com
S828;S815.4
A
0366-6964(2015)05-0768-06

