纳米颗粒对植物光合作用影响机制的研究
李 威, 黄 进, 李其昌, 苏宝连, 谢 浩
(1. 武汉理工大学 化学化工与生命科学学院, 武汉 430070;2. 武汉理工大学 生命复合材料实验室, 武汉430070)
纳米颗粒对植物光合作用影响机制的研究
李 威1, 2, 黄 进1, 李其昌1, 苏宝连2, 谢 浩1
(1. 武汉理工大学 化学化工与生命科学学院, 武汉 430070;2. 武汉理工大学 生命复合材料实验室, 武汉430070)
为探讨纳米颗粒对植物光合作用的影响,采取一种简单、高效的实验方法来进行研究。选取具有代表性的5种金属氧化物纳米颗粒与植物光合作用的主要场所叶绿体相互作用,测定叶绿体光合活性、荧光效应的变化,并通过扫描电镜、荧光显微镜进行观察。研究表明纳米颗粒对叶绿体光合活性的影响是通过相互接触完成的;ZnO及CdS对其活性有明显的抑制效应,并随着浓度的增加其抑制效应越显著;γ-Fe2O3纳米颗粒作为电子受体,在低浓度条件下提高其活性,但随着浓度的增加逐渐显现为抑制效应。故而推测纳米颗粒的影响机制是影响电子传递过程。这为纳米材料在植物领域,包括纳米化肥,纳米仿生,可再生性高效生化探测器的发展提供了参考,同时也为评估纳米材料对环境的潜在影响提供了理论基础。
纳米颗粒;叶绿体;光合活性;光合作用
纳米颗粒由于尺寸小(1~100 nm)和比表面积大等特点,而使其具有优异的物理化学性质,并且在生物医学、光学及电子领域[1-2]具有广泛应用潜力。
在目前,人工模拟光合作用将太阳能转化为电化学能也是一热门话题。同时,利用太阳能是化学和材料科学发展及研究人工光合系统一个巨大的挑战[3]。这同样也是纳米材料——半导体纳米晶体量子点[2,4]的主要研究领域。但目前的这些研究,如将纳米量子点与氧化还原酶相结合在可见光的照射下完成光酶转换[5];核-壳纳米颗粒量子点与生物光捕获蛋白LHCⅡ杂化提高光能利用率[6]等,都是与生物材料结合后来提高纳米材料的光电转化率。反之,纳米材料的光电转化能力能否促进生物材料,如叶绿体的光合作用效率的研究则较少。
另外,在过去的几十年里,在使用微粒控制植物病理学——纳米农药领域引起了广泛的研究兴趣。微粒系统采用纳米颗粒代替或提高一些化学合成农药的效果或直接产生生物防治的效果[7],例如纳米农药碳纳米管封装的杀虫剂[8],硫纳米颗粒作为杀真菌剂的绿色农药[9]等研究取得了一定成果。但纳米材料对植物的生理影响则很少涉及。
麻省理工学院近期研究[10]表明:植物细胞器与非生物纳米结构之间的对接能提高细胞器的光能利用率并赋予其新的功能。单壁碳纳米管(SWNTs)在离体的叶绿体内被动运输不可逆的集中在脂膜上,将光合活性提高了3倍以上,并且提高了电子传递的阈值。此外,近红外荧光监测显示,这一对接同样可以用作光化学传感器。这一发现可能发展成为一个新的领域——植物纳米仿生。植物纳米仿生工程可能会促进仿生材料在光捕获及再生性高效生化检测领域的进一步发展。
为进一步研究纳米颗粒对植物生理的影响,本文选取绿色植物光合作用的主要细胞器——叶绿体为研究对象,选定5种金属氧化物纳米颗粒与之结合,建立实验体系。然后测定纳米颗粒对其叶绿体的生理生化指标及形态影响进行分析。为植物纳米仿生工程纳米材料的选择提供一定的基础,进一步加强纳米颗粒对植物的影响的了解。
1 材料与方法
1.1 实验材料
nano-γ-Fe2O3、nano-ZnO和nano-TiO2这3种纳米颗粒对植物种子萌发及根生长的影响早有研究[11-13]。CdS、ZnO和TiO2这3种纳米颗粒是研究光催化的主要材料。LiFePO4为锂电池正极材料。这5种纳米颗粒与植物生长及光催化的研究有一定的联系。
nano-γ-Fe2O3由武汉理工大学化学化工与生命科学学院提供,其浓度为5.4 mg/mL,CdS、ZnO、LiFePO4、锐钛矿TiO2则由武汉理工大学生命复合材料国家重点实验室提供。其尺寸均保证在十几个纳米级。
1.2 实验方法
1.2.1 叶绿体悬浮液的制备
菠菜(spinach,Spinaciaoleracea)采自于市售菠菜,洗净后剪碎放入研钵,加适量预冷的提取液(山梨醇330 mmol/L、MES 50 mmol/L、EDTA 2 mmol/L、MgCl22 mmol/L、抗坏血酸2 mmol/L,pH值6.1)快速研磨,8层纱布过滤,滤液于1 000 r/min、4 ℃离心2 min,上清液2 500 r/min,4 ℃离心2 min。并用少许蒸馏水洗去表面附着的破碎叶绿体。沉淀加入缓冲溶液(0.05 mol/L Tris-HCl pH值7.4、5 mmol/L MgCl2、0.4 mol/L蔗糖),即得到叶绿体悬浮液[14]。
得到的叶绿体悬浮液分别加入γ-Fe2O3、CdS、ZnO和LiFePO4、锐钛矿TiO2纳米颗粒,各包含100 μg、200 μg和400 μg 3个浓度梯度。4℃混合过夜。
1.2.2 叶绿体光还原活性的测定
叶绿体的Hill反应可用来检测叶绿体的光合活性[15]。Hill试剂即染料2,6-二氯酚靛酚,处于氧化态时为蓝色,还原态时为无色。叶绿体悬浮液0.1 mL,缓冲液(0.05 mol/L Tris-HCl pH值7.4、5 mmol/L MgCl2、0.4 mol/L蔗糖)1.8 mL,加入0.02% DCIP 0.1 mL后立即搅拌,25℃条件下,500 W灯泡光照5 min。每隔1 min用紫外-可见分光光度计测定其在600 nm处的光吸收值。
1.2.3 叶绿体荧光光谱的测定
叶绿体中的Chla受光激发后,吸收的能量很快地以荧光和热的形式被释放。将待测溶液在荧光分光光谱仪上测定,测定温度为25 ℃,激发波长436 nm[15],发射波长范围600~800 nm。而纳米颗粒CdS、ZnO和TiO2均具有荧光效应,激发波长分别为370 nm,300 nm和274 nm[16-18]。但叶绿体的激发光能量不足以使金属纳米颗粒产生荧光效应。
1.2.4 叶绿体形貌及荧光观察
叶绿体悬浮液离心洗涤,用PBS缓冲液悬浮,用终浓度为1.5%的多聚甲醛和戊二醛在4 ℃条件下固定2 h。PBS洗涤后,用乙醇梯度脱水,乙醇浓度从30%递增至100%。将处理好的样品滴到醋酸纤维薄膜上,37 ℃烘干,喷金后用场发射扫描电子显微镜FESEM(Hitachi S4800)观察[19]。
由于叶绿素受光激发后自发荧光,可直接将叶绿体悬浮液滴到载玻片上,用荧光显微镜(Olympus IX73)观察。激发光为绿光,叶绿体自发荧光为红光。
2 结果与分析
2.1 叶绿体光合活性随时间的变化趋势
在光照条件下,叶绿体进行光合作用产生还原H+还原Hill染料,其在600 nm处的吸收值在5 min内的变化趋势见图1。
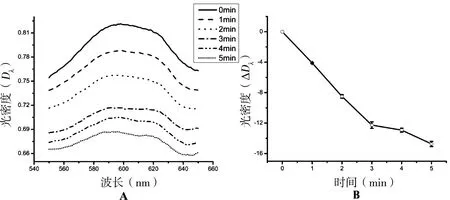
图1 叶绿体光吸收值
图1A的6条曲线从高到低依次为0~5 min的光谱曲线;图1B中反映了叶绿体的ΔD(600 nm)随时间呈线性变化的趋势。ΔD(600 nm)的大小间接反映了叶绿体光合活性的变化趋势。ΔD(600 nm)越大,光合效率越高。在此基础上,纳米颗粒与叶绿体的结合对叶绿体活性的影响同样可以通过这一方法来检测。
2.2 纳米颗粒对叶绿体光合活性的影响
表1中为这5种不同浓度的纳米颗粒在600 nm处光吸收值数据,其相对变化趋势见图2。经分析对比后发现,不同种类的纳米颗粒对叶绿体光合活性的影响程度不一样。ZnO及CdS对其有明显的抑制效应,并且随着纳米颗粒浓度的增加影响抑制效应越明显,ZnO浓度为400 μg/mL时其相对光合活性约为0.5;CdS在浓度为400 μg/mL时其相对活性降低为0.6。这说明较高浓度的ZnO和CdS对叶绿体光合效率的抑制效应较为显著。而LiFePO4、TiO2则无明显影响。但从图2中发现γ-Fe2O3的曲线是先增加再降低,故而推测,在低浓度条件下,γ-Fe2O3对叶绿体活性有一定的促进作用,但随着浓度的增加,其抑制效应逐渐显现。

表1 纳米颗粒对叶绿体光合活性的影响
2.3 叶绿体荧光参数的变化
在叶绿体中,内源性自发荧光产生于多种生物分子,其中包括叶绿素,胡萝卜素和叶黄素等。但叶绿素是叶绿体自发荧光的主要贡献者,在可见光光谱中,能被波长在420~460 nm范围内的光激发产生波长大于600 nm蓝色区域的荧光[20]。

图2 叶绿体相对光合活性变化趋势

图3 叶绿体荧光效应
图3为叶绿体与纳米颗粒混合后的荧光光谱图,从图中可以发现,纳米颗粒的存在对其荧光效应产生影响。图中直观显示ZnO、γ-Fe2O3和LiFePO4依次削弱了叶绿体的荧光效应,而TiO2和CdS则依次增强了荧光效应。深入分析了解到,CdS、ZnO及TiO2都是光催化的常见材料,在光激发下很容易发生电子跃迁产生荧光淬灭效应。其激发波长依次为370 nm、300 nm和274 nm,荧光淬灭效应逐渐减弱,但实际测得的叶绿体荧光效应并不是这一规律。同时了解到CdS和ZnO对植物有一定的毒副作用,而TiO2则没有。此外,由于Fe3+也可以作为Hill反应的电子受体[15],LiFePO4也是电子的良导体。因此可以推测,这5种金属氧化物纳米颗粒对叶绿体光合活性的效应并不是影响叶绿素分子经光照后产生电子的过程,而是影响电子传递过程,从而得出了γ-Fe2O3增强了叶绿体的光合活性这一结果。
2.4 叶绿体FESEM及荧光显微镜的观察
上述实验结果仅说明样品中存在纳米颗粒,其对叶绿体的活性的影响是由于纳米颗粒与叶绿体结合还是仅在溶液中产生影响,并不是很清楚。
叶绿体被绿光激发后,发出红光,而未被荧光标记的纳米颗粒不存在荧光效应。采用FESEM、荧光显微镜观察其结合结果见图4和图5。图4A、图5A和5A′分别为对照组,比较后发现:叶绿体FESEM图中明显有视野较亮、颗粒状的物质吸附在膜表面。每种纳米颗粒都可以观察到这种现象;同样的,叶绿体荧光显微镜图中也很明显的有吸附在叶绿体膜表面且不能发出荧光的颗粒状物质存在。这些显微镜下可见的颗粒状物质是金属氧化物纳米颗粒在叶绿体的影响下,不可逆地聚集在膜表面[13]形成的。这说明,叶绿体膜表面的确有金属纳米颗粒吸附,并可通过对照,找出对应的纳米颗粒聚集的位点。这样就可推断,纳米颗粒吸附并聚集在叶绿体表面并对叶绿体光合活性产生影响。

图4 叶绿体SEM图
A—叶绿体的扫描电镜图;B、C、D、E和F分别是叶绿体与γ-Fe2O3、CdS、ZnO、LiFePO4、TiO2纳米颗粒结合之后的扫描电镜图。图中白色箭头显示叶绿体上吸附的纳米颗粒。

图5 叶绿体荧光显微镜图
A和A′分别是叶绿体显微镜图及所对应荧光显微镜图;B、C、D、E和F分别是叶绿体与γ-Fe2O3、CdS、ZnO、LiFePO4、TiO2纳米颗粒结合之后的显微镜图,而B′、C′、D′、E′和F′则是与之相对应的荧光显微镜图。图中箭头所指的是纳米颗粒所在的位置。
3 结论与展望
近年来,随着纳米技术的发展,纳米农药、植物纳米仿生等领域是研究的热点。这也是纳米技术在植物上的主要研究方向。但纳米颗粒对植物生理的影响方式及主要作用部位并不是了解得很清楚。本研究选取具有代表性的5种金属氧化物纳米颗粒与植物光合作用的主要场所——叶绿体相互作用,简单、直观研究纳米颗粒对细胞器的影响。
叶绿体SEM图及叶绿体荧光显微镜图表明纳米颗粒是吸附并聚集在叶绿体表面的,说明了纳米颗粒对叶绿体光合活性的影响是通过相互接触完成的。在此基础上,通过检测叶绿体光合活性及荧光效应的变化来评估其影响。叶绿体光合活性的变化趋势显示,LiFePO4、TiO2无明显影响,ZnO及CdS对其有明显的抑制效应,并且随着纳米颗粒浓度的增加影响结果越显著。而γ-Fe2O3在低浓度条件下稍有促进作用,但随着浓度的增加逐渐显现为抑制效应。叶绿体荧光效应说明这5种纳米颗粒均在不同程度上影响了叶绿体的荧光效应,并解释了金属氧化物纳米颗粒对叶绿体光合活性的效应并不是影响叶绿素分子经光照后产生电子的过程,而是影响电子传递过程。
由此可得出结论,金属氧化物纳米颗粒会对植物光合作用产生影响,如ZnO及CdS对叶绿体具有明显的毒副作用,一定浓度的γ-Fe2O3纳米颗粒可以提高光合作用效率。这为纳米材料在植物领域,包括纳米化肥,纳米仿生、可再生性高效生化探测器的发展提供了参考,同时也为评估纳米材料对环境的潜在影响提供了理论基础。
[1]Hewakuruppu Y L, Dombrovsky L A, Chen C, et al. Plasmonic "pump probe" method to study semi-transparent nanofluids[J]. Applied Optics, 2013, 52(24): 6041-6050.
[2]Taylor Robert A, Otanicar Todd P, Herukerrupu Yasitha, et al. Feasibility of nanofluid-based optical filters[J]. Applied Optics, 2013, 52 (7): 1413-1422.
[3]Nabiev I, Rakovich A, Sukhanova A, et al. Fluorescent quantum dots as artificial antennas for enhanced light harvesting and energy transfer to photosynthetic reaction centers[J]. Angewandte Chemie International Edition, 2010, 49: 7217-7221.
[4]Kamat P V, Tvrdy K B, Radich J G. Beyond photovoltaics: Semiconductor nanoarchitectures for liquid-junction solar cells[J]. Chemical Reviews, 2010, 110: 6664-6688.
[5]Lee J S, Lee S H, Kim J H, et al. Artificial photosynthesis on a chip: microfluidic cofactor regeneration and photoenzymatic synthesis under visible light[J]. Lab Chip , 2011, 11: 2309-2311.
[6]Werwie M, Xu X X, Haase M. Bio serves nano: biological light-harvesting complex as energy donor for semiconductor quantum dots[J]. Langmuir, 2012, 28: 5810-5818.
[7]AbdulHameed M, Al-Samarrai. Nanoparticles as alternative to pesticides in management plant diseases-A review[J]. International Journal of Scientific and Research Publications, 2012, 2(4): 2250-3153.
[8]Sarlak N, Taherifar A, Salehi F. Synthesis of nanopesticides by encapsulating pesticide nanoparticles using functionalized carbon nanotubes and application of new nanocomposite for plant disease treatment[J]. Journal of Agricultural and Food Chemistry, 2014, 62: 4833-4838.
[9]Jagajjanani R K, Santanu P. Use of sulfur nanoparticles as a green pesticide onFusariumsolaniandVenturiainaequalisphytopathogens[J]. RSC Advances, 2013, 3: 10471-10478.
[10]Giraldo J P, Landary M P, Faltermeier S M, et al. Plant nanobionics approach to augment photosynthesis and biochemical sensing[J]. Nature Materials, 2014, 13: 400-408.
[11]Alidoust D, Isoda A. Phytotoxicity assessment of γ-Fe2O3nanoparticles on root elongation and growth of rice plant[J]. Environ Earth Sci, 2014, 71: 5173-5182.
[12]Lin D H, Xing B S. Phytotoxicity of nanoparticles: Inhibition of seed germination and root growth[J]. Environmental Pollution, 2007, 150: 243-250.
[13]Castiglione M R, Giorgetti L, Geri G, et al. The effects of nano-TiO2on seed germination, development and mitosis of root tip cells ofVicianarbonensisL. andZeamaysL[J]. J Nanopart Res, 2011, 13: 2443-2449.
[14]Cockburn W, Walker D A, Baldry C W. The isolation of spinach chloroplasts in pyrophosphate media[J]. Plant Physiol, 1968, 43: 1415-1418.
[15]Ventrella A, Catucci A, Agostiano A. Herbicides affect fluorescence and electron transfer activity of spinach chloroplasts, thylakoid membranes and isolated Photosystem II[J]. Bioelectrochemistry, 2010, 79: 43-49.
[16]Horvath O. Quenching of CdS fluorescence with benzyl alcohol via transmembrane diffusion in dihexadecyl phosphate vesicles[J]. Langmuir, 1999, 15: 279-281.
[17]Mathew S, Hari M, Libish T M. UV-visible photoluminescence of TiO2nanoparticles prepared by hydrothermal method[J]. Journal of Fluorescence, 2012, 22(6): 1563-1569.
[18]Tachikawa S, Noguchi A, Tsuge T. Optical properties of ZnO nanoparticles capped with polymers[J]. Materials, 2011, 4: 132-1143.
[19]Yang C, Xie H, Su B L, et al. Direct and rapid quantum dots labelling ofEscherichiacolicells[J]. Journal of Colloid and Interface Science, 2011, 393: 438-444.
[20]Fricker M D, White N S. Wavelength considerations in confocal microscopy of botanical specimens[J]. J Microsc, 1992, 166: 29-42.
Effect of nanoparticles on plant photosynthesis mechanism
LI Wei1, 2, HUANG Jin1, LI Qi-chang1, SU Bao-lian2, XIE Hao1
(1. School of Chemistry, Chemical Engineering and Life Sciences; 2. Laboratory of Living Materials at State Key Laboratory of Advanced Technology for Materials Synthesis and Processing,Wuhan University of Technology, Wuhan 430070, China)
To investigate the effect of nanoparticles (NPs) on plant photosynthesis, a simple and efficient approach was adopted. Five typical representative mental oxide NPs were chosen to interacted with the chloroplast, the reaction center of photosynthesis of plant. The variation of photosynthetic activity and fluorescence effect were measured. Scanning electron microscopy (SEM) and fluorescent microscopy showed that the impact of NPs on the photosynthetic activity of chloroplast was achieved by contacting with each other. The results indicated that ZnO and CdS NPs had obvious inhibiting effect, and with the increase of concentration the inhibition was more significantly; γ-Fe2O3NPs can be used as electron acceptor, had some promoting effect at low concentration, but with the increase of the concentration the inhibition effect appeared gradually. Suggesting the impact mechanism of NPs was affecting the process of the electron transfer. This work provides a promising approach for the development of the field of NPs in plants, including nano-fertilizer, nanobionics and a renewable, high-efficiency biochemical detectors. Meanwhile, it provides a theoretical basis for evaluating the potential effects of NPs on environment.
nanoparticles; chloroplast; photosynthetic activity; photosynthesis
2015-01-13;
2015-02-13
李 威,硕士研究生,主要从事人工光合作用系统方面的研究,E-mail:whutlxylw@126.com;
谢 浩,博士,教授,主要从事蛋白质与生物矿化方面的研究,Email:h.xie@whut.edu.cn。
Q945.11
A
2095-1736(2015)05-0063-04
doi∶10.3969/j.issn.2095-1736.2015.05.063

