氯桥联一维链铜配位聚合物:[(μ-Cl)Cu(BBPY)]+n[BBPY:2,6-二(2-苯并咪唑基)吡啶]的合成和结构
冯泳兰,庾江喜,蒋伍玖 ,朱小明,张复兴 ,邝代治
(功能金属有机材料湖南省普通高等学校重点实验室,衡阳师范学院化学与材料科学系,湖南衡阳 421008)
0 引 言
苯并咪唑及其衍生物在农药和医药领域是一类重要的活性物质,在抗癌[1]、抗菌[2]、抗寄生虫[3]等具有广谱的生物活性[4]。苯并咪唑类化合物是一种含氮原子的苯并杂环化合物,与金属离子具有良好的配位作用,其金属配合物还具有光物理性质而倍受人们关注,特别是配合物分子单元之间可形成分子间氢键作用或共轭环之间形成π-π作用构筑丰富的功能分子结构。2,6-二(2-苯并咪唑基)吡啶作为双苯并咪唑的多齿配体,在高性能复合材料、磁性、荧光材料、生物和医药等诸多领域显示出独特的性能,具有广泛的应用。近几年来,作为配体,研究其丰富的配位模式、配合物的性质异常活跃[5-6],合成出锌(II)、镍(II)及稀土配合物的报道[7-9],我们把2,6-二(2-苯并咪唑基)吡啶盐酸盐与铜盐反应合成了一新型氯桥联铜配位聚合物。
1.实验部分
1.1 仪器和试剂
晶体结构用Bruker Smart 1000型单晶衍射仪测定;熔点用北京泰克X-4双目体视显微熔点测定仪测定(温度计未经校正)所用试剂均为市售分析纯。
1.2 配合物的合成
配体的合成:参考文献[10]方法并改进,3.34g(20mmol)吡啶2,6-二甲酸,4.34g(40mmol)邻苯二胺,6M盐酸50ml,聚氟乙烯内衬的不锈钢反应瓶180℃反应6小时,冷却,除去墨绿色溶液,冷乙醇浸出沉淀物,得白色粉末2,6-二(2-苯并咪唑基)吡啶盐酸盐3.6g,收率为48.6%。熔点大于300℃,与文献值吻合。
配合物的合成:取2,6-二(2-苯并咪唑基)吡啶盐酸盐0.40g(1mmol),加少许碳酸钠,乙醇20ml,得紫红色溶液,再加入 0.22g(1mmol)Cu2(OH)2CO3,产生绿色沉淀,转移到聚氟乙烯内衬的不锈钢反应瓶,于160℃反应8小时,冷却,析出绿色晶体。
1.3 晶体结构测定
选取尺寸为0.53mm×0.10mm×0.03mm的晶体,在 Bruker SMART APEX II CCD 单晶衍射仪上,采用经石墨单色化的 Mo Kα射线(λ=0.071073nm),于293(2)K,以φ~ω扫描方式收集衍射数据。配合物在2.26°~26.01°范围内共收集8070个衍射点,其中独立衍射点3701个,用于结构精修的可观察衍射点1627个[I>2σ(I)]。全部数据经Lp因子和多重扫描吸收校正。晶体结构由直接法解出,全部非氢原子坐标在差值Fourier合成中陆续确定,氢原子由理论加氢法给出在晶胞中的位置坐标。对氢原子和非氢原子分别采用各向同性和各向异性热参数进行全矩阵最小二乘法修正。全部结构分析计算工作采用SHELXL-97程序完成。
2 结果与讨论
2.1 晶体结构描述
配合物属单斜晶系,空间群P2(1)/c,晶体学参数:a=1.63408(15)nm,b=1.80390(13)nm,c=0.71299(6)nm,α=90.00(°),β=106.3460(10)°,γ= 90.00 (°),V=2.0511(3)nm3,Z=4,Dc=1.536g·cm-3,m(MoKα)= 1.231mm-1,F(000)=960,R1=0.1626,wR2=0.4478。配合物的分子结构见图1,主要键长和键角列于表1。从分子结构图和结构参数可知,通过2,6-二(2-苯并咪唑基)吡啶的三个N原子与Cu(II)配位形成配合物,Cu与N原子的配位构成两个含铜、氮原子的五元环,这两个新环的形成,控制了C(7)-C(8)和C(12)-C(13)键的旋转,使2,6-二(2-苯并咪唑基)吡啶的苯环、咪唑和吡啶环共平面,结果配合物七个环几乎共平面,如二面角∠C(8)-C(7)-N(1)-Cu(1)=0.79°,∠C(12)-C(13)-N(4)-Cu(1)=0.76°,在各杂环中,N→Cu键长不等,吡啶与铜形成的N→Cu键比咪唑与铜形成的配键稍长,表明三个N原子与铜的作用稍有差异,三个N与铜原子构成的两个键角也不等,∠N(3)-Cu(1)-N(4)大于∠N(3)-Cu(1)-N(1)2.6°,显然,五元杂环为不规则环。此外,环平面外有两个氯原子分别Cu(II)产生两个不对称的Cl→Cu配位,Cu(1)-Cl(1)0.2690(5)nm,Cu(1A)-Cl(1)为0.2248(4)nm,构成六配位畸形配合物。每个氯原子又以μ-2的形式桥联Cu-Cl-Cu两个相邻配合物的铜原子,这就形成中心结构具有[-Cu-Cl-Cu-]n的一维链状配位聚合物结构,如图2所示。
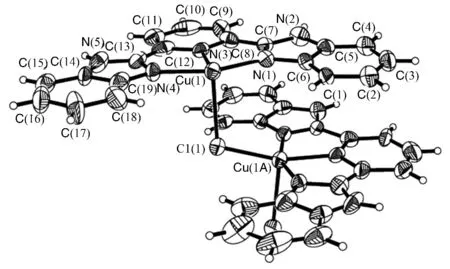
图1 配合物的分子结构Fig.1 Molecular structure of the complex

图2 配位聚合物的一维链结构(a*,c*分别为两个不同轴向观察的链结构)Fig.2 1Dstructure of the coordination polymer
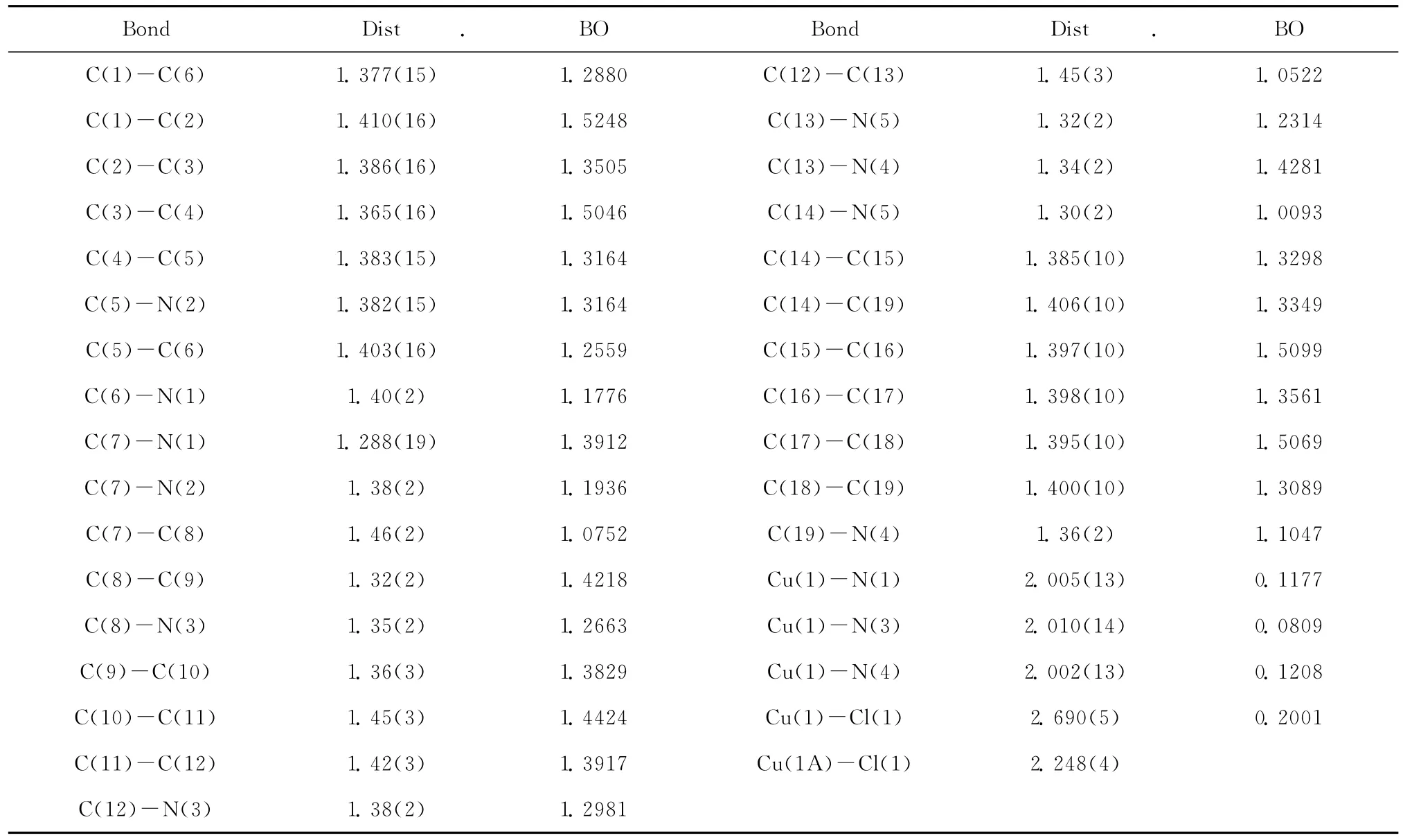
表1 配合物的主要键长(10×nm)和键角及Wiberg键级Table 1Selected bond lengths(10×nm),Bond Angles(°)and Wiberg bond orders of the complex
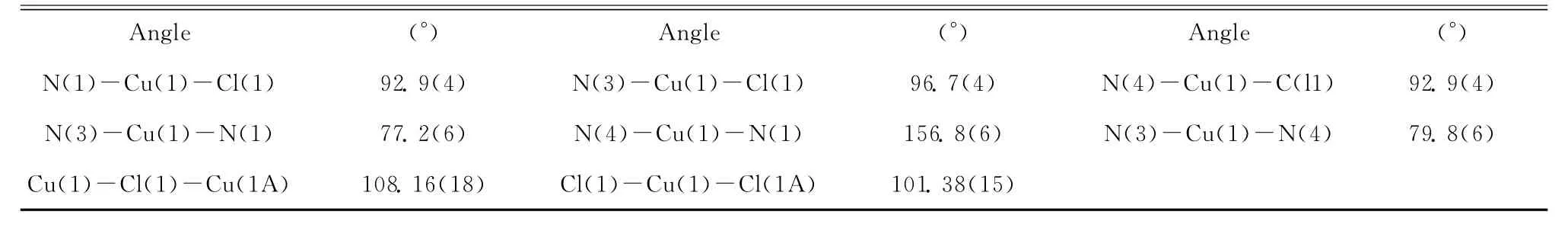
续表
2.2 分子轨道组成研究
利用晶体结构的原子坐标,在GaussView构建配合物的单元分子模型。采用HARTREE-FOCK方法在LANL2DZ基组水平上对结构进行单点计算[11],探索标题配合物的结构成键特征,运用参与组合的各类原子的轨道系数的平方和,归一化后,来表示该类原子在分子轨道中的贡献。把配合物中的原子分为6类:(1)Cu原子;(2)Cl原子;(3)配位 N(I)原子;(4)未配位 N(II)原子;(5)碳原子C;(6)C原子。为节省编幅,只讨论配合物的前沿分子轨道组成,配合物的分子轨道成分如图3所示。表4列出了配合物分子前沿分子轨道组成。计算涉及39个原子、272个原子基函、717个初始函数,94个α电子,93个β电子。全部计算使用Gaussian 03W[12]程序包。

图3 配合物的前沿分子轨道示意图Fig.3 The schematic diagram of frontier MO of the complex
据根据分子轨道理论,前线轨道和相近分子轨道的能量对于配合物的稳定性起着重要作用。对于标题配合物,最高占据轨道(HOMO)能级-0.41784a.u.与最低未占轨道 (LUMO)能级 -0.11603a.u.之差 ΔE 为0.30181a.u.,表明 HO-MO的电子不容易失去,为稳定配合物。
氢原子对前线轨道分子轨道的贡献不大,其它五类原子对前线分子轨道的贡献为主,且它们在对最高占据轨道和最低未占轨道的贡献发生明显变化。在最高占据轨道,一个氯原子对HOMO的贡献达87.01%,并完全由氯原子的px轨道组成贡献,其次是19个碳原子的贡献7.71%,再次是三个配位氮原子的贡献3.25%,中心铜原子主要由它的px轨道组成的贡献。可见,在配合物中通过Cu和Cl的px原子轨道相互作用形成强Cu-Cl键,与N(I)形成弱配位Cu-N键。在LUMO轨道,原子轨道对分子轨道的贡献发生变化,碳原子对LUMO贡献为主,其次是配位氮原子的贡献,再次是铜和未配位氮原子,氯原子对LUMO贡献只有0.50%。
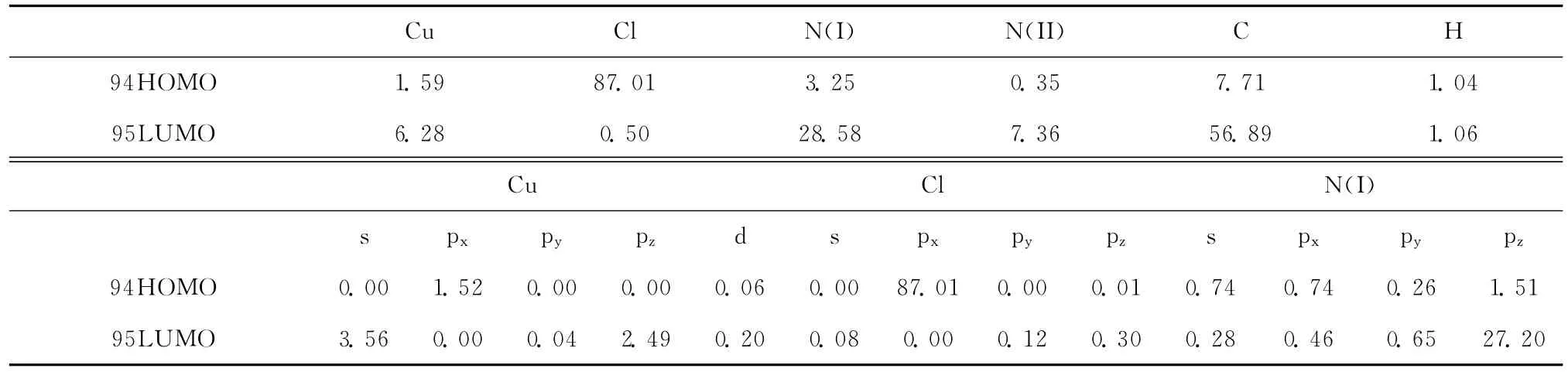
表2 配合物的前沿分子轨道组成(%)Table 2 The composition of the frontier molecular orbitals of the complex(%)
2.3 配合物的Wiberg键级
配合物的Wiberg键级列于表1。配合物中BBPY的非 C(N)-H 键级均在1.0093~1.5248之间有较大变化,表明BBPY的C-C或C-N的共价键由于共轭趋于平均,这与晶体结构的键长趋于平均相一致,在吡啶与咪唑之间的C-C键相对键长最大(0.145~0.146nm)而键级最小(1.05~1.08),共轭最弱的共价键。BBPY利用其三个N原子及氯原子与Cu(II)配位后,氮和氯原子向Cu(II)提供电子形成较弱的 N→Cu(II)和Cl→Cu(II)配位作用,它们在配合物中有最大的键长,且N(3)-Cu(1)大于 N(1,4)-Cu(1),Wiberg键级 N(3)-Cu(1)0.0819,N(1)-Cu(1)0.1177,N(4)-Cu(1)0.1208支持了这一弱键结果。配合物中Cu(II)的电荷+1.0700也说明配位键由配位原子提供了0.93个电子并形成配位共价键。值得指出的是,这4个配位键中,Cl(1)-Cu(1)键级明显大于 N-Cu键级,其Cl(1)-Cu(1)键长(0.2690nm)也明显大于配合物中其它键长,这可能是虽具有较强的Cl(1)→Cu(1)配位共价键,但由于氯原子以μ-2的形式桥联Cu-Cl-Cu两个相邻配合物而使配合物之间的空间位阻较大,将∠Cu(1)-Cl(1)-Cu(1A)拉开到108.16(18)°、Cu(1)-Cl(1)和 Cu(1A)-Cl(1)键长分别拉长到2.690(5)和2.248(4)nm。
[1]SPASOV A A,YOZHITSA I N,BUGAEVA L I,et al.Search for new durgs benzimidazole derivatives:spectrum of pharmarcological activity and toxicological properties(a review)[J].Pharm Chem,1999,33(5):232-243.
[2]宋琳,王惠贞.苯并咪唑Schiff碱的合成及其杀菌活性[J].中国药物化学杂志,2000,10(2):92-94.
[3]TEBBE M J,JENSEN C B,SPITZER W A,et al.The effects of antirhino-and enteroviral vinylacetylene benzimidazoles on cytochrome P450function and hepatic porphyrin levels in mice[J].Antiviral Res,1999,42(1):25-33.
[4]朱莉,廖展如,龙云飞,等.含苯并咪唑锌配合物的合成、表征及晶体结构[J].无机化学学报,2004,20(4):399-402.
[5]景崤壁,毕晓昕,汪清,等.新型含有苯并咪唑取代基的多取代吡啶类化合物及其配合物的合成与表征[J].有机化学,2010,30(4):539-545.
[6]李静,季长春,王作为,等.镉配合物的合成、晶体结构与荧光性质 [J].无机化学学报,2009,25(12):2083-2089.
[7]郭应臣,陈书阳,邱东方,等.基于2,6-二(2-苯并咪唑基)吡啶配体的锌(II)、镍(II)配合物的合成、晶体结构及荧光性质[J].无机化学学报,2011,27(8):1517-1522.
[8]闫振忠,唐 瑜,谭民裕.等.2,6-二(2-苯并咪唑基)吡啶与稀土苦味酸盐配合物的合成、晶体结构及荧光性质研究[J].化学学报,2007,65(7):607-614.
[9]YANG Yana,LI Chang-Guia,LUO Xu-Jianb,et al..Synthesis,crystal structure and characterization of a Ni(II)complex of constructed 2,6-Bis(benzimidazol-2-yl)pyridine[J].Chinese J.S truct.Chem,2014,33(10):1545-154933.
[10]肖小明,王姣亮,周燕霞,等.微波辐射下2,6-二(苯并咪唑-2’)吡啶的合成[J].湖南师范大学自然科学学报,2005,28(1):44-47.
[11]邝代治,冯泳兰.茂金属配合物[Mo(η5-C5H4Si2Me5)(CO)3Cl]的晶体结构和量子化学研究[J].无机化学学报,2002,18(4):394-398.
[12]Aeleen F,Michael J F.Gaussian98user’s reference gaussian,inc.,garnegie Office Park,Bldg.6Pittaburgb,PA15106USA.

