嵌合抗原受体T细胞治疗恶性肿瘤的研究进展
常 征,陈学武,王 丽,于黎鑫
(山东齐都药业有限公司,山东 淄博 255000)
嵌合抗原受体T细胞免疫疗法(Chimeric Antigen Receptor T-Cell Immunotherapy,CAR-T)是近年来迅速发展的肿瘤过继免疫治疗方法[1]。和其他免疫疗法类似,其基本原理是利用病人自身的免疫细胞来清除癌细胞,但与传统免疫治疗方法不同的是,这种细胞疗法利用基因工程技术,通过逆转录病毒和慢病毒载体、转座系统(如SB转座系统)或直接将mRNA转导到T细胞内,给T细胞加入一个能识别肿瘤细胞,并且同时激活T细胞杀死肿瘤细胞的嵌合抗体,这些T细胞进行扩增后回输到患者体内,使免疫细胞具有特异性识别和杀伤肿瘤的能力[2]。目前该免疫疗法在晚期难治性白血病和淋巴瘤患者中进行的早期临床试验已经显示出非常振奋人心的结果[3,4]。
1 CAR结构
CAR是人工构建的融合基因编码的跨膜分子,由胞外区、胞内区和跨膜区构成。胞外区负责抗原的识别,胞内区负责信号的转导,跨膜区连接胞外区和胞内区,对每一个区域的不同设计直接影响CAR-T功能的发挥[5]。膜外区为由单链可变片段(scFv)组成的抗原结合区,可特异性地识别并结合肿瘤细胞表面的抗原,使CAR-T对肿瘤抗原识别具有非MHC限制性和高亲和力的特点。目前已经设计了能识别多种肿瘤抗原的 scFv,如 CD19、CD20、EGFR、Her2/neu、GD2、PSMA、CAIX 及 ROR1 等[6]。跨膜区在 T 细胞活化中起着重要的作用,对跨膜区不同的设计影响导入的CAR基因的表达能力,Pule等[7]证明包含 CD28的跨膜 区表达CAR的能力最强,目前设计用于CAR的跨膜区有:H2-Kb、CD4、CD7、CD8、CD28 等[8]。膜内区为细胞内信号转导区,胞外区和胞内区的信号传导结构域相耦联,如TCRζ(CD3-ζ)或 FcRγ[9]。当 scFv 与其识别的抗原结合时,会通过TCRζ向胞内传导TCR样的信号。通过对胞内区的不断修饰改进,使CAR-T细胞与肿瘤表面抗原结合后,更充分激活并产生强烈的免疫应答反应,从而杀伤肿瘤细胞。此外,也可将趋化因子受体连接到CAR-T细胞上,使CAR-T细胞定向转移到肿瘤部。
2 CAR-T的发展
从1989年Dotti等[10]最初提出嵌合抗原受体T细胞免疫疗法概念,到目前临床试验治疗白血病上取得突破性进展已有将近26年时间,经不断的科研和转化,CAR-T细胞技术已经发展出3代[11]。
第一代CAR-T将免疫球蛋白样scFv和FcεRI受体(γ链)或CD3复合物(ζ链)胞内结构域融合形成嵌合受体,虽然能够介导对肿瘤细胞的杀伤作用,但是不转导增殖信号和诱导细胞因子产生,并且体内持续作用时间不长。
第二代 CAR-T细胞加入了共刺激分子,如 CD27、CD28、CD134(OX40),或 CD137(4 -1BB)[12]。这些共刺激分子能提供不同的效应功能,例如增殖和细胞因子的产生。一项使用针对CD19特异性的第二代CAR-T治疗1例晚期滤泡淋巴瘤的临床试验中,观察到患者在治疗后的第36周骨髓中CD19+细胞仍检测不到,患者获得了明显缓解持续超过32 周[13]。
第三代CAR-T包含了更多的共刺激分子结构域,例如4-1BB(CD137)、OX40(CD134)、CD27、可诱导共刺激分子,以提高T细胞的细胞毒活性、增殖性与存活时间,促进细胞因子的释放[14]。Daffis等[15]通过第三代 CAR -T治疗难治性慢性淋巴细胞细胞白血病,给予患者低剂量的CAR-T过继回输,发现回输体内后CAR-T扩增超过1000倍,并在血液和骨髓中持续高水平存在达6个月之久,骨髓中白血病细胞也被清除,治疗之后患者的缓解持续时间达10个月。有部分CAR-T甚至具有记忆细胞的特点,再次接触白血病细胞时会产生快速反应。此外,目前正在进行的一项Ⅰ期临床试验显示,靶向B细胞淋巴瘤CD20的第三代CAR-T治疗效果也较好,患者耐受良好,无明显毒副作用[16]。
3 CAR-T优势
CAR-T利用基因工程技术给T细胞加入一个能识别肿瘤细胞,并且同时激活T细胞杀死肿瘤细胞的嵌合抗体,靶向杀死癌细胞。其优势主要体现在:①精准杀伤肿瘤细胞。由于CAR-T细胞是应用基因修饰病人自体的T细胞,利用抗原抗体结合的机制,能克服肿瘤细胞通过下调MHC分子表达以及降低抗原递呈等免疫逃逸,让肿瘤细胞无所逃遁;②多靶向杀伤肿瘤细胞[17]。CAR既可以利用肿瘤蛋白质抗原,又可利用糖脂类非蛋白质抗原,扩大了肿瘤抗原靶点范围;③杀伤范围更广。鉴于很多肿瘤细胞表达相同的肿瘤抗原,针对某一种肿瘤抗原的CAR基因构建一旦完成,便可以被广泛利用;④杀瘤效果更持久。新一代CAR结构中加入了促进T细胞增殖与活化的基因序列,能保证T细胞进入体内后还可以增殖,CAR-T细胞具有免疫记忆功能,可以长期在体内存活[18]。
4 CAR-T相关临床试验
目前,世界各国都在积极开展CAR-T疗法的临床试验(见表1、2)[19]。其中,美国开展试验数目最多,试验数量达41项,占据了全球CAR-T疗法临床试验量的74.5%。在美国临床试验注册官网上,截至目前正在招募、尚未招募或还在筹备中的CAR-T疗法临床试验有55个,其中大部分(42个)为血液肿瘤试验,涉及急性淋巴细胞白血病(ALL)、慢性淋巴细胞白血病(CLL)、B细胞淋巴瘤/白血病、霍奇金淋巴瘤和非霍奇金淋巴瘤。剩下的13个是实体瘤试验,涉及头颈癌、乳腺癌、胶质瘤、间皮瘤、黑色素瘤、神经母细胞瘤、前列腺癌、胰腺癌等[20]。虽然中国在CAR-T疗法领域起步较晚,但目前北京大学肿瘤医院和解放军总医院也已经开展相关临床试验。

表1 CAR-T用于血液病的临床试验
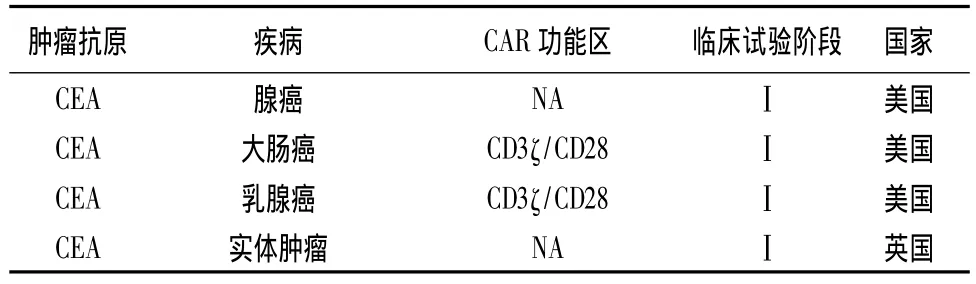
表2 CAR-T用于实体肿瘤的临床试验

续表2:
5 CAR-T应用前景
目前的肿瘤免疫治疗还处于刚刚起步阶段,CAR-T的结构形式到目前为止经历了三代发展,每一代的发展都较前代在活化、增殖能力、抗瘤活性及体内持续时间方面有所提高,并且出现了一些衍生形式。CAR-T细胞治疗也只是对部分血液肿瘤起到一定作用,对实质性肿瘤的治疗还有待突破。同时,如何将CAR-T与其他各种疗法联合使用,如化疗、放疗、肿瘤疫苗、抗体等疗法,以达到最佳的临床疗效,是将来肿瘤综合治疗亟需解决的一个问题。我们相信,随着转化医学研究的不断深入,21世纪将是免疫治疗能够走向肿瘤治疗中心舞台的时代。
[1]Sadelain M,Rivière I,Brentjens R.Targeting tumours with genetically enhanced T lymphocytes[J].Nat Rev Cancer,2003,3(1):35 -45.
[2]Melenhorst JJ,Levine BL.Innovation and opportunity for chimeric antigen receptor targeted T cells[J].Cytotherapy,2013,15(9):1046 -1053.
[3]Mihara K,Bhattacharyya J,Kitanaka A,et al.T-cell immunotherapy with a chimeric receptor against CD38 is effective in eliminating myeloma cells[J].Leukemia,2012,26(2):365-367.
[4]Tettamanti S,Marin V,Pizzitola I,et al.Targeting of acute myeloid leukaemia by cytokine-induced killer cells redirected with a novel CD123-specific chimeric antigen receptor[J].Br J Haematol,2013,161(3):389-401.
[5]钱磊,崔久嵬.嵌合型抗原受体基因修饰的T细胞研究进展[J].中国免疫学杂志,2014,30(6):850 -857.
[6]Turtle CJ,Riddell SR.Genetically retargeting CD8+lymphocyte subsets for cancer immunotherapy[J].Curr Opin Immunol,2011,23(2):299 -305.
[7]Pulè MA,Straathof KC,Dotti G,et al.A chimeric T cell antigen receptor that augments cytokine release and supports clonal expansion of primary human T cells[J].Mol Ther,2005,12(5):933 -941.
[8]Shi H,Liu L,Wang Z.Improving the efficacy and safety of engineered T cell therapy for cancer[J].Cancer Lett,2013,328(2):191 -197.
[9]Yun CO,Nolan KF,Beecham EJ,et al.Targeting of T lymphocytes to melanoma cells through chimeric anti-GD3 immunoglobulin T-cell receptors[J].Neoplasia,2000,2(5):449 -459.
[10]Dotti G,Savoldo B,Brenner M.Fifteen years of gene therapy based on chimeric antigen receptors:"are we nearly there yet"[J].Hum Gene Ther,2009,20(11):1229-1239.
[11]黄莹,韩双印.嵌合抗原受体基因修饰T淋巴细胞在肿瘤免疫治疗中的研究进展[J].中华实验外科杂志,2011,28(10):1812 -1814.
[12]Maher J,Brentjens RJ,Gunset G,et al.Human T-lymphocyte cytotoxicity and proliferation directed by a single chimeric TCRzeta/CD28 receptor[J].Nat Biotechnol,2002,20(1):70 -75.
[13]Negishi H,Osawa T,Ogami K,et al.A critical link between Toll-like receptor 3 and type II interferon signaling pathways in antiviral innate immunity[J].Proc Natl Acad Sci U S A,2008,105(51):20446 -20451.
[14]Brentjens RJ,Santos E,Nikhamin Y,et al.Genetically targeted T cells eradicate systemic acute lymphoblastic leukemia xenografts[J].Clin Cancer Res,2007,13(18 Pt 1):5426-5435.
[15]Daffis S,Samuel MA,Suthar MS,et al.Toll- like receptor 3 has a protective role against West Nile virus infection[J].J Virol,2008,82(21):10349 -10358.
[16]Neteamg,Maródi L.Innate immune mechanisms for recognition and uptake of Candida species[J].Trends Immunol,2010,31(9):346 -353.
[17]Leen AM,Rooney CM,Foster AE.Improving T cell therapy for cancer[J].Annu Rev Immunol,2007,25:243-265.
[18]赵嫄,胡婉丽,张连生.嵌合抗原受体疗法在血液肿瘤免疫治疗中的研究进展与应用前景[J].中华临床医师杂志(电子版),2014,8(6):1158 -1161.
[19]张鸿声.嵌合抗原受体T细胞肿瘤治疗的前生、今世和将来[J].转化医学杂志,2014,3(3):129 -133.
[20]蔡慧,赵莲君,邹征云.嵌合抗原受体基因修饰T淋巴细胞在肿瘤免疫治疗中的研究[J].现代肿瘤医学,2014,22(11):2730 -2734.

