QuEChERS法结合高效液相色谱-高分辨飞行时间质谱测定食用贝类产品中4种脂溶性贝类毒素
曾广丰,刘 青,*,王志元,丁 博,陈文锐,韦晓群,李文斌,胡志玲,韩 深
(1.广东出入境检验检疫局技术中心,广东广州 510623;2.广东省动植物与食品进出口技术措施研究重点实验室,广东广州 510623;3.迪马科技有限公司,北京 100029;4.北京出入境检验检疫局技术中心,北京 100026)
QuEChERS法结合高效液相色谱-高分辨飞行时间质谱测定食用贝类产品中4种脂溶性贝类毒素
曾广丰1,2,刘 青1,2,*,王志元1,2,丁 博1,2,陈文锐1,2,韦晓群1,2,李文斌3,胡志玲3,韩 深4
(1.广东出入境检验检疫局技术中心,广东广州 510623;2.广东省动植物与食品进出口技术措施研究重点实验室,广东广州 510623;3.迪马科技有限公司,北京 100029;4.北京出入境检验检疫局技术中心,北京 100026)
建立了QuEChERS净化技术结合高效液相色谱-高分辨飞行时间质谱法测定食用贝类产品中4种脂溶性贝类毒素(Okadaic Acid,OA、Spirolides1,SPX1、Dinophysistoxin1,DTX1、Azaspiracid1,AZA1)的快速方法。以QuEChERS净化技术对食用贝类样品进行提取与净化后,经C18色谱柱分离,用高分辨飞行时间质谱仪(ESI源)进行测定。用PeakView 软件对分析结果进行全智能分析,对照每个样品与标准品的TOF-MS质量精度及同位素分布情况、保留时间以及TOF-MS/MS谱图,对化合物作出定性判断。同时利用MultiQuant软件对四种毒素进行外标法定量,OA和DTX1的线性范围为2.0~100 μg/L,方法检出限为10 μg/kg;AZA1和SPX1的线性范围为0.5~20 μg/L,方法检出限为2.0 μg/kg,相关系数(R2)均大于0.997。高、中、低三个添加水平的平均回收率在75.6%~94.1%之间,RSD小于10%。应用该方法对进出口的贻贝、北极贝、象拔蚌、牡蛎等20个样品进行检测,发现8个样品的SPX1和2个AZA1测定结果为阳性。该方法操作简便、高效快速、灵敏度高、重现性好,适用于贝类产品中脂溶性贝类毒素的检测。
高效液相色谱-高分辨飞行时间质谱,QuEChERS,脂溶性贝类毒素,食用贝类产品
贝类毒素特指主要由海洋有毒微藻或微生物产生,能够在海洋生物尤其是双壳贝类中富集的、对其他生物包括人类产生危害的一大类小分子有毒化合物[1]。贝类毒素毒性大、反应快、且无适宜解毒剂,具有突发性和广泛性,故水产品的安全问题直接关系到消费者的身体健康和生命安全[2]。常见的脂溶性贝毒有软骨藻酸(DA)、大田软海绵酸毒素(OA)及其类似物、原多甲藻酸毒素(AZA)、虾夷扇贝毒素(YTX)、大环内酯类扇贝毒素(PTX)、鳍藻毒素(DTX)和螺环内酯毒素(SPX)等。欧洲食品安全局对贝肉中部分毒素的安全限量为:OA、PTX和AZA均为160 μg/kg;YTX 1.0 mg/kg,SPX等环亚胺类毒素和DTX等鳍藻毒素还未设定安全限量[3]。
当前贝类毒素的检测方法主要有小鼠生物分析法(MBA法)[4]、细胞毒性测试法[5]、酶蛋白抑制法[6]、免疫分析法[7]、液相色谱-串联质谱法[8]。MBA法检测周期长,易受到其他内源性化合物影响出现假阳性结果;细胞毒性测试法需要使用的细胞容易在实验过程中大面积死亡,使该方法重现性差,不易推广使用;酶蛋白抑制法对蛋白磷酸酶要求极高,必须保证其活性良好,且该法无法提供相关贝类毒素信息;免疫分析法检测较为快捷,但容易对一些主要衍生物有交叉反应或者反应不灵敏;欧盟于2012年提出将液相色谱-串联质谱法作为贝毒测定的参考方法(EN 16204-2012)[9-10]。但该法的建立必须依赖标准物质对仪器条件进行优化,在多残留检测和未知物的分析测定应用中受到限制。高分辨飞行时间质谱仪具有高分辨率和高灵敏度,可实现高通量的目标物或非目标物筛选以及高可靠性的确证定量分析。QuEChERS净化技术是一种通用性较强、快速简便的前处理方法,现已广泛用于食品污染物的检测[11-12]。本文使用QuEChERS净化技术结合液相色谱-高分辨飞行时间质谱检测技术对贝类产品中OA、DTX1、SPX1和AZA1进行测定。与低分辨率质谱相比,高分辨质谱一级全扫描和数据依赖扫描进行检测分析,降低了假阳性结果出现的可能性,使检测结果更加准确。本方法灵敏度高、专属性强,可实现高通量的脂溶性贝类毒素筛选以及高可靠性的确证定量分析,满足日常贝类产品中脂溶性贝类毒素监控的需要。
1 材料与方法
1.1 材料与仪器
四种脂溶性贝类毒素标准品:OA(18.1±1.9)μg/g、DTX1(19.2±1.4)μg/g、SPX1(8.9±0.4)μg/g和AZA1(1.57±0.09)μg/g 0.5 mL甲醇储备液,购自加拿大海洋生物科学研究所(NRC);乙腈、乙酸铵、甲酸(色谱纯,美国Fisher公司);无水硫酸镁(MgSO4)、氯化钠(NaCl)、柠檬酸钠(TSCD)、柠檬酸氢二钠(DHS)、C18、PSA dSPE分散剂(分析纯,迪马科技公司);微孔滤膜(0.22 μm,津腾公司);微纤维滤纸(美国Vicam公司);实验用水为经Milli-Q纯水系统制得的超纯水(电阻率为18.2 MΩ)。
高分辨飞行时间质谱仪 Triple TOF 5600+,美国AB公司;高效液相色谱仪 LC-20AD,日本岛津公司;Phenomenex Kinetex C18色谱柱(100 mm×2.1 mm,2.6 μm) 美国菲罗门公司;氮吹浓缩仪(Turbo Vap@LV,瑞典Biotage公司);高速均质机 T25,德国IKA公司;离心机 4k-15,美国Sigma公司;旋涡混匀器VORTEX 4 德国IKA公司;Milli-Q超纯水装置 美国Millipore公司。
1.2 色谱-质谱条件
1.2.1 色谱条件 色谱柱:Kinetex C18色谱柱(100 mm×2.1 mm,2.6 μm);进样体积:5 μL;流速:500 μL/min(ESI+),300 μL/min(ESI-);柱温:40 ℃;流动相:A-乙腈;B-水(含2 mmol/L醋酸铵,0.1%甲酸),洗脱条件如表1所示。
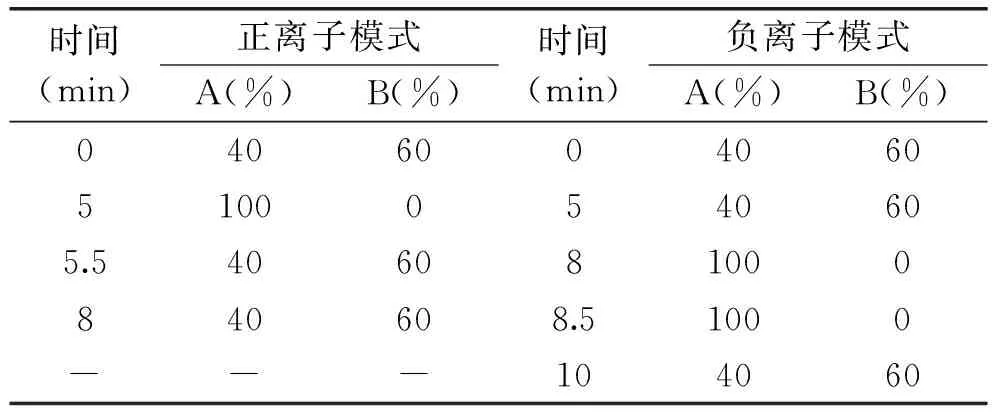
表1 ESI模式下液相色谱洗脱条件
1.2.2 质谱条件 扫描方式:正/负离子扫描,一级(TOF)扫描质量范围(m/z):100~1000;二级(Product ion)扫描质量范围(m/z):50~1000;动态背景扣除:开;IDA阈值:100 cps。实验中选择电喷雾离子源(ESI)作为检测离子源,大气压化学电离源(APCI)作为校正离子源。正离子模式校正液流速为0.3 mL/min;负离子模式校正液流速为0.5 mL/min。通过自动校正系统,每5个样品进行一次自动校正,以确保系统在批内的精准质量数稳定。质谱参数详见表2。

表2 TOF-IDA-MS模式质谱参数

表3 四种贝类毒素标准品信息
1.3 样品前处理
试样制备:由于贝类毒素在贝类产品中分布不匀,内脏部分富集较多,贝肉含量较少,因此在取样时,应取去除外壳的整体作为分析试样,以确保样品的均一性和代表性。样品洗净沥干后称取约300 g于洁净的密样品中,放入-18 ℃的冰箱中密封保存,制样与储存过程中要避免样品间交叉污染。
提取和净化:准确称取制备好的试样10 g(精确至0.01 g)于50 mL离心管中,分别加入25 mL 85%乙腈-水提取液,4 g无水硫酸镁和1 g氯化钠,20000 r/min转速下均质60 s,用微纤维滤纸过滤,取10 mL滤液至离心管中,加入150 mg C18、150 mg PSA、dSPE净化剂和1 g无水硫酸镁,漩涡振荡2 min,在8000 r/min转速下离心5 min,取5 mL上清液移至试管中,40 ℃下氮气吹至近干,以1 mL 85%乙腈水溶液重新溶解,漩涡振荡60 s,过0.22 μm微孔滤膜,待仪器分析测定。
1.4 标准溶液配制
四种贝类毒素的标准储备液,于-18 ℃条件下保存,保存期为6个月;配制标准工作曲线时,使用净化好的空白基质液根据要求将储备液稀释成不同浓度,于4 ℃条件下保存,工作曲线现用现配,有效期2周。四种贝类毒素标准的信息见表3。
2 结果与讨论
2.1 提取方法优化
2.1.1 提取溶剂的选择 四种贝类毒素易溶于甲醇、乙腈,丙酮等有机溶剂。实验选取北极贝样品,加标量为10 μg/kg,超声提取,分别考查了乙酸乙酯、丙酮、甲醇、乙腈四种溶剂的提取效果。结果表明,乙腈对四种贝类毒素的提取效果较好。考虑到使用纯乙腈进行提取时,样品中富含的蛋白质、脂肪、氨基酸等会增加提取液中干扰杂质的含量,因此在比较了不同比例乙腈-水溶液的提取效果后,确定提取溶剂为85%的乙腈-水溶液。不同溶剂对AZA1提取率的影响见图1。
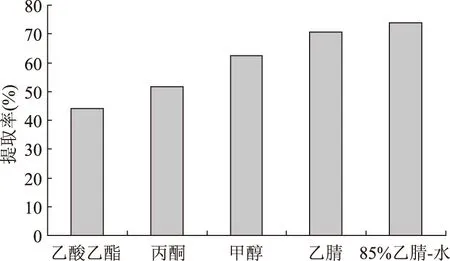
图1 不同溶剂对AZA1提取率的影响Fig.1 AZA1 extraction efficience of different solvent
2.1.2 提取方式的选择 比较了振荡30 min、均质1 min、室温超声20 min三种提取方式。选取北极贝样品,加标量为10 μg/kg,均质提取回收率为82.3%,振荡提取回收率为51.7%,超声提取回收率为64.3%。故选取均质提取方式。
2.1.3 提取温度和时间的优化 对不同的提取时间和温度对提取效果的影响进行了实验,结果表明至少60 s才能够保证目标化合物的提取效率;在室温、40、50、60、70 ℃下,目标化合物的提取效果并无明显差异。故选取在室温条件下,以85%乙腈-水溶液作为提取液,采用高速均质机将样品均质60 s。
2.1.4 净化条件的选择 色谱分析常见的净化方式有液液萃取、固相萃取、免疫亲和萃取等,本文采用了基质固相分散萃取(DSPE)技术进行净化处理,分析比较了Florisil、C18、PSA、GCB等几种常用净化剂的净化效果,通过优化最终确定了使用C18和PSA净化剂。针对常见的四种贝类产品牡蛎、象拔蚌、北极贝和贻贝的提取,对分散剂和盐的用量进行了实验。实验分别考察了无水硫酸镁、氯化钠、柠檬酸钠和柠檬酸氢二钠的加入量对提取效率的影响。结果表明,4 g无水硫酸镁、1 g氯化钠、1 g柠檬酸钠和0.5 g柠檬酸氢二钠的加入即能够获得较好的提取效率。在最优组合条件下,以北极贝为基质加标10 μg/kg,四种贝类毒素的回收率分别为:OA,76.1%;SPX1,90.6%;DTX1,77.8%;AZA1,87.9%。
2.2 色谱条件的优化
实验考察了乙腈-水和甲醇-水两种体系作为流动相时四种贝类毒素的色谱保留行为。结果表明,使用甲醇-水体系作为流动相时,甲醇溶剂体系要将目标化合物洗脱下来所需时间为13 min。而乙腈的洗脱能力较强,所需分析时间缩短,能够提高工作效率。DTX1和OA 10 min即可完成基线分离,AZA1和SPX1 8 min完成基线分离,且峰形尖锐、对称,如图2所示。

图2 四种贝类毒素的提取色谱图Fig.2 Chramotogram of four shellfish toxins
2.3 质谱条件的确定
2.3.1 去簇电压的确定 去簇电压(Declustering Potential,DP)直接影响目标化合物的检测灵敏度。优化DP是为了保证一级谱图中准分子离子的传输效率最高,产生碎片离子最少。增大DP,准分子离子峰丰度增大,但丰度达到最大值后继续增大DP,会导致目标化合物在源内裂解,导致离子碎片增多,准分子离子峰丰度下降。本实验考察了60~150 V和-60~-150 V去簇电压的影响,结果表明,正离子模式在100 V,负离子模式在-100 V的DP下,目标化合物能够得到丰度最高的准分子离子峰。
2.3.2 碰撞能量的确定 碰撞能量(Collision Energy,CE)直接影响目标化合物二级谱图信息的丰富程度。碰撞能量低,准分子离子的响应强度高,但得到的碎片信息少。增大碰撞能量,会导致准分子离子的响应逐渐减弱,碎片离子增多。本实验考察了20~95 eV和-20~-95 eV碰撞电压的影响。为得到信息全面的MS/MS谱图,本实验选取三张不同CE值采集的谱图进行叠加,作为最终的MS/MS谱图。正离子模式的CE值为40、55、70 eV;负离子模式的CE值为-65、-80、-95 eV。
2.3.3 质谱工作流程优化 利用优化完的DP、CE建立TOF-IDA-MS的工作流程,进行目标物测定。一次进样即可同时获得定性和定量数据。将一级高分辨母离子实测值与理论值进行对照,见表4。IDA阈值设为100 cps,丰度大于该设定值即采集MS2谱图。利用系统的自带的动态背景扣除(DBS)功能,可极大降低本底背景的二级质谱信号干扰,以提高样品中目标物的MS2信号。本研究采用电喷雾离子源正/负离子扫描模式,通过总离子流扫描可以看出,4种脂溶性贝类毒素形成的准分子离子峰中AZA1和SPX1[M+H]+峰丰度最高,OA和DTX1[M-H]-峰丰度最高。

表5 贻贝中四种贝类毒素的线性范围、线性方程、相关系数和检测限

表4 四种贝类毒素的质谱分析参数
2.3.4 目标化合物确定 参考欧盟农药残留分析质量控制程序提出的化合物结构确证要求,高分辨质谱仪仅需要一个高分辨母离子和一个高分辨子离子就可以满足对目标化合物的确证要求[13]。在本研究中,我们将全扫描模式的母离子作为定量离子,将丰度最高的IDA数据依赖性扫描碎片离子作为定性离子,见图3。四种脂溶性贝类毒素丰度最高的碎片离子分别为,AZA1(m/z):824.4882,由母离子脱掉一个水分子形成[C47H70NO11]+;SPX1(m/z):674.4384,由母离子脱掉一个水分子形成[C42H60NO6]+;DTX1(m/z):255.1239,[C13H19NO5]-;OA(m/z):255.1235,[C13H19NO5]-。

图3 四种贝类毒素的二级质谱图Fig.3 MS2 fragmentation of four shellfish toxins
2.4 方法学评价
2.4.1 线性范围和检出限 利用系统自带的MultiQuant软件对四种贝类毒素采用外标法进行定量。结果表明,SPX1和AZA1在0.5~20 μg/L的浓度范围内线性较好,OA和DTX1在2.0~100 μg/L的浓度范围内线性较好。以浓度为横坐标(x,μg/L),峰面积为纵坐标(y)进行线性回归计算,所得相关系数(R2)均大于0.997。根据3倍信噪比(S/N)确定化合物的方法检出限。样品中OA和DTX1的方法检出限均为10 μg/kg,AZA1和SPX1的方法检出限为2.0 μg/kg。详见表5。
2.4.2 方法重现性 实验选取北极贝样品进行添加实验,添加量为10 μg/kg,考察了方法一日内的重现性和日间的重现性,实验结果表明,方法的日内和日间重现性较好,相对标准偏差小于10%(n=6),详见表6。
2.4.3 精密度和回收率 分别对空白贻贝进行三个水平的加标实验,每个水平平行测定6次,计算回收率及相对标准偏差。选取纯水代替试样,按照上述步骤进行空白实验。四种毒素在三个水平的添加回收率范围均在75.6%~94.1%之间,RSD均小于10%(n=6),满足分析的要求,详见表7。

表6 方法的日内和日间重现性(n=6)

表7 贻贝基质中四种贝类毒素的回收率和精密度实验结果(n=6)
2.5 实际样品测定
采用已建立的方法,对在广东局辖区口岸提供的北极贝、牡蛎、象拔蚌和贻贝共20份样品进行四种贝类毒素的本底测定,发现8个阳性样品,其中8个为SPX1检出,含量在18.1~55.3 μg/kg之间;其中2个同时有AZA1检出,含量在3.5~6.6 μg/kg之间,均低于欧盟限量要求。
3 结论
本方法采用QuEChERS 净化技术结合高效液相色谱-高分辨飞行时间质谱法快速测定食用贝类产品中4种脂溶性贝类毒素软海绵酸(OA)、原多甲藻酸(AZA1)、鳍藻毒素(DTX1)、螺环内酯毒素(SPX1)。高分辨质谱与QuEChERS 净化技术相结合,灵敏度高,操作简便,能有效去除基质中的各种干扰杂质。方法线性良好,回收率、精密度均能满足进出口贝类产品中脂溶性贝类毒素分析的需要。本方法的建立将有助于认识受污染贝类的脂溶性毒素组分,提高对相关贝类毒素的分析能力,对于保障水产安全以及消费者的人身健康具有重要的现实意义。
[1]谭志军,吴海燕,郭萌萌,等. 脂溶性贝类毒素安全评价与检测技术研究进展[J]. 中国水产科学,2013(2):467-479.
[2]吴小松,姜雪. 麻痹性贝类毒素的检测方法[J]. 科技风,2009(20):194.
[3]EFSA. Statement on further elaboration of the consumption figure of 400g shellfish meat on the basis of new consumption data1[J]. EFSA J. 2010,8(8):1706,1-20.
[4]余新天,黄海燕,付英斌,等. 贝类毒素昆明种小鼠生物测定法建立[J]. 中国公共卫生,2009,05:590-591.
[5]黄海燕,付英斌,赵昆山,等. 麻痹性贝类毒素细胞检测法的建立[J]. 中国卫生检验杂志,2010,04:779-781.
[6]李爱峰,于仁成,李钧,等. 利用蛋白磷酸酶活力抑制法检测牡蛎体内的腹泻性贝毒[J]. 分析化学,2006,03:283-287.
[7]Nadia T,Driss M,Hamid T,et al. Purification and patial characterization of paralytic shellfish poison-binding protein from Acanthocardia tuberculatum[J].Toxicon,2007,(50):311-321.
[8]韩深,王珮玥,刘萤,等. QuEChERS净化技术结合超高效液相色谱-串联质谱法筛查食用贝类中的3种原多甲藻酸贝类毒素[J]. 色谱,2013,(10):939-945.
[9]EFSA.Summary on regulated marine biotoxins-Scientific Opinion of the Panel on Contaminants in the Food Chain.[J]. EFSA J. 2009,(1306):1-23.
[10]EN 16204-2012 Foodstuffs-Determination of Lipophilic Algal Toxins(Okadaic Acid Group Toxins,Yessotoxins,Azaspiracids,Pectenotoxins)in Shellfish and Shellfish Products by LC-MS/MS;German version EN 16204:2012.
[11]闫震,聂继云,徐国锋,等. 超高效液相色谱-串联质谱法对比4种净化方式对不同色素含量基质中19种农药残留检测的影响[J]. 分析测试学报,2014,09:1000-1009.
[12]罗辉泰,黄晓兰,吴惠勤,等. QuEChERS/液相色谱-串联质谱法同时测定鱼肉中30种激素类及氯霉素类药物残留[J].分析测试学报,2011,(12):1329-1337.
[13]SANCO/12495/2011. Method Validation and Quality Control Procedures for Pesticide Residues Analysis in Food and Feed[S].EU:2011.
Determination of four lipophilic shellfish toxins in edible shellfishes by QuEChERS technology combined with high performance liquid chromatography-high resolution time of flight mass spectrometry
ZENG Guang-feng1,2,LIU Qing1,2,*,WANG Zhi-yuan1,2,DING Bo1,2,CHEN Wen-rui1,2,WEI Xiao-qun1,2,LI Wen-bin3,HU Zhi-ling3,HAN Shen4
(1.Inspection & Quarantine Technology Center of Guangdong Entry-Exit Inspection and Quarantine Bureau,Guangzhou 510623,China;2. Guangdong Key Laboratory of Import and Export Technical Measures of Animal,Plant and Food,Guangzhou 510623,China;3.Dikma Technology Ltd.,Beijing 100029,China;4.Inspection & Quarantine Technology Center of Beijing Entry-Exit Inspection and Quarantine Bureau,Beijing 100026,China)
A determination method of four lipophilic shellfish toxins(Okadaic Acid,OA;Spirolides1,SPX1;Dinophysistoxin1,DTX1;Azaspiracid1,AZA1)in edible shellfish products by QuEChERS technology combined with high performance liquid chromatography-high resolution time of flight mass spectrometry(HPLC-TOF-MS/MS)was established. QuEChERS technology was used to extract and purify the samples. Four lipophilic shellfish toxins were separated by C18column and detected by HPLC-TOF-MS/MS at electrospray ionization(ESI)mode. After importing data by PeakView software,TOF-MS/MS quality precision,isotopic distribution and retention time of each compounds,as well as the MS2chromatogram of the standard solution and sample were compared to qualitatively analyze the target compound. Finally,the software of MultiQuant was used to quantify by external standard calibration method.The calibration curves of OA and DTX1 showed good linearity in the range of 2.0~100 μg/L,the limits of detection(LOD,S/N=3)were 10 μg/kg,while the LOD of AZA1and SPX1 were 2.0 μg/kg,the ranges were between 0.5~20 μg/L.The correlation coefficients(R2)were all above 0.997.The average spiked recoveries of four shellfish toxins at three concentration levels were between 75.6%~94.1%,and RSD all below 10%. 20 import & export samples including mussel,octopus,geoduck and oyster were screened by the developed method,SPX1 was found in 8 samples and AZA1 in 2 samples. The developed method was easy,quick,sensitive,reproducible and suitable for the determination of lipophilic shellfish toxins in shellfish products.
high performance liquid chromatography-high resolution time of flight mass spectrometry;QuEChERS;lipophilic shellfish toxins;edible shellfish products
2015-03-23
曾广丰(1988-),男,本科,助理工程师,研究方向:食品安全与检测,E-mail:zgf621@126.com。
*通讯作者:刘青(1971-),女,硕士,高级工程师,研究方向:食品安全与检测,E-mail:liuq@iqtc.cn。
广东检验检疫局科技计划项目(2012GDK38);国家质检总局科技计划项目(2011k193)。
TS254.4
A
1002-0306(2015)21-0289-06
10.13386/j.issn1002-0306.2015.21.051

