胆汁酸的作用与分子调控机制
徐运杰,汪前红(.三河湘大骆驼饲料有限公司,河北三河 060;.唐人神集团人力资源部,湖南株洲 4000)
胆汁酸的作用与分子调控机制
徐运杰1,汪前红2
(1.三河湘大骆驼饲料有限公司,河北三河101601;2.唐人神集团人力资源部,湖南株洲412000)
摘要:胆汁酸不仅能够促进肠道中胆固醇、脂质和脂溶性维生素的吸收,而且还是一个重要的信号调节分子,能够激活肝脏和胃肠道细胞中特异性核受体、G蛋白偶联膜受体以及细胞信号传导通路,从而改变和调控胆汁酸、葡萄糖、脂肪酸和脂蛋白质的合成、代谢和运输以及能量代谢相关酶的基因表达。文章详细论述了胆汁酸的作用以及胆汁酸作为信号分子的调控机制。
关键词:胆汁酸;法尼酯X受体;成纤维细胞生长因子19;胰高血糖素样肽-1;G蛋白偶联膜受体
胆汁酸是肝脏细胞内胆固醇的一种代谢产物,对脂质代谢具有重要的作用。由于人们对养殖效益的追求,在饲养过程中添加促生长的抗生素和大量的脂肪、使用霉变原料(如玉米、DDGS等)以及高密度集约化饲养,使动物肝脏负担过大,从而导致肝脏疾病的发生,如脂肪肝、肝硬化、肝中毒等疾病,这些疾病致使肝脏分泌胆汁酸减少甚至不能分泌,继而引起脂肪代谢障碍,常表现为脂肪泻、消瘦、生长迟缓等,严重影响经济效益。胆汁酸或其类似物作为饲料中一种功能性添加剂,为养殖业解决了上述难题,已经被大多数从业者所认可。本文就胆汁酸的作用和生理代谢作以综述。
1 促进脂肪的消化吸收
胆汁酸通过如下3个方面来提高外源性脂肪的利用率,节约能量原料。通过乳化脂肪,扩大与脂肪酶的接触面积。胆汁酸是肝脏细胞分泌的一类弱酸有机物,是含有亲水(羟基和羧基)和亲油(烷基)基团的两性分子,具有表面活性功能,在十二指肠内乳化脂肪,促进脂质和脂溶性维生素的消化吸收。通过调控胰脂肪酶(LPS)和脂蛋白酯酶(LPL)的活性,提高其对脂肪的水解代谢。胆汁酸在肠道内通过调节LPS和LPL两种酶的活性,从而影响脂肪的代谢过程。另外,胆汁酸还通过调控激素敏感脂肪酶(HSL)的活性,减少自体脂肪的分解代谢。而胆汁酸在肠道内转运脂肪,促进脂肪的吸收。胆汁酸作为LPS的辅基,与辅脂酶一起改变胰脂肪酶的结构,暴露其催化基团,对脂肪进行水解。肠腔中脂肪的分解产物(如脂肪酸、甘油一酯等)与胆汁酸结合,形成水溶性复合物。因此,胆汁酸便成了不溶于水的脂肪水解产物到达肠黏膜表面所必需的运载工具。在胆汁酸的协助下,脂肪水解产物经肠上皮细胞吸收进入血液,胆汁酸可以被肠上皮细胞识别,从而使脂肪酸-胆汁酸复合物进入小肠绒毛膜内,促进脂肪的吸收。胆汁酸在将脂肪酸、甘油一酯转运到肠上皮细胞后重新回到肠腔,在回肠被重吸收进入肝脏,完成胆汁酸的肝肠循环。胆汁酸的肝肠循环见图1[1]。

图1 胆汁酸的肠肝循环
2 胆汁酸的生理代谢
胆汁酸又称为C24类甾醇类,是在肝实质细胞中由胆固醇合成的两性分子。游离胆汁酸主要有鹅去氧胆酸(CDCA)和胆酸。胆汁酸在肝实质细胞中合成后,分泌进入胆管。由于不能透过顶膜以及胆管上皮细胞和肠上皮细胞之间的细胞旁路连接,使得胆道中的结合胆汁酸含量较高。在消化过程中,胆汁酸分泌进入肠道,通过酰胺键与牛磺酸和甘氨酸结合,形成完全离子化的带负电荷的极性分子-结合型胆汁酸(甘氨胆酸或牛磺胆酸),结合型胆汁酸是易溶于水的两性分子,在肠道pH环境下可溶性很高,具有强乳化剂功能,能够使肠腔内油脂乳化成微粒,以增加脂质与消化液中脂肪酶的接触面积,促进脂类和脂溶性维生素的消化吸收[2]。
胆汁酸代谢的一个重要方面是肠肝循环,是指胆汁酸分泌进入肠腔后,在小肠末端或回肠,通过门静脉血再回流进入肝脏。对于成年人,胆汁酸池约2 g,每天通过肠肝循环12次,约95%的胆汁酸再回流入肝脏,另外5%的胆汁酸主要以胆固醇的形式通过粪便排出。在肠道中,结合型胆汁酸在小肠末端肠道细菌的作用下,与牛磺酸和甘氨酸解离,形成次级胆酸。因此,回肠末端的胆汁酸以结合型胆酸和游离型胆酸的混合形式存在。结合型胆酸在小肠前端几乎不能被吸收,但在回肠中能够被顶端钠依赖型胆汁酸转运蛋白有效的吸收,一旦被回肠上皮细胞吸收后,胆汁酸与回肠胆汁酸结合蛋白(IBAT)结合,在异源二聚体有机溶质转运蛋白α和β (OSTα和OSTβ)的参与下,被运送到基底膜,进入肝脏门脉循环,最后主要被Na+/牛磺酸胆盐协同转运多肽(NTCP)主动吸收,回流进入肝实质细胞[3]。
3 胆汁酸的受体和信号通路
有研究发现,胆汁酸不仅能够促进脂质和脂溶性维生素的消化吸收,而且还是重要的信号分子。胆汁酸是核受体-法尼酯X受体(FXR)的自然配体,FXR是核受体超级家族中一员,主要在肝脏、肾脏、肠道和肾上腺中表达。胆汁酸如胆酸、脱氧胆酸和石胆酸能够激活FXR。早期研究表明,FXR是主要的胆汁酸感受器,其涉及到胆汁酸代谢的各个方面,包括胆汁酸的合成、转运、解毒和在肠肝中的排泄。胆汁酸的合成是一个非常严格的调控过程,任何破坏都会导致肝脏和胆道的代谢紊乱,如胆汁淤积和肝纤维化。因此,FXR的激活是胆汁酸合成调控的关键控制机制。FXR的激活能够有效的抑制胆固醇7α羟化酶的表达,胆固醇7α羟化酶是胆汁酸合成的限速酶,通过调控胆汁酸合成相关基因(如胆固醇7α羟化酶-CYP7A1)、吸收相关基因(如Na+/牛磺酸协同转运多肽和有机阴离子转运多肽2/8)和输出相关基因(胆盐输出泵和多药耐药相关蛋白2)的表达来维持肝实质细胞中胆汁酸的动态平衡。此外,石胆酸能够激活核受体[如孕烷X受体(PXR)和维生素D受体(VDR)],调控石胆酸的代谢和脱毒。
FXR的另一个信号通路就是通过相关细胞因子[如成纤维细胞生长因子(FGF)]的负反馈机制抑制肝细胞中胆汁酸的合成。Kim等和Potthoff等利用鼠研究发现,FXR能够刺激鼠肠道中FGF15和人类同源基因FGF19的转录[4-5]。Kim等研究表明,无论是敲除肝脏中的FxrL,还是敲除肠道中的FxrIE,都能增加胆汁酸池的面积。然而,用FXR选择性颉颃剂-GW4064分别处理FxrL鼠和FxrIE鼠发现,GW4064能够显著抑制FxrL鼠体内胆汁酸合成相关基因CYP7A1的表达(P<0.05),但对FxrIE鼠没有显著影响(P>0.05)。说明CYP7A1基因表达的抑制主要受肠道而不是肝脏中FXR激活的调控[4]。Modica等研究发现,选择性激活肠道FGF15能够保护肝脏,从而防止胆汁淤积[6]。通过FXR诱导,肠道FGF19的分泌主要发生在回肠远端的肠上皮细胞区域,因为该区域的胆汁酸转运载体表达最为丰富[3]。目前,关于肠上皮细胞中FXR-FGF19轴的组织特异性分布和分子调控机制尚不明确,需要更进一步的研究。
FGF19的受体是FGF受体4(FGFR4),其在肝脏中表达很丰富。FGFR4缺乏的鼠与正常鼠相比,胆汁酸池更多。Potthoff等研究表明,通过FG⁃FR4激活细胞中的FGF19信号,还需要辅助受体β-Klotho,这种辅助受体基因的组织特异性表达是FGF19反应的重要决定因素[7]。医药界已用消胆胺和FXR配体CDCA证实了FGF19在人体胆汁代谢中的作用。病人服用消胆胺后,血清中7α-hydroxy⁃cholest-4-en-3-one(C4,一种表示CYP7A1激活的标记物)增加,血浆中FGF19水平减少,然而,病人用CDCA处理后,增加了血浆中FGF19水平,降低了血清中的C4含量[8]。Jain等用全肠外营养(TPN)新生仔猪研究表明,TPN能够显著降低FGF19的循环浓度(P<0.05),反之,十二指肠灌注CDCA能够显著诱导FGF19的分泌(P<0.05),这说明肝脏病理与TPN相关,CDCA灌注能够改善肝脏功能。肠外营养相关的肝脏疾病如胆汁淤积和脂肪变性,也许就是肠外营养导致FGF19分泌减少所致[9]。总之,FGF19是一种反馈抑制胆汁酸合成的重要的肠肝信号。
此外,FGF19在调控葡萄糖、蛋白质和脂质代谢方面也具有相当重要的作用[7, 10]。Kir等研究表明,FGF19能够诱导肝糖元和蛋白质的合成,同时抑制糖异生作用[11]。关于FGF19对肝脏脂质代谢的影响机制尚不完全清楚,可能是通过增加脂肪酸的氧化,抑制甘油三酯的合成,从而减少肝脂肪变性。
另外一个重要的胆汁酸受体就是G蛋白偶联膜受体(GPCR)。TGR5也叫G蛋白偶联胆汁酸受体1 (GPBAR 1)或GPR131。TGR5受体是一种细胞表面胆汁酸受体,是GPCR视紫红质样超级家族中的一员。脱氧胆酸、胆汁酸和CDCA的结合型或游离型都可以激活TGR5受体,而石胆酸是TGR5受体最有效的天然颉颃剂。TGR5受体mRNA的转录表达在胆囊中最丰富,在褐色脂肪、肝脏和肠道中较少。TGR5受体的激活,对于胆囊的收缩、填充、能量代谢和保肝利胆具有重要的作用[12]。另外,Parker等研究表明,胆汁酸还能够刺激离体回肠胰高血糖素样肽-1(GLP-1)的分泌[13]。GLP-1作为主要的肠降血糖素,食后能够刺激胰岛素分泌,抑制胰高血糖素分泌和肝脏糖元的异生,降低胃排空速率和食欲,从而提高机体对胰岛素的敏感性,提高血糖清除率。Thomas等对TGR5基因破坏或超表达鼠的研究表明,胆汁酸能够缓解饲喂高脂肪日粮鼠的葡萄糖不耐受和代谢功能障碍[14]。此外,肠腔中胆汁酸还可诱导肠内分泌细胞分泌其他肠激素(如GLP-2和肽YY),从而调控肠道局部的生理代谢[9]。Ipharraguerre等对早期断奶仔猪的研究表明,胆汁酸可以加强诱导GLP-2的分泌,但对断奶后仔猪肠道的生长、形态和炎症并无改善[15]。Gupta等报道,胆汁酸能够激活原代肝细胞中与下调胆固醇7α羟化酶(CYP7A1)和胆汁酸合成相关的c-jun N-末端激酶(JNK)1/2信号转导通路[16]。脱氧胆酸可以激活肝实质细胞和胃肠系统上皮细胞中的表皮生长因子受体[17-18]。
在实际应用中,胆汁酸通过FXR和GPCR作为重要的信号分子,推动了药理学的发展。6-乙基鹅去氧胆酸(INT-747)临床上用来保护肝脏、防止肝胆汁淤积和纤维化[19]。另一个是INT-777,临床上用作诱导GPL-1的分泌,保护高脂肪日粮所导致的代谢功能障碍[20]。此外,半合成的INT-747硫酸酯衍生物INT-767能够防止鼠的慢性胆管疾病[21]。
4 胆汁酸的生物合成途径
肝脏中有两条胆汁酸的生物合成途径,一条主要途径和一条替代途径。主要途径由位于肝实质细胞滑面内质网上的CYP7A1和细胞色素P450启动。胆固醇的7α-羟化是胆汁酸生物合成主要途径的限速步骤。此途径中,胆汁酸和鹅去氧胆酸的比率,受甾醇12α-羟化酶(CYP8B1)的控制。参与胆汁酸生物合成的酶除了位于肝实质细胞的滑面内质网上外,还位于线粒体、过氧化物酶体和细胞质中[22]。
胆汁酸生物合成的替代途径由线粒体上的甾醇27-羟化酶(CYP27A1)启动,其限速步骤是胆固醇运输到线粒体膜内。除了胆汁酸的生物合成外,替代途径产生的27-羟基胆固醇和25-羟基胆固醇能够调节氧化型胆固醇,从而维持肝脏和其他组织中胆固醇和脂肪的动态平衡[23]。肝脏中胆汁酸合成途径见图2。
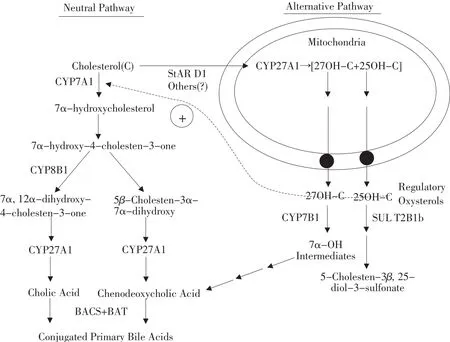
图2 肝脏中胆汁酸合成途径
5 结语
胆汁酸是胆固醇的代谢终产物,体内存在多种复杂机制调节胆汁酸代谢。胆汁酸是胆汁的重要成分,在脂肪代谢中起着重要作用。胆汁酸主要存在于肠肝循环系统,并通过再循环以达到对动物机体的保护作用。同时,胆汁酸还是FXR、PXR、VDR和GPCR等许多受体的天然配体,调节胆汁酸代谢相关的酶类和转运蛋白基因的表达,调节胆汁酸水平,能够激活肝脏和胃肠道细胞中相应受体和细胞信号传导通路,从而改变和编码调控胆汁酸、葡萄糖、脂肪酸和脂蛋白质的合成、代谢、运输以及能量代谢的相关酶的基因表达。正因为胆汁酸具有如此重要的生理生化功能,在实际生产中,应该合理选择饲料原料,不能为了减少成本而选用发霉变质的原料;合理配制日粮,使能量、蛋白质、脂肪、碳水化合物等配比适当,特别是矿物质和维生素,不能过多,亦不能过少,以达到保肝利胆,提高机体免疫力,降低料肉比,从而达到提高经济效益的目的。
[参考文献]
[1] Duane W C. Bile acids: developments new and very old[J]. J Lipid Res, 2009, 50(8): 1 507-1 508.
[2] Huang C, Guo Y, Yuan J. Dietary taurine impairs intestinal growth and mucosal structure of broiler chickens by increasing toxic bile acid concentrations in the intestine[J]. Poult Sci, 2014, 93(6): 1 475-1 483.
[3] Dawson P A, Hubbert M L, Rao A. Getting the mOST from OST: Role of organic solute transporter, OSTalpha-OSTbeta, in bile acid and steroid metabolism[J]. Biochim Biophys Acta, 2010, 1 801(9): 994-1 004.
[4] Kim I, Ahn S H, Inagaki T, et al. Differential regulation of bile ac⁃id homeostasis by the farnesoid X receptor in liver and intestine [J]. J Lipid Res, 2008, 48(12): 2 664-2 672.
[5] Potthoff M J, Potts A, He T T, et al. Colesevelam suppresses hepat⁃ic glycogenolysis by TGR5-mediated induction of GLP-1 action in DIO mice[J]. Am J Physiol Gastrointest Liver Physiol, 2013, 304(4): 371-380.
[6] Modica S, Petruzzelli M, Bellafante E, et al. Selective activation of nuclear bile acid receptor FXR in the intestine protects mice against cholestasis[J]. Gastroenterology, 2012, 142(2): 355-365.
[7] Potthoff M J, Kliewer S A, Mangelsdorf D J. Endocrine fibroblast growth factors 15/19 and 21: From feast to famine[J]. Genes Dev, 2012, 26(4): 312-324.
[8] Lundasen T, Galman C, Angelin B, et al. Circulating intestinal fi broblast growth factor 19 has a pronounced diurnal variation and modulates hepatic bile acid synthesis in man[J]. J Intern Med, 2006, 260(6): 530-536.
[9] Jain A K, Stoll B, Burrin D G, et al. Enteral bile acid treatment im⁃proves parenteral nutrition-related liver disease and intestinal mucosal atrophy in neonatal pigs[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302(2): 218-224.
[10] Thomas C, Pellicciari R, Pruzanski M, et al. Targeting bile-acid signalling for metabolic diseases[J]. Nat Rev Drug Discov, 2008, 7 (8): 678-693.
[11] Kir S, Beddow S A, Samuel V T, et al. FGF19 as a postprandial, insulin-independent activator of hepatic protein and glycogen syn⁃thesis[J]. Science , 2011, 331(6 024): 1 621-1 624.
[12] Li T, Holmstrom S R, Kir S, et al. The G protein-coupled bile ac⁃ id receptor, TGR5, stimulates gallbladder filling[J]. Mol Endocri⁃nol, 2011, 25(6): 1 066-1 071.
[13] Parker H E, Wallis K, Roux C W, et al. Molecular mechanisms un⁃derlying Bile acid-stimulated glucagon-like peptide-1 secretion [J]. Br J Pharmacol, 2012, 165(2): 414-423.
[14] Thomas C, Gioiello A, Noriega L, et al. TGR5-mediated bile acid sensing controls glucose homeostasis[J]. Cell Metab, 2009, 10(3): 167-177.
[15] Ipharraguerre I R , Tedó G, Menoyo D, et al. Bile Acids Induce Glucagon-Like Peptide 2 Secretion with Limited Effects on Intes⁃tinal Adaptation in Early Weaned Pigs[J]. J Nutr, 2013, 143(12): 1 899-1 905.
[16] Gupta S, Stravitz R T, Dent P, et al. Downregulation of cholesterol 7-alpha-hydroxylase(CYP7A1)gene expression by bile acids in primary rat hepatocytes is mediated by the c-Jun N-terminal ki⁃nase pathway[J]. J Biol Chem, 2001, 276(19): 15 816-15 822 .
[17] Rao Y P, Studer E J, Stravitz R T, et al. Activation of the Raf-1/ MEK/ERK cascade by bile acids occurs via the epidermal growth factor receptor in primary rat hepatocytes[J]. Hepatology, 2002, 35 (2): 307-314 .
[18] Werneburg N W, Yoon J H, Higuchi H, et al. Bile acids activate EGF receptor via a TGF-dependent mechanism in human cholan⁃giocyte cell lines[J]. Am J Physiol Gastrointes Liver Physiol, 2003, 285(1): 31-36.
[19] Cipriani S, Mencarelli A, Chini M G, et al. The bile acid receptor GPBAR-1(TGR5)modulates integrity of intestinal barrier and immune response to experimental colitis[J]. PLoS One, 2011, 6 (10): 25637.
[20] Genet C, Strehle A, Schmidt C, et al. Structure-activity relation⁃ship study of betulinic acid, a novel and selective TGR5 agonist, and its synthetic derivatives: Potential impact in diabetes[J]. J Med Chem, 2010, 53(1): 178-190.
[21] Baghdasaryan A, Claudel T, Gumhold J, et al. Dual farnesoid X re⁃ceptor/TGR5 agonist INT-767 reduces liver injury in the Mdr2-/-(Abcb4-/-)mouse cholangiopathy model by promoting biliary HCO(-)(3)output[J]. Hepatology, 2011, 54(4): 1 303-1 312.
[22] Lundell K, Wikvall K. Species-specifi c and age-dependent bile acid composition: aspects of CYP8B and CYP4A subfamilies in bile acid biosynthesis[J]. Curr Drug Metab, 2008, 9(4): 323-331. [23] Chen W, Chen G, Head D L, et al. Enzymatic reduction of oxyster⁃ols impairs LXR signaling in cultured cells and the livers of mice [J]. Cell Metab, 2007, 5(1): 73-79.
Effect of Bile Acid and Molecular Regulation Mechanism
XU Yunjie1, WANG Qianhong2
(1. Sanhe Xiangda Luotuo Feed Co., Ltd., Sanhe 101601, Hebei China; 2. Human Resources Department, Tangrenshen Group, Zhuzhou 412000, Hunan China)
Abstract:Bile acid can not only promote the absorption of cholesterol, lipid and fat soluble vitamins in the in⁃testine, but aslo bile acid is an important signaling regulatory molecule. It has been discovered to activate specific nuclear receptors, G protein coupled receptor and cell signaling pathways in cells in the liver and gastrointestinal tract, so as to alter the expression of numerous genes encoding enzyme/proteins involved in the regulation of bile ac⁃id, glucose, fatty acid, lipoprotein synthesis, metabolism, transport and energy metabolism. The effect of bile acid and its molecular regulation mechanism were discussed in detail in this paper.
Key words:bile acid; farnesoid X receptor; fibroblast growth factor 19; glucagon-like peptide-1; G protein coupled membrane receptor
作者简介:徐运杰(1980-),男,湖南邵阳人,硕士,主要从事饲料配方的研究。
收稿日期:2014-12-22
中图分类号:R657.3;S816.7
文献标志码:A
文章编号:1001-0084(2015)01-0021-05

