紫外诱变筛选低自溶高产2,3-丁二醇的地衣芽孢杆菌突变子*
郭文逸,潘学玮,尤甲甲,杨洪江
(天津科技大学生物工程学院工业微生物教育部重点实验室,天津市工业微生物重点实验室,天津,300457)
微生物具有生产2,3-丁二醇的能力,其中肺炎克雷伯氏菌为常用的生产菌株,但该菌株为条件致病菌,不利于大规模工业化生产[1]。地衣芽胞杆菌属于GRAS(generally recognized as safe)菌株,具有生长繁殖迅速、代谢快、产生多种蛋白酶等特点,利于产物的快速生成,并且它能够产生芽孢,抗逆性强[2],所以近年来有越来越多关于地衣芽孢杆菌产2,3-丁二醇的报道。
在前期实验中,筛选到1株地衣芽孢杆菌BL41[3]。发酵后期,发酵液的 OD600值逐渐下降,且逐渐变黏稠,与之相对应,2,3-丁二醇的合成能力逐步下降。本文通过分析胞外多糖、聚谷氨酸产量以及细菌数量的变化,最终发现此现象主要由细胞自溶引起。因此推测,如果发酵后期细胞自溶水平下降,即可防止菌株生物量快速减少,2,3-丁二醇产率增加,从而提高2,3-丁二醇的产量。因此对该菌株进行紫外诱变,在筛选平板中获得自溶水平低的突变株,进而筛选得到高产2,3-丁二醇的菌株。
1 材料与方法
1.1 培养基
LB培养基(g/L):酵母粉5,蛋白胨10,NaCl 10。MR-VP 培养基(g/L):蛋白胨7,葡萄糖5,K2HPO45。种子培养基(g/L):葡萄糖40,酵母粉10,硫酸铵1,K2HPO41。发酵培养基(g/L):葡萄糖100,酵母粉5,蛋白胨 12,MnSO40.025,K2HPO43,MgSO40.2,乙酸钠5。上述培养基pH值均为7.0,除LB培养基121℃灭菌20 min外,其余培养基均为115℃灭菌20 min。
自溶检测培养基:将菌株BL41单菌落接种于600 mL的液体LB培养基中,37℃,220 r/min培养3~4 h,菌体浓度达到108,100 ℃煮1 h,杀死细胞,于4 000 r/min离心10 min,弃去上清液,将菌体细胞加到200 mL无菌的LB琼脂培养基中制备平板,用于筛选自溶水平低的突变株[4]。
1.2 实验方法
1.2.1 胞外多糖和聚谷氨酸的测定
以葡萄糖为标准,绘制葡萄糖标准曲线。利用醇沉法沉淀发酵液中多糖,沉淀重悬制成多糖溶液,采用苯酚硫酸法测定其胞外多糖产量[5]。
采用生物传感仪测定发酵液水解前后谷氨酸含量,其差值为 γ-聚谷氨酸的产量[6]。
1.2.2 菌株生物量的测定
将单菌落进行两级种子培养后,按5%的接种量转接到30 mL发酵培养基中,37℃,160 r/min培养,选取不同时间点取样,稀释10-6后涂布于LB平板上,37℃培养12 h,然后记录菌落数。
1.2.3 紫外诱变筛选高产2,3-丁二醇菌株
将菌株BL41紫外诱变[3]后避光培养24 h,然后取100 μL转接于新鲜LB中,37℃,220 r/min培养,每隔12 h转接1次,转接30代后将其稀释涂板,避光培养48 h后观察菌落周围透明圈大小。选取自溶水平低的突变株进行肌酸比色实验,从而获得高产乙偶姻菌株[4]。将上述菌株分别进行两级种子培养后接种于初始葡萄糖质量浓度分别为100、120、140、160 g/L的发酵培养基中,利用气相色谱法分别测定36、42、48 h 时2,3-丁二醇产量,从而筛选高产 2,3-丁二醇菌株。
1.2.4 四联发酵罐的分批补料实验
为进一步确定突变株的生产能力,在四联发酵罐中进行分批补料发酵,菌种经过两级种子培养后按5%接种量接入600 mL的发酵培养基中,培养温度为37℃,通气量2 vvm。前期转速为400 r/min,14 h后降低为200 r/min。通过补加一定量的葡萄糖,残糖浓度维持在30 g/L左右。初始pH为7.0,随着发酵的进行,pH会先下降然后再上升,当pH上升到6.5时,补加氨水使其降到6.0。
1.2.5 分析检测方法
利用紫外分光光度计测定OD600。发酵上清液过膜后,稀释100倍利用生物传感仪测定葡萄糖浓度。发酵上清液过膜后,稀释10倍利用气相色谱法测定2,3-丁二醇和乙偶姻含量[3]。
2 结果
2.1 细胞自溶导致生物量下降
地衣芽孢杆菌BL41在发酵过程中发酵液变黏稠,推测为其产生了胞外多糖或γ-聚谷氨酸。然而苯酚硫酸法结果显示,发酵液中胞外多糖的含量仅为1.0 g/L,含量较低。因此,这不是发酵液黏稠的主要原因。通过生物传感仪测定发酵液及其水解样品中谷氨酸含量,结果显示均为0.2 g/L,说明发酵液中无γ-聚谷氨酸产生,这也不是引起发酵液黏稠的原因。
进一步推测地衣芽孢杆菌BL41在发酵中存在细胞自溶现象,导致OD600值显著下降和胞内核酸和蛋白质等大分子释放到培养基中,使发酵液变黏。琼脂糖凝胶电泳结果显示,12 h的发酵上清液中没有DNA条带产生,此时细胞处于对数期,没有显著自溶现象发生,无大分子物质泄露到细胞外;而随着发酵的进行,在24 h和48 h的样品中,均出现大于15 kb的DNA条带,特别是36 h样品中的DNA数量要显著多于24 h的样品,且伴随明显的DNA降解现象(图1)。
同时,采用涂板方法直接测定地衣芽孢杆菌BL41的生物量。发酵前期,细菌数量逐渐增加,12 h时达到最高,菌浓为3.9×109CFU/mL。随后,细菌数量开始下降,至发酵结束时,细菌细胞数减少了48.7%(图2)。
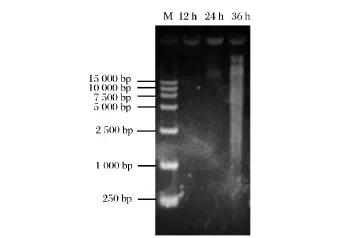
图1 细胞自溶产生的胞外DNAFig.1 Extracellular DNA produced by autolysis
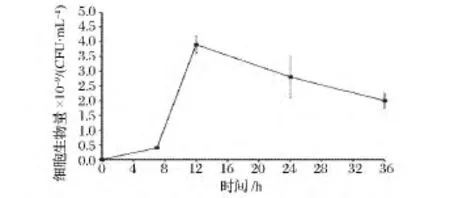
图2 发酵过程中B.licheniformis BL41生物量Fig.2 Cell biomass of B.licheniformis BL41 during fermentation process
2.2 紫外诱变筛选自溶水平低的突变株
由上述结果得出,发酵后期,细胞大量死亡,导致生产2,3-丁二醇的生物量减少,从而降低2,3-丁二醇的生成。Nagraj以冻干细胞为底物,设计自溶筛选平板,通过观察自溶圈大小,获得不产自溶素的菌株[4]。然而冷冻干燥法耗时过长,获得细胞干粉量较小,因此本文对其进行改造。
菌株BL41的细胞加热死亡后,以死细胞及细胞碎片作为底物加入到LB琼脂培养基中,倒平板备用。将菌液稀释后均匀涂布于上述平板,观察菌落周围透明圈大小。如图3所示,中间白色部分为单菌落,而菌落周围的黑色部分则为自溶素裂解细胞产生的透明圈,其中图(A)和(B)分别表示出发菌株和突变菌株的自溶圈,两菌落直径大小相似,然而明显可以看出,出发菌株的透明圈较大。
透明圈直径与菌落直径之比可以表征菌株自溶水平高低,比值越高说明自溶水平越高。通过紫外诱变的方法,获得自溶水平低的突变株。在自溶筛选平板上共得到220株突变子,其中61株突变子的透明圈直径/菌落直径比值小于出发菌株1.57,结果如表1所示。
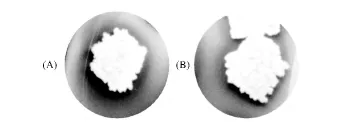
图3 筛选平板上菌落周围的透明水解圈Fig.3 Transparent zones around the colonies on the screen plate

表1 突变子的相对自溶水平分析Table 1 Analysis of the relative autolysis level of the mutants
2.3 肌酸比色法筛选高产乙偶姻的菌株
将上述31株透明圈直径/菌落直径比值小于1.29的突变子进行肌酸比色实验,分析乙偶姻含量,从而快速大量筛选出高产乙偶姻菌株,减少复筛工作量。其结果如图4所示,菌株 BL41-103,BL41-105,BL41-122,BL41-196,BL41-202,BL41-213,BL41-216的乙偶姻产量最高,均高于出发菌株BL41。
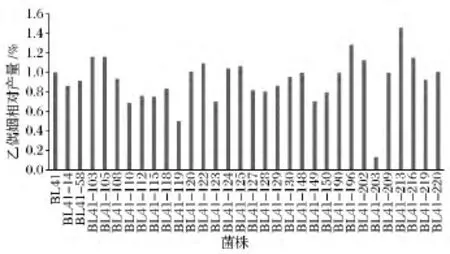
图4 突变子合成乙偶姻的水平Fig.4 Analysis of acetoin production in mutants
2.4 摇瓶发酵筛选高产2,3-丁二醇的菌株
选取乙偶姻产量高的菌株,进一步通过摇瓶发酵分析其2,3-丁二醇产量。然而,不同菌株的葡萄糖利用能力不同,因此采用不同的初始葡萄糖浓度进行发酵。由表2所示,发酵36 h时,除BL41-103外,大部分菌株在100 g/L的初始葡萄糖浓度下获得最高2,3-丁二醇产量,然而随葡萄糖浓度的升高,其产量下降。菌株BL41-213在36 h时2,3-丁二醇产量最高,为54.6 g/L,相比于出发菌株提高了34.2%。
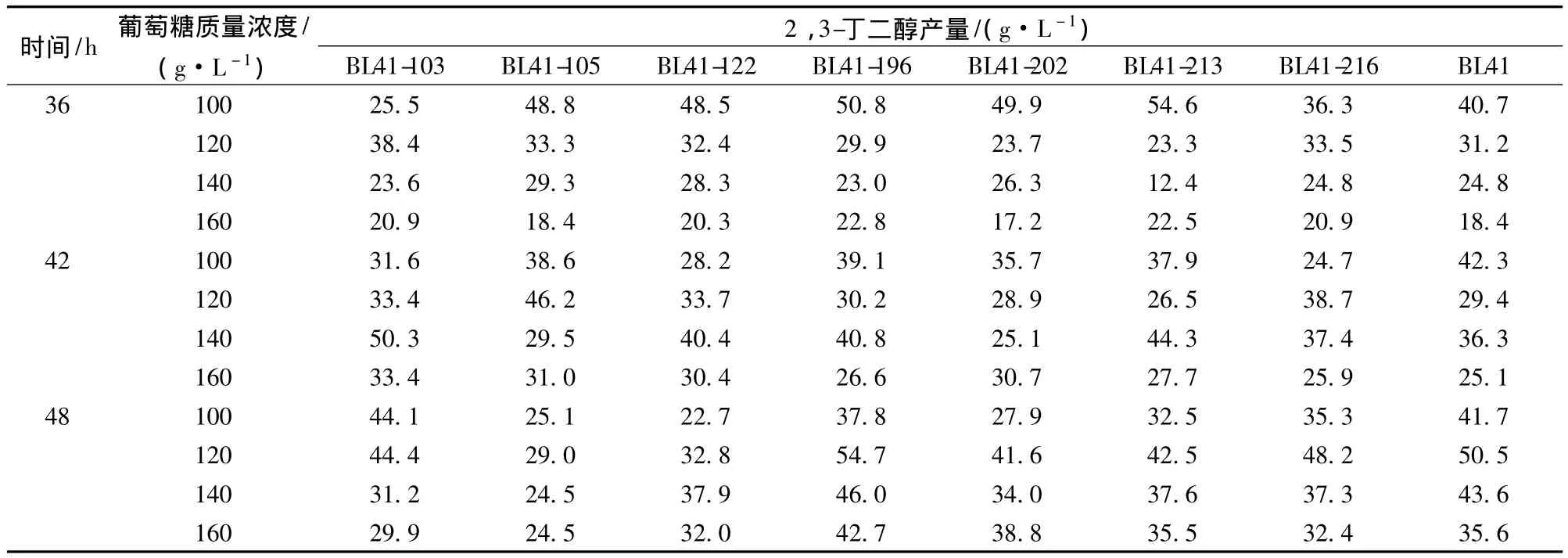
表2 初始葡萄糖质量浓度对2,3-丁二醇产量的影响Table 2 Effect of initial glucose concentration on 2,3-butanediol production
发酵42 h时,在初始葡萄糖质量浓度为100 g/L的情况下,菌株的乙偶姻产量升高,而2,3-丁二醇产量下降。可能是由于培养基中葡萄糖消耗完后,生成的2,3-丁二醇作为储备碳源可逆的转化为乙偶姻。而此时,初始葡萄糖浓度大于100 g/L的培养基中,由于葡萄糖未耗尽,仍有2,3-丁二醇生成,因此其产量均较高。
大部分菌株在120 g/L的初始葡萄糖质量浓度下,发酵48 h获得最大2,3-丁二醇产量。其中菌株BL41-196的2,3-丁二醇的产量达到54.7 g/L,为发酵过程中的最高值。而BL41-103的2,3-丁二醇产量在48 h,初始葡萄糖质量浓度为100 g/L时最高,达到44.1 g/L。
大部分菌株在初始葡萄糖质量浓度为140 g/L和160 g/L时,2,3-丁二醇的产量普遍低于100 g/L和120 g/L时的产量。底物浓度过高,抑制了2,3-丁二醇的生成。
2.5 四联发酵罐发酵筛选高产2,3-丁二醇菌株
为进一步确定突变株的生产能力,对上述3株高产2,3-丁二醇菌株 BL41-103,BL41-196和 BL41-213进行四联发酵罐的扩大培养,并以出发菌株BL41为对照。
由图5(A)所示,发酵前20 h时,4株菌的2,3-丁二醇产量近似相等,此后,2,3-丁二醇产量则出现差别。BL41-103在发酵36 h时即达到最高产量,为60.3 g/L,比出发菌株 BL41提高了25.9%,此后,BL41-103的2,3-丁二醇产量即开始下降。除BL41-103外,其余3株菌的2,3-丁二醇产量均在44 h时达到最高值,其中BL41-196的2,3-丁二醇产量最高,为 65.1 g/L,比出发菌株提高了 36.0%。而BL41-213的产量为56.1 g/L,仅比菌株BL41提高了17.1%。
发酵时间为24 h时,BL41-196的产率达到最高,并且维持1.7 g/(L· h)长达12 h。而BL41-213也在24 h时达到最高产率1.7 g/(L·h),此后,2,3-丁二醇产率则快速下降。BL41-103在28 h时产率为1.7 g/(L·h),并在此产率下维持8 h,发酵36 h后产率则快速下降,因此,BL41-103在较短时间内达到最大2,3-丁二醇产量。BL41在24 h时达到最高产率1.4 g/(L·h),然后,其产率开始下降(图5(B))。
发酵过程中,副产物乳酸和乙偶姻的产量如图6(A、B)所示。发酵后期,2,3-丁二醇产量开始下降,转化为乙偶姻,因此乙偶姻的产量呈逐渐上升趋势,但是整个发酵过程中其产量都低于3 g/L。乳酸的产量则略高,最高达到12 g/L。
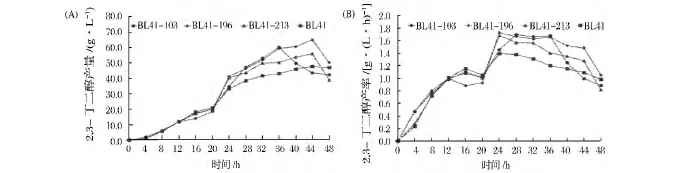
图5 四联发酵罐发酵分析2,3-丁二醇的产量和产率Fig.5 Production and productivity of 2,3-BD for mutant strains in multifors
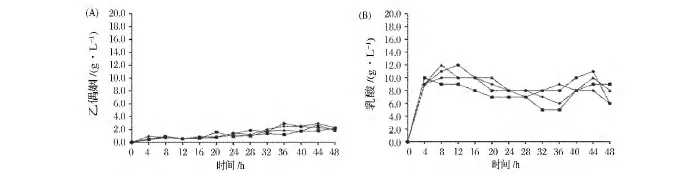
图6 四联发酵罐发酵的副产物产量Fig.6 Production of the byproducts of the mutants in fermentation process with a multifors bioreactor
2.6 突变株生物量的测定
上述发酵进行到20 h后,细胞自溶现象明显,四株菌的OD600均在此时开始下降,其中BL41-103的OD600由14.6下降为12.1。而其余3株菌的OD600则近似相等,均由12.6左右降至11.0左右。同时,由于发酵后期营养成分的不足及副产物的积累,细胞开始死亡,这两种原因导致细胞生物量快速下降。
如图7所示,四株菌在发酵后期细菌数量均下降,其中菌株BL41的细胞死亡率最高,发酵36 h时为36.5%,而另外 3株菌(BL41-103,BL41-196,BL41-213)的死亡率分别为 29.0%,23.5% 和31.0%,均小于出发菌株BL41。菌株BL41-196的细胞死亡率最低,且其最终细菌浓度高于BL41,而该菌株的2,3-丁二醇产量最高,生物量与代谢产物的生成保持一致。BL41-103的细胞死亡率也较低,并且在发酵前期BL41-103的生长速率高于另外三株菌,因此其在短时间内获得较高2,3-丁二醇产量。尽管最终菌株BL41-213细菌数量少于出发菌株,但其细胞死亡率小于出发菌株BL41,因此其2,3-丁二醇产量也略高于出发菌株。
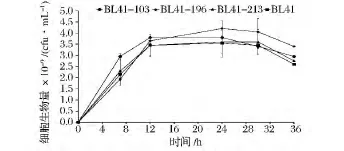
图7 突变株的生物量变化Fig.7 Biomass production of mutant strains during fermentation
3 讨论
地衣芽孢杆菌在植物病害防治、饲料加工、医药开发等多方面具有广泛应用,是非常具有应用价值的菌株[7],其在2,3-丁二醇生产上也有很大潜力。早在1992年,就有研究利用地衣芽孢杆菌生产2,3-丁二醇,发酵72 h后,其2,3-丁二醇的产量为47 g/100 g,为当时的最高产量[8]。而在地衣芽孢杆菌NCIMB 8059中则得到最优培养条件,温度为37℃,pH 为6.0,接种量10 g/L,初始底物浓度30 g/L[9]。
自溶素普遍存在于细菌之中,它参与细菌的生长发育、细胞分离、孢子形成等重要生理活动[10]。自溶现象在芽孢杆菌中也有多种应用,如蜡状芽孢杆菌群中,通过不同pH条件下自溶现象的不同,对其进行分类[11]。在苏云金芽孢杆菌中,利用细胞壁锚定结合性能的自溶素作为运载蛋白,构建芽孢杆菌的表面展示系统[12]。然而,菌体自溶对发酵过程却具有不良影响。乳酸杆菌的高密度培养过程中,由于菌体自溶,活菌数很难达到较高的增殖水平[13]。而且,自溶素对细胞壁的水解作用导致细胞壁破裂出现孔洞,胞内容物,如DNA、RNA等,流失到细胞外[14]。而胞外DNA在菌体表面间起到了粘结作用,致使发酵液变黏[15]。
本研究通过分析发酵后期培养液粘稠现象产生的原因,证实了该菌株在发酵期间细胞自溶现象比较严重。而在金黄色葡萄球菌中,通过转座子Tn917-lacZ随机诱变,获得了2株无法合成自溶素的缺陷型突变株[4]。由于紫外诱变的方法方便简单,因此本文利用紫外诱变筛选自溶水平降低的突变子,并从这些突变子中挑选出乙偶姻合成水平较高的菌株,最终突变子产2,3-丁二醇水平较出发菌株有了明显提高。本研究首次将降低细胞自溶水平、提高发酵过程中生物量和提高2,3-丁二醇产量联系在一起,取得了较好的结果。
4 结论
本研究通过紫外诱变,成功地筛选出自溶水平较低的突变子,并从中进一步筛选出2,3-丁二醇的高产菌株。本研究结果显示,通过降低菌株的自溶水平,增加发酵过程中的生物量,是提高发酵水平的一条重要途径。
[1] 林璐.基于知识图谱的生物制造2,3-丁二醇研究态势分析[J].情报探索,2014(3):28-31.
[2] 张帜,李理想,马翠卿.芽胞杆菌发酵产2,3-丁二醇的研究进展及展望[J].生物加工过程,2014,12(3):79-86.
[3] 郭文逸,孙庆惠,宋丽娜,等.地衣芽孢杆菌高产2,3-丁二醇菌株的选育和发酵研究[J].生物技术通报,2014,8:159-163.
[4] Nagraj M,Philip T.Isolation and characterization of autolysis-defective mutants of Staphylococcas aureus created by Tn917-lacZ[J].Journal of Bacteriology,1993,175(5):1 493-1 497.
[5] 张晓玲,牟光庆.响应面法优化枯草芽孢杆菌产胞外多糖培养基[J].食品工业科技,2012,33(15):133-138.
[6] 缪静,杨在东.碳源对 γ-聚谷氨酸发酵的影响[J].中国酿造,2010(3):70-72.
[7] 唐娟,张毅.地衣芽孢杆菌应用研究进展[J].湖北农业科学,2008,47(3):351 -354.
[8] S.Nilegaonkar.Production of 2,3-butanediol from glucose by Bacillus licheniformis[J].World Journal of Microbiology and Biotechnology,1992,8(4):378 -381.
[9] Perego P.Effects of temperature,inoculum size and starch hydrolyzate concentration on butanediol production by Ba-cillus licheniformis[J].Bioresource Technology,2003,89(2):125–131.
[10] 刘申.细菌自溶素的研究进展[J].中国实用医药,2009,4(12):226 -228.
[11] Raddadi N,Cherif A.The autolytic phenotype of the Bacillus cereus group[J].Journal of Applied Microbiology,2005,99(5):1 070 -1 081.
[12] 邵小虎.苏云金芽胞杆菌自溶素蛋白用于构建表面展示系统的研究[J].武汉:华中农业大学,2009.
[13] 李艾黎,邓凯波,霍贵成.环境因素对酸奶菌株自溶的影响[J].微生物学通报,2008,35(8):1 262-1 267.
[14] 冯镇.乳酸菌自溶影响因素及机理研究[D].哈尔滨:东北农业大学,2003.
[15] 黄炎.胞外DNA在细菌生物膜形成中的作用[J].国际检验医学杂志,2013,34(24):3 380-3 382.
[16] Stomer F C.The pH 6 Acetolactate-forming enzyme from Aerobacter aerogenes:I.kinetic studies[J].Journal of Biological Chemistry,1968,243(13):3 735 -3 739.
[17] ZHANG X,BAO T,RAO Z,et al.Two-stage pH control strategy based on the pH preference of acetoin reductase regulates acetoin and 2,3-butanediol distribution in Bacillus subtilis[J].PLoS One,2014,9(3):91187.
[18] Kaloyan Petrov,Penka Petrova.Enhanced production of 2,3-butanediol from glycerol by forced pH fluctuations[J].Applied Microbiology Biotechnology,2010,87(3):943-949.

