人hDlg蛋白 PDZ结构域的克隆及原核表达与纯化
党育平,袁小英,李 强,刘 玮
人hDlg蛋白 PDZ结构域的克隆及原核表达与纯化
党育平,袁小英,李 强,刘 玮

党育平
目的 探讨人果蝇肿瘤抑制蛋白hDlg的 PDZ结构域在大肠杆菌中的表达与纯化。方法 从HeLa细胞中设计引物克隆含有hDlg PDZ cDNA片段后进行第二轮扩增,并连接至T载体进行测序鉴定,EcoRⅠ和XhoⅠ双酶切后连接至pGEX-6p-1原核表达载体。转化BL21大肠杆菌后37 ℃诱导表达。结果 测序和双酶切鉴定hDlg的PDZ结构域被成功克隆至pGEX-6p-1原核表达载体。37 ℃诱导表达后,大部分GST-PDZ融合蛋白以包涵体的形式存在,部分存在于细菌裂解上清液中。16 ℃诱导表达后,无法检测到目的蛋白的表达。通过GST-beads结合的方式对细菌裂解液进行纯化,可溶性GST-PDZ的蛋白量可以显著提高。结论 通过GST-PDZ诱导表达,再通过GST-beads结合纯化的方式成功表达可溶性的hHlg PDZ结构域。
人乳头瘤病毒;hDlg;PDZ结构域;原核表达
人乳头瘤病毒(human papilloma virus,HPV)是一类分子量较小的无包膜的双链环状嗜上皮性DNA 病毒,主要感染人皮肤或黏膜上皮细胞。在我国HPV引起的生殖器部位感染发病率逐年升高[1]。在妇性,高危型HPV感染主要引发宫颈病变,导致妇女子宫颈部位的细胞恶变,恶变转化后的癌细胞在体内能够形成失控性增生,并可能发生转移[2,3]。目前共有170种不同类型的HPV病毒被分离鉴定[4],但并非所有的HPV感染均引发癌症,只有HPV16 和HVP18具有致癌性[5]。高危型HPV编码3种癌蛋白(E5、E6和E7),其中以E6的致癌作用最为重要,与病毒感染细胞的恶性转化密切相关[6]。近年来的研究发现,高危型HPV E6与一组含有PDZ结构域功能蛋白间的相互作用与其致癌性密切相关[7]。人类的hDlg (human homologue of the drosophila discs large tumor suppressor protein )基因作为一种含有PDZ结构域的蛋白被发现同高危型的HPV E6结合[6,8]。而HPV E6和hDlg PDZ结构域之前的结合也可能成为未来潜在的宫颈癌或HPV感染的治疗位点。本研究尝试克隆hDlg的PDZ结构域,在大肠杆菌中表达纯化和GST融合的PDZ结构域,为未来研究HPV感染的治疗提供基础和新思路。
1 材料与方法
1.1 RNA提取、反转录及聚合酶链反应(PCR)克隆
含有PDZ结构域的人hDIg 蛋白的mRNA通过总RNA提取,使用TRizol 试剂(Invitrogen, Carlsbad, CA, USA),按照试剂说明书进行操作,从本实验室自行保存的HeLa细胞中提取。提取纯化后的RNA经 过RNase-free DNase (Promega, Madison, Wisconsin, USA)处理去除基因组DNA污染,使用 AMV reverse transcriptase(Promega,Madison, Wisconsin, USA),按照说明书混合使用Oligodt和随机六聚脱氧核苷酸(randomhexamer)进行反转录。将反转录产物10倍稀释后用基因特异性引物进行两轮扩增,第1轮扩增所使用引物为上游引物PDZ-F1:ATGCCGGTCCGGAAGCAAGATAC CCAGAGA;下游引物为PDZ-R1:ATGGTTATCA ACAGGCTGAG AAGAAGAGTT;PCR产物为1215 bp。在第1轮扩增完成后,将PCR产物稀释100倍,作为模板,进行第2轮扩增。第2轮PCR扩增使用上游引物为PDZ-F2:AAGAATTCGAAATAAA GCTCATTAAAGGT;下游引物为PDZ-R2:AAGTC GACCTCGAGGGGTTTTGCCACTTTCAAATA;扩增目的片段为261 bp。反转录和PCR扩增所使用仪器为Bio-Rad iCycle(Bio-Rad Laboratories, Hercules, CA, USA)。PCR产物在含有溴化乙锭(EB)的1%琼脂糖(Agarose,购自Sigma,St. Louis, MO,USA)上使用75 V电压运行45 min后,使用ChemiDoc XRS Image System(Bio-Rad)检测PCR产物,图像使用QuantityOne程序(Bio-Rad)摄像,并记录处理。
1.2 含有PDZ结构域的T载体及原核表达载体的构建及鉴定
将第2轮PCR扩增的产物电泳后,使用Wizard PCR& Gel cleanup systerm(Promega)按照说明书操作纯化PCR产物,再按照试剂盒说明书操作连接至pGEM®-T Vector Systems(Promega)后,通过热激法将质粒转化至大肠杆菌DH5α感受态细胞中,使用EcoRⅠ(Promega)和XhoⅠ(Promega)酶切鉴定阳性克隆。
将T载体上的PDZ结构DNA片段用EcoRⅠ和XhoⅠ双酶切回收后,使用T4 DNA连接酶连接至pGEX-6p-1原核表达载体中,用于连接反应的pGEX-6p-1原核表达载体预先使用EcoRⅠ和XhoⅠ酶切。并使用TSAP(Promega)处理脱磷酸以降低假阳性菌落,链接产物按照先前所述用热激法转入大肠杆菌DH5α感受态细胞中[9],其后挑取阳性菌落进行EcoRⅠ和XhoⅠ双酶切鉴定。所有使用的限制性内切酶和TSAP均购自Promega,并按照试剂说明书操作。1.3 GST-PDZ蛋白的原核表达及纯化鉴定
含有PDZ片段的原核表达质粒pGEX-PDZ通过热激法被转化至大肠杆菌BL21表达菌株中。 含有质粒的BL21大肠杆菌于正常的LB(Sigma)培养基上在摇床上以220 r/min在37 ℃培养过夜。然后从过夜培养的细菌中,吸取2 ml菌液,做500倍的稀释后在摇床上以250 r/min培养2~3 h。在培养的过程中,每间隔10 min吸取菌液检测A600值,在A600的数值达到0.8时,按照1 mmol/L的量加入IPTG(Sigma)诱导细菌表达重组蛋白,并在摇床上继续培养3 h。诱导表达时,细菌的培养温度分为37 ℃和16 ℃两种,分别比较两种不同的温度条件下重组蛋白表达产量。
对细菌进行诱导培养后,以10 000 r/min离心菌液,然后使用含有5 mmol/L EDTA(Sigma)pH 7.2的PBS缓冲液重悬,比例为每1.5 ml菌液对应的细菌沉淀使用100 μl PBS缓冲液重悬细菌后,使用超声波裂解仪((Model Q500, QsonicaSonicator Ultrasonic Processor,Newtown, CT,USA),按照输出电压1 000 V rms和20 kHz的频率,以10 s超声波,10 s暂停为1个周期,共裂解6个周期。其后,将细菌裂解液在4 ℃下,按照14 000 g的离心力离心10 min,分为离心沉淀部分与上清部分。分别按照先前的报道与Lameani sample buffer混合后,煮沸10 min变性蛋白,再进行SDS-PAGE[10]。
2 结果
2.1 含有PDZ结构域的T载体及原核表达载体的构建及鉴定
为了克隆完整的PDZ结构域,采用两步法进行克隆,第1对引物克隆一段长度为1215 bp的DNA片段,含有PDZ结构域(图1a)。由于此片段粘端并不能直接克隆至T载体,进一步设计第2对引物,克隆出完整的PDZ结构域DNA片段(261 bp),并且将其连接至T载体上,使用EcoRⅠ和XhoⅠ双酶切鉴定阳性克隆后(图1b),测序验证序列的正确性。再将PDZ结构域的片段从T载体上切下,连接至原核表达载体pGEX-6p-1,酶切检测阳性克隆,其PDZ片段为261 bp(图1c)。
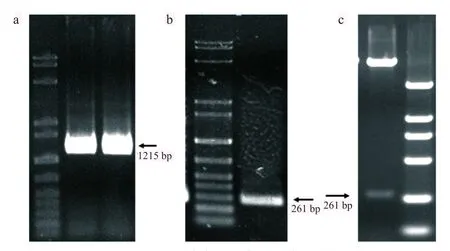
图1 PDZ结构域的克隆与酶切鉴定
2.2 GST-PDZ在大肠杆菌BL21株的表达
成功构建原核表达载体后,原核表达质粒被转入BL21表达菌,分别用正常37 ℃诱导和低温16 ℃诱导的方式检测蛋白表达量,在37 ℃诱导后,细菌自身蛋白的表达明显减少;细菌裂解后,大部分GSTPDZ蛋白以不可溶的包涵体形式存在,另外一部分存在于可溶性的上清液中(图2a)。与此同时,在16 ℃低温诱导组,GST-PDZ的表达量则低于可检测水平,无论在上清液还是包涵体沉淀中,均无GSTPDZ的表达(图2b)。
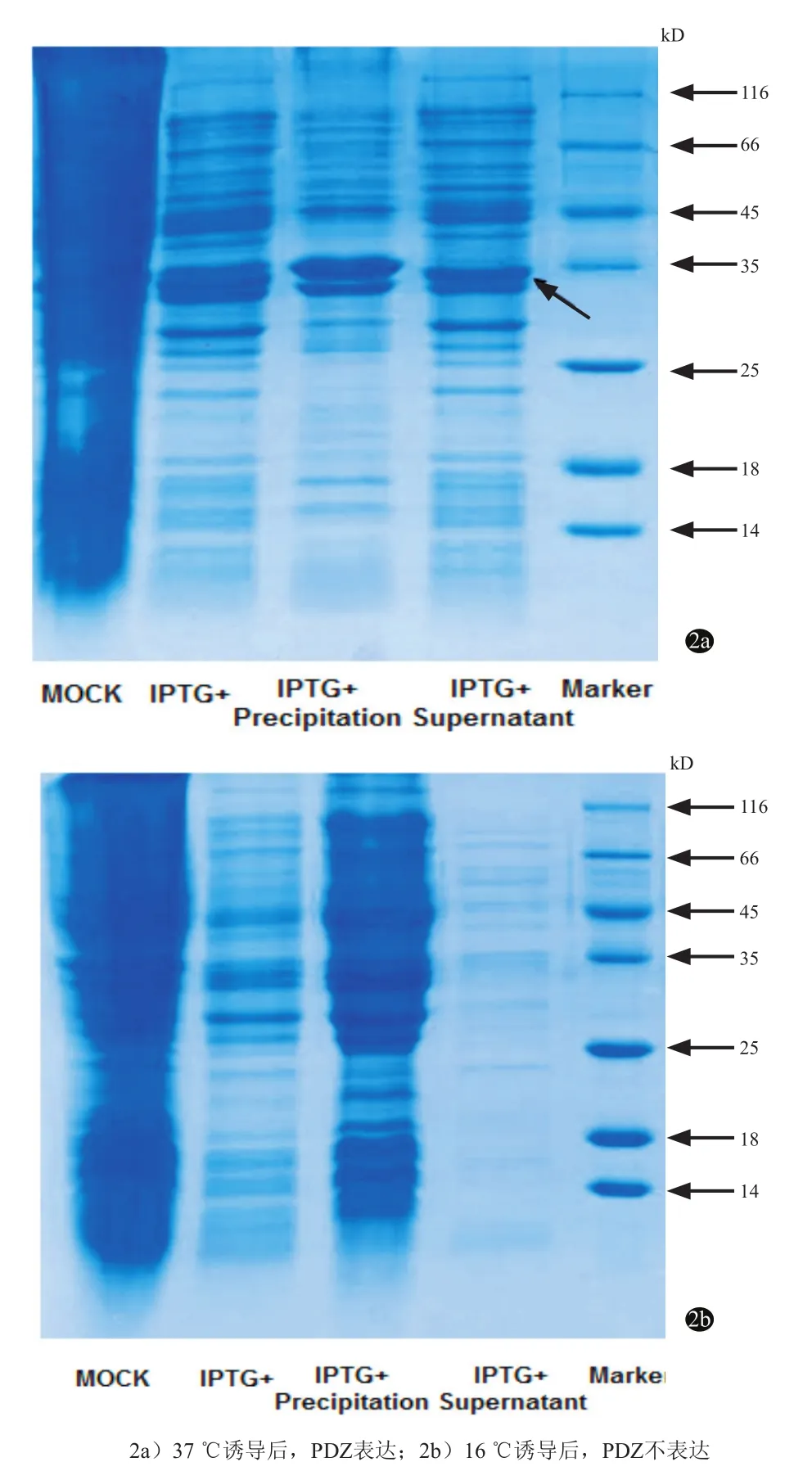
图2 PDZ结构域在BL21菌中的表达
2.3 GST-PDZ的表达后纯化
在确认了GST-PDZ的表达后,通过GST-beads 将37 ℃诱导表达的细菌蛋白裂解液上清和GST-beads进行结合,尝试对重组蛋白进行更进一步的纯化。GST-PDZ依然大量以包涵体的形式存在。但是通过GST-beads的结合后,上清液中的大部分融合蛋白均与beads相结合,而在洗液中则明显减弱,显示GST-beads的结合可以更进一步从裂解液中纯化可溶性的重组蛋白(图3)。
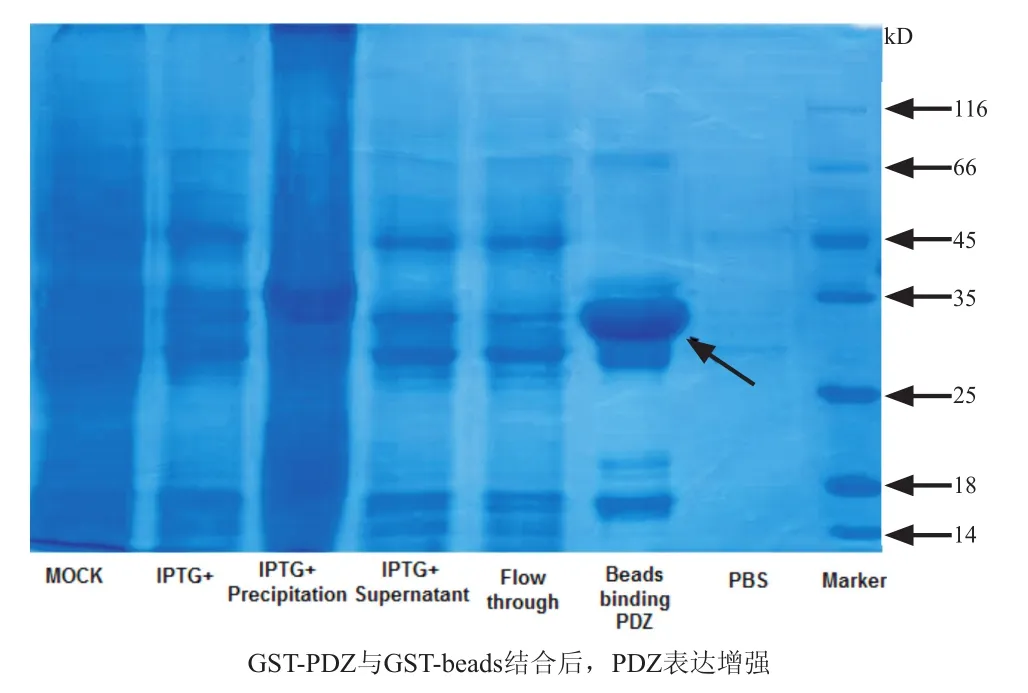
图3 PDZ结构域的纯化
3 讨论
高危型HPV所编码的2种早期基因E6和E7是其致癌性的关键基因[11]。在这两种癌蛋白中,E6被认为在HPV的致癌性中发挥关键作用。一般认为高危型HPV E6主要通过抑制抑癌蛋白p53而发挥转化功能[7]。但近年的研究发现高危型HPV E6对p53的作用不能完全解释其转化功能。在一些实验中,高危型HPV E6的突变体虽然不能诱导p53的降解,却仍然能使上皮细胞永生化[8]。而一些E6突变体虽然保留对p53的抑制作用,但并无转化功能[7]。而在此基础上,研究发现高危型HPV E6与一组含有PDZ结构域功能蛋白间的相互作用与其致癌性密切相关[7]。
PDZ是最早发现含有此结构域的3种蛋白质首字母的缩写(post-syn-aptic density protein-95 PSD-95/ SPA90, discs-large protein/drosophila tumor suppressor DLG-A, zonula occludens-1 ZO-1)[12]。PDZ蛋白多位于膜内或膜外, 是一段大约有80~90氨基酸长保守序列,与细胞骨架有广泛的联系[13]。PDZ蛋白参与细胞信号转导、细胞分裂、蛋白运输、降解、细胞骨架组织和基因表达等众多的生物学过程[12,13]。而所有高危HPV E6一个显著特征在其碳末段都有一个高度保守的含有4的氨基酸残基的PDZ结合序列,尽管该区域不涉及与p53结合和降解,但与其转化活性有关[14,15]。
第一个被发现同高危HPV E6结合含有PDZ结构域蛋白是hDlg[8]。 作为果蝇恶性肿瘤抑制蛋白因子Dlg的人类同源基因,hDlg与Dlg有60%氨基酸相同,是一种膜相关的鸟苷酸激酶蛋白(MAGUK)家族成员,主要起细胞支架和信号转导的作用[8]。研究也提示hDlg可能起抑制肿瘤的作用[8]。细胞极性是上皮组织的一个标志性特点,极性丢失与上皮细胞的恶性转化密切相关。
在笔者的研究中,尝试表达纯化人hDlg的PDZ结构域,并期望未来以此为基础尝试研究能够抑制高危型HPV E6和hDlg PDZ结构域结合的肽段。除GST融合蛋白外,也同时尝试表达MBP(maltosebinding protein,麦芽糖结合蛋白)融合PDZ蛋白,以及携带His标签的PDZ融合蛋白尝试提高可溶性PDZ蛋白的表达。然而,无论是在37 ℃还是在16℃下进行诱导表达,MBP-PDZ和His-PDZ的表达在SDS-PAGE上均无法被检测到。因此,尽管大部分GST-PDZ的融合蛋白以不可溶的包涵体存在,但GST融合蛋白似乎是惟一可行的原核表达方式,并且能够通过与GST-beads结合的方式来对重组蛋白进行一定的富集作用。在未来的研究中,将更进一步以重组表达的GST-PDZ为基础进行下一步研究。
[1] 肖子娥, 黄捷. 尖锐湿疣患者人乳头瘤病毒基因分型检测 [J]. 实用皮肤病学杂志, 2014, 7(2):99-101.
[2] Boshart M, Gissmann L, Ikenberg H, et al. A new type of papillomavirus DNA, its presence in genital cancer biopsies and in cell lines derived from cervical cancer [J]. EMBO J, 1984, 3(5):1151-1157.
[3] Dürst M, Gissmann L, Ikenberg H, et al. A papillomavirus DNA from a cervical carcinoma and its prevalence in cancer biopsy samples from different geographic regions [J]. Proc Natl Acad Sci USA, 1983, 80(12):3812-3815.
[4] Bzhalava D, Guan P, Franceschi S, et al. A systematic review of the prevalence of mucosal and cutaneous human papillomavirus types [J]. Virology, 2013, 445(1-2):224-231.
[5] Muñoz N, Bosch FX, de Sanjosé S, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer [J]. N Engl J Med, 2003, 348(6):518-527.
[6] Manzo-Merino J, Thomas M, Fuentes-Gonzalez AM, et al. HPV E6 oncoprotein as a potential therapeutic target in HPV related cancers [J]. Expert Opin Ther Targets, 2013, 17(11):1357-1368.
[7] Sanclemente G, Gill DK. Human papillomavirus molecular biology and pathogenesis [J]. J Eur Acad Dermatol Venereol, 2002, 16(3):231-240.
[8] Caruana G, Bernstein A. Craniofacial dysmorphogenesis including cleft palate in mice with an insertional mutation in the discs large gene [J]. Mol Cell Biol, 2001, 21(5):1475-1483.
[9] Froger A, Hall JE. Transformation of plasmid DNA into E. coli using the heat shock method [J]. J Vis Exp, 2007, (6):253.
[10] Patel D, Nan Y, Shen M, et al. Porcine reproductive and respiratory syndrome virus inhibits type I interferon signaling by blocking STAT1/ STAT2 nuclear translocation [J]. J Virol, 2010, 84(21):11045-11055.
[11] Tsao SW, Mok SC, Fey EG, et al. Characterization of human ovarian surface epithelial cells immortalized by human papilloma viral oncogenes (HPV-E6E7 ORFs)[J]. Exp Cell Res, 1995, 218(2):499-507.
[12] Jeleń F, Oleksy A, Smietana K, et al. PDZ domains - common players in the cell signaling [J]. Acta Biochim Pol, 2003, 50(4):985-1017.
[13] Schlieker C, Mogk A, Bukau B. A PDZ switch for a cellular stress response [J]. Cell, 2004, 117(4):417-419.
[14] Kiyono T, Hiraiwa A, Fujita M, et al. Binding of high-risk human papillomavirus E6 oncoproteins to the human homologue of the Drosophila discs large tumor suppressor protein [J]. Proc Natl Acad Sci USA, 1997, 94(21):11612-11616.
[15] Watson RA, Thomas M, Banks L, et al. Activity of the human papillomavirus E6 PDZ-binding motif correlates with an enhanced morphological transformation of immortalized human keratinocytes [J]. J Cell Sci, 2003, 116(Pt 24):4925-4934.
Prokaryotic expression and purification of hDlg PDZ domain in E.coli BL21 strain
DANG Yu-ping,YUAN Xiao-ying,LI Qiang,et al
Department of Dermatology, Airforce General Hospital of Chinese People's Liberation Army, Beijing 100142, China
Objective To investigate the expression and purification of hDlg PDZ domain in E.coli BL21 strain. Methods The cDNA fragment containing PDZ domain was cloned from total RNA of HeLa cell. The second round PCR was conducted to clone the PDZ domain. Then the PDZ domain was ligated to T vector. EcoRⅠ and XhoⅠ were used to release the PDZ domain with adequate restriction cites from T vector and the released fragment was cloned to pGEX-6p-1 expressing vector for prokaryotic expression in E.coli BL21. Results DNA sequencing and restriction enzyme digest were conducted to verify the insertion of PDZ domain in pGEX-6p-1 vector. After IPTG induction under 37℃, the GST-fusion protein was mainly existed as inclusion body with less fusion protein existed in supernatant. However, the fusion protein expression was under detectable level if IPTG induction was performed under 16℃. The GST-beads binding assay could be conducted to enrich the GST-PDZ from supernatant of bacterial lysate. Conclusion The PDZ domain of hDlg could be successfully expressed as GST fusion protein and GST-beads binding assay could be used for purify the soluble form of GST-PDZ.
HPV; hDlg; PDZ domain;Expression,prokaryotic [J Pract Dermatol, 2015, 8(6):415-418]
R752
A
1674-1293(2015)06-0415-04
2015-07-05
2015-08-18)
(本文编辑 耿建丽)
10.11786/sypfbxzz.1674-1293.20150604
100142 北京,空军总医院皮肤科(党育平,袁小英,李强,刘玮)
党育平,博士,副主任医师,研究方向:人乳头瘤病毒致病机制及疫苗的研究,E-mail: 6106215676@qq.com
刘玮,E-mail: lwei5811@126.com

