蒸发光散射高效液相色谱法测定黄芪饮片中的黄芪甲苷含量
荀其宁,侯倩倩,刘志娟,许峰,张文申,刘霞,冀克俭
(中国兵器工业集团第五三研究所,济南 250031 )
蒸发光散射高效液相色谱法测定黄芪饮片中的黄芪甲苷含量
荀其宁,侯倩倩,刘志娟,许峰,张文申,刘霞,冀克俭
(中国兵器工业集团第五三研究所,济南 250031 )
采用蒸发光散射高效液相色谱法测定黄芪饮片中黄芪甲苷的含量。黄芪饮片分别用甲醇和正丁醇提取,以NaOH溶液洗涤,蒸干,再用甲醇溶解,采用Agilent SB-C18柱(250 mm×4.6 mm,5 μm)分离测定,流动相为乙腈-水(32∶68),流量为1.0 mL/min,漂移管温度为80℃。方法检出限为1.5 μg/mL,黄芪甲苷溶液的质量浓度在2~12 μg/mL范围内与色谱峰面积线性关系良好(r2=0.999 6),测定结果的相对标准偏差为0.65%(n=6),平均加标回收率为99.6%。该方法稳定可靠,可用于黄芪药材及其生物制品中黄芪甲苷含量的测定。
黄芪;黄芪甲苷;液相色谱;蒸发光散射检测器
黄芪为豆科植物蒙古黄芪或膜荚黄芪的干燥根,味甘,性微温,具有清热燥湿、补气固表、利尿脱毒排脓、敛疮生肌之功效[1]。黄芪含皂苷、黄酮、多糖及氨基酸等多种化学成分,其中黄芪甲苷为黄芪中的主要活性成分,是黄芪药材及其制剂质量控制的指标性成分[2-5]。黄芪收载于《中国药典》2010版(一部)。
黄芪甲苷常用的含量测定方法有薄层扫描法和高效液相色谱法。薄层扫描法操作繁琐,测定结果重现性差。常规的高效液相色谱-紫外检测器不适用于黄芪甲苷的检测,因为黄芪甲苷仅在200 nm左右有微弱的吸收,检测灵敏度低,噪音大[6-9]。而蒸发光散射检测器对黄芪甲苷具有较高的检测灵敏度,在实验中得到广泛应用[10-16]。笔者对样品前处理方法进行优化处理,建立了一种准确可靠的黄芪甲苷含量测定方法。
1 实验部分
1.1 主要仪器与试剂
液相色谱仪:Agilent 1260型,配有蒸发光散射检测器,美国安捷伦科技有限公司;
分析天平:ABS135-S型,美国梅特勒-托利多公司;
超声波清洗器:KQ5200型,昆山市超声仪器有限公司;
甲醇、乙醇:色谱纯,美国Fisher Scientific公司;
正丁醇:分析纯,山东莱阳经济技术开发区精细化工厂;
氢氧化钠:分析纯,天津天大化工实验室;
高纯氮气:纯度为99.999%,济南尧天仪器有限公司;
黄芪甲苷对照品:编号为110781,纯度为95.8%,中国食品药品检定研究所;
黄芪饮片样品:市售;
实验用水为高纯水。
1.2 色谱条件
色谱柱:Agilent SB-C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈-水(体积比为32∶68),流量为1.0 mL/min;柱温:35℃;进样体积:20 μL;喷雾器温度:60℃;漂移管温度:80℃。
1.3 溶液的配制
1.3.1 黄芪甲苷对照品溶液
精密称取黄芪甲苷对照品5 mg于10 mL容量瓶中,加入甲醇定容至标线,摇匀即得。
1.3.2 黄芪饮片样品溶液
取黄芪饮片适量,于50℃干燥至恒重,用研钵研磨成粉,过380 μm(40目)筛。取4 g粉末,置于索氏提取器中,加入40 mL甲醇,冷浸过夜。隔天加甲醇适量,加热回流4 h,将提取液回收并浓缩至干。残渣加水10 mL,微热使其溶解,分别用40 mL水饱和的正丁醇振摇提取4次后合并正丁醇液。分别用40 mL 1% NaOH溶液(替代药典方法中的氨试液)充分洗涤2次,弃去1% NaOH溶液,将正丁醇液蒸干。加水5 mL溶解残渣,放冷,注入D101型大孔吸附树脂柱(12 cm×1.5 cm),以50 mL水洗脱,弃去,然后用30 mL 40%乙醇洗脱,弃去,再用80 mL 70%乙醇洗脱,弃去。蒸干后残渣加甲醇溶解并转移至5 mL容量瓶中,用甲醇定容至标线,摇匀,用0.45μm滤膜滤过,即得。
2 结果与讨论
2.1 样品处理方法
黄芪饮片样品的前处理对含量测定影响较大,注意事项主要包括:(1)用索氏提取器提取时,供试品需全部浸泡在甲醇中,约20 min虹吸一次,加热回流6 h;(2)用水饱和正丁醇振摇提取时,采用分液漏斗,每次至少30 min,分离液体速度要慢;(3)用D101型大孔吸附树脂柱洗脱时,洗脱过程要保持慢速,保证前一种洗脱液完全流出时再加入另一种洗脱液;(4)对氨试液及1% NaOH溶液的去杂效果进行了试验比较,通过处理后样品比较及色谱分析,结果表明,1% NaOH溶液能更好地去除样品中黄酮等含酚羟基等酸性杂质,洗涤效果更好。
2.2 色谱条件的确定
2.2.1 色谱柱
比较了Agilent SB-C18柱、Agilent TC-C18柱和Agilent Bonus-RP柱,结果表明,采用Agilent SB-C18柱时黄芪甲苷的分离度好,而且色谱峰形尖锐对称,故实验采用Agilent SB-C18柱。
2.2.2 流动相
分别以甲醇-水(80∶20)和乙腈-水(32∶68)为流动相考察供试品溶液中各组分的分离情况。结果表明,以甲醇-水(80∶20)为流动相时,黄芪甲苷出峰慢,而且与其它组分的色谱峰不能完全分离;而以乙腈-水(32∶68)为流动相时,黄芪甲苷与其它组分分离良好。故选用乙腈-水(32∶68)为流动相。
在1.2色谱条件下,黄芪甲苷对照品溶液及样品加标溶液色谱图分别见图1、图2。由图1、图2可知,黄芪饮片样品中,黄芪甲苷与其它组分分离良好,色谱峰形尖锐对称,适于用作定量分析。
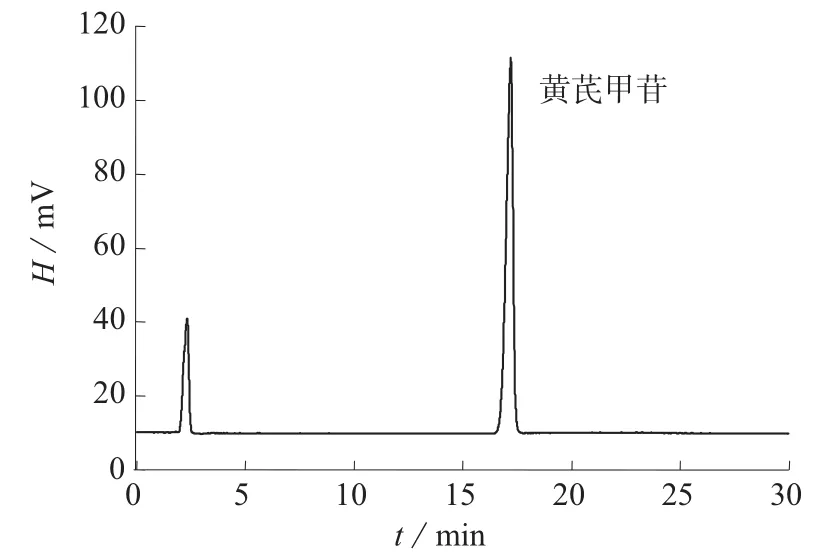
图1 黄芪甲苷标准溶液色谱图
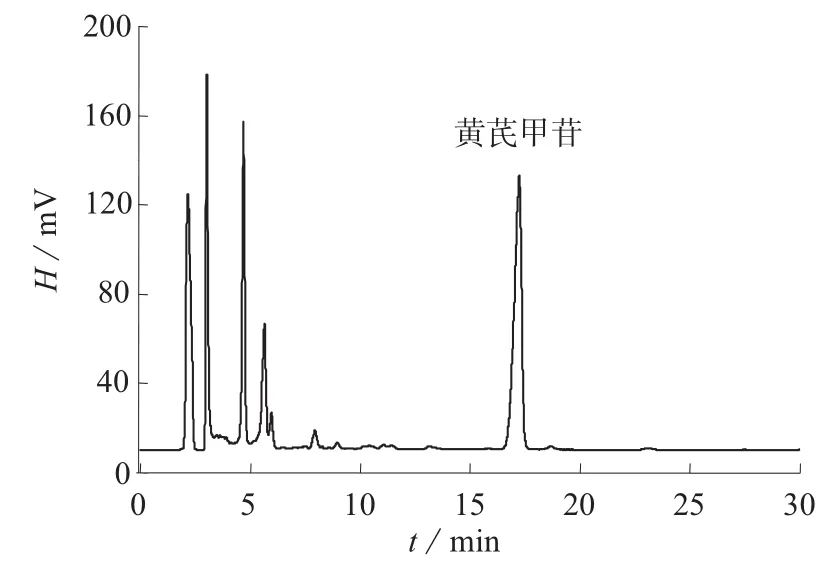
图2 黄芪饮片样品溶液色谱图
2.3 线性方程和检出限
分别精密移取标准溶液10,20,30,40,50,60 μL,置于10 mL 量瓶中,加甲醇稀释至标线,摇匀,进样20 μL,以对照品色谱峰面积的自然对数为纵坐标,以进样量的自然对数为横坐标,进行线性回归,得回归方程为y=1.544 4x+10.145 3,相关系数r2=0.999 6,结果表明,黄芪甲苷在2~12 μg/mL范围内与色谱峰面积线性关系良好。
逐步稀释黄芪甲苷标准储备液,在1.2色谱条件下进行测定,根据被测组分在气相色谱上的信噪比(S/N)为3确定检出限为1.5 μg/mL;以信噪比10计算定量限,结果为7.5 μg/mL。
2.4 精密度试验
将黄芪饮片溶液,连续进样6针,黄芪甲苷色谱峰面积测定结果见表1。由表1可知,色谱峰面积测定结果的相对标准偏差为0.65%,表明本方法精密度良好。

表1 色谱峰面积测定结果
2.5 加标回收试验
精密称定黄芪饮片9份,根据1.3.2配制样品溶液,精确加入黄芪甲苷对照品溶液0.8,1.0,1.2 mL各3份,用甲醇稀释至标线,摇匀,作为样品溶液,依法测定,计算加标回收率,结果见表2。由表2可知,黄芪甲苷的平均回收率为99.6%,表明本法准确度较高。
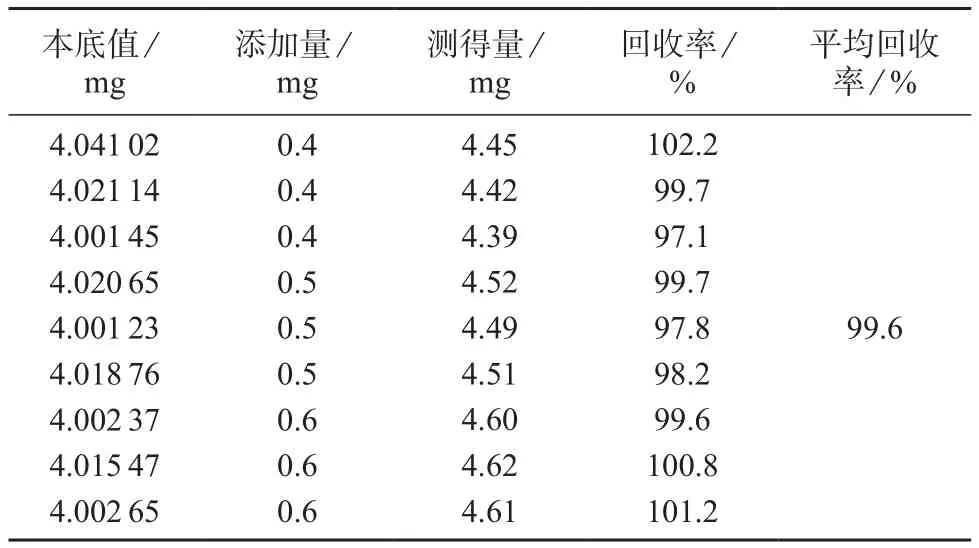
表2 加标回收试验结果
3 结语
采用蒸发光散射高效液相色谱法测定黄芪饮片中黄芪甲苷的含量,具有良好的准确性和重现性,可用于黄芪及其制剂中黄芪甲苷的含量分析。
[1] 国家药典委员会.中国人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:283-284.
[2] Yu S Y,Yang H T O,Yang J Y,et al. Subchronic toxicity studies of Radix Astragali extract in rats and dogs[ J]. J Ethnopharmacol,2007,110: 352-355.
[3] 朱燕辉,严奉祥.黄芪甲苷及其生物学活性[J].现代生物医学进展,2008,8(4): 781-783.
[4] 葛德洲,邓祖磊.高效液相色谱-蒸发光散射法测定甜梦胶囊中黄芪甲苷含量[J].中国药业,2015,24(5): 31-32.
[5] 蒋红艳,杨元娟,何静,等.黄芪及其制剂中黄芪甲苷定量分析方法研究进展[J].中国医药指南,2009,7(10): 209-211.
[6] 吴高芬.高效液相色谱-蒸发光散射器法测定芪芳气血颗粒中黄芪甲苷含量[J].中国药业,2015,24(12): 60-62.
[7] Huang Chenrong,Wang Guangji,Li Hao,et al. Sensitive and selectiveliquid chromatography-electrospray ionization-mass spectrometry analysis of astragaloside Ⅳ in rat plasma[J]. Pharm Biomed Anal,2006,40: 788-793.
[8] 张莲珠,汲立伟,吕雪峰.HPLC测定克尼胶囊中黄芪甲苷的含量[J].中成药,2005,27(8): 991-992.
[9] 姜勇,金芳,鲍忠,等.不同来源黄芪药材中黄芪甲苷的定量分析[J].中国中药杂志,2006,31(11): 930-933.
[10] 王鹏,赵承孝,李青山,等.高效液相色谱-蒸发光散射测定蒙古黄芪中黄芪甲苷的含量及其提取工艺的优化[J].中国药物与临床,2010,10(2): 134-136.
[11] 李晶,韦露莎,申旭霁,等.HPLC-ESI-MSn 法测定黄芪药材中黄芪甲苷[J].中成药,2011,33(4): 720-722.
[12] 罗丹,罗国安,陈丽,等.HPLC-ELSD测定得力生注射液的黄芪甲苷的含量[J].中药与临床,2014,5(6): 21-23.
[13] 冯琬淇,袁桂霞.HPLC-ELSD法测定阿胶三宝膏中黄芪甲苷的含量[J].中医药导报,2014,21(9): 60-62.
[14] 刘丹静,朱庄松,温海涛,等.HPLC-ELSD法测定芪灵扶正片中黄芪甲苷的含量[J].北方药学,2015,12(6): 3-4.
[15] 曹桂萍,王晓晶.HPLC-ELSD 法测定骨痹灵片中黄芪甲苷的含量[J].现代中药研究与实践,2014,28(6): 65-67.
[16] 王建舫,胡格,张涛,等.高效液相色谱-蒸发光散射法测定芪参口服液中黄芪甲苷的含量[J].中兽医医药杂志,2012,31(5): 11-14.
Determination of Astragaloside Ⅳ in Astragalus Decoction Pieces by HPLC-ELSD
Xun Qining, Hou Qianqian, Liu Zhijuan, Xu Feng, Zhang Wenshen, Liu Xia, Ji Kejian
(CNGC Institute53, Jinan 250031, China)
HPLC-ELSD method was used to determine astragaloside Ⅳ in astraglus decoction pieces. The sample of astragalous decoction pieces was extracted by methanol andn-butyl alchol, after cleaning with NaOH solution, the sample was dried and disolved in methanol, and was determined by Agilent SB-C18column (250 mm×4.6 mm, 5μm), acetonitrile-water(32∶68) was as the mobile with the flow rate of 1.0 mL/min, the drifttube temperature was 80℃. The detection limit of the method was 1.5 μg/mL. The linear range was 2-12 μg/mL(r2=0.999 6). The RSD of determination results was 0.65%(n=6). The average recovery of astragaloside Ⅳ was 99.6%. This method is accurate, reliable and with good reproducibility, and it can be used for the determination of astragaloside Ⅳ in Radix Astragali and its products.
astragalous decoction pieces;astragaloside IV; HPLC; ELSD
O657.7
:A
:1008-6145(2015)05-0062-03
10.3969/j.issn.1008-6145.2015.05.016
联系人:侯倩倩;E-mail: houqianqian53@163.com
2015-08-04

