冻融温度对东北黑土理化性质及土壤酶活性的影响
李琳慧+李旭+许梦+王观竹+于济通+郭平


摘要:选择东北地区黑土为供试土壤,用人工控温方法,分析探讨不同冻融温度下冻融处理对土壤理化性质及酶活性的影响。结果表明,随着土壤冻结温度的降低,大团聚体更容易被破坏,向中级团聚体转化;土壤pH值、CaCO3含量升高,氧化还原电位、阳离子交换量降低,这主要是由于冻结土壤的温度越低,硝化作用越弱,产生的H+减少;可溶性有机质含量升高,微生物量碳含量下降,这主要是由于冻结温度越低,对微生物的灭杀作用及大团聚体破坏作用越强烈;胡敏酸(HA)含量升高,富里酸(FA)含量降低,HA/FA升高,冻结温度越低越利于改善腐殖质的品质;土壤FDA水解酶、蛋白酶、纤维素酶和过氧化氢酶活性均下降,这既有冻融作用对土壤酶的直接影响,也有冻融作用通过影响土壤微生物进而对土壤酶产生的间接影响所致。
关键词:冻融温度;黑土;理化性质;酶活性;气候变化
中图分类号: S151.9 文献标志码: A
文章编号:1002-1302(2015)04-0318-03
收稿日期:2014-08-29
基金项目:国家自然科学基金(编号:40971248)。
作者简介:李琳慧(1989—),女,吉林长春人,硕士,从事环境污染防治与生物修复研究。E-mail:LLHlilinhui@163.com。
通信作者:郭 平,博士,教授,硕士生导师,从事环境污染防治与生物修复研究。E-mail:guoping@jlu.edu.cn。
东北黑土区是我国重要的商品粮生产基地,区内存在季节性冻融。冻融是指土层由于温度降到0 ℃以下和升至0 ℃以上而产生冻结和融化的一种物理地质作用和现象,能够改变土壤固相物质的构成。非冻结条件下土壤固相以矿物成分为主;冻结条件下固相则由矿物和固态冰组成,随着土温的变化,水会发生相态转移。冻融土壤的相变及其伴生现象必然引起土壤理化性质和生物学性质上的变化[1],进而影响土壤的环境行为及土壤中营养元素的化学循环,并对农作物品质产生影响。国内外对于冻融作用机理的研究起步较早,也取得了一定的进展。Edwards等指出,冻融交替对土壤性质的影响主要取决于冻融速率、冻融温度、土壤含水量、土壤容重及冻融交替的次数[2-4]。另有研究表明,冻融交替作用可以改变土壤的物理性质,如土壤团聚体的大小分布和稳定性,显著影响土壤水热传导、溶质运移和水分入渗等特性[5-6],使土壤容重降低、孔隙度增大、饱和导水率提高[7]。关于冻融温度对土壤影响的研究大多倾向于工程力学,冻融温度对土壤物理、化学、生物学性质影响的研究并不多见。现今全球气候变化问题是人类面临最为严峻的挑战之一,气候的变化直接影响冻融温度的变化,进而对土壤性质产生影响。本试验以东北黑土为研究对象,进行冻融循环试验,讨论不同冻融温度对土壤团聚体结构、pH值、氧化还原电位(Eh)、阳离子交换量(CEC)、碳酸钙(CaCO3)、可溶性有机质(DOM)、微生物量碳和腐殖质、土壤酶活性的影响,从物理、化学、生物学角度全面探索冻融温度对土壤的影响,并分析其原因,为进一步研究东北地区土壤的污染物环境行为及C、N、P等营养元素循环提供科学依据。
1 材料与方法
1.1 样品采集与制备
黑土采自吉林省长春市农业生态园0~20 cm表层土壤,在室温下风干并完全混合,剔除植物根、沙砾等杂物,按四分法获取足量样品,研磨,过孔径为2 mm的筛,保存于聚乙烯塑料封口袋中备用。供试土壤pH值为6.90,有机质、游离氧化铁、Eh值、CEC值分别为22.50 g/kg、56.46 g/kg、430 mV、39.25 cmol/kg。
1.2 冻融模拟试验
称取土壤样品100 g若干份,调节土壤含水率为90%;将土壤样品分别置于-15、-25、-35 ℃不同温度的低温冰箱中完全冻结24 h,然后取出放到5 ℃冰箱里再融化24 h为1个冻融周期,经过6次冻融循环;将土壤取出风干,分别得到冻结温度为-15、-25、-35 ℃的土壤样品。在相同冻融时间内,将土样一直保存在5 ℃作为未冻融处理。冻融结束,测定冻融组及未冻融组2~1、1~0.5、0.5~0.25 mm和 <0.25 mm 的土壤团聚体分布、pH值、Eh、CEC、CaCO3含量、DOM、微生物量碳、腐殖质以及土壤酶活性。
1.3 测定方法
采用玻璃电极法测定土壤pH值(水土比为1 ∶ 2.5);Eh测定采用铂电极直接测定法(水土比为1 ∶ 2.5);CEC测定采用醋酸铵交换法[8];土壤有机质含量测定采用Waikley-Black 湿式氧化法[9];游离氧化铁测定采用连二亚硫酸钠-柠檬酸钠-重碳酸钠提取法,简称DCB法[10];CaCO3含量测定采用扩散吸收法;土壤DOM含量采用岛津TOC仪测量;微生物量碳测定采用氯仿熏蒸法;腐殖质组成测定采用焦磷酸钠提取土壤中的富里酸和胡敏酸,然后采用重铬酸钾氧化法测定;FDA水解酶活性采用刘海芳等的方法[11]测定;蛋白酶活性采用茚三酮比色法测定;纤维素酶活性采用3,5-二硝基水杨酸法测定;过氧化氢酶活性采用高锰酸钾滴定法测定。
2 结果与分析
2.1 冻结温度对团聚体粒径分布的影响
由图1可知,随着冻结温度的降低,土壤 2~1 mm和0.5~0.25 mm粒径范围的团聚体含量逐渐下降,1~0.5 mm和<0.25 mm粒径范围的团聚体含量上升;冻融组2~1 mm和1~0.5 mm 粒径范围的团聚体含量均低于未冻融组,冻融组0.5~0.25 mm和<0.25 mm粒径范围的团聚体含量均高于未冻融组;随着冻结温度的降低,大团聚体含量变化较大,而小团聚体变化并不明显。这说明冻结温度越低,冻融作用对大团聚体的破坏作用越强,并且越利于向中级团聚体转化,这可能是在土壤冻结时,土壤孔隙中冰晶的膨胀打破了颗粒与颗粒之间的联结,而有效地将土壤大团聚体破碎成小团聚体[12]。endprint
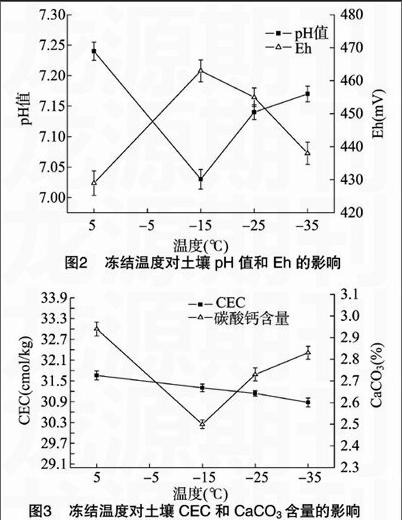
2.2 冻结温度对pH值、Eh、EC、CEC 和 CaCO3的影响
由图2、图3可知,与未冻融相比,冻融作用使土壤pH值、CEC、CaCO3含量降低,Eh升高;冻融处理组中,随着冻结温度的降低,土壤pH值、CaCO3含量升高,Eh、CEC降低。
冻融作用使土壤的pH值降低,这可能是由于冻融处理促进了硝化作用[13]和溶解性有机酸的释放[7],从而促进了土壤溶液的酸化。CEC是表示土壤吸附或交换周围溶液中阳离子的参数,土壤胶体微粒表面羟基(OH)的解离受介质pH值的影响,当介质pH值降低时,土壤胶体微粒表面所载负电荷减少[14],因此,冻融土壤pH值的降低引起了土壤CEC降低。此外,土壤中CaCO3含量与pH值具有良好的正相关关系[15],因此,冻融后的土壤CaCO3含量也降低。土壤pH值Eh有重要影响(Eh=Eh0-0.059pH),Eh随pH值的降低而升高,冻融土壤pH值的降低自然引起冻融土壤Eh的升高。
在不同冻结温度处理中,土壤pH值随着冻结温度的升高而降低,这是由于硝化速率随着温度的升高而增加[16],提供了更多H+,并进一步导致CaCO3含量逐渐降低,Eh逐渐升高。目前,CEC随冻结温度升高而升高的原因尚不明确,有研究表明,土壤交换性阳离子以土壤胶体(有机质和矿质胶体)为载体,有机质的CEC远大于矿质胶体,冻结温度的变化可能引起了土壤有机质含量的变化,进而影响了CEC。
2.3 冻结温度对DOM、微生物量碳和腐殖质的影响
土壤DOM及微生物量碳都属土壤活性有机质,受气候影响较大,能在不同程度上反映土壤有机质(碳)的有效性,指示土壤有机质(碳)或土壤质量。由图4可知,与未冻融相比,冻融作用使DOM含量提高、土壤微生物量碳含量降低;
随着冻结温度的降低,DOM含量呈现上升趋势,当冻结温度达到-35 ℃时,DOM 含量急剧上升,而土壤微生物量碳含量逐渐降低。
冻融作用使土壤DOM的含量增加,这可能是由于冻融作用对微生物有灭杀作用,当土壤冻结时微生物死亡,当土壤融化时死亡微生物细胞内所含的有机质溶解释放出来进入土壤,从而增加了土壤DOM含量[17];另外,冻融作用可以将大团聚体破碎成小团聚体,使得被土壤包裹吸附着的小分子物质提前释放出来,从而也增加了土壤DOM含量。由于温度越低,土壤稳定性团聚体越少[3],因而随着冻结温度的降低,DOM含量升高,且冻结温度越低,微生物死亡量越多,更多胞内有机质释放到土壤中,DOM含量随之升高。与此同时,微生物死亡量增加会导致微生物量碳的减少。
腐殖酸是自然环境中广泛存在的一类高分子物质,是影响农药在土壤环境中行为和归宿的重要因子之一。腐殖酸包括胡敏酸(HA)和富里酸(FA)。HA的芳构化程度、缩合程度较FA的高[18],因此,HA/FA是衡量土壤腐殖化程度的标志之一,比值越大,表明腐殖质的品质越好[19]。由图5、图6可知,与未冻融相比,冻融处理使FA的含量降低、HA的含量升高,并且使腐殖化程度HA/FA增强;冻融处理组中,随着冻结温度的降低,FA呈现下降趋势,HA和 HA/FA值呈现上升趋势,冻融作用可以改善腐殖质的品质,并且冻结温度越低,改善效果越好。
2.4 冻融作用对土壤酶活性的影响
土壤酶是土壤中一切生物化学过程的主要参与者,对土壤肥力的演化具有重要影响。由表2可知,与未冻融处理相比,冻融作用使土壤FDA水解酶、蛋白酶、纤维素酶和过氧化氢酶的活性均降低;随着冻结温度降低,酶的活性下降。这是由于土壤酶主要来源于微生物[20],冻融处理通过影响微生物活性而间接影响酶活性,土壤冻结时,部分土壤微生物受到低
温胁迫死亡,冻结温度越低,死亡微生物数量越多,因而导致产生的酶数量减少;土壤融化时,由于融化的时间较短,微生物繁殖缓慢,活性仍然很低,因此不利于土壤酶的产生。冻融作用还可以直接影响酶的活性,这是由于酶的活性受温度影响很大,只有在最适温度时酶的活性才最高,高于或低于最适温度,酶活性都会降低,冻结温度越低,土壤酶活性受到的抑制越强烈,融化后酶的活性也难以恢复。
表1 冻结温度对土壤FDA水解酶、蛋白酶、纤维素酶
和过氧化氢酶活性的影响
温度
(℃)
酶的活性
FDA水解酶
[mg/(kg·h)] 蛋白酶
[μg/(g·24 h)] 纤维素酶
[mg/(g·72 h)] 过氧化氢酶
[mL/(g·20 min)]
5 1.90 1.00 0.59 4.73
-15 1.02 0.98 0.37 4.71
-25 1.01 0.90 0.35 4.68
-35 0.97 0.81 0.29 4.67
3 结论
研究结果表明,冻融温度的变化影响了土壤的性质,随着冻结温度的降低,冻融作用对大团聚体的破坏作用越强,并且越利于向中小级团聚体转化;土壤pH值、CaCO3含量升高,Eh、CEC降低,这是因为硝化速率随着温度的升高而增加,提供了更多H+,从而导致pH值、CaCO3、Eh、CEC发生相应变化;冻融作用对微生物的灭杀作用及大团聚体破坏越强烈,导致更多DOM释放,在这个过程中,微生物量碳含量由于微生物的死亡而下降,从而导致微生物量碳含量下降;FA的含量降低,HA的含量升高,腐殖化程度HA/FA增大,腐殖质的品质改善效果越好;FDA 水解酶、蛋白酶、纤维素酶和过氧化氢酶活性呈现下降趋势,冻融作用可以直接或通过影响微生物而间接抑制酶活性。
参考文献:
[1]王娇月,宋长春,王宪伟,等. 冻融作用对土壤有机碳库及微生物的影响研究进展[J]. 冰川冻土,2011,33(2):442-452.endprint
[2]Edwards L M. The effect of alternate freezing and thawing on aggregate stability and aggregate size distribution of some Prince Edward Island soils[J]. Journal of Soil Science,1991,42(2):193-204.
[3]Lehrsch G A,Sojka R E,Carter D L,et al. Freezing effects on aggregate stability affected by texture,mineralogy,and organic matter[J]. Soil Science Society of America Journal,1991,55(5):1401-1406.
[4]Lehrsch G A. Freeze-thaw cycles increase near-surface aggregate stability[J]. Soil Science,1998,163(1):63-70.
[5]Hansson K,Sˇim unek J,Mizoguchi M,et al. Water flow and heat transport in frozen soil:numerical solution and freeze-thaw applications [J]. Vadose Zone Journal,2004,3(2):693-704.
[6]Burton D L,Beauchamp E G. Profile nitrous-oxide and carbon dioxide concentrations in a soil subject to freezing[J]. Soil Science Society of America Journal,1994,58(1):115-122.
[7]王 洋,刘景双,王国平,等. 冻融作用与土壤理化效应的关系研究[J]. 地理与地理信息科学,2007,23(2):91-96.
[8]Sumner M E,Miller W P. Cation exchange capacity and exchange coefficients[M]//Bigham J M. Methods of soil analysis:Part 3. Chemical methods. Madison:Soil Science Society of America,1996:1201-1229.
[9]Carter M R. Soil sampling and methods of analysis[M]. Boca Raton,FL,USA:CRC Press,1993.
[10]Komarek M,Tlustos P,Száková J,et al. The role of Fe-and Mn-oxides during EDTA-enhanced phytoextraction of heavy metals[J]. Plant Soil and Environment,2007,53(5):216-224.
[11]刘海芳,马军辉,金 辽,等. 水稻土 FDA水解酶活性的测定方法及应用[J]. 土壤学报,2009,46(2):365-367.
[12]Bullock M S,Nelson S D,Kemper W D. Soil cohesion as affected by freezing,water content,time and tillage[J]. Soil Science Society of America Journal,1988,52(3):770-776.
[13]Freppaz M,Williams B L,Edwards A C,et al. Simulating soil freeze/thaw cycles typical of winter alpine conditions:implications for N and P availability[J]. Applied Soil Ecology,2007,35(1):247-255.
[14]沈 月,依艳丽,张大庚,等. 耕地棕壤酸碱缓冲性能及酸化速率研究[J]. 水土保持学报,2012,26(1):95-100.
[15]朱礼学. 土壤pH值及CaCO3在多目标地球化学调查中的研究意义[J]. 四川地质学报,2001,21(4):226-228.
[16]周旺明,秦胜金,刘景双,等. 沼泽湿地土壤氮矿化对温度变化及冻融的响应[J]. 农业环境科学学报,2011,30(4):806-811.
[17]周旺明,王金达,刘景双,等. 冻融对湿地土壤可溶性碳、氮和氮矿化的影响[J]. 生态与农村环境学报,2008,24(3):1-6.
[18]王秀红. 我国水平地带性土壤中有机质的空间变化特征[J]. 地理科学,2001,21(1):19-23.
[19]陈立新,杨承栋.落叶松人工林土壤腐殖物质组分及其对酸度的影响[J]. 林业科学,2007,43(2):8-14.
[20]汤 洁,梁 爽,张 豪,等. 吉林西部盐碱水田区冻融期土壤水盐运移特征及酶活性变化[J]. 吉林大学学报:地球科学版,2014(2):636-644.endprint

