无花果多糖体外抗氧化及抗肿瘤活性研究
郭润妮,倪孟祥
(中国药科大学生命科学与技术学院,江苏南京 210009)
无花果多糖体外抗氧化及抗肿瘤活性研究
郭润妮,倪孟祥
(中国药科大学生命科学与技术学院,江苏南京 210009)
从无花果中提取、分离和纯化得到了均一性无花果多糖FCPS-1、FCPS-2、FCPS-3,通过测定DPPH自由基清除率、超氧阴离子自由基清除率、羟基自由基清除率、还原能力研究了其体外抗氧化活性,采用MTT法研究了其体外抗肿瘤活性。结果表明:以上无花果多糖均表现出与浓度正相关的体外抗氧化活性,其中FCPS-3具有相对更强的体外抗氧化活性。FCPS-3对HepG-2细胞和7901细胞具有更强的体外抗肿瘤活性,在浓度为2.0mg·mL-1时,FCPS-3对HepG-2细胞和7901细胞的抑制率分别为57.30%和54.49%。表明无花果多糖可作为潜在的天然抗肿瘤药物。
无花果多糖;抗氧化活性;抗肿瘤活性
无花果是地中海暖温带气候地区的一种很常见的桑科植物[1]。研究表明,食用无花果有助于预防静脉阻塞,其高纤维含量还具有通便的作用,而无花果果胶更是可以抑制肿瘤细胞的生长。从无花果中提取的苯甲醛、呋喃香豆素内酯、补骨酯素等多种抗癌活性成分的抗癌效果已得到世界公认。此外,无花果中还富含黄酮、多糖、SOD等具有防治心血管疾病和老年痴呆症的生理活性物质[2],具有极高的研究价值。
近年来,多糖因为具有相对低的毒性和特殊的生物、化学、物理性质而被广泛研究[3-4]。多糖是无花果中的主要活性成分之一。目前有关研究无花果多糖的提取、分离、结构鉴定等及提高免疫功能作用已有报道。但关于无花果多糖抗氧化和抗肿瘤活性的研究鲜见报道。因此,作者在分离纯化得到均一性无花果多糖的基础上,对其体外抗氧化和抗肿瘤活性进行了研究。
1 实验
1.1 材料、试剂与仪器
干无花果,市售,粉碎过40目筛。
二苯代苦味肼自由基(DPPH)、噻唑蓝(MTT)、氯化硝基四唑氮蓝(NBT)、烟酰胺腺嘌呤二核苷酸(NADH),Sigma公司;1640培养基、胎牛血清,Giboco公司;吩嗪硫酸甲酯(PMS)、二甲基亚砜(DMSO)、正己烷、乙酸乙酯、正丁醇,分析纯,国药集团化学试剂有限公司。
人肝癌细胞(HepG-2细胞)、人结肠癌细胞(SW1116细胞)、人胃癌细胞(7901细胞),中国科学院细胞库。
SHZ-D(Ⅲ)型循环水式真空泵、HH-S型水浴锅、RE-52C型旋转蒸发器,巩义予华仪器有限责任公司;VIS-7220型可见分光光度计,北京瑞利分析仪器有限公司;BS1245型分析天平,北京赛多利斯仪器系统有限责任公司;DHG-9140A型电热恒温鼓风干燥箱,上海恒科有限公司;直热式CO2培养箱,Excella公司;倒置相差生物显微镜,Olympus公司;血球计数器,青岛求精计数器有限公司;SW-CJ-2FD型超净工作台,上海博讯实业有限公司医疗设备厂。
1.2 方法
1.2.1 无花果多糖的提取、分离与纯化
工艺流程:精密称取无花果粉末→氯仿抽提去脂→超声破碎→沸水浸提→过滤、浓缩→Sevage法除蛋白→醇沉→过滤或离心→醇沉物清洗→真空干燥→粗多糖→大孔吸附树脂脱色→DEAE-52离子交换纤维素柱分离得到单组分→SephadexG-150葡聚糖凝胶过滤层析得到均一组分→冷冻干燥→精多糖。
具体操作:取经过氯仿脱脂处理的无花果粉末,加入20BV的水,超声20min后沸水浸提3h,过滤,滤液浓缩,采用Sevage法除去蛋白,大孔吸附树脂脱色,醇沉,离心,得到粗多糖FCPS。
取一定量的FCPS溶于双蒸水,上样到已平衡的DEAE-52离子交换纤维素柱上,用蒸馏水和不同浓度氯化钠溶液洗脱,苯酚硫酸法跟踪检测,根据洗脱曲线的主峰位合并收集液,透析,干燥,得到3个无花果多糖纯化组分。将得到的3个组分分别溶解,上样到已平衡的SephadexG-150葡聚糖凝胶过滤层析柱,采用氯化钠溶液洗脱,根据洗脱曲线的主峰位合并收集液,透析脱盐,冷冻干燥,得到无花果多糖均一组分FCPS-1、FCPS-2和FCPS-3。
1.2.2 无花果多糖体外抗氧化活性的测定
1.2.2.1 DPPH自由基清除率测定[5]
将2.0mL浓度(mg·mL-1)分别为0.5、1.0、1.5、2.0、2.5的无花果多糖样品溶液加入到2mL DPPH溶液(2×10-4mol·L-1,溶解于95%乙醇)中。混合均匀并在黑暗中反应30min,测定517nm处的吸光度。DPPH自由基清除率按式(1)计算:
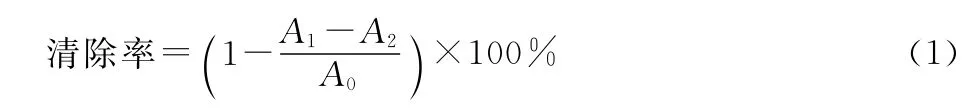
式中:A0为水代替样品溶液时的吸光度;A1为样品溶液的吸光度;A2为乙醇代替DPPH溶液时的吸光度。
1.2.2.2 羟基自由基清除率测定[6]
向1.0mL浓度(mg·mL-1)分别为0.5、1.0、1.5、2.0、2.5的无花果多糖样品溶液中加入1.0mL邻二氮菲溶液(0.75mmol·L-1,溶解于95%乙醇中)、2.0mL磷酸盐缓冲溶液(0.2mmol·L-1,pH值7.4)和1.0mL蒸馏水。混合均匀后,加入1.0mL硫酸亚铁(0.75mmol·L-1)和1.0mL H2O2(0.01%),37℃反应1h,测定562nm处的吸光度。羟基自由基清除率按式(2)计算:
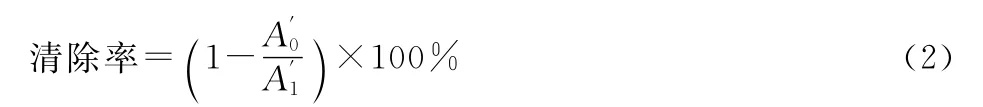
式中:A′0为样品和反应溶液的混合物的吸光度;A′1为蒸馏水代替样品溶液的吸光度。
1.2.2.3 超氧阴离子自由基清除率测定[7]
向1.5mL浓度(mg·mL-1)分别为0.5、1.0、1.5、2.0、2.5的无花果多糖样品溶液(溶解于Tris-HCl,pH=8.0,16mmol·L-1)中加入0.5mL NBT溶液(300μmol·L-1,溶解于Tris-HCl,pH=8.0,16 mmol·L-1)、0.5mL NADH溶液(468μmol·L-1,溶解于Tris-HCl,pH=8.0,16mmol·L-1),加入0.4mL PMS溶液(60μmol·L-1)启动反应,25℃水浴5min,测定560nm处的吸光度。超氧阴离子自由基清除率按式(3)计算:

式中:A′′0为蒸馏水代替样品溶液的吸光度;A′′1为样品溶液的吸光度;A′′2为蒸馏水代替PMS溶液的吸光度。
1.2.2.4 还原能力测定[8]
向1.0mL浓度(mg·mL-1)分别为0.5、1.0、1.5、2.0、2.5的无花果多糖样品溶液中加入2.5mL PBS(0.2mol·L-1,pH值6.6)和2.5mL铁氰化钾(1%),混合均匀,50℃反应20min。接着加入2.5 mL三氯乙酸(10%),2 000r·min-1离心10min,吸取上清液2.5mL与0.5mL FeCl3溶液(0.1%)混合,在700nm处测定吸光度。溶液的吸光度越高,表示还原能力越强。
1.2.3 体外抗肿瘤活性的测定
选择HepG-2细胞、SW1116细胞、7901细胞,采用MTT法[9]对无花果多糖的体外抗肿瘤活性进行研究。
将生长至对数期的细胞用胰酶溶液消化,加入培养基,制成细胞浓度为5×104个·mL-1的细胞悬液。将细胞悬液接种于96孔板中,待6h细胞贴壁后,弃培养基。实验设空白组(细胞培养基)、对照组(细胞,细胞培养基)、实验组(细胞,多糖培养基,浓度分别为2.0mg·mL-1、1.5mg·mL-1、1.0mg·mL-1、0.5 mg·mL-1),以上各组设6个复孔。将细胞培养板放入CO2培养箱中培养24h。之后小心弃去培养基,每孔加入MTT 20μL继续培养4h后小心弃去MTT溶液,每孔加入DMSO 150μL,振荡器上振荡10min后,用酶标仪测定590nm处的吸光度。重复3次,各组数据的平均值用于公式计算和统计学分析。
2 结果与讨论
2.1 无花果多糖的体外抗氧化活性
2.1.1 DPPH自由基清除率
DPPH自由基作为一种稳定的自由基,可清除其它自由基,清除率越大表明抗氧化能力越强[10]。3种无花果多糖对DPPH自由基的清除率如图1所示。
由图1可知,所有样品对DPPH自由基的清除率都与浓度呈正相关。3种样品对DPPH自由基清除能力大小依次为:FCPS-2>FCPS-3>FCPS-1,在浓度为2.5mg·mL-1时的清除率分别为54.44%、44.21%和43.30%。
2.1.2 羟基自由基清除率
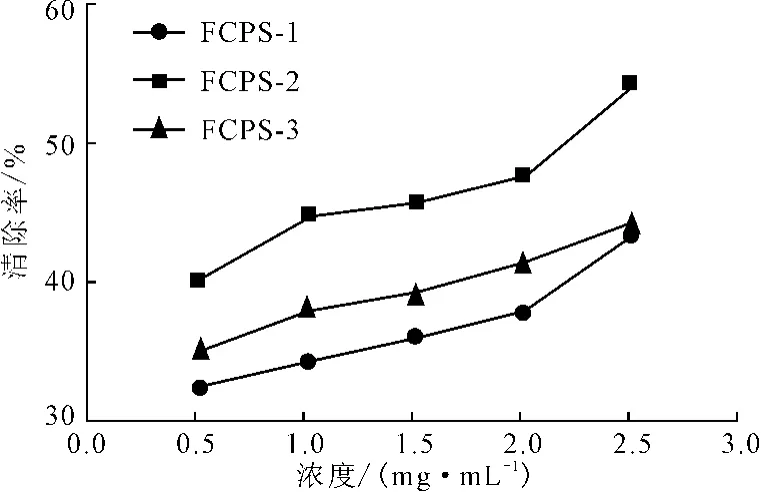
图1 无花果多糖的DPPH自由基清除率Fig.1 The scavenging rate of DPPH radicals by polysaccharides fromFicus carica L.
利用Fenton体系产生的羟基自由基可与邻二氮菲在添加抗氧化剂的条件下反应,可得到受试抗氧化剂清除羟基自由基的情况[11]。3种无花果多糖对羟基自由基的清除率如图2所示。
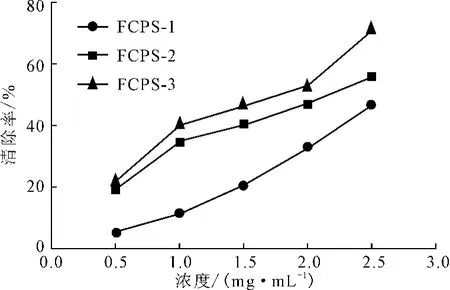
图2 无花果多糖的羟基自由基清除率Fig.2 The scavenging rate of hydroxyl radicals by polysaccharides fromFicus carica L.
由图2可知,所有样品对羟基自由基的清除率都与浓度呈正相关。3种样品对羟基自由基清除能力大小依次为:FCPS-3>FCPS-2>FCPS-1,在浓度为2.5 mg·mL-1时的清除率分别为71.88%、56.25%和46.88%。
2.1.3 超氧阴离子自由基清除率
在检测抗氧化物质的活性时经常把清除超氧阴离子自由基作为其中一个重要的指标[12]。3种无花果多糖对超氧阴离子自由基的清除率如图3所示。
由图3可知,所有样品对超氧阴离子自由基的清除率都与浓度呈正相关。3种样品对超氧阴离子自由基清除能力大小依次为:FCPS-3>FCPS-2>FCPS-1,在浓度为2.5mg·mL-1时的清除率分别为54.60%、51.53%和44.76%。
2.1.4 还原能力
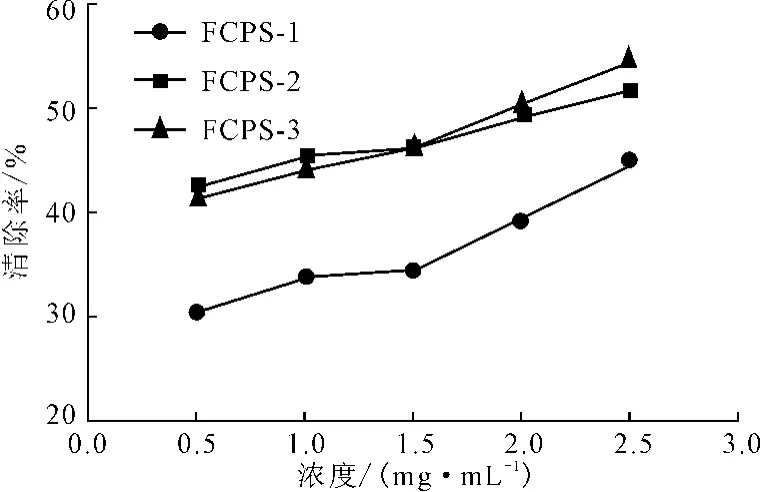
图3 无花果多糖的超氧阴离子自由基清除率Fig.3 The scavenging rate of superoxide anion radicals by polysccharides fromFicus carica L.
抗氧化剂是通过自身的还原作用给出电子而清除自由基的,还原能力越强,抗氧化性越强。3种无花果多糖的还原能力如图4所示。
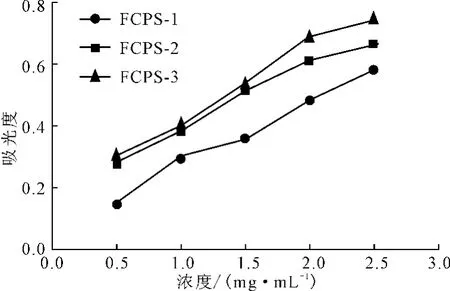
图4 无花果多糖的还原能力Fig.4 The reducing capacity of polysaccharidesfromFicus carica L.
由图4可知,所有样品的还原能力都与浓度呈正相关。3种样品的还原能力大小依次为:FCPS-3>FCPS-2>FCPS-1。
2.2 无花果多糖的体外抗肿瘤活性(图5)
由图5可知,各个浓度的FCPS-1、FCPS-2、FCPS-3对HepG-2细胞(图5a)、7901细胞(图5b)、SW1116细胞(图5c)的增殖均有抑制作用,且随着多糖浓度的升高抑制率升高,其中浓度为2.0mg·mL-1的FCPS-3对HepG-2细胞和7901细胞的抑制率最高,分别达57.30%和54.49%,且呈现剂量-效应依赖关系。对实验所选取的3种肿瘤细胞的抑制作用在其剂量浓度小于1.0mg·mL-1时不显著,当其浓度大于1.0mg·mL-1时,抑制作用开始显现,但并不呈现剂量-效应依赖关系。
3 结论
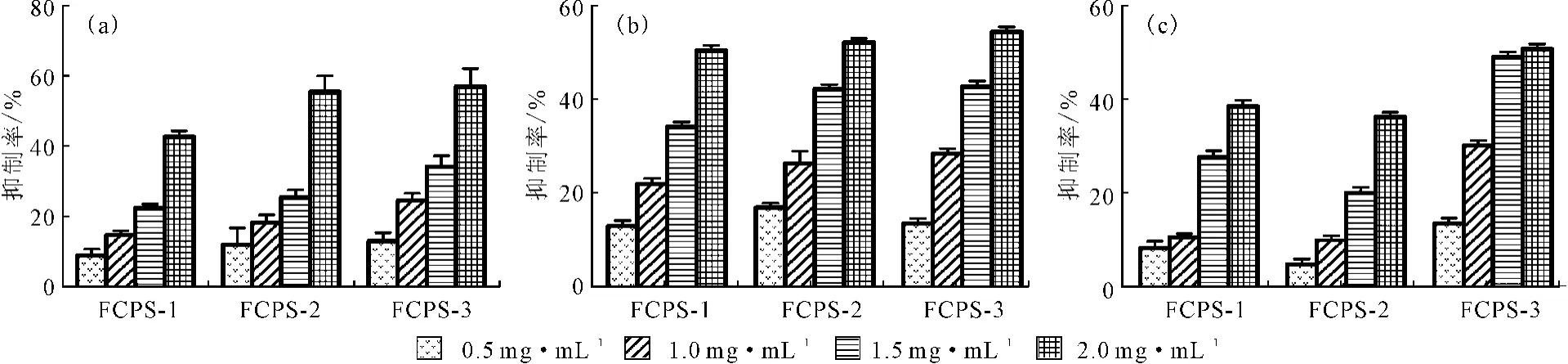
图5 无花果多糖对HepG-2细胞(a)、7901细胞(b)、SW1116细胞(c)的抑制率Fig.5 Inhibition rate of polysaccharides fromFicus carica L.aganist HepG-2 cells(a),7901 cells(b),SW1116 cells(c)
从无花果中提取、分离和纯化得到了均一性无花果多糖FCPS-1、FCPS-2、FCPS-3。无花果多糖均表现出与浓度正相关的体外抗氧化活性,其中FCPS-3具有相对更强的体外抗氧化活性。FCPS-3对HepG-2细胞和7901细胞具有更强的体外抗肿瘤活性,在浓度为2.0mg·mL-1时,FCPS-3对HepG-2细胞和7901细胞的抑制率分别为57.30%和54.49%。表明FCPS-3具有最强的生物活性,可为后续无花果多糖的生物活性研究提供参考。
[1]VEBERIC R,COLARIC M,STAMPAR F.Phenolic acids and flavonoids of fig fruit(FicuscaricaL.)in the northern Mediterranean region[J].Food Chem,2008,106(1):153-157.
[2]TEIXEIRA D M,PATAO R F,COELHO A V,et al.Comparison between sample disruption methods and solid-liquid extraction(SLE)to extract phenolic compounds fromFicuscaricaleaves[J].J Chromatogr,2010,1103:22-28.
[3]SCHEPETKIN I A,QUINN M T.Botanical polysaccharides:Macrophage immunomodulation and therapeutic potential[J].International Immunopharmacology,2006,6(3):317-333.
[4]FAN L,DING S,AI L,et al.Antitumor and immunomodulatory activity of water-soluble polysaccharide fromInonotusobliquus[J].Carbohydrate Polymers,2012,90(2):870-874.
[5]NEGRO C,TOMMASI L,MICELI A.Phenolic compounds and antioxidant activity from red grape marc extracts[J].Bioresource Technology,2003,87(1):41-44.
[6]SUN Y X,WANG S S,LI T B.Purification,structure and immunobiological activity of a new water-soluble polysaccharide from the mycelium ofPolyporusalbicans(Imaz.)Teng[J].Bioresource Technology,2008,99(4):900-904.
[7]ROBAK J,GRYGLEWSKI R J.Flavonoids are scavengers of superoxide anions[J].Journal of Biochemical Pharmacology,1988,37:837-841.
[8]OYAIZU M.Studies on products of browning reaction-antioxidative activities of products of browning reaction prepared from glucosamine[J].Japanese Journal of Nutrition,1986,44(6):307-315.
[9]TAO Y Z,ZHANG Y Y,ZHANG L N.Chemical modification and antitumor activities of two polysaccharide-protein complexes fromPleurotustuber-regium[J].International Journal of Biological Macromolecules,2009,45:109-115.
[10]彭长连,陈少微,林植芳,等.用清除有机自由基DPPH法评价植物抗氧化能力[J].生物化学与生物物理进展,2000,27(6):658-661.
[11]许向荣,王文华.羟自由基的测定方法[J].中国卫生检验杂志,1997,7(5):311-313.
[12]文镜,贺素华,杨育颖,等.保健食品清除自由基作用的体外测定方法和原理[J].食品科学,2004,25(1):190-195.
Study on Antioxidant and Antitumor Activities of Polysaccharides fromFicus Carica L.in vitro
GUO Run-ni,NI Meng-xiang
(College of Life Science and Technology,China Pharmaceutical University,Nanjing210009,China)
The homogeneous polysaccharides FCPS-1,FCPS-2and FCPS-3were extracted,separated and purified fromFicuscaricaL..Theirinvitroantioxidant activities were studied by scavenging rate determination of DPPH radicals,superoxide anion radicals,hydroxyl radicals and reducing capacity.Theirinvitroantitumor activities were evaluated by MTT assay.Results showed that,three polysaccharides exhibitedinvitroantioxidant activities in a dose-dependent manner.FCPS-3presented relatively stronger antioxidant activity.Among three polysaccharides,FCPS-3showed higherinvitroantitumor activities against HepG-2and 7901cells.At concentration of 2.0mg·mL-1,the inhibition rates of FCPS-3on HepG-2and 7901cells were 57.30%and 54.49%,respectively.These results indicated that polysaccharides fromFicuscaricaL.could be explored as potential natural antitumor agents.
polysaccharides fromFicuscaricaL.;antioxidant activity;antitumor activity
O 629.12
A
1672-5425(2015)03-0049-04
10.3969/j.issn.1672-5425.2015.03.012
2014-11-30
郭润妮(1990-),女,安徽人,硕士研究生,研究方向:微生物与生化药学,E-mail:guorunni@126.com;通讯作者:倪孟祥,副教授,E-mail:nimx2000@aliyun.com。

