大花红山茶花粉形态特征和培养条件及其储藏过程的生理动态分析
贾文庆,王少平,李纪元
(1 中国林业科学研究院亚热带林业研究所,浙江富阳311400;2 河南科技学院 园艺园林学院,河南新乡453003)
大花红山茶(Camellia magniflora)为山茶科山茶属内罕见的天然八倍体物种,其花大如牡丹,艳红亮丽;茶籽榨油,既为高级食用油,又可制成高级化妆品,具有极高的观赏价值和经济价值[1-3]。分布在低山地区而具有较强的抗寒、抗病能力,因而是一种重要的遗传种质资源。红山茶组(Sect.Camellia)多种植物开花量大,但花径小,抗性差。因此,开展红山茶组种类与山茶的种间杂交工作,是培育大花、抗性强观赏品种最具潜力的途径之一。
杂交育种是培育园林植物新品种最有效、最常用的手段之一,杂交经常遇到花期不遇、远距离杂交的实际问题,这就需要采集和保存花粉,花粉生活力是评价贮藏成败的主要标志,离体培养法是检测花粉萌发率最准确的方法之一[4-6]。有关大花红山茶花粉生活力及贮藏特性尚未见报道。当前,有关花粉保存的研究多集中在不同贮藏方法(温度、湿度等)和萌发率的关系,赵文飞等[7]、谭健晖[8]、刘艳萍等[9]研究发现:花粉保存期间,内部发生一系列的生理代谢反应,活力逐渐下降,而花粉中的保护酶类能够清除氧自由基,延缓衰老,因此,保护酶活性的高低也是反映花粉活力的重要指标。本试验以大花红山茶花粉为试验材料,使用扫描电子显微镜观察了花粉表观形态,采用离体培养法研究了花粉的萌发特性,并探讨了不同贮藏方法对花粉萌发率、SOD、POD 和CAT 活性的影响,旨在找出大花红山茶花粉生活力测定的快速准确方法,从花粉的酶活性方面对花粉贮藏期间的生理生化反应进行探索,以期为开展山茶属种间杂交育种及亲本选择提供依据。
1 材料和方法
1.1 试验材料
试验于2013 年在中国林业科学院亚热带林业研究所山茶资源圃进行。材料为生长健壮的树龄为15a的大花红山茶植株。2013年2月上旬上午10时采集盛花期微开花朵,把花药剪下放到硫酸纸上,常温放置24h让其自然散粉,收集花粉,一部分用于花粉生活力测定,一部分真空干燥6h后转入离心管密封保存,备用。
1.2 花粉形态扫描电镜观测
将真空干燥花粉均匀撒于贴有双面胶的样品台上,放在日立SU-1510扫描电镜下观察,记录极轴(P)值、赤道长度(E)值,观察描述、记录花粉的表面纹饰。花粉形态的描述主要依据王开发和王宪曾(1983)的《孢粉学概论》中的名词术语和定义。
1.3 不同培养基对大花红山茶花粉萌发的影响
在预备试验基础上,共设30个固体培养基,基础成分为:100mg·L-1KNO3+50mg·L-1Mg-SO4+300mg·L-1Ca(NO3)2,添加不同浓度的硼酸、蔗糖,浓度梯度见表1,pH 5.8。用毛笔蘸取花粉播于载玻片培养基上,放入培养皿里浸湿的吸水纸上,加盖。培养条件为(25±1)℃,全光照培养。每处理设置3重复,每重复观察3个视野,总计观察花粉数大于150粒,计算花粉萌发率[7]。
花粉萌发率(%)=花粉管长度大于花粉直径的花粉数/观察花粉数×100%
1.4 不同贮藏方法对大花红山茶山茶花粉萌发、保护酶活性的影响试验
将真空干燥的花粉,设置常温、4 ℃(低温)、-20 ℃、-80 ℃(超低温)4种贮藏温度,将花粉装入放有硅胶干燥剂7mL试管中,用棉花封口,每贮藏温度放置10~15 支。贮藏24、40、72、120、184、264、100、360d后,从4种贮藏条件中各取出1支花粉,用少许采用1.2所得最佳培养基测定萌发率,其余花粉用于保护酶活性测验。
1.5 不同贮藏方法对保护酶活性的影响试验
酶液的提取:准确称取1.000g大花红山茶花粉,放入4 ℃预冷玻璃研钵中,加入少许PVP、石英砂,然后加入10 mL 0.05 mol·L-1磷酸缓冲液(pH 7.0),匀速研磨30~40S,然后将混合液倒入试管中于10 000r/min冷冻离心机里离心20min。上清液即为酶液。
超氧化物岐化酶(SOD)活性采用氮蓝四唑法(NBT)[10]测定;过氧化氢酶(CAT)活性采用紫外吸收法[11]测定;过氧化物酶(POD)活性采用愈创木酚显色法 进行测定。
数据用SPSS 11.0进行方差分析,采用Excel 2003进行绘图。
2 结果与分析
2.1 大花红山茶表观形态
从图1 可以看出大花红山茶花粉粒为椭球形(图1,A~F),大花红山茶花粉粒平均极轴长为71.05μm,平均赤道轴长约34.83μm,与本组卵果红山茶大小相似度较高[12],属于大型花粉。畸形花粉较多,占24.56%,呈船型或不规则形状(图1,A、B)。大花红山茶花粉粒纹饰为穴状、小沟状雕饰纹,网眼为圆形、长条形、三角形及不规则形。网脊粗大弯曲,粗细均匀,网眼大,形状及大小不规则,网眼平均间距约为1.79μm,分布不均匀(图1,H、I)。花粉赤道面观长椭圆形,两端渐宽,极面观三裂圆形,花粉具3孔沟,沟宽约5μm,沟长快达到花粉粒两端,长度平均约70.65μm,沟区有光滑的沟膜,沟界极区平均宽约6.53μm。
2.2 不同培养基对大花红山茶花粉萌发的影响
表1表明,大花红山茶在蔗糖、硼酸浓度都为0和单独添加蔗糖或者硼酸时萌发率不高,在空白基础培养基上萌发率为16.55%,当单独使用蔗糖时,浓度为150g·L-1萌发率最高,达41.88%;单独使用硼酸时,浓度为20 mg·L-1萌发率最高,达29.66%。高浓度的蔗糖和硼酸使花粉萌发率下降,供试的30种培养基中,硼酸和蔗糖浓度分别为20 mg·L-1、150g·L-1时,花粉萌发率最高,达68.10%,显著高于其它组合,为大花红山茶最佳花粉萌发培养基。

图1 大花红山茶花粉扫描电镜观察Fig.1 Pollen morphology of C.magniflora under SEM

表1 不同培养基对大花红山茶花粉萌发率的影响Table 1 Effects of different media on pollen germination of C.magniflora
2.3 不同贮藏温度、贮藏时间下花粉萌发情况
图2表明,不同贮藏温度与时间对大花红山茶花粉活力影响显著,贮藏后花粉萌发率差异较大。常温贮藏的花粉随贮藏时间的延长花粉萌发率迅速降低,贮藏120d 后花粉失去生活力,不再萌发;4℃下贮藏184d时花粉萌发率降为0。0~120d时,-20 ℃、-80 ℃贮藏条件花粉活力出现较快的下降趋势;贮藏120~360d,-20 ℃、-80 ℃贮藏条件花粉活力下降速度较慢,至360d时,-80 ℃贮藏的花粉仍保持较高的萌发率,达39.40%,-20℃贮藏的花粉萌发率也达到21.30%。综上所述,适宜花粉贮藏的条件为-80 ℃。
2.4 不同贮藏温度与时间对大花红山茶花粉保护酶活性的影响
2.4.1 不同贮藏温度和时间对大花红山茶花粉超氧化物歧化酶活性的影响 从表2和图3可以看出,不同的贮藏时间和贮藏温度对SOD 活性有显著影响(P<0.01)。由图2 可知,大花红山茶花粉SOD 活性在常温、4 ℃贮藏条件下,随贮藏时间的延长呈先升高再迅速下降趋势,最高峰分别出现在贮藏后72d和120d,说明花粉常温、4 ℃贮藏后超氧自由基不断增加,诱导SOD 的活性增强,随着时间的延长,SOD 活性随萌发率的下降而迅速下降。4℃下贮藏264d花粉萌发率降为0时的SOD 活性仅为最高峰的4.31%。-20 ℃、-80 ℃贮藏0~184d,超氧化物歧化酶活性呈缓慢下降-缓慢上升-再下降,比较而言,-80 ℃贮藏的大花红山茶花粉SOD 活性下降幅度曲线明显较-20 ℃平缓。-20℃、-80 ℃贮藏184~360d,-80 ℃下超氧化物歧化酶活性呈缓慢上升的趋势,而-20 ℃下则呈现持续下降的趋势;-80 ℃贮藏360d,SOD 活性为314,达到原来的1.35倍,说明大花红山茶花粉仍保持较高的活性。
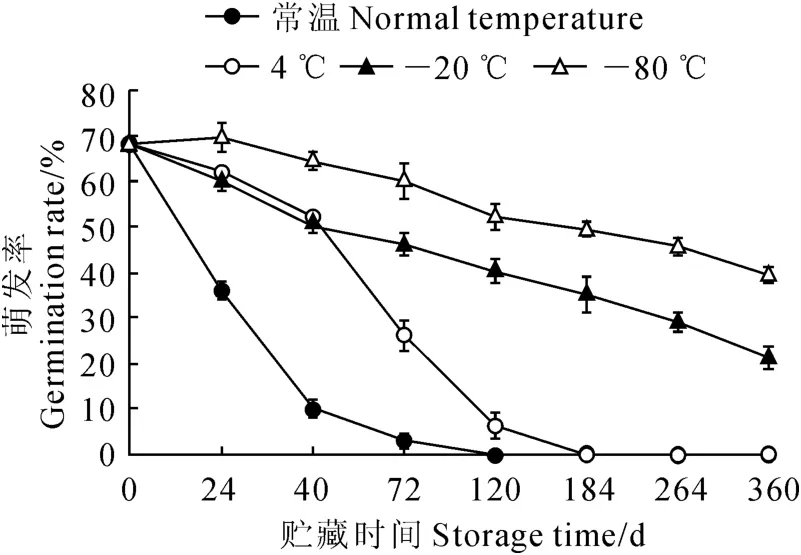
图2 不同贮藏方法对花粉萌发的影响Fig.2 Effects of different storage methods on pollen’s germination

图3 不同贮藏时间及贮藏温度对大花红山茶花粉SOD 活性的影响Fig.3 Effects of different storage times and temperatures on pollen’s SOD activity
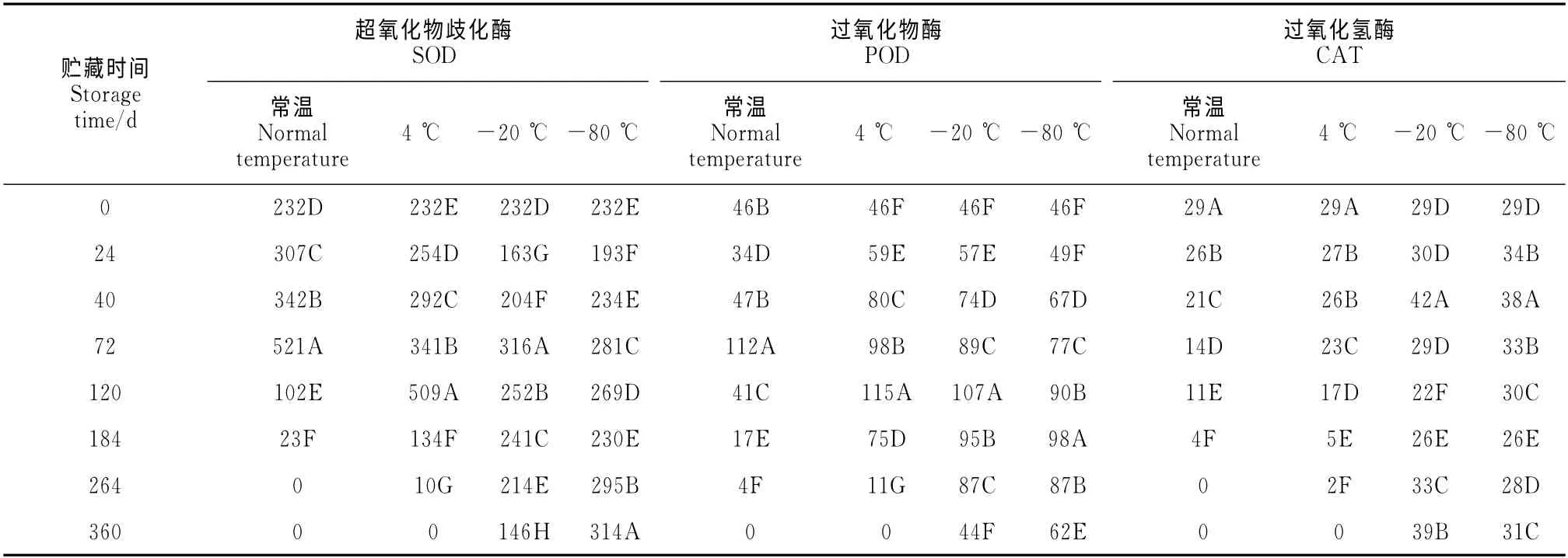
表2 不同贮藏温度与时间对大花红山茶花粉保护酶活性的影响Table 2 Effects of different storage time and temperature on pollen’s protective enzymes activity
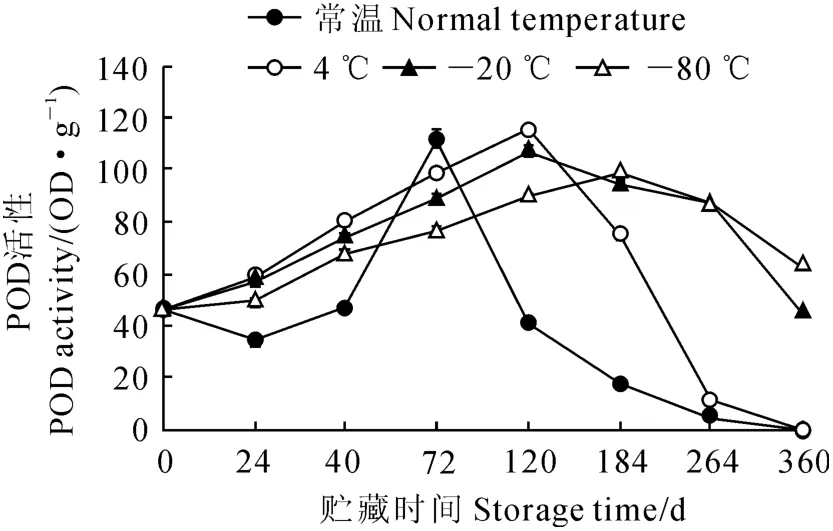
图4 不同贮藏时间及贮藏温度对大花红山茶花粉POD 活性的影响Fig.4 Effects of different storage times and temperatures on pollen’s POD activity

图5 不同贮藏时间及贮藏温度对大花红山茶花粉CAT 活性的影响Fig.5 Effects of different storage times and temperatures on pollen’s CAT activity

表3 花粉萌发率与3种保护酶活性的相关分析表Table 3 The correlation analysis of pollen’s germinationand activities of three protective enzymes
2.4.2 不同贮藏温度和时间对大花红山茶花粉过氧化物酶活性的影响 从表2和图4可以看出,大花红山茶花粉经过不同低温和时间处理后,POD活性变化显著(P<0.01)。常温、4 ℃贮藏下,大花红山茶花粉的过氧化物酶活性随时间的增长,基本呈现逐步升高后迅速下降的趋势,常温保存至72d时,过氧化物酶活性升至112,达到最高,为原来的2.43倍,之后随着时间的增长,大花红山茶花粉自身的保护能力迅速下降,过氧化物酶合成受到抑制,至贮藏264d,降为0;4 ℃贮藏,大花红山茶花粉的过氧化物酶活性最高峰出现在120d,之后随着时间的增长,POD 活性开始迅速降低,到264d时,POD降为11;-20 ℃和-80 ℃贮藏,过氧化物酶活性变化基本一致,呈升高-下降的趋势,最高峰分别出现在120及184d。此时过氧化物酶活性分别为原来的2.33和2.13倍,之后过氧化物酶活性开始下降。360d时过氧化物酶活性分别降为44和62,为原来的0.96和1.35倍,这表明花粉能够及时分解自由基,进而保护花粉减少低温伤害,保持较高的花粉活力。
2.4.3 不同贮藏温度和时间对大花红山茶花粉过氧化氢酶活性的影响 如表2和图5所示,不同贮藏方法对CAT 活性差异显著,常温、4 ℃贮藏温度下,大花红山茶花粉的CAT 活性随贮藏时间的延长,呈现逐渐下降的趋势,分别在贮藏264d和360 d降为0。-20 ℃、-80 ℃贮藏温度下随贮藏时间的延长,大花红山茶花粉的CAT 活性呈现升高-下降-再升高的趋势,总体上-20 ℃贮藏下CAT 高低起伏较大,最高值均出现在40d,最高峰峰值分别为42和38,为原来的1.45倍和1.31倍。
2.5 大花红山茶花粉萌发率与过氧化物酶、过氧化氢酶、超氧化物歧化酶活性的关系
相关分析显示,花粉萌发率与3种保护酶之间呈正相关(表3),花粉萌发率与超氧化物歧化酶活性、过氧化物酶呈正相关,与过氧化氢酶活性呈显著正相关(P<0.01),说明在大花红山茶花粉的贮藏过程中,过氧化氢酶活性对花粉萌发率起着主导作用,即过氧化氢酶活性对花粉萌发率的影响作用大于超氧化物歧化酶和过氧化物酶活性。
3 讨 论
3.1 大花红山茶花粉表观形态
山茶属植物由于种类众多,形态差异较大,其分类上一直存在许多分歧。利用花粉形态作为本属分类的依据就成为比较可靠的方法之一。本研究中首次使用扫描电镜对大花红山茶花粉形态进行观测,其椭球形的花粉形态基本符合山茶属花粉形态多为球形、长球形和扁球形的一般特征 ,但与倪穗等[12]对红山茶组其它27个种的花粉形态研究结果相比,大花红山茶的花粉表观形态与之差异较大,主要表现在:(1)本种极面观呈正三角形,沟界极区较宽,其它种则相对较窄[12];(2)本种花粉粒纹饰为穴状、小沟状雕饰纹,其它种花粉外壁纹饰一般为皱沟状、皱波状、皱波状-颗粒状和颗粒状4种类型。(3)大花红山茶花粉粒平均极轴长为71.05μm,除与卵果红山茶基本相当外,其它种均较小。这些差异表明,大花红山茶在山茶属中可能具有较特殊的分类地位和系统演化地位,本种与其它红山茶组植物花粉外壁纹饰的亚显微特征不同对其分类地位及演化关系还有待于进一步研究。
3.2 不同培养基及不同贮藏方法对花粉萌发的影响
离体萌发法结果准确、简单易行,因此应用广泛[4-9]。山茶科植物花粉萌发所需的蔗糖、硼酸浓度一般分别为100~200 g·L-1,50~100 mg·L-1[12,14]。本试验结果显示,大花红山茶花粉萌发最适蔗糖、硼酸浓度分别为150g·L-1、20 mg·L-1,与多数山茶科植物花粉萌发所需蔗糖浓度范围相一致,但仅需要较低浓度的硼酸。
适宜的贮藏方法可以确保杂交育种获得较多群体数量的后代。低温贮藏可降低花粉的生理功能,适宜较长时间保持花粉生活力[4-7]。本试验结果表明,经过不同贮藏处理的花粉发芽率较初始发芽率均有不同程度的降低,常温、4 ℃贮藏的花粉发芽率下降明显,常温保存的花粉120d后完全丧失生活力。4 ℃条件下的花粉生活力在贮藏前40d时萌发率下降缓慢,而后随着贮藏时间的增加而迅速下降,贮藏264d时,花粉完全丧失生活力。说明4℃条件只适合花粉短期贮藏。在-80 ℃贮藏条件下,花粉贮藏前期生活力保持相对平衡状态,贮藏24d时达到最高值,之后出现下降的趋势,贮藏360d的花粉萌发率仍达39.40%。这表明大花红山茶花粉在超低温贮藏条件下能保持较高的生活力。不同山茶花种间花期相差很大,有夏季开花的杜鹃红山茶,秋季开花的油茶,贮藏大花红山茶花粉作为父本,对于种间杂交、解决花期不遇、培育新品种具有重要的意义。
3.3 花粉萌发率与3种保护酶活性
适宜的贮藏方法可使花粉生活力和保护酶活性保持较高的水平[7-9],本试验表明:-20 ℃、-80 ℃下贮藏花粉,贮藏360d后,花粉萌发率为21.30%,39.40%,分别达到原来的31.27%和57.86%,3种保护酶活性基本在原来的62.93%以上,说明贮藏360d后花粉生命力旺盛,对活性氧的清除能力强,仍能通过自身协调作用来抑制花粉衰老和失活。
研究花粉在低温胁迫条件下的生理生化变化,有助于了解低温胁迫对花粉伤害的机制,同时也可为今后花粉贮藏方法的选择提供理论依据。逆境条件下,植物通常可以提高保护酶活性,清除过多的活性氧,维持代谢平衡,保持膜系统的稳定,从而避免或减少伤害[15-17]。降低贮藏期间花粉含水量以及贮藏温度有利于降低贮藏时的生理活动,减少营养消耗,但随着贮藏时间的增长,自由基增多,出现膜脂过氧化作用,花粉为了避免或减少伤害,启动3种保护酶进行保护,清除活性氧自由基,维持细胞膜稳定。但随贮藏时间的延长,花粉细胞水分胁迫加重,自由基出现累积,花粉细胞衰老出现氧化胁迫,大花红山茶花粉的3种保护酶酶活性不足以消除因胁迫而造成的伤害,致使花粉生活力逐渐下降,最后死亡[7-9]。本试验发现:花粉萌发率下降最快时期(常温下24~72d,4 ℃贮藏40~120d,-20 ℃、80 ℃下40~184d),CAT、POD、SOD 酶活性迅速增高,先后出现高峰值,之后又逐渐下降,其中-20 ℃、80℃下CAT 的活性随着贮藏时间的进一步延长,又出现升高的趋势。这表明在花粉贮藏过程中,萌发率下降最快期间,3种保护酶活性迅速增高,出现最高峰值,活性增强,协同作用以抵抗胁迫,在此前后花粉萌发率出现大幅度下降,推测3种保护酶活性毕竟是有限的,当其活性不足以消除因胁迫而造成的伤害,花粉也会逐渐死亡,表现出花粉生活力迅速下降[7-9]。
花粉生活力在贮藏过程中逐渐降低,花粉细胞内部的生理代谢活动与加速和抑制其衰老、失活的诸多因子紧密相关,花粉萌发率是花粉内部保护机制效果的外在表现[7-9]。本试验显示:常温下随着贮藏时间的延长,SOD 首先启动,POD 随后启动,而后3种保护酶活性随着花粉萌发率的快速下降而迅速下降,这表明常温下SOD 较为敏感,常温不适合花粉的长期保存。4 ℃、-20 ℃下,POD 高峰值首先出现,但单一的SOD 的抗氧化能力有限,随着胁迫的加剧,SOD 启动,在120d出现最高值,之后迅速下降,这段时间也是花粉活力迅速下降的时期,这表明,4 ℃下POD 敏感,适合花粉1~6 个月的保存;-80 ℃下CAT 高峰值首先出现,贮藏360d的花粉萌发率仍达39.40%。这表明CAT 为零下低温敏感性保护酶,-80 ℃适合大花红山茶花粉的长 期保存。
[1] CHEN Q M(陈钦铭),JIANG Y W(江永文).The octoploid Camellia magniflorais good[J].Plants(植物杂志),1988,(5):17(in Chinese).
[2] LI J Y(李纪元),XIE M CH(谢明初),WANG X H(王新海),et al.Germplasm resources of Camellia magnifloraand potential utilization[J].Journal of Zhejiang Forestry Science and Technology(浙江林业科技),2002,22(6):56-58(in Chinese).
[3] ZHANG H(张 华).The gomphosis stem grafting technology of Camellia magniflora on hammering block[J].Journal of Hunan Forestry Science and Technology(湖南林业科技),2005,32(3):62-63(in Chinese).
[4] 潘瑞炽.植物生理学[M].北京:高等教育出版社,2001:257-261.
[5] JIA W Q 贾文庆),YOU Y(尤 扬),LIU H CH(刘会超),et al.Morphological observation and pollen viability of dwarf peony[J].Journal of Northwest Forestry University(西北林学院学报),2012,27(5):76-79(in Chinese).
[6] GUAN Y(管 雨),JIA W Q(贾文庆),LIU H CH(刘会超),et al.Pollen viability and storage of Chaenomeles sinensis[J].Journal of Zhejiang Forestry College(浙江农林大学学报),2012,29(5):790-794(in Chinese).
[7] ZHAO W F(赵文飞),XING SH Y(邢世岩),JIANG Y X(姜永旭),et al.Effects of storage time on germination percentage and protective enzymes activity of Ginkgo biloba L.pollen[J].Journal of Wuhan Botanical Research(武汉植物学研究),2004,22(3):259-263(in Chinese).
[8] TAN J H(谭健晖).Effects of storage temperature and storage time on germination rate and protective enzymes activity of Pinus massoniana pollen[J].Scientia Silvae Sinicae(林业科学),2011,47(9):28-32(in Chinese).
[9] LIU Y P(刘艳萍),ZHU Y L(朱延林),MA Y T(马永涛),et al.Effects of different storage conditions on germination rate and protective enzymes activity of Magnolia ill,flora Desr.pollen[J].Journal of Northeast Forestry University(东北林业大学学报),2013,42(4):59-61(in Chinese).
[10] 李合生,孙 群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:164-167.
[11] ORMAN R G.Peroxede levels and the activities of catalase,peroxidase and indoleacetic acid oxidase during and after chilling cucumber seedlings[J].Plant Physiology,1980,65:407-408.
[12] NI S(倪 穗),LI J Y(李纪元),TIAN M(田 敏),et al.Pollen exine sculpture of Sect.Camellia in genus Camelliaand its taxonomic significance[J].Journal of Nanjing Forestry University((Nat.Sci.Edi.)(南京林业大学学报·自然科学版),2007,31(4):16-20(in Chinese).
[13] XU L(许 林),DU K B(杜克兵),CHEN F ZH(陈法志),et al.Pollen morphology,vitality and storage capacity of Camellia rosthorniana Hand.-Mazz[J].Acta Horticulturae Sinica(园艺学报),2010,37(11):1 857-1 862(in Chinese).
[14] HUANG Y F(黄永芳),WU X H(吴雪辉),HE M E(何美儿),et al.Studies on the pollen storage and viability of 3oil-tea species[J].Journal of Fujian College of Forestry(福建林学院学报),2011,31(1):56-59(in Chinese).
[15] CAO X Q(曹锡清).Effect of lipid peroxidation on cell and organism[J].Progress in Biochemistry and Biophysics(生物化学和生物物理进展),1986,13(2):17-23(in Chinese).
[16] AKHOND M A Y,MOLLA M A H,ISLAM M O,et al.Cross compatibility between Abelmoschus esculentus and A.moschatus[J].Euphytica,2012,114(3):175-180.
[17] MILTIADIS V,PORLINGIS I C.Effect of temperature on pollen germination and pollen tube growth,effective pollination period and fruit set of pear[J].Hort.Science,1985,20(4):733-735.

