人毛乳头细胞微囊诱导大鼠足垫毛囊形成模型的建立
林常敏, 蔡湘娜, 蔡博治, 李 宇, 黄 铿
实验研究
人毛乳头细胞微囊诱导大鼠足垫毛囊形成模型的建立
林常敏, 蔡湘娜, 蔡博治, 李 宇, 黄 铿
目的 建立可靠的、异种毛乳头诱导毛发形成的动物模型。方法 以局部注射方式将毛乳头细胞微囊移植至大鼠足垫。移植后第2周至10个月期间定期取材,观察毛囊结构形成的过程,免疫组化追踪毛囊形成过程K15(Keratin15,角蛋白15)的时空变化。结果 移植后第10周,移植部位皮肤出现肉眼可见的毛发纤维。表皮干细胞标记物K15免疫组化染色显示,处于毛乳头细胞微囊上方的表皮干细胞逐渐向皮下组织迁移。结论 本研究完全排除了受体动物自身毛囊细胞的干扰,为研究毛囊发育过程中上皮细胞与真皮细胞间相互作用的调节机制提供了理想的动物模型。
毛囊; 毛乳头; 诱导; 动物模型; 足垫
在毛囊重建、毛发再生及毛囊生物学相关研究中,建立合适的毛发诱导动物模型是实验成功的前提。自20世纪70年代,以大鼠、小鼠、裸鼠作为受体的毛发诱导模型相继建立[1- 4]。然而,目前毛发诱导模型尚存在以下问题:⑴上述实验所用模型大部分为有毛囊结构的鼠耳或存在退化毛囊结构的裸鼠,无法排除移植部位自身残存的毛囊结构的影响;⑵缺乏标准化的操作规范,包括诱导的部位、深度、范围等,影响了诱导结果的可信度及稳定性[5- 6]。自2008年1月至2013年1月,我们选用大鼠足垫(先天无毛区)为研究对象,以排除动物受体自身毛囊细胞对实验的干扰;并在本课题组前期研究的基础上,将相同来源、相同数量的人头皮毛乳头细胞APA微囊移植至大鼠足垫皮下,诱导局部毛囊重建和毛发再生,同时规范了微囊移植的部位、层次、范围,拟进一步改良构建一个可靠而稳定的人头皮毛乳头细胞,诱导大鼠足垫毛囊结构形成模型。同时,追踪基底层表皮干细胞标记物在毛囊再生过程中的走向,以期获得表皮干细胞存在向毛囊上皮细胞分化潜能的依据。
1 实验方法
1.1 人头皮毛乳头细胞微囊诱导大鼠足垫毛囊形成模型的构建 人头皮毛乳头的分离和培养采用本课题组建立的“改良一步酶消化法”并加以改进[7]。毛乳头细胞微囊化参照Lin和Sun的方法并进行改良[8]。取体外培养了3 d的毛乳头细胞微囊进行移植实验。移植前,以无血清培养液培养毛乳头细胞微囊1 d;用1 ml注射器抽适量的毛乳头细胞微囊,排空培养液,换16号针头,自足趾、足掌交界处中点进针至足后跟的皮下组织浅层(注意控制进针深度)约2.0 mm处,边退针边将0.3 ml的人头皮毛乳头细胞微囊注入,范围2.0 mm×8.0 mm~2.0 mm×10.0 mm,以EC生物胶封闭进针口;对侧足垫注入等体积人成纤维细胞微囊作为阴性对照组。术后2~8周,每周取材1次,以后第10、12、16、20、28、32、40周取材,组织石蜡包埋、切片,观察足垫皮肤组织形态的变化。1.2 石蜡切片的制备 大鼠处死后立即沿足垫边缘剪下整个足垫皮肤及皮下组织,沿横轴修成4小块,分别转入包埋盒,4%中性多聚甲醛室温固定4 h;常规脱水、透明、包埋、切片、HE染色或免疫组化染色。
1.3 苏丹Ⅲ染色 取移植后第10周肉眼毛发纤维形成部位的足垫皮肤进行冰冻切片;70%乙醇固定1 min;苏丹Ⅲ乙醇溶液浸染30 min;70%乙醇洗去多余的染料、水化、复染、固定、观察拍照。
1.4 K15免疫组织化学染色 K15 浓度1∶100,常规程序进行。
2 结果
2.1 毛乳头细胞APA微囊的形态 微囊肉眼呈透明、圆形微粒;相差显微镜下观察:毛乳头细胞微囊呈圆形,直径400~500 μm,大小均匀,表面光滑,囊中细胞分布均匀,部分细胞聚集成团,形似毛乳头(图1)。
2.2 人头皮毛乳头细胞微囊诱导大鼠足垫毛囊结构形成模型的建立 肉眼观察可见毛乳头细胞微囊移植后10~12周,在足垫后侧2/3处(足弓部)接近微囊注射区周围、足垫与足背交界0.5 mm左右的无毛区观察到异常的毛发纤维,足垫内、外侧均有,毛发2~4根为1撮,长度3.0~4.0 mm,直径较粗,性状接近毛乳头来源的人毛发,无色,生长方向与足背毛发纤维的方向相反(图2)。毛发纤维维持4周左右脱落,并观察至40周,未再次观察到毛发纤维产生。HE染色观察结果见表1,图3。
2.3 K15免疫组化染色结果 K15为表皮干细胞、尤其是毛囊干细胞的特异性标记物,大鼠足垫毛囊诱导模型K15染色结果显示:表皮基底层部分细胞、微囊周围、真皮层部分杂乱的细胞及诱导形成的毛囊毛球部周围可观察到K15的表达,以真皮层新生毛囊结构表达最强(图4,5)。
3 讨论
毛乳头诱导毛囊结构重建的功能已被大量的实验所证实,但实验所用模型大部分为有毛囊结构的鼠耳或存在退化毛囊结构的裸鼠。1992年,CA Jahoda等将大鼠足垫皮肤游离后形成表皮- 毛乳头细胞凝胶- 真皮的复合体移植至裸鼠背部,形成了毛囊结构,但由于足垫皮肤的完整结构受到破坏,加上移植复合体的体积很小(3 mm×4 mm),依然无法排除移植部位自身残存毛囊结构的影响。因此,相关的研究,包括毛乳头诱导毛囊再生的分子机制、毛囊再生过程相关信号通路的相互作用机制等都受到动物模型的制约[9- 12]。
本实验将选择大鼠足垫这个先天毛囊缺如的部位,直接进行注射制备动物模型,既保持了足垫皮肤的完整性,又充分排除了来自移植体、受体自身的影响。10周后,在移植部位及其周围形成肉眼可见的毛发纤维,组织切片上还观察到毛囊的性状与其细胞来源的人毛囊结构相似,并存在成熟的皮脂腺结构。该动物模型的建立,为进一步研究毛囊再生启动过程中相关信号分子的作用机制奠定了基础。再则,利用大鼠足垫这个特殊部位诱导毛囊结构的重建,可以观察毛囊从启动发育- 不成熟结构- 形成成熟结构的完整过程,与毛囊的胚胎发生非常相似,对于研究毛囊发生的启动机制,揭开第一真皮信号、第一表皮信号及毛囊启动过程表皮- 真皮的相互作用有重要的意义。大鼠足垫移植部位组织学研究显示,实验组足垫皮肤形成的毛囊数量(30~40个)多于所植入“人工毛乳头”( 15~20个)的数量,这一发现与我们的“人工毛乳头”鼠耳皮下移植实验结果一致,说明 “人工毛乳头”诱导毛囊形成的机制十分复杂,它既可以通过某些信号传导系统启动真皮与上皮间相互作用而形成毛囊,也可能直接参与毛囊结构的组织构成。R Michel等研究了表皮细胞中K19的表达,K19表达细胞在表皮中所占数量较少,且大部分位于毛囊外根鞘隆突部,以氚标记的胸腺嘧啶核苷酸标记K19细胞证明其为慢循环细胞,这些特征均符合传统对表皮干细胞的认识[13- 14]。因此,K19可作为表皮干细胞的一个表面标记。此外,考虑到有实验发现毛囊隆突部表皮干细胞表达K15(keratin 15,角蛋白15),而且在干细胞的分化过程中,K15表达的减少较K19表达的减少更早;K15阴性而K19阳性的细胞可能是“早期”短暂扩增细胞,故在鉴别表皮干细胞时K15可能较K19更有意义。为此,本实验选择K15作为追踪基底层表皮干细胞迁移的标记[15]。本实验观察到,位于毛乳头细胞微囊移植部位之上的表皮干细胞逐渐地向皮下组织迁移,并在毛乳头细胞微囊及其周围聚集(图6)。初步证实在毛乳头细胞产生的诱导信号影响下,表皮干细胞存在两个分化方向,即向上分化为表皮细胞,向下分化为毛囊上皮细胞。但是,在这个过程中,表皮干细胞是直接转化为毛囊上皮细胞,或是首先转化为类毛囊干细胞,再进一步分化成毛囊的各种上皮细胞,尚待进一步研究。
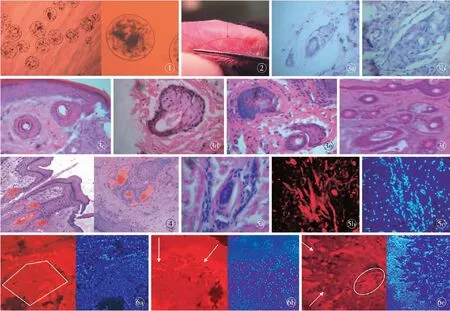
图1 倒置相差显微镜下的毛乳头细胞微囊(左:×40,右:×100) 图2 毛乳头细胞微囊移植后10~12 周(箭头所示) 图3 毛乳头细胞微囊诱导大鼠足垫形成毛囊纵切面(HE ×200) a.移植后第3周 b.在微囊周围聚集形成毛囊、皮脂腺样结构 c.移植后第4周 d.移植后第8周 e.移植后足中第10周 f.移植后足跟第10周 图4 毛乳头细胞微囊大鼠足垫移植后第10周(左:×200,右:×400 ) 图5 人毛乳头细胞诱导大鼠足垫新生毛囊形成时K15呈强阳性表达(×200) a.HE染色 b.K15免疫荧光染色 c.相应的DAPI染色显示的细胞核结构 图6 毛乳头细胞微囊诱导大鼠足垫形成过程上皮细胞的迁移 a.K15荧光免疫组化染色见皮下组织中微囊周围聚集大量K15阳性细胞(左),DAPI染色显示核结构(右) b.K15荧光免疫组化染色见表皮干细胞向下迁移(左),DAPI染色显示核结构(右) c.K15荧光免疫组化染色见表皮干细胞迁移正在形成毛囊样结构(左,箭头示表皮基底层,椭圆形框中为正在形成的毛囊样结构),DAPI染色显示核结构(右)
Fig 1 Microcapsule structures were access with inverted contrast microscope (left: ×40, right:×100). Fig 2 The tenth to the twelfth week after DPCs microcapsules transplantation (the arrows indicated). Fig 3 Longitudinal sections of hair follicles induced by DPC microcapsules (HE×200). a. the third week after transplantation. b. Hair follicles and sebaceous glands were found around the DPC microcapsules. c. the fourth week after transplantation. d. the eighth weeks after transplantation. e. the tenth week after middle site transplantation. f. the tenth week after heel transplantation. Fig 4 DPC microcapsules transplanted into footpads at the tenth week (left: ×200, right: ×400). Fig 5 K15 was strongly expressed at the regenerated hair follicles induced by DPC microcapsules in the footpads. (×200). a. HE staining. b. K15 fluorescent immunohistochemisry staining. c. DAPI showed the nuclei. Fig 6 Epithelial cells migrated from epidermis to dermis after DPC micrcapsultes transplantation. a. K15 fluorescent immunohistochemical showed positive cells gathered around the DPC microcasultes (left, ×100), DAPI showed nuclei (right, ×100). b. K15 fluorescent immunohistochemical showed epithelial stem cells migration (left, ×200), DAPI showed nuclei (right, ×200). c. K15 fluorescent immunohistochemical showed epithelial stem cells migrating and forming hair follicle structures (left, arrow point out the basal layer, hair follicle structure forming within the oval field, ×200), DAPI showed nuclei (right,×200).

表1 人头皮毛乳头细胞微囊诱导大鼠足垫毛囊结构形成的过程
本研究建立了一个异体、异种毛乳头细胞移植诱导毛发形成的动物模型,同时用表皮干细胞标记物的时空表达方式初步解释了该模型毛囊干细胞的来源,第一次提出表皮干细胞的迁移是毛乳头诱导毛囊形成过程毛囊细胞来源的假说,并提供了形态学的直接证据。以大鼠足垫为毛囊结构诱导模型,完全排除了受体动物自身毛囊细胞的干扰,为研究毛囊发育过程中上皮细胞与真皮细胞间相互作用的调节机制、利用相关信号分子开发促进毛囊再生的药物,提供了理想的动物模型,具有重要的基础研究及临床应用价值。
[1] Ohyama M, Zheng Y, Paus R, et al. The mesenchymal component of hair follicle neogenesis: background, methods and molecular characterization [J]. Exp Dermatol, 2010,19(2):89- 99.
[2] 李 晔, 包 旭, 陈 曦, 等. 小鼠毛囊再生与胸腺素β4的促进效应[J]. 中国组织工程研究, 2014,18(11):1687- 1693.
[3] Chermnykh ES, Vorotelyak EA, Gnedeva KY, et al. Dermal papilla cells induce keratinocyte tubulogenesis in culture[J]. Histochem Cell Biol, 2010,133(5):567- 576.
[4] Lo AT, Mori H, Mott J, et al. Constructing Three- Dimensional models to study mammary gland branching morphogenesis and functional differentiation[J]. J Mammary Gland Biol Neoplasia, 2012,17(2):103- 110.
[5] 戚益铭, 褚 蕴, 胡林锋. 体外培养基对人毛乳头细胞增殖影响的研究[J]. 求医问药(学术版), 2012,10 (10):681.
[6] 刘燕茹, 王 琴, 成蓓蓓, 等. 海藻多聚糖硫酸酯对人毛乳头细胞增殖的影响[J]. 中国美容医学, 2012,21 (11):1542- 1543.
[7] 陈先才, 陈海滨, 蔡博治, 等. 胶原酶消化法分离、培养大鼠触须毛乳头的方法[J]. 现代医院, 2011,11(5):20- 21.
[8] Lim F, Sun AM. Microencapsulated islets as bioartificial endocrine pancreas[J]. Science, 1980,210(4472):908- 910.
[9] Soma T, Fujiwara S, Shirakata Y, et al. Hair- inducing ability of human dermal papilla cells cultured under Wnt/β- catenin signalling activation[J]. Exp Dermatol, 2012,21(4):307- 309.
[10] Dickinson LE, Kusuma S, Gerecht S. Reconstructing the Differentiation Niche of Embryonic Stem Cells Using Biomaterials[J]. Macromol Biosci, 2011,11(1):36- 49.
[11] Jaks V, Kasper M, Toftgård R. The hair follicle- a stem cell zoo[J]. Exp Cell Res, 2010,316(8):1422- 1428.
[12] Fang DR, Lv ZF, Qiao G. Dynamic Wnt5a expression in murine hair follicle cycle and its inhibitory effects on follicular in vivo[J]. Asian Pac J Trop Med, 2014,7(4):285- 288.
[13] Rabbani P, Takeo M, Chou W, et al. Coordinated Activation of Wnt in Epithelial and Melanocyte Stem Cells Initiates Pigmented Hair Regeneration[J]. Cell, 2011,145(6):941- 955.
[14] Charruyer A, Ghadially R. What′s new in dermatology:epidermalstem cells[J]. G Ital Dermatol Venerel, 2011,146(1):57- 67.
[15] 杨 青, 李秀兰, 张 杨, 等. 表皮干细胞与毛囊干细胞生物学特性比较[J]. 中国组织工程研究, 2012,16(27):5034- 5048.
Model of hair follicle regeneration model induced by microencapsulated dermal papilla cells
LINChang-min,CAIXiang-na,CAIBo-zhi,etal.
(DepartmentofEmergency,SecondAffiliatedHospital,ShantouUniversityMedicalCollege,Shantou515041,China)
Objective To create a stable animal model for the xenotransplantation of human dermal papilla cells microcapsules into rat footpad to induce the hair follicles formation and growth. Methods Cultured dermal papilla cells were encapsulated and then implanted into the rat footpads. After the xenotransplantation, observed them timely and studied the histomorphology by microscopy from the second week to the tenth month. K15 immunohistochemistry stain and analyzed the relationship between them. Results At the tenth week following transplantation, hair fibers were visible in the footpad. K15 positive cells were transmitting from basal layer to subcutaneous and observed near the dermal papilla cell microcapsules. Conclusion dermal papilla cell microcapsules retain the capacity to initiate follicle regeneration and suitable for allograft or xenotransplatation. The animal model of dermal papilla cells microcapsule induces hair follicles regeneration in rat footpad exclude the effect of hair follicle epithelial cells. It is a stable model for study the interaction of epidermis and dermis during the formation of hair follicle.
Hair follicle; Dermal papilla; Induce; Animal model; Footpad
国家自然科学基金面上项目(81372084,81171832)
515041 广东 汕头,汕头大学医学院 组织学与胚胎学教研室(林常敏);汕头大学医学院第一附属医院 (美容整形外科:蔡湘娜,李 宇;组织工程实验室:蔡博治);汕头大学医学院第二附属医院 急诊外科(黄 铿)
林常敏(1978- ),女,广东汕头人,副教授,博士.
黄 铿,515041,汕头大学医学院第二附属医院 急诊外科,电子信箱:cocolin@stu.edu.cn
10.3969/j.issn.1673- 7040.2015.03.022
R- 332
A
1673- 7040(2015)03- 0186- 04
2014- 02- 08)

