瑞舒伐他汀对自发性高血压大鼠心肌组织SOD、MDA、NO、ET的影响
闫洪娟,谢悦陶,刘 光,于明月,边树怀,罗秋华
(1.邯郸市第一医院 老年病二科,河北 邯郸 056000;2.河北省人民医院 心内一科,河北 石家庄 050000;3.河北医科大学第四医院 心内科,河北 石家庄 050000;4.河北省人民医院 功能检查科,河北 石家庄 050000;5.河北省人民医院 老年病一科,河北 石家庄 050000)
瑞舒伐他汀对自发性高血压大鼠心肌组织SOD、MDA、NO、ET的影响
闫洪娟1,谢悦陶2,刘光3,于明月4,边树怀5,罗秋华1
(1.邯郸市第一医院 老年病二科,河北 邯郸 056000;2.河北省人民医院 心内一科,河北 石家庄 050000;3.河北医科大学第四医院 心内科,河北 石家庄 050000;4.河北省人民医院 功能检查科,河北 石家庄 050000;5.河北省人民医院 老年病一科,河北 石家庄 050000)
目的观察氧自由基损害和血管内皮功能失调与高血压发生的关系及瑞舒伐他汀干预的影响。方法将8只Wistar-Kyoto大鼠(WKY)作为正常对照组;32只自发性高血压(SHR)大鼠,随机分为瑞舒伐他汀低剂量组3.125 mg/(kg·d)、瑞舒伐他汀中剂量组6.25 mg/(kg·d)、瑞舒伐他汀高剂量组12.5 mg/(kg·d)和SHR对照组,每组8只。给药大鼠分别每日给予不同剂量瑞舒伐他汀+1 mL蒸馏水灌胃;SHR对照组给予相同容积的蒸馏水灌胃,测量血压。4周停药,3天后麻醉状态下提取心肌组织,用比色法检测SOD、MDA、NO的水平,免疫组化法测定ET的表达,PCR法测定SODmRNA的水平。结果自发性高血压大鼠SOD活力、SODmRNA表达、NO含量下降,MDA含量、ET-1的表达增强,与正常对照组比较,P<0.05。瑞舒伐他汀干预后上述指标均有改善(P<0.05),且呈剂量相关性。瑞舒伐他汀干预后SHR大鼠血压下降,但无剂量相关性。结论SHR大鼠存在氧化应激反应的增强,瑞舒伐他汀可通过降低氧化应激反应,改善血管内皮功能、降低血压。
自发性高血压大鼠;内皮功能;氧化应激反应;一氧化氮;内皮素;瑞舒伐他汀
[引用本文]闫洪娟,谢悦陶,刘光,等. 瑞舒伐他汀对自发性高血压大鼠心肌组织SOD、MDA、NO、ET的影响[J].大连医科大学学报,2015,37(3):232-236.
在生理条件下,活性氧族(ROS)的生成与清除处于动态平衡状态,不会对机体造成影响,ROS水平由内源性抗氧化系统调节,超氧化物歧化酶(SOD)就是重要的抗氧化酶之一。在高血压状态下,ROS增多,SOD减少,此外,过多的ROS能攻击生物膜中的不饱和脂肪酸,引发脂质过氧化作用,形成脂质过氧化产物,如丙二醛(MDA)。脂质过氧化产物通过链式放大反应放大ROS的作用,因而MDA的含量常可反映机体内脂质过氧化程度和氧化应激水平[1]。
一氧化氮(NO)和内皮素(ET)是血管内皮细胞产生和释放的两种生物学效应相反的舒缩血管因子,正常情况下两者持续不断的释放入邻近血管平滑肌,调节血管的舒缩状态,以维持血压的稳定以及组织的灌流。高血压患者血管内皮损伤,引起炎性细胞黏附、激活和吞噬反应,导致氧自由基大量产生,氧自由基可损伤血管内皮细胞,灭活NO,亦可抑制血管内皮细胞合成与释放NO,造成NO合成、释放相对不足,ET合成、释放相对增加[2]。
本实验通过应用不同剂量的瑞舒伐他汀干预后了解上述指标和SODmRNA表达的变化,探讨其对高血压患者氧化应激及内皮功能的影响及可能的机制,即瑞舒伐他汀是否可以发挥抗氧化、保护内皮的作用及有无量效关系,进而为临床治疗提供实验依据。
1 材料和方法
1.1实验动物
雄性清洁级Wistar-Kyoto大鼠(WKY)8只,购自河北医科大学实验动物中心,雄性清洁级自发性高血压大鼠(SHR)32只,购自北京维通利华动物中心。体重240~260克,常规饲养于河北省人民医院动物中心,实验的环境条件符合中国国家标准《实验动物环境及设施》(GB14925-2001)对动物实验设施的有关标准,动物饲养管理和动物实验操作符合《北京市实验动物管理条例》等法规的要求,经医院动物实验伦理委员会批准。
1.2分组和给药
将8只WKY大鼠作为正常对照组,SHR大鼠随机分为4组,分别为瑞舒伐他汀低剂量组3.125 mg/(kg·d)、瑞舒伐他汀中剂量组6.25 mg/(kg·d)、瑞舒伐他汀高剂量组12.5 mg(kg·d)和SHR对照组,每组8只,给药组间血压差异无统计学意义(P>0.05),对照组及给药组间体重差异无统计学意义(P>0.05)。
适应性饲养2周后,喂药组采用灌胃法于每日16:00分别给予瑞舒伐他汀3.125 mg/(kg·d)、6.25 mg/(kg·d)、12.5 mg/(kg·d)加蒸馏水1 mL灌胃;SHR对照组给予相同容积的蒸馏水,共喂药4周。
1.3标本的收集及检测指标
喂药结束3 d后用鼠尾测压仪测各组大鼠血压。10%水合氯醛(0.5 mL/100 g)腹腔注射,待动物麻醉后迅速开胸,暴露心脏。
1.3.1ET表达测定:取左心室肌肉组织一块,去除表面水分及心脏周围结缔组织,立即置入4%多聚甲醛常规灌注固定,包取蜡块,用免疫组化法测心肌组织ET的表达;判定标准:依照阳性细胞数量,可分为:弱阳性(+ ,指阳性细胞总数在25%以下);中等阳性(++,指阳性细胞总数在25%~49%);强阳性(+++ ,指阳性细胞总数在50%以上)。采用积分综合计量,计算公式为:每组积分=弱阳性标本所占百分比×1 +中等阳性标本所占百分比×2+中等阳性标本所占百分比×3;随机观察10个高倍视野。
1.3.2SOD、MDA、NO含量测定:取左心室肌肉组织一块,去除表面水分及心脏周围结缔组织,按重量体积比为1∶9加生理盐水制备成10%的组织匀浆,1000 r/min离心5 min取上清-20 ℃保存,用比色法测定心肌组织SOD、MDA、NO含量。
1.3.3SOD mRNA的表达量测定:迅速切取一块左室肌肉组织,置于Eppendorf管中液氮冷冻,随后于-70 ℃低温冰箱中保存。设计SOD引物,引物1: 5’-AGCGGATGAAGAGAGGCATG-3’,引物2:5’-ATCACACCAC AAGCCAAGC-3’。迅速取低温冰箱中保存的心肌组织约50~100 mg,加1 mL的Ttizol,4 ℃冰浴中用匀浆器迅速匀浆提取心肌组织总RNA,进行RNA纯度、含量及完整性鉴定,cDNA及目的基因的合成,SOD反应条件为预变性94 ℃ 5 min,95 ℃、56 ℃各30 s,反应进行35个循环,4 ℃保存,对PCR产物进行电泳分析,再用UVP凝胶成像系统进行电泳谱带分析,以特定性扩增产物SOD电泳带峰面积积分值与β-actin电泳带峰面积积分值之比作为SOD的相对表达量。
1.4大鼠血压的测定
实验前后均采用鼠尾血压仪测定大鼠的尾动脉血压,测量非同时3次血压,取平均值。采用中日友好医院生产的RBP-1B型光电法鼠尾血压测定仪测定。连续测3次,每次间隔1 min,以均值作为收缩压值。
1.5统计学方法

2 结 果
2.1各组大鼠体重、收缩压水平的变化
用药后各组大鼠间体重差异无显著性意义(P>0.05)。实验前后,SHR大鼠血压均高于WKY大鼠血压,差异有显著性意义(P<0.05),实验后,瑞舒伐他汀干预组血压下降,与SHR对照组相比,差异有显著性意义(P<0.05),无剂量相关性(P>0.05),但较同组实验前血压虽有下降,差异无显著性意义(P>0.05)。见表1。
2.2各组大鼠心肌组织SOD活力、MDA含量、NO含量及ET-1表达
表1 各组大鼠的血压变化Tab 1 The SBP of each group of rats

表1 各组大鼠的血压变化Tab 1 The SBP of each group of rats
1)与SHR对照组比较,P<0.05
组别n干预前血压(mmHg)干预后血压(mmHg)正常对照组8108.07±2.111)109.23±2.411)SHR对照组8148.45±5.33152.88±5.13瑞舒伐他汀低剂量组8145.43±5.48143.15±5.131)瑞舒伐他汀中剂8143.22±4.90140.70±4.721)量组瑞舒伐他汀高剂量组8148.82±5.82143.63±6.061)
与 WKY大鼠比较,SHR大鼠心肌组织SOD活力、NO含量下降,MDA含量、ET-1表达增加,差异有显著性意义(P<0.05);瑞舒伐他汀干预后,SOD活力、NO含量升高,MDA含量、ET-1表达降低,呈剂量相关性(P<0.05)。见表2,图1。

表2 各组大鼠心肌组织各项指标Tab 2 Comparison of laboratory data of cardiac muscle

图1 大鼠心肌组织中ET-1的表达(×400)Fig 1 ET-1 in each group (×400)
2.3各组大鼠心肌组织SOD mRNA的表达
与 WKY大鼠比较,SHR大鼠心肌组织SOD mRNA的表达下降,经瑞舒伐他汀干预后,SOD mRNA的表达逐渐增强,与剂量呈正相关(P<0.05)。见表3,图2。
3 讨 论
氧化应激是指体内组织或细胞内氧自由基生成增加和(或)清除能力降低导致细胞暴露于高浓度O2分子或O2的衍生物即所谓的反应氧族(ROS)而引起的氧化损伤。在生理条件下,活性氧族(ROS)的生成与清除处于动态平衡状态,不会对机体造成影响,ROS水平由内源性抗氧化系统调节,超氧化物歧化酶(SOD)就是重要的抗氧化酶之一。在高血压状态下,ROS增多,SOD减少,此外,过多的ROS能攻击生物膜中的不饱和脂肪酸,引发脂质过氧化作用,形成脂质过氧化产物,如丙二醛(MDA)。脂质过氧化产物通过链式放大反应放大ROS的作用,因而MDA的含量常可反映机体内脂质过氧化程度和氧化应激水平[2]。
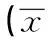
表3 各组大鼠SOD mRNA的表达水平Tab 3 Comparisons of myocardial tissue levels of SOD mRNA ±s)

图2 心肌组织琼脂糖电泳聚合酶链反应结果Fig 2 Agarose gel electrophoresis showed PCR amplication in myocardial tissueM:Maker;1:正常对照组;2、3:SHR对照组;4、5:瑞舒伐他汀低剂量组;6、7:瑞舒伐他汀中剂量组;8、9:瑞舒伐他汀高剂量组
ROS对高血压的发生起着重要作用,血压升高常伴氧化应激的增强, 有研究显示,高血压的发生发展与氧化应激密切相关[3]。自由基损伤参与了高血压的发生发展,其机制为:(1)自由基引起生物膜脂质过氧化,其代谢产物可影响生物膜的功能,使血管弹性降低,血压升高[4];(2)一氧化氮(NO)和内皮素(ET)是血管内皮细胞产生和释放的两种生物学效应相反的舒缩血管因子,正常情况下两者持续不断的释放入邻近血管平滑肌,调节血管的舒缩状态,以维持血压的稳定、组织的灌流。高血压状态下ROS增多,可损伤血管内皮细胞,灭活NO,亦可抑制血管内皮细胞合成与释放NO,造成NO合成、释放相对不足[5];还可激活前列腺素H2/血栓素A2受体,使前列腺素H2和血栓素A2增加,它们属于环氧化酶源性内皮依赖性收缩因子。也能通过氧化低密度脂蛋白刺激血管内皮素(ET)释放。ET是强烈的缩血管因子,并能促进血管紧张素-II、醛固酮分泌。NO和ET失衡破坏了血管自身血压稳定机制,血压升高[6-7]。
一方面,高血压时,氧化应激增强,超氧阴离子、自由基或剪切应力增加,引起内皮依赖性舒张因子如NO合成受损,而拮抗NO作用的ET、TXA2等内皮依赖性收缩因子增加,从而使舒缩因子失衡,引起血管收缩,还可以促进血管平滑肌增殖,甚至纤维化,导致血管壁僵硬,内皮功能受损。另一方面,内皮受损时,ACE分解缓激肽(BK)增多,使BK2受体诱发的L-Arg-NO途径失活,内皮衍生的NO减少[8]。此外,RAAS系统被激活,AngⅡ升高,导致血管收缩,血压升高。内皮功能受损时,通过多种途径分泌和释放的NO、t-PA等舒张血管、抗炎、抗增殖因子减少,而ET、AngⅡ等缩血管、促增殖因子增多,使血管平滑肌长期痉挛、增生,导致血管阻力增加,血压升高;而血压升高后又进一步损害内皮功能,如此周而复始,形成恶性循环。本研究中,自发性高血压大鼠血液及心肌组织中SOD活力、NO 含量下降,MDA、ET含量增高,表明高血压状态时存在氧化应激的增强和内皮功能受损,进一步论证了上述观点。
有研究表明, 对抗ROS 能使血压降低, 内皮功能改善, 逆转动脉重构。SOD 过度表达降低血压和氧化标志物, 增加NO 和内皮依赖的舒张功能[9]; 近年来,一些学者发现SOD拟似物[10]、维生素D、维生素E、阿托伐他汀[11]辅助治疗原发性高血压,可以降低体内ROS水平,增加NO生成,减少ET产生,从而提出了抗氧化应激在高血压治疗中的作用。本研究用他汀类药物干预,结果显示:瑞舒伐他汀能显著降低SHR大鼠心肌组织ET、MDA水平,增加NO、SOD水平,同时SOD mRNA的表达升高,提示瑞舒伐他汀可以减少体内氧化应激反应,改善高血压患者内皮功能。经瑞舒伐他汀干预后SHR大鼠心肌组织SOD mRNA的表达升高,提示内源性SOD诱导发生在基因转录和翻译水平,一般情况下,机体SOD基因的启动子并没有完全开放,当受到外界因素诱导时,未开放的SOD基因启动子处于开放状态,从而导致SOD mRNA表达增强,同时表现在翻译水平上,SOD活力增加[12]。
他汀类药物即3-羟基3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,是一类可有效降低总胆固醇与低密度脂蛋白胆固醇(LDL-C)的药物。大量基础与临床研究表明,他汀类药物可以通过其调脂作用以及多种调脂以外途径对心血管系统发挥有益影响,其中抑制氧化应激反应是近年来最受关注的他汀类药物的非调脂作用。本研究显示瑞舒伐他汀除了上述作用外,还有一定的降低血压的作用,与常用降压药物相比,其降压幅度较小,不能达到要求的降压目标,但大量的循证医学显示:即便是轻微的血压下降就可以显著降低心血管事件的风险,故高血压联合应用他汀类药物会使患者获益。其降压机制可能为:(1)逆转血管内皮功能失调,恢复NO/AngⅡ的平衡,改善内皮功能。国外研究表明,他汀类药物通过激活牛内皮细胞NOS使内皮NO释放显著增加,减少了超氧化物的产生[13],他汀类药物也显著增强SHR大鼠主动脉舒张功能,降低AngⅡ诱导的血管收缩。同时显著减少了主动脉血管紧张素Ⅰ受体mRNA及NADPH氧化酶关键性亚基p22phox mRNA的表达,并使活性氧的产生明显减少而降低血管壁内皮细胞NOS的活性和mRNA的表达显著上调[14]。(2)稳定细胞膜、改善血管平滑肌细胞内Ca2+内环境及离子转运功能,抑制血管平滑肌细胞收缩与生长,使血管反应性趋于正常[15]。(3)抑制血管平滑肌细胞增殖肥大、迁移及促进细胞凋亡,逆转血管重塑过程中细胞生长和细胞凋亡间的失衡状态,从而延缓高血压的病理进程[16]。
本研究结果显示,高血压状态时,存在氧化应激的增强,内皮功能受损。因此,对高血压患者,除应积极控制血压外,还应重视氧自由基清除、减少脂质过氧化作用,改善血管内皮功能,这对稳定和改善高血压患者的病情是有益的,有助于减少其他心血管疾病及其并发症的发生。但本研究只是个小样本研究,且为动物实验,还需进一步扩大样本含量,在高血压人群中验证。
[1] Wu S,Gao X,Rang S,et al.Protective effects of cariporide on endothelial dysfunction induced by homoeysteine[J].Pharmacology,2013,92:303-309.
[2] Kim JH,Bae HY,Kim SY.Clinical marker of platelet hyperreactivity in diabetes mellitus[J].Diabetes Metab J, 2013,37:423-428.
[3] Friederich PM,Welch WJ,Luo Z,et al.Angiotensin II reduces transport-dependent oxygen consumption but increases transport-independent oxygen consumption in immortalized mouse proximal tubular cells[J].Adv Exp Med Biol,2014,812:157-163.
[4] Lacy F,Connor DT,Schonbein GW.Plasma hydrogen peroxide production in hypertensives and normotensive subjects at genetics risks of hypertension[J].Hypertension,2002,6(4):291-303.
[5] 隋辉,王文.氧自由基与高血压关系研究进展[J]. 高血压杂志,2002,10(5):414-416.
[6] Channon KM, Guzik TJ. Mechanisms of superoxide production in human blood vessels:relationship to endothelial dysfunction,clinical and genetic riscfac tors[J].J Physiol Pharmacol, 2003, 53(4):515-524.
[7] Zheng F,Lu W,Jia C,et al.Relationships between glucose excursion and the activation of oxidative stress in patients with newly diagnosed type 2 diabetes or impaired glucose regulation[J].Endocrine,2010,37:201-208.
[8] Pitocco D,Tesauro M,Alessandro R,et al.Oxidative stress in diabetes:implications for vascular and other complications[J].Int J Mol Sci,2013,14:21525-21550.
[9] Yan HM,Zhao J,Ma DZ,et al.The effect of pitavastatin calcium on endothelial dysfunction induced by hypercholesterolemia[J].Expert Opin Pharmacother,2011,12:1463-1471.
[10] Monnier L,Colette C,Mas E,et al.Regulation of oxidative stress by glycaemic control:evidence for an independent inhibitory effeet of insulin therapy[J].Diabetologia,2010,53:562-57I.
[11] Dikalova A, Clempus R, Lassegue B, et al. Noxlov erexpression potentiates angiotensin Ⅱ-induced hypertension and vscular smooth muscle hypertrophy in transgenic mice[J].Circulation,2005,112:2668-2676.
[12] 葛长江,胡申江.阿托伐他汀影响自发性高血压大鼠血压的机制探讨[J].中国病理生理杂志,2005,21(12):2324-2327.
[13] Lob HE, Schultz D,Marvar PJ,et al.Role of the NADPH oxidases in the subfornieal organ in angiotensin Ⅱ-induced hypertension[J].Hypertension,2013,61:382-387.
[14] 李卫萍,孙明,周宏研,等.阿托伐他汀对自发性高血压大鼠主动脉活性氧、AT1受体和p22phox表达的影响[J].临床心血管病杂志,2005,21(2):104-107.
[15] 葛长江,胡申江,吕树铮,等.阿托伐他汀对动脉内膜损伤后血管平滑肌细胞离子泵活性和内膜增殖的影响[J]. 临床心血管病杂志,2006,22(4):206-208.
[16] 葛长江,胡申江,武森,等.阿托伐他汀对自发性高血压大鼠血管重塑的影响[J].浙江大学学报,2003,4(5):612-615.
Influence of rosuvastatin to SOD,MDA,NO,ET of myocardial tissue in spontaneously hypertensive rats
YAN Hong-juan1, XIE Yue-tao2, LIU Guang3, YU Ming-yue4, BIAN Shu-huai5, LUO Qiu-hua1
(1.Department2ofGeriatrics,TheFirstHospitalofHandan,Handan056000,China; 2.Department1ofCardiology,HeBeiGeneralHospital,Shijiazhuang050000,China; 3.DepartmentofGeriatrics,TheFourthHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China; 4.DepartmentofFounction,HeBeiGeneralHospital,Shijiazhuang050000,China; 5.Department1ofGeriatrics,HeBeiGeneralHospital,Shijiazhuang050000,China)
Objective To observe the relationship of oxygen free radical damage and endothelial dysfunction with hypertension and the effect of rosuvastatin therapy. Methods Eight Wistar-Kyoto rats (WKY) were used as normal control group, and thirty-two spontaneously hypertensive rats (SHR) were randomly and evenly divided into four groups: low-dose group (3.125 mg/kg·d), mid-dose group (6.25 mg/kg·d), high-dose group (12.5 mg/kg·d) and SHR control group. After treated with oral administration of rosuvastatin and equal volume distilled water (control group) for 4 weeks, all rats were measured blood pressure, then killed. The levels of SOD,MDA,No and ET-1, SOD mRNA expression in myocardial tissue were detected by colorimetry, immunohistochemistry and RT-PCR. Results Compared with normal control group,the levels of SOD, NO, and SOD mRNA expression decreased, while MDA level and ET-1 expression increased in SHR group (P<0.05). All these indexes were improved after rosuvastatin treatment (P<0.05), and with a dose-dependent effect. The blood pressure of SHR decreased after rosuvastatin treatment, without the dose-dependent effect. Conclusions The oxidative stress enhanced in SHR. Rosuvastatin could reduce blood pressure by reducing oxidative stress and improving endothelial function.
spontaneously hypertensive rat; endothelial function; oxidative stress; nitric oxide; endothelin; rosuvastatin
论著10.11724/jdmu.2015.03.06
闫洪娟(1984-),女,河北邯郸人,主治医师。E-mail:yy021223@163.com
边树怀,教授,主任医师。E-mail:fow12345@126.com
R544.1
A
1671-7295(2015)03-0232-05
2015-01-14;
2015-04-26)

