外周血循环肿瘤DNA检测方法及应用
杨超程昌明杨慧敏邱耕★
外周血循环肿瘤DNA检测方法及应用
杨超1,2程昌明1杨慧敏1,2邱耕1,2★
肿瘤是一种威胁人类健康的重大疾病。研究发现,肿瘤的发生和发展是基于分子水平上癌基因(oncogenes)的激活和抑癌基因(anti-oncogene)的失活所致。基因突变分析对于肿瘤诊断和预后至关重要。早期诊断被认为是提高癌症病人治愈率,降低其死亡率最有效的途径。外周血循环肿瘤核酸中可检测到与肿瘤细胞一致的基因突变。这些基因突变的检测可以为肿瘤的分期及药物的治疗疗效和预后提供丰富的信息。因此,外周血循环肿瘤DNA突变检测为肿瘤的早期诊断和治疗提供了新的研究方向和领域。
肿瘤;循环肿瘤DNA;基因突变分析;外周血
[KEY WORDS]Tumor;Circulating tumor DNA;Gene mutation analysis;Peripheral blood
分子诊断是以分子生物学理论为基础,利用分子生物学的技术和方法研究人体内源性或外源性生物大分子和大分子体系的存在、结构或表达调控的变化,为疾病的预防、预测、诊断、治疗提供信息和决策依据。人类的许多遗传性疾病、恶性肿瘤等重大疾病都是由于基因结构的变异所引起,因此,实现对基因热点突变的早期、准确、简便、快速的确认,对于人类相关疾病的发病机理及早期治疗具有非常重要的意义。
1 肿瘤发生状况与早期诊断
肿瘤是一类威胁人类健康的重大疾病。2008年全球肿瘤新发病例1 270万例,死亡760万例(美国NIH数据)[1-2]。预计到 2020年,全球肿瘤患者总数将超过1 500万人,死亡人数超过艾滋病、疟疾和结核病的总和,全球每年用于肿瘤诊疗的费用超过2 100亿美元[3]。我国的肿瘤发病状况同样不容乐观,据卫生部最新统计资料显示,我国大中城市肿瘤的发病率呈逐年上升趋势,每年新增近260万肿瘤患者。我国是一个人口大国,不仅肿瘤发病率高,而且死亡率也很高,恶性肿瘤患者年死亡率接近30%,5年以上生存率仅为31.77%[4]。目前临床广泛使用的手术切除、放疗和化疗等难以解决中晚期肿瘤治疗的问题,在可预期的未来,通过对现有治疗方案的改善远不能大幅度降低肿瘤患者的死亡率。
实现肿瘤早期诊断是提高肿瘤治愈率,降低肿瘤患者死亡率的有效途径。2005年世界卫生组织(world health organization,WHO)就指出:如果能够早期发现,40%以上的癌症是可以治愈的,包括乳腺癌、结肠癌、宫颈癌等最常见的癌症[5]。由于在肿瘤发生的早期,患者没有明显的体征变化,难以通过一般生化和影像学检测发现肿瘤的踪迹。而当患者有明显体征时,肿瘤往往已经发展到中晚期,错失了治疗的最佳时机。无论是手术治疗还是放化疗,大部分中晚期肿瘤病人都预后不良,生存时间极为有限。肿瘤血清蛋白标志物检测是帮助发现早期肿瘤的一种重要方法,但是现有肿瘤血清蛋白标志物普遍存在特异性不强的问题。目前常用的肿瘤血清蛋白标志物如甲胎蛋白(alpha fetoprotein,AFP)、癌胚抗原(carcino-embryonic antigen,CEA)、糖链抗原-125(carbohydrate antigen 125,CA125)等,并非肿瘤细胞所特有,也会存在于某些良性肿瘤、胚胎组织、甚至正常组织中。以肝细胞癌 (hepatocellular carcinoma,HCC)为例,HCC是一种高度恶性肿瘤,早期多无明显症状,确诊时往往已属中、晚期。目前HCC缺乏有效治疗手段,中晚期HCC切除后复发率高,易转移,其死亡率已居我国肿瘤死亡率的第二位。AFP是目前应用最广泛的HCC肿瘤标志物,但仍有30%~40%的HCC患者AFP水平为正常,而活动性肝病、生殖腺胚胎瘤患者和妊娠妇女的AFP水平也会升高[6]。如何从健康人群中发现肿瘤的高危个体,并进行早期诊断,目前尚缺乏行之有效的方法。
2 外周血核酸检测与肿瘤分子诊断
研究表明,肿瘤发生的根本原因在于分子水平上特定基因结构的改变。肿瘤的发生发展通常表现为多种基因结构改变(如突变、重组等)导致癌基因的激活或抑癌基因的失活,且不同发展阶段其癌基因或抑癌基因的活性有所差别[7-9]。通常,从最初的基因结构改变到发生癌症,大约需要十余年时间。所以,如果能在基因结构改变到转化为癌症的这个阶段检测到患者血液中肿瘤特异性核酸标志物,就可以对肿瘤的发生、发展进行有效的诊断和预测,获得良好的治疗效果[10-12]。
肿瘤的侵袭和转移伴随其发生发展的整个过程,它包括一系列内在联系的步骤,即粘附、降解和移动。肿瘤细胞可以通过分泌抑制黏附因子表达的物质降低细胞的粘附性,增加其运动能力。因此,在肿瘤发生的早期,肿瘤细胞就已具有侵袭和微转移的特性[13]。研究发现,具备侵袭和微转移特性的肿瘤细胞可以破坏宿主结缔组织而进入脉管系统。除此之外,诊疗操作也可使肿瘤细胞人为扩散进入外周血循环系统。通常可以把因自发或诊疗操作进入人体外周血的肿瘤细胞称为循环肿瘤细胞(circulating tumor cell,CTC)[14]。显然,如果能在肿瘤早期患者的外周血中检测到循环肿瘤细胞,了解肿瘤细胞的基因突变状况,对于肿瘤的早期诊断和个体化治疗都具有十分重要的意义[15-16]。在肿瘤发生的早期,进入外周血的肿瘤细胞数量很少,通常约1×108个白细胞和5×1010个红细胞中仅有数个肿瘤细胞,常规的检测手段如影像学及血清肿瘤标记物检查等,无法直接发现这些通过外周血液循环进行转移的细胞。因此,为了提高循环肿瘤细胞的检出率,需在检测前对循环肿瘤细胞进行富集。目前,循环肿瘤细胞最主要的富集方法是免疫磁性分离法(immunomagnetic separation,IMS),见图1。该方法通过磁珠表面的特异性单抗与肿瘤细胞表面抗原发生免疫识别反应,从血液中分离出待检测肿瘤细胞[17-18]。这些特异性单抗主要针对上皮细胞抗原,如上皮细胞粘附分子(epithelial cell adhesion molecule,EpCAM)、细胞角蛋白(cytokeratin,CK)等;或器官特异性标志物,如前列腺特定抗原(prostate-specific antigen,PSA)、人表皮生长因子受体 (human epidermal growthfactor receptor,HER)的抗体等[19-20]。由于目前尚无循环肿瘤细胞特异性抗原,针对循环肿瘤细胞所采用的抗体识别能力较差,往往会造成假阳性或假阴性检测结果,这些检测特异性和灵敏性问题限制了循环肿瘤细胞检测技术在肿瘤分子诊断中的应用[21-22]。

图1 循环肿瘤细胞检测[14]
除循环肿瘤细胞外,实现肿瘤分子诊断的另一种方法是外周血循环核酸检测。肿瘤患者外周血中的循环核酸除了来源于凋亡的正常细胞外,还有来源于肿瘤细胞的核酸物质。1977年Leon等[23]人首次发现肿瘤患者血清或血浆中的循环核酸浓度高于正常人约10~100倍,该结论为肿瘤分子诊断提供了新的思路和方法。从外周血循环核酸的浓度看,在早期肿瘤患者血清或血浆中就可检测出较高浓度的循环核酸,而且这种循环核酸浓度的变化要远早于影像学等检测到的肿瘤组织变化[24-25]。关于肿瘤患者外周血循环核酸升高的原因有多种解释,主要有以下3种观点 (图2):(1)循环肿瘤细胞或微转移灶的裂解;(2)肿瘤细胞的凋亡、坏死;(3)肿瘤细胞增生旺盛,自发性所释放的核酸[26-27]。据文献报道,按肿瘤患者外周血循环核酸浓度推算,每毫升血中至少应含1 000~10 000个肿瘤细胞,而实际每毫升血中仅能检测到数个肿瘤细胞,显然循环肿瘤细胞或微转移灶的裂解并非外周血循环核酸浓度升高的主要原因[28]。肿瘤细胞自发性释放核酸的观点能较好地解释肿瘤患者外周血出现高水平游离核酸的现象。肿瘤细胞相对正常细胞更容易脱落,脱落的肿瘤细胞进入血液后会被人体免疫细胞攻击杀死,在酶的作用下成为核酸碎片,造成肿瘤患者血清中循环核酸浓度升高。但是现在越来越多证据也表明,除肿瘤细胞增生旺盛时自发释放核酸外,肿瘤细胞凋亡也是外周血循环游离核酸的一个重要来源。
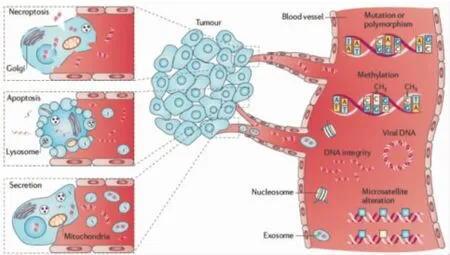
图2 外周血中循环核酸的主要来源[27]
相比于从数以亿计的血细胞中分离出数个肿瘤细胞的检测技术,往往更容易从高浓度的外周血循环核酸中发现来自肿瘤细胞的核酸标志物,而且循环核酸中的突变基因与肿瘤的相关性高,具有更好的特异性,可作为肿瘤诊断的重要标志物。通过对外周血循环核酸中肿瘤核酸标志物进行定性和定量检测,不仅可用于肿瘤筛查、早期诊断、辅助诊断、良恶性鉴别和临床分期,对监测疗效、判断预后、预测肿瘤的复发和转移也具有重要价值[29-31]。由于外周血循环肿瘤核酸标志物检测所需的样本是外周血,易于取得,避免了活组织取样对人体的伤害,作为一种微创性检测技术,尤其适合健康人群和肿瘤高危人群的筛查,以及肿瘤患者术后的长期监测。
3 外周血循环突变基因检测
在肿瘤患者的外周血循环核酸中,大多数是来源于正常细胞凋亡所释放的核酸 (简称为野生型),来源于肿瘤细胞的核酸(简称为突变型)在循环核酸总量中所占比例非常低。研究发现,在中晚期癌症患者外周血循环核酸总量中所占的比例一般仅为8%~10%左右,在肿瘤早期甚至低至0.01%~1.7%[32-34]。此外,突变型与野生型相比仅一个或数个碱基的差别,所造成的基因理化特性改变甚微,无疑使检测循环核酸中的低含量的突变型核酸极为困难,这也对该检测技术的灵敏度提出了更高的要求。
目前,DNA测序法是核酸序列分析的 “金标准”,由于外周血循环核酸检测中大量野生型的存在,直接测序仅能检测到样本中比例高于20%的突变型,难以达到检测外周血循环核酸中低含量突变型核酸的要求[35-36]。另外,由于外周血循环核酸中存在大量的野生型,常规聚合酶链式反应(polymerase chain reaction,PCR)技术对微少突变型进行扩增时容易产生偏向性扩增,即野生型由于数量占优而被优先扩增,导致样本中突变型的相对比例进一步降低,不利于后续的突变型的检测。除此之外,非特异扩增的干扰,实验过程的繁琐以及诸多不确定因素的影响导致此类方法对突变型的检测灵敏度也只能达到1%~10%左右[37-40],常见突变检测技术见表1。因此,如何提高突变检测的灵敏度,实现对循环核酸中肿瘤细胞特异性核酸标志物的检测是生物医学研究者亟待解决的难题。

表1 常见突变检测技术的灵敏度Table 1 Sensitivity for detecting mutation of the routine gene analysis methods
近年来的研究表明,单纯的生物学方法已很难进一步提高突变检测的灵敏度,而将纳米材料与分子生物学技术结合,借助纳米材料的独特性质提高对生物分子的检测灵敏度已逐步成为生物医学研究领域的一个热点[49-50]。美国纳斯达克上市的Luminex公司研发的液相悬浮芯片技术 (又称微球依赖的悬浮点阵技术,Luminex xMAPTM),将荧光微球与探针特异性延伸反应结合,最后采用自行开发的液相芯片荧光检测系统进行检测,为高通量核酸分析提供了新的平台,具有检测时间短,微阵列应用灵活等优点[51-52],见图 3。Cheng等[53-55]提出了基于磁性微球和微乳液PCR方法的BEAMing技术,通过乳液PCR扩增反应对微少突变基因进行扩增,避免了大量野生型基因对微少突变基因扩增的干扰,而且将扩增的突变基因富集在磁珠表面,再通过荧光分子信标(molecular beacon)探针杂交过程将突变信号转化为磁性微球的荧光信号,最后通过流式细胞仪进行检测,该方法对点突变基因的检测灵敏度达到0.01%。但是上述两种方法的检测步骤烦琐,对设备要求较高,而且检测设备和试剂均需进口,检测价格不菲,在我国难以得到广泛使用。此外,上述两种技术均采用荧光标记和分析方法,由于荧光染料比较容易淬灭,对突变检测结果的稳定性也有一定程度的影响。
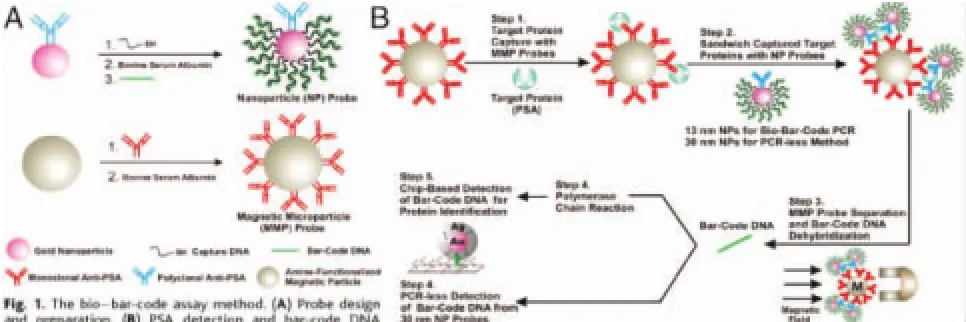
图3 基于纳米材料的Barcode DNA蛋白检测技术[50]
目前针对外周血肿瘤细胞循环核酸检测技术的发展趋势,作者所在研究团队利用生物芯片上海国家工程研究中心的现有资源,通过查阅大量文献专利,并向有关专家、学者咨询,基于磁纳米材料技术设计了两条微少突变基因检测技术路线,其技术具有特异性高、灵敏度高、成本低等特点。技术路线一,见图4:采用乳液PCR(emulsion PCR)结合等位基因特异性扩增(allele-specific amplification)的悬浮液相芯片技术检测核酸突变型,简称EARMS技术。该技术以乳液PCR作为靶基因扩增方式,避免了大量野生型对微量突变型扩增的干扰,通过等位基因特异性引物,实现突变型的特异性扩增和标记。同时,该技术结合磁性微球的特性,利用磁性分离方法将突变型分子数量转化为磁珠的数量。最后通过荧光酶标仪或流式细胞仪对磁珠表面的突变型分子荧光信号进行检测,以达到对突变型进行定量或定性分析的目的[55]。本技术将微少突变型的特异性扩增和标记简化为一步反应,大大缩减了检测步骤,降低了检测成本。模拟样本检测结果显示,该技术对突变基因的检测灵敏度可达到0.1%~0.01%,基本满足了外周血循环肿瘤核酸标志物检测的要求。

图4 乳液PCR结合等位基因特异性扩增的悬浮液相芯片技术检测微少突变基因[55]
技术路线二,见图5:采用磁珠分离技术结合连接酶检测反应(ligase detection reaction,LDR)对核酸突变型进行特异性富集,最后采用高灵敏的电化学发光技术进行突变型检测。该技术主要包括PCR预扩增、LDR连接和电化学发光基团标记、磁珠捕获、电化学发光检测4个步骤。首先对细胞或非细胞体系中提取的基因组DNA进行预扩增,然后针对发生点突变的碱基设计检测探针和匹配探针,其中检测探针5′端连接识别分子,匹配探针的3′端标记电化学发光信号分子。两种探针以突变型为模板进行连接反应。然后通过表面带有与探针识别分子匹配的捕获分子的磁珠捕获LDR连接产物。最后分离出磁珠,用电化学发光方法检测磁珠表面的突变型信号[56]。该技术具有快速、高效、高通量、高灵敏度等优点,可以检测到样品中含量低至0.01%的突变型型,具有极高的检测灵敏度,并能达到多个突变同时检测的目的,在肿瘤早期检测领域有很好的应用前景。
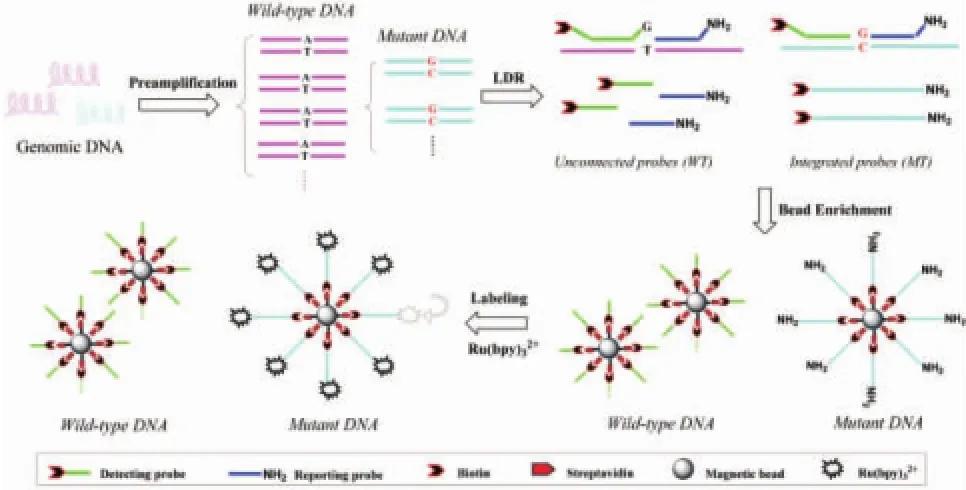
图5 连接酶检测反应结合磁珠富集的电化学发光-突变基因检测技术[56]
上述核酸突变型检测技术主要针对外周血中肿瘤相关靶基因或突变进行检测,可用于肿瘤的早期筛查、术后监控以及用药指导等,具有灵敏度高、特异性好、成本低的优点。而且,由于所检测样本主要来源于外周血,来源丰富,易于获取,避免了手术等手段对人体的伤害。本项目所涉及的相关技术作为一类微创性的检测技术,尤其适合健康人群和肿瘤高危人群的筛查,以及肿瘤患者术后的长期监控。目前,作者所在单位正以以上相关技术作为基础开发相应的肿瘤检测系列产品和服务,推进技术的产业化。
4 结语
目前,肿瘤的临床诊断仍然依赖于病理或细胞学检查,然而通过有创性组织活检往往会给患者造成巨大的痛苦,因此探寻一种新的肿瘤诊断方法是当前迫切需要解决的问题。由于外周血循环核酸包含来自肿瘤细胞的核酸,具有和恶性肿瘤相关的分子生物学特征,可作为敏感高效的肿瘤分子标志物,它不仅能提供关于肿瘤发生和发展状况的丰富信息,而且相对活组织取样等创伤性取样方式,循环核酸检测具有取样方便、微创的优点,便于连续检测和随访追踪。所以基于外周血循环核酸开发一种灵敏度高、特异性强及结果判定简单的肿瘤早期检测方法将会成为肿瘤分子诊断技术研究的一个热点和重要发展方向。随着外周血循环核酸基础实验及临床研究在深度及广度上的日益加大,外周血循环核酸的检测将为肿瘤筛查诊断、疗效观察及预后监测展示出了广阔的临床应用前景。
随着生物技术的发展,肿瘤的早期诊断、预后监测、个体化治疗以及复发监控等越来越受益于肿瘤分子标志物的发现及其检测方法的完善。尽管目前科学界对肿瘤发生的分子机制尚未完全明了,但基因结构的变化仍被认为是诱导肿瘤发生关键因素。通过对外周血循环核酸中来自肿瘤细胞的特异性基因结构改变进行检测是肿瘤分子诊断的一个重要研究方向。高灵敏度微少突变型检测技术的研发将为肿瘤分子诊断提供一种准确可靠的检测工具,不仅有助于提高我国肿瘤的诊治水平,填补国内相关技术空白,而且也将推动分子诊断行业的发展,获取巨大的经济效益和社会效益。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics[J].CA Cancer J Clin,2012,62(1):10-29.
[2]World Health Organization.World cancer report 2008 [M].2008.
[3]World Health Organization.Global action against cancer-now![M].2005.
[4] 中华人民共和国卫生部.2010年中国卫生统计年鉴[G].中国协和医科大学出版社,2010.
[5]World Health Organization.Cancer control:knowledge into action[M].2005.
[6] 胡捷,周俭,王征,等.外周血循环DNA在肝细胞癌早期诊治的研究进展[J].复旦学报:医学版,2009,36(6):776-778.
[7]Hanahan D,Weinberg RA.The hallmarks of cancer[J].Cell,2000,100(1):57-70.
[8]Kan Z,Jaiswal BS,Stinson J,et al.Diverse somatic mutation patterns and pathway alterations in human cancers[J].Nature,2010,466(7308):869-873.
[9]Greenman C,Stephens P,Smith R,et al.Patterns of somatic mutation in human cancer genomes[J].Nature,2007,446(7132):153-158.
[10]Sidransky D.Nucleic acid-based methods for the detection of cancer[J].Science,1997,278(5340):1054-1059.
[11]Hayden EC.Personalized cancer therapy gets closer[J].Nature,2009,458(7235):131-132.
[12]Ding L,Getz G,Wheeler DA,et al.Somatic mutations affect key pathways in lung adenocarcinoma[J].Nature,2008,455(7216):1069-1075.
[13]Paterlini-Brechot P,Benali NL.Circulating tumor cells (CTC)detection:clinical impact and future directions [J].Cancer Lett,2007,253(2):180-204.
[14]Pantel K,Brakenhoff RH,Brandt B.Detection,clinical relevance and specific biological properties of disseminating tumour cells[J].Nat Rev Cancer,2008,8(5):329-340.
[15]周晴接,杨建民.循环肿瘤细胞研究进展[J].世界华人消化杂志,2010,18(11):1081-1087.
[16]Anja Stolpe,Klaus P,Stefan S,et al.Circulating tumor cell isolation and diagnostics: toward routine clinical use[J].Cancer Res,2011,71(18):5955-5960.
[17]Li J,Chen L,Zhang X,et al.Detection of circulating tumor cells in hepatocellular carcinoma using antibodies against asialoglycoprotein receptor, carbamoyl phosphate synthetase 1 and pan-cytokeratin[J].Plos One,2014,9(4):e96185.
[18]Hofman V,Ilie MI,Long E,et al.Detection of circulating tumor cells as a prognostic factor in patients undergoing radicalsurgery for non-small-celllung carcinoma:comparison of the efficacy of the CellSearch AssayTMand the isolation by size of epithelial tumor cell method[J].Int J Cancer,2011,129(7):1651-1660.
[19]Nagrath S,Sequist LV,Maheswaran S,et al.Isolation of rare circulating tumour cells in cancer patients by microchip technology[J].Nature,2007,450(7173):1235-1239.
[20]Yu M,Stott S,Toner M,et al.Circulating tumor cells:approaches to isolation and characterization[J].J Cell Biol,2011,192(3):373-382.
[21]Hassanein M,Callison JC,Callaway-Lane C,et al.The state of molecular biomarkers for the early detection of lung cancer[J].Cancer Prev Res(Phila),2012,5(8):992-1006.
[22]曹璐,徐文,殷正丰.循环肿瘤细胞分离与检测[J].第二军医大学学报,2010,31(3):313-316.
[23]Leon SA,Shapiro B,Sklaroff DM,et al.Free DNA in the serum of cancer patients and the effect of therapy [J].Cancer Res,1977,37(3):646-650.
[24]Jahr S,Hentze H,Englisch S,et al.DNA fragments in the blood plasma of cancer patients:quantitations and evidence for their origin from apoptotic and necrotic cells[J].Cancer Res,2001,61(4):1659-1665.
[25]Thijssen MA, Swinkels DW, Ruers TJ, et al.Difference between free circulating plasma and serum DNA in patients with colorectal liver metastases[J].Anticancer Res,2002,22(1A):421-425.
[26]Wu TL,Zhang D,Chia JH,et al.Cell-free DNA:measurement in various carcinomas and establishment of normal reference range[J].Clin Chim Acta,2002,321(1-2):77-87.
[27]Schwarzenbach H, Hoon DS, Pantel K.Cell-free nucleic acids as biomarkers in cancer patients[J].Nat Rev Cancer,2011,11(6):426-437.
[28]Anker P,Mulcahy H,Chen XQ,et al.Detection of circulating tumour DNA in the blood(plasma/serum)of cancer patients[J].Cancer Metastasis Rev,1999,18(1):65-73.
[29]Fleischhacker M,Schmidt B.Free circulating nucleic acids in plasma and serum (CNAPS)-Useful for the detection of lung cancer patients[J].Cancer Biomark,2010,6(3-4):211-219.
[30]Pinzani P,Salvianti F,Pazzagli M,et al.Circulating nucleic acids in cancer and pregnancy[J].Methods,2010,50(4):302-307.
[31]Jung K,Fleischhacker M,Rabien A.Cell-free DNA in the blood as a solid tumor biomarker-a critical appraisal of the literature[J].Clin Chim Acta,2010,411(21-22):1611-1624.
[32]Diehl F,Schmidt K,Choti MA,et al.Circulating mutant DNA to assess tumor dynamics[J].Nat Med,2008,14(9):985-990.
[33]Diehl F,Li M,Dressman D,et al.Detection and quantification of mutations in the plasma of patients with colorectal tumors[J].Proc Natl Acad Sci USA,2005,102(45):16368-16373.
[34]Holdhoff M,Schmidt K,Donehower R,et al.Analysis of circulating tumor DNA to confirm somatic KRAS mutations[J].J Natl Cancer Inst,2009,101(18):1284-1285.
[35]Fan X,Furnari FB,Cavenee WK,et al.Non-isotopic silver-stained SSCP is more sensitive than automated direct sequencing for the detection of PTEN mutations in a mixture of DNA extracted from normal and tumor cells[J].Int J Oncol,2001,18(5):1023-1026.
[36]Pao W,Ladanyi M.Epidermal growth factor receptor mutation testing in lung cancer:searching for the ideal method[J].Clin Cancer Res,2007,13(17):4954-4955.
[37]Nollau P,Moser C,Weinland G,et al.Detection of K-ras mutations in stools of patients with colorectal cancer by mutant-enriched PCR[J].Int J Cancer,1996,66(3):332-336.
[38]Chakravarti D,Mailander P,Franzen J,et al.Detection of dibenzo[a,l]pyrene-induced H-ras codon 61 mutant genes in preneoplastic SENCAR mouse skin using a new PCR-RFLP method[J].Oncogene,1998,16(24):3203-3210.
[39]Behn M,Schuermann M.Sensitive detection of p53 gene mutations by a ‘mutant enriched’ PCR-SSCP technique[J].Nucleic Acids Res,1998,26(5):1356-1358.
[40]Marchetti A,Martella C,Felicioni L,et al.EGFR mutations in non-small-cell lung cancer:analysis of a large series of cases and development of a rapid and sensitive method for diagnostic screening with potential implications on pharmacologic treatment[J].J Clin Oncol,2005,23(4):857-865.
[41]Endo K,Konishi A,Sasaki H,et al.Epidermal growth factor receptor gene mutation in non-small cell lung cancer using highly sensitive and fast TaqMan PCR assay[J].Lung Cancer,2005,50(3):375-384.
[42]张汛,王跃华,高宁,等.即时定量PCR-Sanger测序与TaqMan探针法检测结直肠癌KRAS、BRAF基因突变的对比分析[J].中华病理学杂志,2014,43(2):77-82.
[43]Zhou C,Ni J,Zhao Y,et al.Rapid detection of epidermal growth factor receptor mutations in nonsmall cell lung cancer using real-time polymerase chain reaction with TaqMan-MGB probes[J].Cancer J,2006,12(1):33-39.
[44]Kimura H,Kasahara K,Kawaishi M,et al.Detection of epidermal growth factor receptor mutations in serum as a predictor of the response to gefitinib in patients with non-small-cell lung cancer[J].Clin Cancer Res,2006,12(13):3915-3921.
[45]Asano H,Toyooka S,Tokumo M,et al.Detection of EGFR gene mutation in lung cancer by mutant-enriched polymerase chain reaction assay[J].Clin Cancer Res,2006,12(1):43-48.
[46]Thomas RK,Nickerson E,Simons JF,et al.Sensitive mutation detection in heterogeneous cancer specimens by massively parallel picoliter reactor sequencing[J].Nat Med,2006,12(7):852-855.
[47]高菲,师建国,魏金花,等.HRM法检测肺癌EGFR基因突变[J].现代肿瘤医学,2011,19(6):1809-1092.
[48]Cohen V,Agulnik JS,Jarry J,et al.Evaluation of denaturing high-performance liquid chromatography as a rapid detection method for identification of epidermal growth factor receptor mutations in nonsmall-cell lung cancer[J].Cancer,2006,107(12):2858-2865.
[49]Stoeva SI,Lee JS,Thaxton CS,et al.Multiplexed DNA detection with biobarcoded nanoparticle probes[J].Angew Chem Int Ed Engl,2006,45(20):3303-3306.
[50]Nam JM,Thaxton CS,Mirkin CA.Nanoparticle-based bio-bar codes for the ultrasensitive detection of proteins [J].Science,2003,301(5641):1884-1886.
[51]Dunbar SA.Applications of luminex xMAP technology for rapid,high-throughput multiplexed nucleic acid detection[J].Clin Chim Acta,2006,363(1-2):71-82.
[52]Wang Y,Shi J,Wu Y,et al.Use of Luminex xMAP bead-based suspension array for detecting microRNA in NSCLC tissues and its clinical application[J].Tumori,2012,98(6):792-799.
[53]Richardson AL,Iglehart JD.BEAMing up personalized medicine:mutation detection in blood[J].Clin Cancer Res,2012,18(12):3209-3211.
[54]Metzger BP,Gelembiuk GW,Lee CE.Direct sequencing of haplotypes from diploid individuals through a modified emulsion PCR-based single-molecule sequencing approach[J].Mol Ecol Resour,2013,13(1):135-143.[55]Cheng C,Zhou Y,Yang C,et al.Detection of rare pointmutation via allele-specific amplification in emulsion PCR[J].BMB Rep,2013,46(5):270-275.
[56]Cheng C,Wang J,Yang C,et al.Electrochemiluminescent assay for detection of extremely rare mutations based on ligase reaction and bead enrichment[J].Anal Biochem,2013,434(1):34-38.
The detection methods and applications of circulating tumour DNA in peripheral blood
YANG Chao1,2,CHENG Changming1,YANG Huimin1,2,QIU Geng1,2★
(1.National Engineering Center for Biochip at Shanghai,Shanghai,China,201203;2.Shanghai Biomedical Lab Co.,Ltd,Shanghai,China,200436)
Tumor is a major threat to human health.Recent studies showed that oncogenesis were on account of the activation of oncogene and the inactivation of tumor suppressor gene at the molecular level.Gene mutation analysis is crucial in the diagnosis and prognosis of tumor.Early diagnosis has been proved to be the most effective way to improve the survival rates and decrease the mortality of cancer patients.Tests showed that gene mutations in the circulating tumor in peripheral blood were the same as what in tumor cells.The detection of these gene mutations may provide abundant information for the staging of tumor and the rapeutic effect and prognosis of drug.Hence, detecting of tumor-associated mutation in circulatory DNA in peripheral blood provides new direction for tumor early-stage diagnosis and therapy.
上海市科技成果转化和产业化项目(13CT1900900)
1.生物芯片上海国家研究中心,上海 201203 2.上海伯豪医学检验所,上海 200436
邱耕,E-mail:qiugeng@shbiochip.com

