不同药剂对榆紫叶甲的防治效果及对其生殖系统的影响初探
任 生,王牧原,郑 军
(吉林省林业调查规划院,吉林 长春 130022)
榆树(Ulmus pumila L.)是我国重要的用材树种,亦是优良的绿化树种。近年来,榆紫叶甲(Ambrostoma quadriimpressum Motschulsky)对榆树的危害呈加重趋势。榆紫叶甲为鞘翅目(Coleoptera)叶甲总科(Chrysomeloidea)叶甲科(Chrysomelidae)食叶害虫,主要分布于我国东北地区、内蒙古和俄罗斯远东地区,是榆树的主要食叶害虫之一。该虫食性专一,为害期可持续6 个月。它主要取食榆树芽胞、叶片,并连年为害[1]。尤其早春大发生时,常将新发叶芽食光,使树势衰弱并引起其他病虫危害[2],严重影响榆树的生长、发育。
作者从不同药剂的特性和原理入手,对榆紫叶甲进行胃毒试验,观察不同药剂对榆紫叶甲的影响;同时,对榆紫叶甲死亡个体的生殖系统进行外部形态和切片观察,从宏观和微观两方面观测生殖系统的变化情况,旨在为榆紫叶甲的防治提供基础数据。
1 材料与方法
1.1 配制农药试剂
①配制农药稀释剂。5%杀铃脲乳油、5%伏虫灵乳油、6%吡虫啉可溶剂、5%除虫脲乳油、20%除虫脲悬浮剂、20%米满悬浮剂和苦参碱,先各取3.5 mL,加蒸馏水稀释至700 mL(即配制成200 倍稀释液),之后再各取2.8 mL,加蒸馏水稀释至1 400 mL(即500 倍稀释液),倒出700 mL,余下部分再加蒸馏水稀释至1 400 mL(即1 000 倍稀释液)。
②20%抑食肼可湿性粉剂,取3.5 g,配制成200 倍稀释液700 mL(方法如上),再取2.8 g制成500 倍稀释液700 mL、1 000 倍稀释液1 400 mL。
③配制蔗糖酯溶液。分别称取蔗糖酯5.6 g、2.8 g、1.4 g,加蒸馏水700 mL 溶解,即配制成质量浓度分别为 8 mg·mL-1、4 mg·mL-1、2 mg·mL-1的溶液。
1.2 榆紫叶甲胃毒试验
采集新鲜榆树嫩枝,将7 种农药:5%杀铃脲乳油、5%伏虫灵乳油、6%吡虫啉可溶剂、5%除虫脲乳油、20%除虫脲悬浮剂、20%抑食肼可湿性粉剂、20%米满悬浮剂和1.78 mg·mL-1苦参碱、蔗糖脂的200 倍稀释液、500 倍稀释液、1 000 倍稀释液用喷壶分别喷洒在嫩枝上面,注意顺风均匀喷洒,另在足够6 瓶样本所用的嫩枝上面喷洒清水。然后在通风阴凉处静置2 h 让稀释液自然风干,以没有明显的液珠、闻不到较浓烈的农药味为准。
从野外采集榆紫叶甲成虫,放入玻璃瓶中,每瓶20 头左右。将喷药及喷洒清水处理后的嫩枝的根部插入装满清水的小瓶中,瓶口处用脱脂棉进行封口处理,以保持嫩枝的水分汲取。然后将喷药处理的嫩枝放入装有榆紫叶甲的玻璃瓶中供榆紫叶甲取食,嫩枝的投放量要足够满足试验期内榆紫叶甲的食用。每种农药、每种稀释液做3 瓶样本,共计81 瓶样本。另外,将喷洒清水处理的嫩枝分别放入6 个装有榆紫叶甲的玻璃瓶中,作为对照。总样本瓶数为87瓶。
自样本做好开始,每天观察2 次,每两天记录1 次每个样本中成虫的死亡数目,并记录对应的农药类型、稀释倍数及样本号。观察直到所有的成虫死亡,即样本瓶中没有生存的成虫为止。每次观察后把死亡的成虫放入70%的乙醇中保存。
1.3 成虫的生殖系统解剖
取榆紫叶甲个体,用剪刀剪下鞘翅,并从背部由下至上剪开,用大头针将体壁固定于蜡盘,在蜡盘中加入0.5%生理盐水,将蜡盘置于解剖镜下,拨开食道和其他器官,找到生殖器官,用解剖针将其与其他器官拨离,将生殖器官完整剥出,并用解剖针将黏附在生殖器官上的脂肪小心剥离,留下完整的生殖系统,放入Bouin’s 固定液中固定[4],制作成石蜡切片,用苏木精-伊红(HE)染色后,利用光学显微镜观察。
2 结果与分析
2.1 不同药剂、不同稀释倍数对榆紫叶甲的防治效果
不同药剂、不同稀释倍数对榆紫叶甲的防治效果见图1。

图1 不同药剂、不同稀释倍数对榆紫叶甲的防治效果Fig.1 The control effect of different pesticides and dilution ratio to Ambrostoma quadriimpressum
从图1 中可以看出,与对照组相比,9 种药 (试)剂处理过的榆紫叶甲死亡率均有不同程度的增加,特别是灭幼脲类农药,对榆紫叶甲具有较好的防治效果。经方差分析表明,6%吡虫啉可溶液剂和5%除虫脲乳油1 000 倍稀释液可使榆紫叶甲致死率达到100%;5%杀铃脲乳油200 倍稀释液对榆紫叶甲的致死率非常高,与对照组比较,差异均达到显著水平(<0.05);5%杀铃脲乳油200 倍稀释液与1 000 倍稀释液差异达显著水平,其余同种药剂不同倍数稀释液之间差异不显著。
2.2 不同药剂对榆紫叶甲生殖系统组织形态的影响
2.2.1 对照组样本
①雄性样本
雄性样本精巢的横切面如图2 所示。

图2 对照组雄性样本Fig.2 The male samples of control group
从图2 中可以看出,对照组雄性样本的精巢由精巢管组成,精巢管内产生精子,两张图都可以清晰地看到精巢管,结构紧密。
②雌性样本
雌性样本卵巢的横切面和纵切面见图3。

图3 对照组雌性样本Fig.3 The female samples of control group

图4 5%杀铃脲乳油处理的雄性样本Fig.4 The male sample of 5%triflumuron emulsifiable concentrate treatment
从图3 中的横切面可以看到卵巢管基部的卵子,纵切面由上至下可以看出卵子发生的基本过程。卵子表现为发育成熟的个体。
2.2.2 5%杀铃脲乳油处理的样本
①雄性样本
雄性样本的精巢纵切面如图4 所示。
从图4 中可以看出,5%杀铃脲乳油处理的雄性样本的精巢管结构不是很清晰,精巢管内精子数量较少,着色略浅。
②雌性样本
雌性样本卵巢管的纵切面如图5 所示。
从图5 中可以看出,雌性样本的卵巢基部着色较浅,腺体的结构较为分散。在图5 中无法看到卵子,着色较深的部位可以判断为卵原细胞,且分布比较均匀。
2.2.3 5%伏虫灵乳油的样本
①雄性样本
雄性样本精巢的纵切面(左)与横切面(右)如图6 所示。

图6 5%伏虫灵乳油处理的雄性样本Fig.6 The male sample of 5%hexaflumaron emulsifiable concentrate treatment

图7 5%伏虫灵乳油处理的雌性样本Fig.7 The female sample of 5% hexaflumaron emulsifiable concentrate treatment
从图6 精巢的横切面可以看出,精巢管着色很浅,说明精巢管内精子数量较少;精巢的纵切面显示,精巢形态较对照组有所不同。
②雌性样本
雌性样本纵切面如图7 所示。
从图7 中可以看出,卵巢管内没有明显的卵子与卵母细胞,卵巢管内物质分布比较均匀,说明此类药剂对卵子的形成有一定的抑制作用。
2.2.4 6%吡虫啉可溶液剂的样本
雄性(左)、雌性(右)样本的解剖结构如图8 所示。

图8 6%吡虫啉可溶液剂处理的雄性(左)、雌性(右)样本Fig.8 The male(left)and female(right)sample of 6%imidacloprid soluble concentrate treatment
从图8 中可以看出,雄性样本和雌性样本的着色都较浅,说明样本精巢中精子数量和卵巢中卵子数目都较少。精巢内中央部分有深红色的暗斑,推测其组织发生了一定变化。
2.2.5 5%除虫脲乳油的样本
①雄性样本
雄性样本的解剖结构如图9 所示。

图9 5%除虫脲乳油处理的雄性样本Fig.9 The male sample of 5%diflubenzuronone emulsifiable concentrate treatment

图10 5%除虫脲乳油处理的雌性样本Fig.10 The female sample of 5%diflubenzuronone emulsifiable concentrate treatment
从图9 中可以看出,雄性样本的精巢形态发生了萎缩,内部组织表现为未发育成熟状态。说明该药剂可以对精巢产生幼化作用。
②雌性样本
雌性样本的解剖结构如图10 所示。
从图10 中可以看出,雌性样本的着色较浅,卵巢内出现个别卵母细胞,卵巢管内组织分布比较均匀,但是未见卵子。
2.2.6 20%除虫脲悬浮剂的样本
①雄性样本
雄性样本的解剖结构如图11 所示。

图11 20%除虫脲悬浮剂处理的雄性样本Fig.11 The male sample of 20% diflubenzuronone suspending agent treatment
从图11 中可以看出,样本的精巢形态略微发生变化,精巢内部组织不清晰,从染色的效果来看,精巢内精子数量较少,组织也有少许变化。
②雌性样本
雌性样本的解剖结构如图12 所示。

图12 20%除虫脲悬浮剂处理的雌性样本Fig.12 The female sample of 20%diflubenzuronone suspending agent treatment
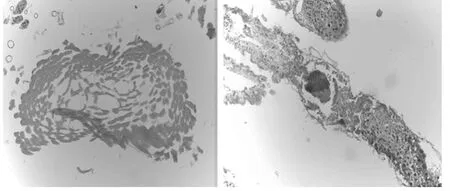
图13 20%抑食肼可湿性粉剂处理的雄性(左)、雌性(右)样本Fig.13 The male(left)and female(right)sample of 20%RH-5849 wettable powder treatment
从图12 中可以看出,卵巢的基部结构较为松散,卵巢管内只观察到卵原细胞。说明此种药剂对卵子的发生起到了抑制作用。
2.2.7 20%抑食肼可湿性粉剂的样本
雄性(左)、雌性(右)样本的解剖结构如图13 所示。
从图13 中可以看出,经20%抑食肼可湿性粉剂处理的雌雄样本基本与对照组无差异。可以推测该药剂对样本的生殖系统基本没有影响。
2.2.8 20%米满悬浮剂的样本
①雄性样本
雄性样本的解剖结构如图14 所示。

图14 20%米满悬浮剂处理的雄性样本Fig.14 The male sample of 20%tebufenozide suspending agent treatment
从图14 中可以看出,雄性样本的精巢形态与对照组有所变化,精巢内可以看到的精子数量很少,腺体较为分散,精巢发生萎缩。说明该药剂对样本的精巢有幼化作用。
②雌性样本
雌性样本的解剖结构如图15 所示。

图15 20%米满悬浮剂处理的雌性样本Fig.15 The female sample of 20% tebufenozide suspending agent treatment

图16 1.78mg·mL-1苦参碱处理的雄性(左)、雌性(右)样本Fig.16 The male(left)and female(right)sample of 1.78 mg·mL-1 matrine treatment
图15 中只能看到少数卵原细胞,没有看到卵母细胞,卵巢管形态没有发生变化。可见,该药剂对样本的卵子形成有抑制作用。
2.2.9 1.78 mg·mL-1苦参碱的样本
雄性(左)、雌性(右)样本的解剖结构如图16 所示。
从图16 可以看出,样本有完整的精子和卵子细胞,而且着色较深,形态也与对照组基本相似。由此可以判断,1.78 mg·mL-1苦参碱未对其生殖系统产生影响。
2.2.10 蔗糖酯的样本
雄性(左)、雌性(右)样本的解剖结构如图17 所示。

图17 蔗糖酯处理的雄性(左)、雌性(右)样本Fig.17 The male(left)and female(right)sample of sucrose ester treatment
从图17 中可以看出,雄性(左)、雌性(右)样本的组织结构、染色状态,与对照组相比较没有发现明显差别,由此可推测组织及形态无明显变化。
3 结论与讨论
采用灭幼脲类、苦参碱、蔗糖酯和抑食肼类9 种药(试)剂对榆紫叶甲进行防治效果测定,结果表明:6%吡虫啉可溶液剂、5%除虫脲乳油在低体积分数下就可以起到极好的杀虫效果,蔗糖酯作用不明显,其他几种药剂的杀虫效果亦较为理想。对死亡个体生殖系统的组织形态学研究发现:灭幼脲类农药与20%米满悬浮剂对精子和卵子的形成起到一定的抑制作用,灭幼脲类农药可导致生殖系统形态发生萎缩变化,而其他药剂作用不明显。
灭幼脲类农药对哺乳动物无蓄积毒性,不致癌、不致畸,不致突变。在自然环境中,灭幼脲除光解外[3],还可被土壤中的微生物快速降解[4,5],不被植物吸收,无内吸作用,在动物体内也能很快代谢、排泄。因此,在食物链中没有积累。而灭幼脲对昆虫的毒性很高,主要是胃毒作用,接触毒性较弱,无熏蒸作用。目前国内外应用灭幼脲防治农林、果树、蔬菜、贮粮、畜牧、卫生等约8 目34 科90 多种害虫,均取得很好的效果,其中以鳞翅目、双翅目、鞘翅目的害虫种类较多[6~11]。本研究证实,与其他3 种农药相比较,灭幼脲类6 种农药1 000 倍稀释液对鞘翅目榆紫叶甲的防治效果显著,因此,在防治过程中,应考虑采用灭幼脲类农药。
灭幼脲处理成虫进而抑制卵的孵化,已在双翅目、鳞翅目、鞘翅目等多种昆虫得到证实[12~15]。研究结果显示,灭幼脲类农药对榆紫叶甲雌虫和雄虫的生殖系统及内部精子卵子的组织结构均产生一定的破坏作用,证实灭幼脲类农药对鞘翅目生殖系统产生影响。
至于在实践中,究竟采用何种质量分类及配比更加经济有效,还需进一步进行野外试验;这9 种农药究竟对榆紫叶甲生殖系统的组织形态产生何种变化,还需进行透射电镜观察,进行深入研究。
[1]马凤贵.毒绳防治榆紫叶甲试验[J].新农业,1998:29-36.
[2]戴万琢,张万军,侯丽伟.松原市森林病虫害发生的特点及防治对策[J].吉林林业科技,1998,(1):56-60.
[3]刘国光,金祖亮,徐晓白.灭幼脲(Ⅲ)在模拟大气条件下光解行为的研究[J].环境科学学报,1992,(2):72-84.
[4]Seuferer,S.L. Metabolism of Difubenzuron by Soil Microorganisms and Mutagenicity of the Metabolites[J].Pesticide Biochemistry And Physiology,1979,(10):174-180.
[5]施国涵.土壤微生物对灭幼脲Ⅲ号杀虫剂代谢作用的研究[J].环境科学学报,1990,10(3):296-302.
[6]苗建才.灭幼脲类杀虫剂防治森林害虫的研究进展[J].林业科技,1989,25(6):536-541.
[7]Viana,Paulo A.Control of fall armyworm.Spodoptera frugiperda(J.E.Smith)(Lepidoptera:Noctuidea)in field corn with insecticides applied through a sprinkler irrigation system[J].Anais da Sociedade Entomologica do Brasil,1998,27(3):451-458.
[8]Webb,Ralph E.An evaluation of the residual activity of traditional,safe,and biological insecticidea against the gypsymoth[J].Journal of Arboriculture,1998,24(5):286-292.
[9]Delgado,Francisco X.Field assessment of Beayveria bassiana(Badsamo)Vuilemin and potential synergism with diflubenzuron for control of savanna grasshopper complex(Orthoptera)in Mali[J].Journal of Invertebrate Pathology,1999,73(1):34-39.
[10]张玉军,郑君山,庞旭红.榆紫叶甲无公害防治技术研究[J].吉林林业科技,2013,42(1):37-38,46.
[11]王珊珊,张帅,王诗乐,等. 河岸带乔木树种配置方式对面源污染物NH4+-N 的去除效果[J]. 森林工程,2014,30(4):27-30.
[12]Kim,G.H.Effects of diflubenzuron on longevity and reproduction of Riptorfus clauatus (Hemiptera:Alydiae)[J].Ibid,1992,(85):644-648.
[13]陈霈,弓惠芬,王进忠,等.灭幼脲对粘虫不育作用的机理[J].昆虫学报,1993,36(4):396-408.
[14]Redfem,R.E. Large milkweed bug:effects of diflubenzuron and its analogus or reproduction[J].J.Econ.Entomol.1980,73:682-693.
[15]Chang,S.C.Effects of substituted benzylphenals on reproduction of house flies[J].Ibid,1980,(73):745-747.

