作物脂肪氧化酶的研究进展
扎 桑 卓 嘎 徐东东 张利莎, 董国清 袁兴淼 张 京 郭刚刚*
(1.西藏大学农牧学院,西藏林芝860000;2.农业部作物种质资源与生物技术重点开放实验室/国家农作物基因资源与基因改良重大科学工程/中国农业科学院作物科学研究所,北京100081;3.武汉轻工大学生物与制药工程学院,湖北武汉430023)
作物脂肪氧化酶的研究进展
扎桑1,2卓嘎1*徐东东2张利莎2,3董国清3袁兴淼2张京2郭刚刚2*
(1.西藏大学农牧学院,西藏林芝860000;2.农业部作物种质资源与生物技术重点开放实验室/国家农作物基因资源与基因改良重大科学工程/中国农业科学院作物科学研究所,北京100081;3.武汉轻工大学生物与制药工程学院,湖北武汉430023)
脂肪氧化酶及其代谢产物参与作物生长发育的多个阶段,同时还参与介导损伤反应及病原菌防御性反应。此外,作物脂肪氧化酶作为影响食品风味和商品品质的关键因素,直接影响作物食品的生产加工工艺和货架寿命。然而由于不同脂肪氧化酶家族成员在脂质代谢中所起作用有所不同,使得育种家针对特定育种目标开展定向遗传改良成为可能。因此,本文对脂肪氧化酶参与的生化途径、脂质代谢主要产物的生理功能及其对作物品质性状的影响,以及作物脂肪氧化酶性状改良的育种实践、研究进展等进行了综述。
作物脂肪氧化酶;LOX途径;品质;抗逆性;遗传改良
脂肪氧化酶(lipoxygenase,LOX;EC1.13.11.12)在植物[1-5]、动物[6-7]以及微生物[8-10]中普遍存在,是一类含非血红素铁的蛋白酶家族,主要通过催化多元不饱和脂肪酸发生双加氧反应生成脂肪酸氢过氧化物,再经一系列不同酶的作用,最终生成具有一定生理功能的小分子醛、醇和酮等代谢产物,从而在农作物产品风味形成、营养生长、损伤反应、防御反应和抗逆性等诸多方面产生重要影响。本文对脂肪氧化酶及其代谢产物参与的生化途径、生理功能、对作物品质性状的影响,以及农作物相关性状改良的利用实践等方面的研究进展进行了综述。
1 脂肪氧化酶的生化途径
早在1932年,Andre和Hou首次在大豆中发现了脂肪氧化酶[11],随着植物中越来越多的脂肪氧化酶成员的发现和深入研究[12-16],目前对于脂肪氧化酶途径(简称LOX途径)已有明确认识。LOX途径是指脂肪氧化酶专一性催化含有(Z,Z)-1,4-戊二烯结构的多不饱和脂肪酸(Polyunsaturated fatty acid, PUFA)生成氢过氧化物,再经一系列不同酶的作用,最终生成具有一定生理功能的化合物的过程。在高等植物体内,LOX途径主要是以亚油酸(linoleic acid,18∶2)和亚麻酸(α-linolenic acid,18∶3)等非饱和十八碳酸为初始底物[17],因此又称十八碳酸途径。由于亚油酸等初始底物是由甘油酸经脂酶或水解酶水解而来,因此广义上的LOX途径还包括甘油酸的水解过程,而狭义上的LOX途径则是从脂肪酸氧化开始。此外,由于脂肪氧化酶催化的加氧反应可发生在戊二烯结构的任一端,根据专一性催化PUFA碳链骨架位置的不同(C-9/C-13),可将脂肪氧化酶分为9-LOX和13-LOX,而一些脂肪氧化酶能够同时地催化两个位点的氧化反应,分别产生9-和13-氢过氧化物(HPOD/HPOT)。目前作物中已研究明确的脂肪氧化酶中,大豆和水稻的L-1、大麦的LOX2/LoxC、玉米的ZmLOX10/11以及豌豆的LOX1∶Ps∶1等都属于13-LOX;水稻的L-3、大麦的LOX1/LoxA以及玉米的ZmLOX1/3/4/5等则属于9-LOX;而大豆的L-2/L-3和水稻的L-2等则属于具有双位点催化活性的9-/13-LOX(表1)[18-20]。
PUFA经9-LOX和13-LOX催化产生的氢过氧化物在下游过氧化物裂解酶(Hydroperoxide Lyase,HPL)、乙醇脱氢酶(Alcohol dehydrogenase,ADH)、异构酶(Isomerase,ISO)和醇酰基转移酶(Alcohol acyltransferase,AAT)等一系列酶作用下进一步转化为各种烯醛和烯醇类化合物。另一方面,13-HPOT在AOS(Allene oxide synthase)和丙二烯氧化物环化酶AOC(Allene oxide cyclase)等酶以及多步β-氧化(β-oxidation)作用下生成植物内源性激素茉莉酸(Jasmonic acid)(图1)[15,21-22]。
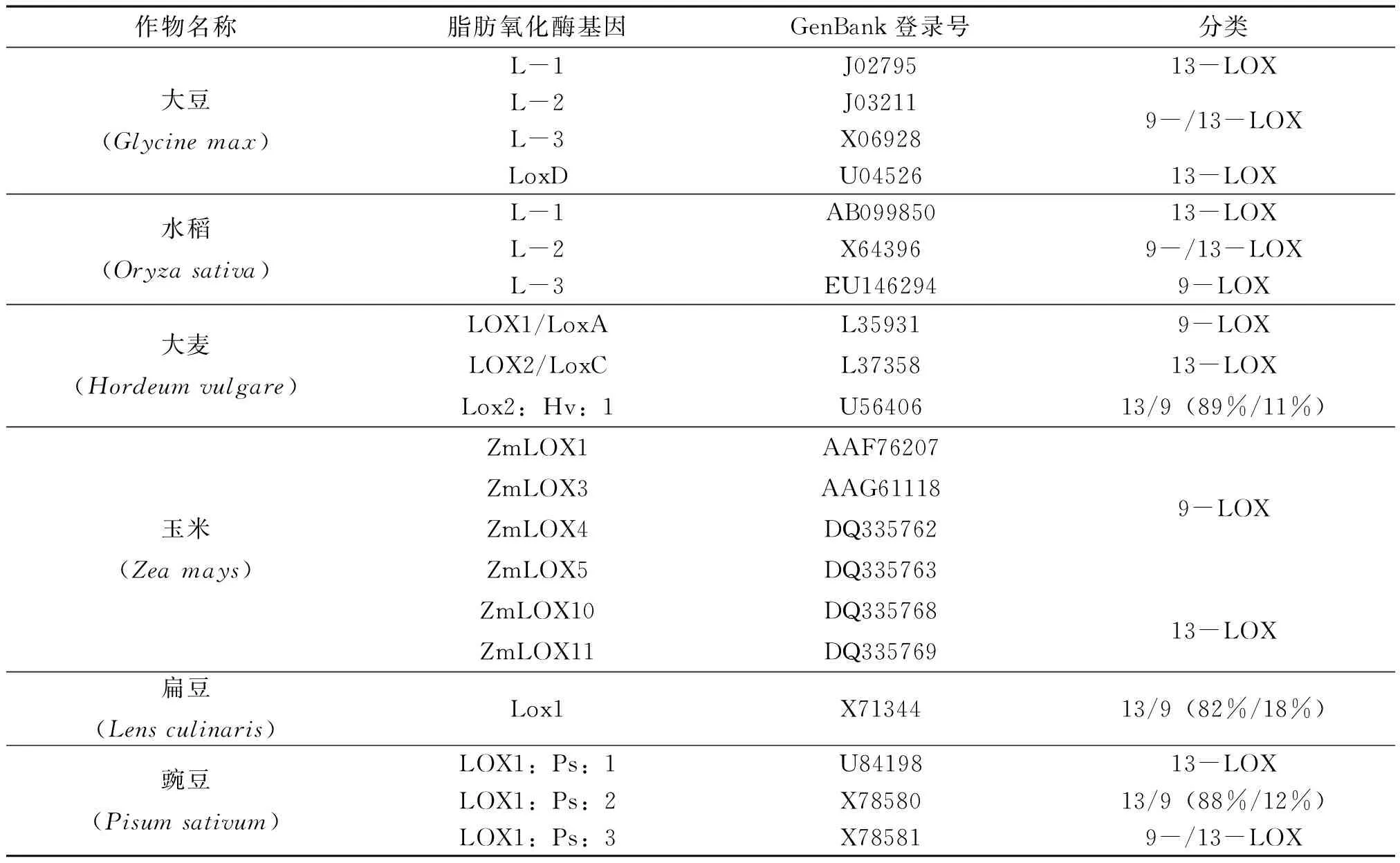
表1 作物脂肪氧化酶及其分类
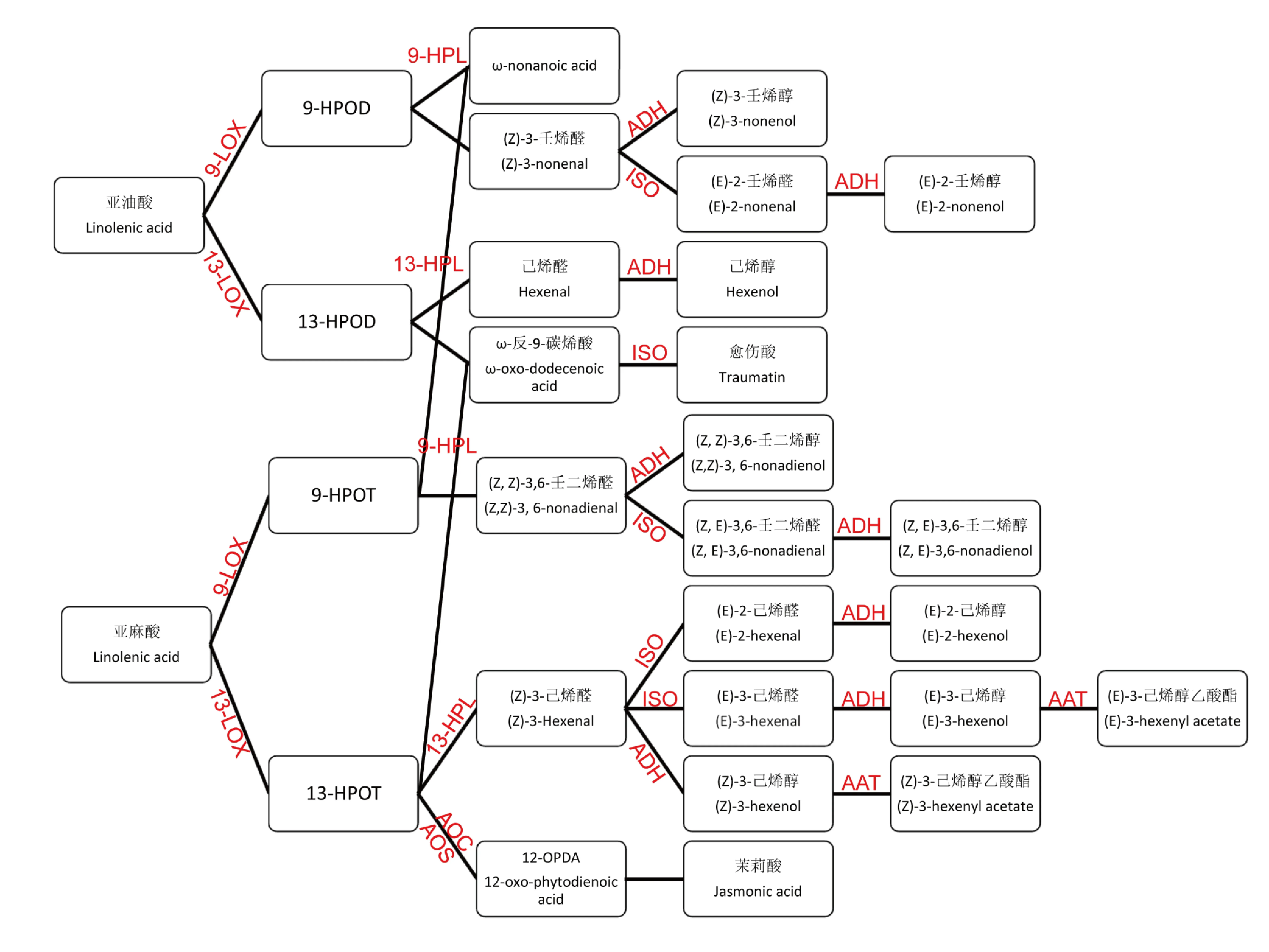
图1 脂肪氧化酶(LOX)代谢生化途径
注:LOX: Lipoxygenase; HPL: Hydroperoxide Lyase;AOS: Allene oxide synthase;AOC: Allene oxide cyclase;ISO: Isomerase;ADH: Alcohol dehydrogenase;AAT: Alcohol acyltransferase.
2 脂肪氧化酶及其代谢产物的生理功能
作物中的LOX不仅可作为营养器官贮藏蛋白(Vegetative storage protein, VSP)参与脂类迁移,以及调节“源”与“库”的分配[23-24],而且LOX生化途径所产生的代谢产物(统称为脂氧化物,Oxylipin)参与作物生长发育的各个阶段,参与的生理过程涉及植株生长发育和成熟衰老[17, 25]、机械损伤反应[26- 27]、介导病原菌防御性反应,并在影响食品风味及品质等方面起着非常重要的作用[16](表2)。

表2 LOX途径脂氧化物的主要生理功能
2.1影响植株生长发育和成熟衰老
在作物种子尤其是含油种子萌动过程中,LOX启动脂肪体中储藏的脂肪酸氧化,且高活性脂肪氧化酶加速细胞膜的破坏,使得氧化的脂肪酸很容易地从脂肪体解离,进而释放到胞液中以实现营养分配。因此,在植株幼嫩部位和快速生长的组织中脂肪氧化酶的活力一般较高,促进贮藏养分向正在发育的幼胚运输[28]。另一方面,LOX途径产生的茉莉酸能够通过反馈抑制脂肪氧化酶的活性和脂质降解等来抑制种子萌发,这对于保障作物种子避开不利的环境条件,在适宜条件下萌动可能起着至关重要的作用[29-31]。
另外,在植物生长发育过程中,脂肪酸的过氧化物可以使蛋白质失活、叶绿体的光化学反应失活并破坏细胞膜的结构,这样促进了植物的衰老过程。茉莉酸促进乙烯合成、叶片衰老、叶片脱落、气孔关闭、呼吸作用。
2.2参与机械损伤反应
植物叶片受到昆虫取食以及机械损伤时,脂肪氧化酶转录水平和蛋白活性均会迅速增强,从而促进损伤诱导的脂氧化物生成。研究表明,13-LOX途径的代谢产物与植物对虫害的趋避反应有密切关系[32-33]。其中过氧化物和己醛等还对害虫有驱除作用[34];愈伤酸(12-oxo-10(E)-dodecenoic acid, Traumatin)能够促进损伤伤口的愈合,促进茉莉酸和12-氧-植物二烯酸(12-oxo-phytodienoil acid,12- OPDA)等损伤信号分子的含量增加,以及诱导防御性绿叶挥发物(Green leaf volatiles,GLVs)的大量产生[35-36],如Hildebrand 等发现 (Z)-3-己烯醇对蚜虫有趋避作用[37]。反-2-己烯醛的释放则能够诱导HMGR和LOX 等防御基因的表达[38];而缺乏茉莉酸合成或感知的拟南芥植株对损伤和昆虫的侵害反应迟钝[39- 40]。由此可见,损伤反应诱导的LOX途径能够通过产生脂氧化物等损伤相关信号分子,促进伤口愈合以及吸引植食性昆虫的捕食性天敌和寄生性天敌,从而帮助植物直接或间接抵御包括昆虫取食在内的机械损伤[41-43]。
2.3介导病原菌防御性反应
许多植物的LOX 基因在病原微生物(如细菌、真菌、病毒等)的伤害诱导下表达,且LOX活性增加与细胞的物理伤害伴随发生,导致局部细胞死亡,使植物抗性增强[44- 45]。例如,烟草病原菌Phytopathoraparasitica可以诱导LOX 在烟草叶片表达并产生过敏性细胞死亡[46];水稻稻瘟病菌侵染可以诱导LOX 的表达[47];小麦非亲和性锈病病原菌侵染后28h也能够检测到LOX活性增加[48]。在病原菌感染后,拟南芥中LOX1 mRNA水平增加了约6倍[49]。此外,在抗病性和敏感性的植物品系中,LOX对病原菌入侵反应产生的反应并不相同。如在抗病性的燕麦品系中,冠锈病菌Pucciniacoronata的侵入会伴随出现LOX活性的增加,但在敏感型品系中LOX活性则无变化[50]。
2.4对食品风味和品质的影响
大量研究表明,作物中的LOX途径所产生的醛类和醇类等挥发性代谢产物不仅在参与损伤反应和昆虫趋避方面起作用,而且在食品风味形成、加工储藏过程中的品质变化以及最终形成的商品品质和货架寿命等方面有着更为关键的作用。在食品风味形成过程中,脂肪氧化酶途径依赖LOX和HPL通过降解PUFA所产生的挥发性代谢产物赋予了果实成熟所特有的风味。青叶醇(Z)-3-己烯醇)和青叶醛(E)-2-己烯醛)等是植物叶片呈现强烈青草香气的主要物质,13-HPL是这一生化途径中的关键酶。
在油料作物和粮食作物的贮藏和加工过程中,豆制品的豆腥味,稻米的哈喇味以及人们常说的“陈芝麻烂谷子”等酸败气味等都是脂质代谢产物作用的结果,不仅如此,PUFA的氧化还导致食品的营养品质和商品品质降低。
研究发现,LOX在大豆成熟种子中的含量占种子蛋白质含量的1%~2%,所催化产生的过氧化氢衍生物直接与食品中的蛋白质和氨基酸结合,不仅破坏了人体必需脂肪酸,还产生豆腥味和苦涩味,降低了大豆食品的营养价值和商品品质[51-52]。与大豆类似,花生、玉米在储藏过程中品质下降主要包括脂质体的溶合、细胞膜完整性下降、透性增加、细胞溶质功能丧失、贮藏物质和维生素等主要成分的改变以及种子活力和发芽力的降低,关键原因之一也是由于脂肪氧化酶参与了所贮藏的脂肪酸的氧化代谢[53- 54]。
不仅如此,脂质降解还是导致谷物贮藏期间产生陈味、品质变劣的主要原因。与油料作物相比,尽管水稻、大麦和小麦等粮食作物种子中的脂质含量仅占2%~3%,但脂肪氧化酶活性与这些谷物的耐储藏性密切相关。在水稻中,脂质代谢不仅产生了挥发性的己醛、戊醛和戊醇等与稻米陈化变质有关的陈米味,而且由于脂氧化物、活性氧和自由基等具有高度的氧化活性,还可能直接参与稻谷中的贮藏蛋白的分子内和分子间二硫键氧化交联,影响其结构和功能,同时也可能与氨基酸和维生素相结合,不仅导致大米酸度增加食味变差,食用和营养价值降低甚至不能食用,而且导致陈化稻谷表现出发芽率下降或丧失[55-57]。
大麦麦芽是生产啤酒的主要原料,脂肪氧化酶活性也是影响大麦储藏啤酒风味特性的重要因素之一。通过降低脂肪氧化酶活性可以延长大麦的储藏期及其啤酒风味稳定性。在啤酒加工储藏过程中,LOX作用于亚油酸所产生和积累的9-HPOD在HvHPL等酶的进一步作用下转化为T2N(E)-2-壬烯醛)和三羟基十八碳酸(THODs),其中T2N已明确为啤酒老化物质,是啤酒产生“硬纸板味”的关键性脂质代谢产物,而三羟基十八碳酸能够对泡沫稳定性和啤酒风味产生不良影响。
在小麦中,LOX低活性或缺失品种中,脂质氧化反应有效减轻,从而减轻了小麦籽粒的氧化变质,延长其储藏期,减少粮食浪费[58]。同时,LOX活性与普通小麦食品的风味和外观品质也有着密切关系。硬粒小麦的LOX活性与意大利面条的亮黄色呈显著负相关[59-60],而普通小麦中提高脂肪氧化酶活性有助于提高小麦结构中麦谷蛋白交联和氧化作用,从而改善中国食品的面粉颜色和面团流变学特性;新磨制的小麦面粉因含类胡萝卜素而呈淡黄色,利用掺入适量的LOX活性高的大豆粉能偶联氧化类胡萝卜素进行漂白的特点来漂白面团,可作为生物增白剂的主要来源替代化学漂白剂,不仅提高了食品的安全性,同时也提高了其商品及加工品质[61- 62]。
3 作物脂肪氧化酶性状改良及育种应用
从LOX途径催化反应的特异性中我们也可以看出,作物中多个脂肪氧化酶基因之间存在功能分化。如玉米[63]和水稻[64]中LOX1和LOX2的缺失对延缓种子陈化变质、保持种子活力等方面起着重要作用,而LOX3的缺失则能够减轻仓储害虫危害。在大麦中发现的3个LOX基因中[65-68],仅有LOX1参与的9-HPOD代谢被确认是影响啤酒品质的关键因素[69]。
对不同作物而言,脂肪氧化酶活性的影响因素也有所不同。LOX活性与基因型[70]、底物、酶抑制剂[71]、还原剂、金属离子、温度、酸碱度等反应条件以及各种生理生化因素关系密切[72],同时还与种子发育成熟度、含水量、储藏条件以及加工工艺[73]等有关,但不同基因型间差异尤为显著,说明遗传因素是决定作物LOX结构和活性的首要因素[74]。因此通过遗传改良,提高储藏种子的活力和保证作物的商品品质成为作物品质育种的重要目标之一。目前主要通过筛选特定的脂肪氧化酶活性差异的种质,并通过遗传和生化分析发掘功能性分子标记开展辅助育种,此外还通过基因工程手段直接开展作物脂肪氧化酶的性状改良。
3.1脂肪氧化酶活性差异的种质资源筛选
鉴于脂肪氧化酶对于作物品质和储藏特性的影响,过去30多年中,世界上众多科研团队在各主要作物中开展了脂肪氧化酶活性差异种质的筛选,对相关种质中发掘出的具有商业价值的基因资源进行了专利保护,并在生产上广泛用于育种实践。
大豆中,Hildebrand和Hyowitz等[75]从6499份大豆资源中筛选出2份LOX1缺失的种质;随后, LOX3[76-77]和LOX2[78-79]缺失的种质也相继被发掘;在此基础上一批LOX活性全缺失的种质被相继创制出来,与普通大豆品种相比,3个LOX功能全部缺失的大豆产量并未降低,蛋白质和氨基酸等营养成分没有损失;但豆腥味降低甚至消失,不仅不再需要进行脱腥处理,而且VE含量提高,口感和风味更好[80-83]。此外,LOX活性缺失的水稻种质[64,74, 84]、大麦种质也相继从种质资源[85-86]以及人工诱变产生的突变体中(专利US7420105 B2)筛选出来,其中Guo等[87]从1083份中国大麦种质中筛选出4份源于黄河中下游地区的LOX1活性缺失的种质,发现该基因第二内含子中的一个SNP变异导致内含子转录剪接位点改变是引起其活性丧失的根本原因。
3.2功能标记发掘及分子辅助育种
随着遗传学研究的深入和分子标记技术的发展,确定导致基因功能改变的基因座以及相应的功能位点,根据不同的育种目标,开发特异性分子标记,并将其用于与常规杂交选育相结合的分子辅助育种,已经成为当前育种的新常态。段红梅等[88]利用SSR 标记进行遗传背景分析,明确了大豆SSR标记辅助背景选择时适宜的标记数目和选择方式,获得进一步回交的鲁豆4 号的缺失株系,从而加速培育鲁豆4号脂肪氧化酶活性缺失近等基因系。孙君明等[89]以大豆脂肪氧化酶缺失近等基因系Century为材料,筛选出数个与大豆LOX1 缺失基因连锁的RAPD 标记,提供了以Century近等基因系为遗传背景的大豆脂肪氧化酶育种的可靠标记。在水稻中,与LOX 缺失同功酶 LOX1、LOX2和LOX3连锁的RAPD分子标记被用于耐储藏水稻品种的分子标记辅助选择[ 90-91]。小麦中,LOX活性相关功能标记也被开发用于分子辅助育种[58]。在大麦中,针对脂肪氧化酶突变位点的共显性分子标记被开发出来,并用于分子标记辅助的高品质啤酒大麦新品种育种[85, 87]。对育成的LOX1活性缺失啤酒大麦的酿造实验结果表明,其风味稳定性更好、老化物质含量更低,而且货架期显著延长。
3.3遗传转化与转基因育种
利用转基因技术对控制作物品质形成关键基因进行定向操作,可大大加速作物育种进程。目前,在作物脂肪氧化酶基因的遗传转化方面也取得了相关研究进展。Sharma等[92]通过粒子轰击的方法将编码大麦LOX100(Lox2:Hv:1)蛋白基因转入大麦幼胚中,再生植株中叶绿体和细胞质中均有LOX表达,并发现了LOX衍生物含量较高的转基因植物。随后,又通过基因枪法首次获得过表达13-LOX的转基因大麦,并研究了LOX蛋白与植物衰老之间的联系[93]。马建等[94]通过花粉管通道法将脂肪氧化酶基因RNAi表达载体导入大豆,抑制了大豆籽粒中脂肪氧化酶基因表达,其脂肪氧化酶含量比对照平均降低55%~77%,而转基因植株脂肪含量得到提升,最高达到24.76%。在水稻中,为获得耐储藏的水稻转基因株系,李俊卿等[95]用农杆菌介导法将脂肪氧化酶基因的RNAi表达载体转化到水稻愈伤组织中,得到可抑制LOX基因正常表达的阳性转基因水稻幼苗。许惠滨等[96]通过农杆菌介导法,将反义lox-3基因导入籼型恢复系“航1号”中,从转基因植株中筛选出脂肪氧化酶低表达的株系。刘振华等[97]对转入小麦中的脂氧合酶基因的外源RNAi序列的转基因株系中外源基因拷贝数及其种子脂氧合酶活性进行测定分析,成功获得含有不同外源Loxi片段拷贝数的脂氧合酶活性显著降低的转基因小麦株系。
4 结论与展望
鉴于脂肪氧化酶所参与的脂质代谢对作物的病虫害防御反应、耐储藏性、风味形成、产品品质以及产品保质期和货架寿命等的影响,使得脂肪氧化酶的性状改良成为作物遗传改良的重要目标之一。
在作物脂肪氧化酶途径中,对于同一反应底物,不同的LOX蛋白所催化成的产物各异,因此,作物中各LOX成员及其代谢通路的功能解析、不同LOX活性差异种质资源的筛选,以及LOX途径相关基因的功能性分子标记的开发应用,使得针对不同需求的育种目标开展分子辅助育种成为现实。
LOX途径代谢产物在参与植物生长发育、损伤反应和抗病虫害等方面的深入研究,将有助于实现对作物生长发育的精确调控、预防性生物农药以及新型植保素的开发等。随着未来代谢组学研究手段的发展,作物脂类代谢产物的生理生化功能将获得更深层次的认知。
[1]Feussner I,Wasternack C.The lipoxygenase pathway[J].Annual Review of Plant Biology,2002,53(1):275-297
[2]Start W G,Ma Y,Polacco J C,et al.Two soybean seed lipoxygenase nulls accumulate reduced levels of lipoxygenase transcripts[J].Plant Molecular Biology,1986,7(1):11-23
[3]Brash A R.Lipoxygenases:occurrence,functions,catalysis,and acquisition of substrate[J].Journal of Biological Chemistry,1999,274(34):23679-23682
[4]Chen G,Hackett R,Walker D,et al.Identification of a specific isoform of tomato lipoxygenase (TomloxC) involved in the generation of fatty acid-derived flavor compounds[J].Plant Physiology,2004,136(1):2641-2651
[5]Liavonchanka A,Feussner I.Lipoxygenases:occurrence,functions and catalysis[J].Journal of Plant Physiology,2006,163(3):348-357
[6]Nugteren D H.Arachidonate lipoxygenase in blood platelets[J].Biochimica et Biophysica Acta,1975,380(2):299-307
[7]Schewe T,Halangk W,Hiebsch C,et al.A lipoxygenase in rabbit reticulocytes which attacks phospholipids and intact mitochondria[J].FEBS Letters,1975,60(1):149-152
[8]Zimmerman D C,Vick B A.Lipoxygenase inChlorellapyrenoidosa[J].Lipids,1973,8(5):264-266
[9]Hamberg M.Isolation and structures of lipoxygenase products fromSaprolegniaparasitica[J].Biochimica et Biophysica Acta,1986,876(3):688-692
[10]Beneytout J L,Andrianarison R H,Rakotoarisoa Z,et al.Properties of a lipoxygenase in green algae (Oscillatoriasp.)[J].Plant Physiology,1989,91(1):367-372
[11]Andre E,Hou K W.The presence of a lipid oxidase in soybeanGlycinesoya[J].CR Acad Sci (Paris),1932,194:645-648
[12]Theorell H,Holman R T,Akeson A.Crystalline lipoxidase[J].Acta Chemica Scandinavica,1947,1(6):571-576
[13]Christopher J,Pistorius E,Axelrod B.Isolation of an isozyme of soybean lipoxygenase[J].Biochimica et Biophysica Acta,1970,198(1):12-19
[14]Christopher J P,Pistorius E K,Axelrod B.Isolation of a third isoenzyme of soybean lipoxygenase[J].Biochimica et Biophysica Acta,1972,284(1):54-62
[15]Gigot C,Ongena M,Fauconnier M L,et al.The lipoxygenase metabolic pathway in plants: potential for industrial production of natural green leaf volatiles[J].Biotechnologie Agronomie Societe et Environnement,2010,14(3):451-460
[16]Porta H,Rocha-Sosa M.Plant lipoxygenases.Physiological and molecular features[J].Plant Physiology,2002,130(1):15-21
[17]Siedow J N.Plant lipoxygenase:structure and function[J].Annual Review of Plant Biology,1991,42(1):145-188
[18]Axelrod B,Cheesbrough T M,Laakso S.Lipoxygenase from soybeans:EC 1.13.11.12 Linoleate:oxygen oxidoreductase[J].Methods in Enzymology,1981,71:441-451
[19]Holtman WL,Vre denbreg·Heistek JC Schmitt NF,et al.Lipoxygenase-2 oxygenates storage lipids in embryos of germinating barley[J].European Journal of Biochemistry,1997,248(2):452-458
[20]Nemchenko A,Kunze S,Feussner I,et al.Duplicate maize 13-lipoxygenase genes are differentially regulated by circadian rhythm,cold stress,wounding,pathogen infection,and hormonal treatments[J].Journal of Experimental Botany,2006,57(14):3767-3779
[21]Gardner H W.Biological roles and biochemistry of the lipoxygenase pathway [J].HortScience,1995,30(4):197-205
[22]Shibata D,Axelrod B.Plant lipoxygenases[J].Journal of Lipid Mediators and Cell Signalling,1995,12(2):213-228
[23]Fischer A M,Dubbs W E,Baker R A,et al.Protein dynamics,activity and cellular localization of soybean lipoxygenases indicate distinct functional roles for individual isoforms[J].The Plant Journal,1999,19(5):543-554
[24]Stephenson L C,Bunker T W,Dubbs W E,et al. Specific soybean lipoxygenases localize to discrete subcellular compartments and their mRNAs are differentially regulated by source-sink status[J].Plant Physiology,1998,116(3):923-933
[25]Suzuki Y,Matsukura U.Lipoxygenase activity in maturing and germinating rice seeds with and without lipoxygenase-3 in mature seeds[J].Plant Science,1997,125(2):119-126
[26]Saravitz D M,Siedow J N.The differential expression of wound-inducible lipoxygenase genes in soybean leaves[J].Plant Physiology,1996,110(1):287-299
[27]Hildebrand D F,Rodriguez J G,Brown G C,et al.Peroxidative responses of leaves in two soybean genotypes injured by twospotted spider mites (Acari:Tetranychidae)[J].Journal of Economic Entomology,1986,79(6):1459-1465
[28]Feussner I,Kühn H,Wasternack C.Lipoxygenase-dependent degradation of storage lipids[J].Trends in Plant Science,2001,6(6):268-273
[29]宾金华,潘瑞炽.甲基茉莉酸酯对花生种子萌发和贮藏物质降解的影响[J].热带亚热带植物学报,1998,6(3):239-244
[30]杨艺,常丹,王艳,等.茉莉酸与茉莉酸甲酯预处理对干旱胁迫下棉花种子萌发和种苗生理特性的影响[J].西北植物学报,2015,35(2):302-308
[31]李荣冲,沈亮余,梁晶龙,等.高温高湿胁迫下茉莉酸甲酯对紫苏种子萌发及生理特性的影响[J].西北植物学报,2012,32(2):312-317
[32]Shiojiri K,Kishimoto K,Ozawa R,et al.Changing green leaf volatile biosynthesis in plants:an approach for improving plant resistance against both herbivores and pathogens[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(45):16672-16676
[33]Chehab E W,Kaspi R,Savchenko T,et al.Distinct roles of jasmonates and aldehydes in plant-defense responses[J].PLOS ONE,2008,3(4):e1904
[34]Mohri S,Endo Y,Matsuda K,et al.Physiological effects of soybean seed lipoxygenases on insects[J].Agricultural and Biological Chemistry,1990,54(9):2265-2270
[35]Creelman R A,Mullet J E.Biosynthesis and action of jasmonates in plants[J].Annual Review of Plant Biology,1997,48(1):355-381
[36]Parchmann S,Gundlach H,Mueller M J.Induction of 12-oxo-phytodienoic acid in wounded plants and elicited plant cell cultures[J].Plant Physiology,1997,115(3):1057
[37]Hildebrand D F,Brown G C,Jackson D M,et al.Effects of some leaf-emitted volatile compounds on aphid population increase[J].Journal of Chemical Ecology,1993,19(9):1875-1887
[38]Bate N J,Rothstein S J.C6-volatiles derived from the lipoxygenase pathway induce a subset of defense-related genes[J].The Plant Journal,1998,16(5):561-569
[39]McConn M,Creelman R A,Bell E,et al.Jasmonate is essential for insect defense in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,1997,94(10):5473-5477
[40]Xie D X,Feys B F,James S,et al.COI1:an Arabidopsis gene required for jasmonate-regulated defense and fertility[J].Science,1998,280(5366):1091-1094
[41]Thaler J S.Jasmonate-inducible plant defences cause increased parasitism of herbivores[J].Nature,1999,399(6737):686-688
[42]Alborn H T,Turlings T C J,Jones T H,et al.An elicitor of plant volatiles from beet armyworm oral secretion[J].Science,1997,276(5314):945-949
[43]Agrawal A A.Mechanisms,ecological consequences and agricultural implications of tri-trophic interactions[J].Current Opinion in Plant Biology,2000,3(4):329-335
[44]Dixon R A,Lamb C J.Molecular communication in interactions between plants and microbial pathogens[J].Annual Review of Plant Biology,1990,41(1):339-367
[45]Ponz F,Bruening G.Mechanisms of resistance to plant viruses[J].Annual Review of Phytopathology,1986,24(1):355-381
[46]Véronési C,Rickauer M,Fournier J,et al.Lipoxygenase gene expression in the tobacco-Phytophthora parasitica nicotianae interaction[J].Plant Physiology,1996,112(3):997-1004
[47]Peng Y L,Shirano Y,Ohta H,et al.A novel lipoxygenase from rice.Primary structure and specific expression upon incompatible infection with rice blast fungus[J].Journal of Biological Chemistry,1994,269(5):3755-3761
[48]Ocampo C A,Moerschbacher B,Grambow H J.Increase lipoxygenase activity is involved in the hypersensitive response of wheat leaf cells infected with avirulent rust fungi or treated with fungal elicitor[J].Zeitschrift fuer Naturforschung,C,1986,41(5-6):558-563
[49]Melan M A,Dong X,Endara M E,et al.AnArabidopsisthalianalipoxygenase gene can be induced by pathogens,abscisic acid,and methyl jasmonate[J].Plant Physiology,1993,101(2):441-450
[50]张荣平.脂氧合酶在植物体内的生理功能[J].莱阳农学院学报,1993,10(1):47-51
[51]李里特,王海.功能性大豆食品[M].北京:中国轻工业出版社,2002
[52]孙星邈,李明姝,颜秀娟,等.脂肪氧化酶缺失大豆研究进展[J].农业与技术,2008,28(6):43-44
[53]高奇.花生脂肪酶和脂肪氧化酶活力检测技术优化及其对储藏特性的影响[D].合肥:安徽农业大学,2012
[54]程昕昕,王荣海,刘正.脂肪氧化酶缺失体对玉米种子劣变的影响[J].中国种业,2009(6):44-45
[55]王海滨.植物的脂肪氧化酶[J].植物生理学通讯,1990(2):63-67
[56]Gardner H W.Lipoxygenase pathway in cereals[M].In Advances in Cereal Science and Technology,edited by Y. Pomeranz,American Association of Cereal Chemists,St Paul,MN,1988(9):161-215
[57]Hildebrand D F.Lipoxygenases[J].Physiologia Plantarum,1989,76(2):249-253
[58]吴萍.小麦籽粒脂肪氧化酶活性功能标记的开发与应用[D].合肥:安徽农业大学,2013
[60]Zhang W,Chao S,Manthey F,et al.QTL analysis of pasta quality using a composite microsatellite and SNP map of durum wheat[J].Theoretical and Applied Genetics,2008,117(8):1361-1377
[61]Parker G D,Chalmers K J,Rathjen A J,et al.Mapping loci associated with flour colour in wheat (TriticumaestivumL.)[J].Theoretical and Applied Genetics,1998,97(1/2):238-245
[62]Carrera A,Echenique V,Zhang W,et al.A deletion at the Lpx-B1 locus is associated with low lipoxygenase activity and improved pasta color in durum wheat (Triticumturgidumssp.durum)[J].Journal of Cereal Science,2007,45(1):67-77
[63]程昕昕,耿广汉,李志成,等.玉米种子脂肪氧化酶 LOX-3 缺失与耐贮性研究[J].作物杂志,2011(3):34-37
[64]吴跃进,卢义宣,吴敬德,等.耐储藏专用型水稻选育及相关技术研究[J].中国稻米,2004,10(3):6-7
[65]Rouster J,Leah R,Mundy J,et al.Identification of a methyl jasmonate-responsive region in the promoter of a lipoxygenase 1 gene expressed in barley grain[J].The Plant Journal,1997,11(3):513-523
[66]Rouster J,van Mechelen J,Cameron-Mills V.The untranslated leader sequence of the barleylipoxygenase 1 (Lox1) gene confers embryo-specific expression[J].The Plant Journal,1998,15(3):435-440
[67]van Mechelen J R,Schuurink R C,Smits M,et al.Molecular characterization of two lipoxygenases from barley[J].Plant Molecular Biology,1999,39(6):1283-1298
[68]van Mechelen J R,Smits M,Douma A C,et al.Primary structure of a lipoxygenase from barley grain as deduced from its cDNA sequence[J].Biochimica et Biophysica Acta (BBA)-Lipids and Lipid Metabolism,1995,1254(2):221-225
[69]Doderer A,Kokkelink I,van der Veen S,et al.Purification and characterization of two lipoxygenase isoenzymes from germinating barley[J].Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology,1992,1120(1):97-104
[70]韩春雨,常汝镇,邱丽娟.大豆脂肪氧化酶研究历史与进展[C]//作物科学研究理论与实践——'2000 作物科学学术研讨会文集.北京:中国作物学会,2001:235-243
[71]Borrelli G M,Troccoli A,Di Fonzo N,et al.Durum wheat lipoxygenase activity and other quality parameters that affect pasta color[J].Cereal Chemistry,1999,76(3):335-340
[72]Ohta H,Ida S,Mikami B,et al.Purification and characterization of rice lipoxygenase component 3 from embryos[J].Agricultural and Biological Chemistry,1986,50(12):3165-3171
[73]刘明丽,余俊红,娄晓红,等.脂肪氧合酶及其对啤酒风味稳定性的影响[J].酿酒科技,2011(5):98-102
[74]柳武革,王丰,刘振荣,等.水稻耐储藏特性研究进展[J].生物技术通报,2006(S1):50-52
[75]Hildebrand D F,Hymowitz T.Role of β-amylase in starch metabolism during soybean seed development and germination[J].Physiologia Plantarum,1981,53(4):429-434
[76]Kitamura K,Davies C S,Kaizuma N,et al.Genetic analysis of a null-allele for lipoxygenase-3 in soybean seeds[J].Crop Science,1983,23(5):924-927
[77]韩粉霞,丁安林,孙君明,等.大豆脂肪氧化酶同工酶全缺失种质的创新[J].遗传学报:英文版,2005,32(2):197-202
[78]Davies C S,Nielsen N C.Genetic analysis of a null-allele for lipoxygenase-2 in soybean[J].Crop Science,1986,26(3):460-463
[79]丁安林,张艳,常汝镇,等.大豆脂肪氧化酶研究进展[J].大豆科学,1995,14(1):67-73
[80]Narvel J M,Fehr W R,Welke G A.Agronomic and seed traits of soybean lines lacking seed lipoxygenases[J].Crop Science,1998,38(4):926-928
[81]张太平,朱星陶.贵州大豆脂肪氧化酶缺失体的农艺和品质性状分析[J].大豆科学,2000,19(2):131-139
[82]Suda I,Nishiba Y,Furuta S.Vitamin E content and radical scavenging activity of soymilk made from lipoxygenas e-lacking (Triple-Null) soybean[C]//Third International Symposium on the Role of Soy in Preventing and Treating Chronic Disease,Washington,DC,USA,2000,132(3):702
[83]韩粉霞,丁安林,孙君明,等.大豆脂肪氧化酶及 Kunitz 胰蛋白酶抑制剂缺失种质的创新[J].遗传学报,2005,32(4):417-423
[84]Suzuki Y,Ise K,Li C,et al.Volatile components in stored rice [Oryzasativa(L.)]of varieties with and without lipoxygenase-3 in seeds[J].Journal of Agricultural and Food Chemistry,1999,47(3):1119-1124
[85]Hirota N,Kaneko T,Kuroda H,et al.Characterization of lipoxygenase-1 null mutants in barley[J].Theoretical and Applied Genetics,2005,111(8):1580-1584
[86]Oozeki M,Nagamine T,Ikeda T M,et al.Genetic variation in lipoxygenase activity among Japanese malting barley cultivars and identification of a new lipoxygenase-1 deficient mutant[J].Breeding Research,2007,9(2):55-61
[87]Guo G,Dondup D,Yuan X,et al.Rare allele of HvLOX1 associated with lipoxygenase activity in barley (HordeumvulgareL.)[J].Theoretical and Applied Genetics,2014,127(10):2095-2103
[88]段红梅,王文秀,常汝镇,等.大豆 SSR 标记辅助遗传背景选择的效果分析[J].植物遗传资源学报,2003,4(1):36-42
[89]孙君明,伍树明,陶文静,等.大豆脂肪氧化酶-1 缺失基因 (lx1) 的 RAPD 标记[J].中国农业科学,2004,37(2):170-174.
[90]宋美,张瑛,吴敬德,等.水稻脂质氧化酶同工酶种质储藏特性的研究[J].中国农学通报,2005,21(2):65-68
[91]曾大力.水稻耐贮藏种质的筛选及遗传育种研究[D].北京:中国农业科学院,2002
[92]Sharma V K,Monostori T,Hause B,et al.Genetic transformation of barley to modify expression of a 13-lipoxygenase[J].Acta Biologica Szegediensis,2005,49(1-2):33-34
[93]Sharma V K,Monostori T,Göbel C,et al.Transgenic barley plants overexpressing a 13-lipoxygenase to modify oxylipin signature[J].Phytochemistry,2006,67(3):264-276
[94]马建.大豆脂肪氧化酶基因 RNAi 表达载体的构建及表达调控的研究[D].长春:吉林农业大学,2008
[95]李俊卿.水稻脂肪氧化酶 RNA 干扰载体的构建及转化水稻进行耐储藏的研究[D].重庆:重庆大学,2008
[96]许惠滨.反义 Lox-3 基因转化籼稻的遗传体系研究[D].福州:福建农林大学,2010
[97]刘振华,刘香利,李冰冰,等.小麦转基因株系中外源脂氧合酶抑制基因 (Loxi) 拷贝数分析[J].农业生物技术学报,2014,22(8):949-957
2015-04-12
“十二五”农村领域国家科技计划(2013BAD01B05-2、2012BAD03B01-2);科技部国际合作项目(2013DFR30890-1);现代农业产业技术体系建设专项(CARS-05)。
扎桑(1988-),女,硕士研究生,主要从事高原作物栽培生理与生态研究。
卓嘎(1971-),女,副研究员,主要从事高原作物栽培生理与生态研究。
郭刚刚(1983-),男,副研究员,主要从事大麦种质资源与新基因发掘研究。

