视网膜母细胞瘤蛋白(pRb)、MMP—3和人细胞周期素D2(Cyclin—D2)在前列腺癌中的表达及临床意义
阳翔莲
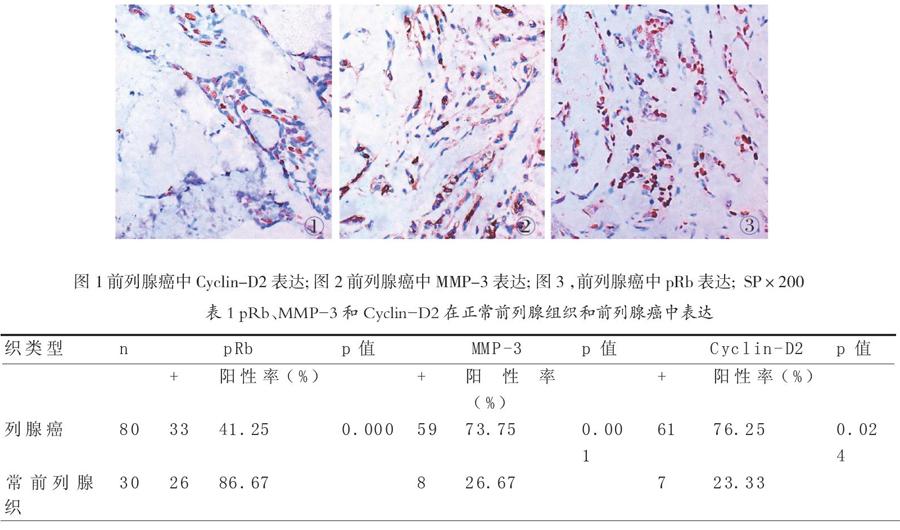


摘要:目的:探讨Cyclin-D2、MMP-3和pRb蛋白在前列腺癌组织中的表达及与前列腺癌生物学行为的关系.方法:应用免疫组化SP法检测源80例前列腺癌和30例正常前列腺组织中Cyclin-D2、MMP-3和pRb蛋白的表达.结果: Cyclin-D2、MMP-3和pRb在前列腺癌中的阳性率分别为76.25%、73.75%、41.25%;Cyclin-D2和pRb蛋白在前列腺癌中的表达与病理类型有关(p<0.05),MMP-3在前列腺癌中的表达与病理类型无关( p>0.05);Cyclin-D2、MMP-3和pRb蛋白在前列腺癌复发组中的阳性率与无复发组相比,差异有显著性(p<0.05);Cyclin-D2与pRb在前列腺癌中的表达呈负相关,与MMP-3表达呈正相关。结论: Cyclin-D2、MMP-3和pRb蛋白的异常表达在前列腺癌发生、发展和复发中起重要作用,联合检测多个指标可能对患者预后的判断有指导意义。
关键词: 前列腺癌;Cyclin-D2;MMP-3;pRb;免疫组织化学
前列腺癌在欧美国家发病率较高, 东亚地区发病率较低, 但有增高趋势, 我国近年来该病的发病率较20 世纪60 年代前明显增高[1]. 对前列腺癌的诊治已日益受到重视.,目前对前列腺癌发生发展和侵袭转移的具体分子机制尚不清楚。
pRb蛋白由原始抑癌基因Rb编码表达,在细胞周期中以磷酸化和去磷酸化的形式决定着转录因子E2F的活性,从而控制着细胞的生长和分化,其在控制细胞周期G1-S期转化中起关键作用。CyclinD2是D型细胞周期素的成员之一,与细胞周期调节、分化和恶性转化有关。研究表明,cyclinD2是Myc的直接靶点,它的聚集有助于隔离细胞周期抑制子p27而启动细胞周期[2]。基质金属蛋白酶3(matrix metalloproteinase3,MMP -3)的功能比较特殊,可以降解、重塑细胞外基质,并完全激活多种基质金属蛋白酶前体(ProMMPs),包括ProMMP1、ProMMP3、ProMMP7、ProMMP8、ProMMP9、ProMMP13 等,使其成为临床许多疾病病理过程研究的重要环节。本实验通过检测前列腺癌中pRb、MMP-3及Cyclin-D2的表达,旨在明确pRb、MMP-3及Cyclin-D2在前列腺癌发生发展中的作用及三者间相关性,从而为前列腺癌的生物治疗提供新的实验依据。
1 研究对象与方法
1.1 标本来源:本实验石蜡标本取自2003年1月至2010年12月在湖南中医药大学第一附属医院泌尿外科住院行手术治疗,术前未行化疗和放疗,术后均经病理检查确诊的患者。前列腺癌的病理分级采用Bocking( 1982) 的三级标准, I , Ⅱ , Ⅲ级分别有42, 20 和18 例。 临床分期采用1993 年版吴阶平主编泌尿外科标准分为A、B、C、D 四期,分别各有31、24、17和8例. 甲醛固定石蜡包埋的组织切片常规进行HE染色,分别由2名病理诊断医师确定肿瘤的病理类型以及组织学分级。包括正常前列腺组织30例和前列腺癌80例(浆液性囊腺癌42例,黏液性囊腺癌24例,子宫内膜样癌14例)。80例前列腺癌中,中位年龄43岁;按组织分化程度分为:高一中分化47例,低分化33例;采用国际妇产科联盟(FIG0)2009年制定的分期标准,临床分期:I期+Ⅱ期42例,Ⅲ期+Ⅳ期38例。
1.2 免疫组化
pRb、MMP-3和Cyclin-D2单克隆即用型抗体和S-P Kits均购自北京中杉金桥公司,免疫组化采用SP法,DAB显色。以已知 pRb、MMP-3和Cyclin-D2阳性组织切片作为阳性对照,以PBS代替一抗作为阴性对照。
1.3 结果判定
Cyclin-D2和pRb阳性表达定位于肿瘤细胞胞核内,Cyclin-D2阳性表达定位于肿瘤细胞胞质内,均以出现棕褐色颗粒为阳性。每张切片随机选择10个高倍视野,计数1000个细胞,阳性细胞<10%为阴性,≥10%为阳性。
1.4 统计学分析
采用SPSS18.0统计软件对所得数据进行分析,组间数据用χ2检验,相关分析用Spearman等级相关分析。
2 结果
2.1 pRb、MMP-3和Cyclin-D2在正常前列腺组织和前列腺癌中表达
Cyclin-D2在前列腺癌中阳性率为76.25%(61/80)(图1),在正常前列腺组织中阳性率为23.33%(7/30),两者差异有显著性(p<0.05);pRb在前列腺癌中阳性率为41.25%(33/80)(图2),在正常前列腺组织中阳性率为86.67%(26/30),两者差异有显著性(p<0.05);MMP3在前列腺癌中阳性率为73.75%(59/80)(圖3),在正常前列腺组织中阳性率为26.67%(8/30),两者差异有显著性( p<0.05,表1)。
2.3 前列腺癌中pRb、MMP-3和Cyclin-D2蛋白表达的相关性
在33例pRb阳性表达的前列腺癌中MMP-3和Cyclin-D2阳性例数分别为19例(57.58%)和20例(60.61%),47例pRb阴性表达的前列腺癌中MMP-3和Cyclin-D2阳性例数分别为40例(85.11%)和41例(87.23%);在61例Cyclin-D2阳性和19例 阴性表达的前列腺癌中MMP-3的阳性例数分别为55例(90.16%)和4例(21.05%)。Spearman等级相关分析表明,pRb分别与MMP-3和Cyclin-D2呈负相关,而MMP-3与Cyclin-D2呈正相关(表3)。
3 讨论
研究证实Cyclin-D2是多种人类癌症的重要调控因子。Sakuma M等研究表明,Cyclin-D2启动子异常甲基化与前列腺癌患者预后差相关,与本组实验结果相似;Cyclin-D2蛋白在前列腺癌中的阳性率明显高于正常前列腺组织组,与Milde-Langosch K研究结果一致;本组研究还发现Cyclin-D2蛋白在低分化前列腺癌组的阳性率明显高于中高分化组,Cyclin-D2在复发组中的阳性率明显高于无复发组,差异有显著性(p<0.05)。从病理分级上看,低分化前列腺癌侵袭性明显高于高中分化型,且Cyclin-D2高表达者复发率增高,说明Cyclin-D2的表达随着前列腺癌恶性程度升高而升高,Cyclin-D2蛋白的高表达患者预后差,与相关文献类似,提示其表达可作为评价前列腺癌恶性程度的客观指标之一。
MMP-3是一组锌离子依赖性蛋白水解酶,由多个结构和功能上与ECM 结构蛋白及生长因子的功能单位具有同源性的区段拼接而成,这些相互适应的结构表现在“外显子改装”和“外显子插入”中,其催化区域是包含锌离子的由160~170 个氨基酸组成的致密球形结构,该区域能特异的与底物结合,同时,也是大多数人工合成的小分子MMP 抑制剂的作用靶点[3] 。MMP3 可降解几乎所有的ECM,降低细胞之间的黏附状态,从而使肿瘤细胞易于侵袭迁移,引起肿瘤的转移[4] 。国内外有关MMP-3在前列腺癌中的表达报道较少,本研究发现前列腺癌组织和正常前列腺组织中MMP-3的阳性率分别为73.75%和26.67%,两者差异有显著性(p<0.05),另外MMP-3阳性率高的前列腺癌患者与阳性率低者相比,术后肿瘤复发率较高,两者差异有显著性(p<0.05),说明MMP-3在前列腺癌的发展、浸润和转移过程中发挥重要作用。其机制可能是前列腺癌过量表达MMP-3,其激活后降解了肿瘤细胞周围基质和脉管基膜,使肿瘤细胞易于侵入周围组织和脉管系统,形成连锁反应进而共同促进肿瘤生长与侵袭。
pRb是视网膜母细胞瘤基因家族成员之一,是抑癌基因Rb的一种蛋白表达产物[5],其与PRB2/p130、p107三者共同组成了视网膜母细胞瘤家族(Rb家族)蛋白。三种蛋白的结构和功能相似,作用相互补充。在细胞周期的进行中,通过对转录因子E2F家族成员活性的调节,在细胞周期的不同阶段发挥负调控功能,将正在分裂的细胞阻滞于G1期,激活这个途径的活动依赖于视网膜母细胞瘤蛋白质pRb损伤或缺失[6]。因此pRb是典型的抑癌基因之一,在人体内的各种正常组织中广泛表达,而其发生突变或缺失与人类多种肿瘤的发生、发展密切相关[7]。pRb在多种恶性肿瘤中低表达,其在前列腺癌中的相关研究较罕见。本组研究结果显示,pRb在前列腺癌中的表达水平明显低于正常前列腺组织, pRb在前列腺癌复发组中的阳性率明显低于无复发组,差异均有显著性( p<0.05)。这些结果均提示,pRb的失活促进了前列腺癌的恶性增殖及转移,pRb阴性表达的前列腺癌患者预后差。pRb在恶性肿瘤中的预后与国内学者孙光等[8]在膀胱癌中的结果类似。
另外本文发现,在前列腺癌中Cyclin-D2与pRb的表达呈负相关,与MMP-3呈正相关,提示Cyclin-D2与pRb、MMP-3可能共同参与前列腺癌的发生、发展。pRb能够调节E2F转录调节因子家族的活性,而E2F是许多与G1/S过渡有关的基因表达所需要的,这些基因之中就包括Cyclin-D2,这一现象表明在前列腺癌和癌前发生阶段即存在pRb表达的缺失,也存在Cyclin-D2蛋白的异常高表达,使得细胞周期失控,促进了细胞的生长和肿瘤的发展,是前列腺癌的发生、发展中的重要事件。MMP-3蛋白表达与Cyclin-D2蛋白表达呈正相关,其可能是Cyclin-D2蛋白的异常高表达,使得细胞周期失控,而MMP-3能降解细胞外基质,进一步促进上皮前列腺癌的侵袭性生长,可能与Cyclin-D2在前列腺癌表达的调节过程中起到协同作用有关,其具体机制有待进一步研究。
综上所述,本实验中Cyclin-D2与pRb、MMP-3蛋白表达与前列腺癌生物学行为和预后相关,Cyclin-D2、MMP-3蛋白高表达、pRb蛋白低表达或阴性者,肿瘤恶性程度高,进展快,复发率高,预后差。联合检测前列腺癌中Cyclin-D2与pRb、MMP-3蛋白表达水平可能对判断前列腺癌恶性程度及预后具有指导意义。
参考文献:
1 Arikan SK, Kasap B, Yetimalar H, et al. Impact of prognostic factors on survival rates in patients with ovarian carcinoma [J]. Asian Pac J Cancer Prev, 2014;15(15):6087-6094.
3 Chiles TC. Regulation and function of cyclin D2 in B lymphocyte subsets [J]. J Immunol, 2004 ;173(5):2901-2907.
4 Tallant C, Marrero A, Gomis-Ruth F X. Matrix metalloproteinases:fold and function of their catalytic domains[J]. Biochim Biophys Acta, 2010;1803(1):20 -28.
5 Amalinei C, Caruntu I D, Giusca S E, et al. Matrix metalloproteinasesinvolvenent in pathological conditions [J]. Rom J Morphol Enbryol, 2010; 51(2):215 -218.
6Schwarze F, Meraner J, Lechner M, et al.Cell cycle-dependent acetylation of Rb2/p130 in NIH3T3 cells [J]. Oncogene, 2010 ;29(42):5755-5760.
7 Helmbold H, Galderisi U, Bohn W.The switch from pRb/p105 to Rb2/p130 in DNA damage and cellular senescence [J]. J Cell Physiol, 2012 ;227(2):508-513.
8 Hoe SL, Lee ES, Khoo AS, et al. Lack of Rb2/p130 genetic alteration in Malaysian nasopharyngeal carcinoma [J]. Malays J Pathol, 2009 ;31(1):53-56.
9 孫光,陈志文,张淑敏, et al. 抑癌基因Rb、MTS1的表达与膀胱癌的预后[J]. 中国肿瘤临床,2000;27(3):177-179.

