高效石油降解菌株的筛选及菌群的构建
徐志霞,张颖,金显敏,梁晨,李丹,金映虹
(海南师范大学生命科学学院,海南海口571158)
高效石油降解菌株的筛选及菌群的构建
徐志霞,张颖,金显敏,梁晨,李丹,金映虹*
(海南师范大学生命科学学院,海南海口571158)
从海南澄迈油井周围污染的土壤中采集样品,以原油为唯一碳源,经初筛、复筛得到13株具降解石油性能的微生物,其中J-2、J-4、J-12、J-13菌株在培养10 d后,其石油降解率分别可达到27.92%、37.36%、30.98%和14.10%.选择这4株菌进行2株菌、3株菌、4株菌的混合培养,构建了11个降解石油的微生物体系,研究发现J-2与J-4混合菌群降解效果最好,高达71.58%,明显优于其他的混合菌群体系和单菌株的降解效果.根据形态学观察和生理生化特征对这4种菌株进行鉴定,初步确定为粉红头孢霉属(Cephaesosp),青霉属(Penicillium),链霉菌属(Streptomyces)和黄单胞菌属(Xanthomonas).
石油;高效降解;筛选;菌群构建
石油是含有各种芳香烃、烷烃、环烷烃成分的一种复杂混合物,是古代海洋或湖泊的生物经过漫长的演化而形成的一种化石燃料[1-2].目前,石油及其提炼品(汽油、煤油、柴油等)在人类生产和生活中扮演着极其重要的角色,因此被人们称为“工业血液”[3].当今能够替代石油的新型能源由于成本高等原因尚未能广泛应用,因此人们对石油的需求量仍然居高不下[4].然而石油在开采、运输、装卸、加工和使用过程中,对环境造成严重污染,产生致癌物,污染土壤、地下水源、海洋环境等,危害人类健康.传统的石油污染治理方法主要为物理和化学方法,但其治理效果不佳,耗资巨大,并残余大量有毒物质于自然环境中,因此微生物修复技术(Bioremediation)以其经济、安全、效率高、适用范围广和无明显的二次污染等显著优点[5]越来越引起人们的关注.
大多数未污染土壤的复杂微生物群落都含有天然降解石油的微生物,这种固有的特性使大多数土壤具有很大的石油降解能力[6].大量的研究表明,在生物圈中,可以降解石油污染物的微生物超过100余属,200多个种,分属于霉菌、酵母菌、细菌、放线菌等[7],其降解菌种类十分丰富,具有菌种的多样性.但是石油组成成分复杂,很难实现只靠一种微生物即可对其污染物实现完全降解.
本研究通过对石油污染土壤样品进行筛选,得到4株高效石油降解菌株,根据形态学观察和生理生化特征初步鉴定为粉红头孢霉属(Cephaesosp)、青霉属(Penicillium)、链霉菌属(Streptomyces)和黄单胞菌属(Xanthomonas),并以此为基础进行石油降解微生物菌群的构建及研究,进一步提高降解效率,达到更高效降解石油的目的.
1 材料与方法
1.1材料
1.1.1实验材料
原油及土样均采自海南澄迈油井.
1.1.2培养基
原油培养基:NH4NO31.0g,K2HPO41.0g,KH2PO41.0g,MgSO4·7H2O 0.2g,CaCl20.02g,Na2EDTA·2H2O 0.02g,FeCl30.05g,蒸馏水1000 mL,pH7.4,分装时每50 mL培养基加1 mL原油.固体平板培养需另外加入2%琼脂.
1.2方法
1.2.1石油降解菌的富集培养和分离纯化[8]
将5 g(干重)石油污染土壤接入45 mL原油培养基中,30℃,180 r/min恒温摇床上富集培养7 d.取培养液在原油平板培养基上进行划线分离,同时取适量菌液进行稀释,在原油平板培养基上涂布分离,将培养皿置于30℃培养箱中进行培养,定期观察.另外,将富集培养液按10%的比例接入新鲜的原油培养基中,相同条件下进行第二次富集培养,同样操作进行3次,每次的富集培养液都经过划线和平板稀释分离.
3次富集培养之后,观察平板上长势良好的优势菌株,选取形态特征一致的单菌落,并分别接种于相应的牛肉膏蛋白胨培养基、查氏培养基、高氏Ⅰ号培养基、马铃薯培养基中,进行多次划线分离,纯化得到单菌后斜面保存.
1.2.2高效石油降解菌的筛选
将分离纯化得到的具有降解石油能力的13株菌株,分别接种至含50 mL原油培养基的三角瓶中,接种量为1 mL,以不接种的原油培养基作空白对照组,30℃,180 r/min振荡培养10d.培养结束后采用重量法测定每株菌的石油降解率[9].
降解率=(m3-m2)/m1×100%
m3为对照组的残余油量,m2为降解后的残余油量,m1为最初的含油量.
1.2.3高效石油降解体系的构建
通过筛选得到4株高效石油降解菌,分别接种至含50 mL原油培养基的三角瓶中,30℃,180 r/min振荡培养24 h,制备一定浓度的菌悬液,接种于装用原油培养基的三角瓶(装液量50 mL/250 mL)中,每株菌接种量均为1 mL,30℃,180 r/min振荡培养10d.培养结束后测定每个微生物降解体系的降解率,选出较佳的降解体系.
1.2.4高效石油降解菌的初步鉴定
根据菌株的形态特征和生理生化特征,参照伯杰氏细菌鉴定手册[10]、常见细菌系统鉴定手册[11]、常见真菌鉴定手册[12],对分离得到的石油降解菌进行初步鉴定.
2 结果与分析
2.1石油降解菌的富集培养和分离纯化
从海南省澄迈采集的石油污染土样通过原油培养基的3次富集培养后,挑选生长良好的优势菌株,分离纯化得到具有较好石油降解能力的细菌8株,霉菌4株及放线菌1株,共计13株菌株.
2.2高效石油降解菌的筛选
将富集分离纯化得到的13株菌株,并分别接种于原油培养基中培养,与未接菌的空白对照组进行对比,观察培养液的颜色、混浊程度及分层现象等变化.培养前,培养液上下层呈黑褐色和乳黄色.培养后,培养液出现三种情况:图1-A,培养液分为3层,由上往下依次为残余石油油膜、褐色絮状物和浅褐色溶液;图1-B,培养液颜色澄清透明,分散着明显的真菌丝状菌落,菌体中间呈深褐色;图1-C,培养液无明显变化.

图1 石油降解菌培养液变化情况Fig.1Results of cultivated oil degrading bacteria
进一步对13株菌进行石油降解率的测定(见表1),其中J-2、J-4、J-12、J-13编号的菌株降解率较高,分别为27.92%、37.36%、30.98%、14.10%,挑选这4株菌株用以构建降解菌群.
2.3石油降解菌的菌群构建
将筛选获得的具有高效降解石油性能的菌株J-2、J-4、J-12、J-13进行不同的组合,分别2株菌、3株菌和4株菌混合,等比例接种培养,构建不同的微生物降解菌群,并检测其石油降解率,通过与单菌株的降解率比对,研究不同降解体系的降解效果(见表2).

表1 单菌株石油降解率Tab.1Result of degradation rate of solo strain

表2 微生物降解体系的石油降解率Tab.2Result of degradation rate of different degradation systems
根据表2的降解率可初步判断,不同菌株构成的降解菌群相对于单菌株而言,降解率有的升高,有的降低,这可能是由于不同菌株之间的相互作用导致的.其中由菌株J-2和J-4的混合降解组降解效果较其他组高,在装液量50 mL、石油浓度为2%的培养基中,10 d后其石油降解率可达到71.58%,较单菌株中降解效果最好的J-4的降解率提高近一倍.
2.4高效石油降解菌的初步鉴定
对J-2、J-4、J-12、J-13进行鉴定,其菌落形态特征见表3,菌体形态见图2,可初步判断J-2、J-4为真菌,J-12为放线菌,J-13为细菌.其中,J-13的染色结果表明该菌为革兰氏阴性细菌.
对J-12和J-13进行了生理生化特征试验,其结果见表4.
根据上述实验结果,参照参照伯杰氏细菌鉴定手册[10]、常见细菌系统鉴定手册[11]、常见真菌鉴定手册[12],初步鉴定J-2为粉红头孢霉属(Cephaesosp),J-4为青霉属(Penicillium),J-12为链霉菌属(Strepto⁃myces),J-13为黄单胞菌属(Xanthomonas).
3 结论
随着国内外经济的发展,随着原油的开采量不断上升,由此引起的土壤及海洋石油污染日益加剧. 20世纪80年代末,美国在短时间内利用生物修复技术成功清除了油轮石油泄漏的污染物,开启了生物修复技术的研究,也引发石油污染微生物降解的讨论[13].

图2 菌体形态(a),(b)J-2(×400);(c)J-4(×400);(d)J-12(×400);(e)J-13(×1000)Fig.2Shapes of strain J-2、J-4、J-12、J-13

表3 石油降解菌的形态特征Tab.3Morphological characteristics of oil degrading strain
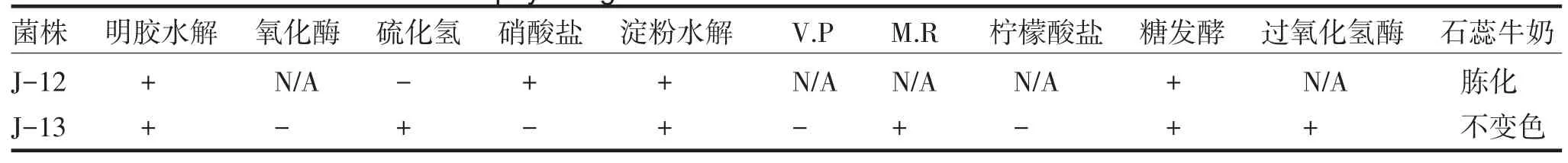
表4 J-12和J-13菌株生理生化结果Tab.4Results of physiological and biochemical characters with J-12 and J-13
在本研究中以海南澄迈油井附近被石油污染的土壤为样品,利用石油为唯一碳源的培养基富集纯化得到的13株菌,经过筛选获取降解效果较好的4株菌,分别为J-2、J-4、J-12、J-13,在装液量50 mL、石油浓度为2%的培养基中,10d后其石油降解率可达到27.92%、37.36%、30.98%、14.10%.
由于石油成分复杂,依靠单一的微生物无法彻底完成石油的降解,需要通过具有不同降解功能的微生物共同作用,才可能实现石油污染物的完全降解[14].本研究对筛选得到的4株菌进行2株菌、3株菌、4株菌混合培养,构建了11个降解石油的微生物体系,通过与单菌株降解率比较,发现J-2与J-4混合菌群降解效果最好,可将降解率提高至71.58%,明显优于其他的微生物体系的降解效果.
根据形态学观察和生理生化特征对这4种菌株进行鉴定,初步确定为粉红头孢霉属(Cephaesosp),青霉属(Penicillium),链霉菌属(Streptomyces)和黄单胞菌属(Xanthomonas).本研究组将进一步研究培养温度、pH、盐度、时间等对菌株降解能力的影响,通过改变不同菌株在微生物系统中的比例构成,使微生物降解系统达到更好的降解效果.
[1]张光宇.SBR工艺污水处理厂抗石油污染物冲击强化处理技术研究[D].山东:青岛理工大学,2010.
[2]陆昕.产表面活性剂石油降解菌的选育及对陕北石油污染土壤生物修复的试验研究[D].陕西:西北大学,2010.
[3]林标声,陈雪英,江胜滔,等.土壤中高效石油降解菌的筛选及其降解特征的研究[J].福建师范大学福清分校学报,2010,98(2):11-16.
[4]张磊.中国石油安全分析与对策研究[D].天津:天津大学,2007.
[5]邵宗泽,许晔,马迎飞,等.2株海洋石油降解细菌的降解能力[J].环境科学,2004,25(5):133-137.
[6]阮志勇.石油降解菌株的筛选、鉴定及其石油降解特性的初步研究[D].北京:中国农业科学院,2006.
[7]贾燕,伊华.石油降解菌株的筛选、初步鉴定及其特性研究[J].暨南大学学报,2007,28(3):296-301.
[8]李超敏,王加宁,邱维忠,等.高效石油降解菌的分离鉴定及降解能力的研究[J].生物技术,2007,17(4):80-82.
[9]张鹏.石油降解菌的分离、鉴定及降解特性的研究[D].山东:山东师范大学,2006.
[10]R.E.布坎南,N.E.吉本斯.伯杰.细菌鉴定手册(第八版)[M].北京:科学出版社,1984:1037-1161.
[11]东秀珠,蔡妙莫.常见细菌系统鉴定手册[M].北京:科学出版社,2001:128-180.
[12]魏景超.真菌鉴定手册[M].上海:上海科技出版社,1979:132-135;491-495.
[13]刘晓春,阎光绪,郭绍辉,等.微生物降解土壤中石油污染物的研究进展[J].污染防治技术,2007,20(6):51-54.
[14]李宝明,阮志勇,姜瑞波.石油降解菌的筛选、鉴定及菌群构建[J].中国土壤与肥料,2007(3):68-72.
责任编辑:刘红
Efficient Oil Degrading Bacteria Screening and Degradation Systems Construction
XU Zhixia,ZHANG Ying,JIN Xianmin,LIANG Chen,LI Dan,JIN Yinghong*
(College of Life Science,Hainan Normal University,Haikou 571158,China)
Four strains of high efficient oil degrading which could take used of petroleum as sole carbon source were isolat⁃ed from Hainan Chengmai,and marked as No.J-2,J-4,J-12 and J-13.After incubation for ten days,every strain's degra⁃dation rate of petroleum was 27.92%,37.36%,30.98%,and 14.10%respectively.In the further exploration of mixed cul⁃ture of two bacteria,three bacteria or four bacteria,11 microbial systems of degradation petroleum had been built.The re⁃sults showed that the degradation rate of system No.J-2 and J-4 could reach 71.58%,which had the most efficient degrad⁃ing than any other systems or single strains in this study.These strains were preliminary identified as Cephaesosp,Penicilli⁃um,Streptomyces and Xanthomonas by physiology and biochemistry research.
Petroleum;high efficient degradation;screening;degradation systems
Q 939.9
A
1674-4942(2015)04-0421-04
2015-09-19
2014年海南师范大学青年教师科研启动项目(QN1437)

