碱性成纤维细胞及角蛋白对丝素蛋白膜改性的实验研究
刁小娟赵东旭李珺山陈帼玲
碱性成纤维细胞及角蛋白对丝素蛋白膜改性的实验研究
刁小娟1赵东旭1李珺山1陈帼玲2
目的 探讨碱性成纤维细胞生长因子(bFGF)及角蛋白对丝素蛋白膜改性后的生物相容性改变。方法 还原法制备水溶性人发角蛋白,用共混法使人发角蛋白与丝素蛋白形成共混膜;化学交联法用bFGF对丝素膜进行表面修饰形成交联膜。通过MTT法及荧光显微镜观察检测3T3细胞在三种丝素基材料上的增殖情况。通过接触角测定,对上述三种材料亲水性进行表征。不同的丝素基材料对细胞增殖的促进情况以及接触角的测定2组间SUVmax比较采用两样本t检验。结果 制备的人发角蛋白分子量范围在44-66 KDa之间,条带清晰。MTT 法及显微镜观察表明,含角蛋白40%共混膜对细胞生长的促进作用最为明显(0.718 ± 0.03,P < 0.05),交联膜次之(0.545 ± 0.022,P < 0.05),最后是丝素膜(0.463 ± 0.027,P < 0.01)。接触角测定结果表明,共混膜的接触角(17.5 ± 1.6,P < 0.01)最小,交联膜(47 ± 1.8,P < 0.01)次之,丝素膜的接触角(61 ± 1.5,P < 0.05)最大,即共混膜黏附性最好。结论 制备的40%共混膜具有最强生物相容性,bFGF修饰的丝素蛋白交联膜次之,最后是丝素膜。
成纤维细胞; 丝素蛋白; 生长因子; 角蛋白
丝素是经蚕丝脱胶后而得的一种天然高分子材料,目前,鉴于丝素蛋白良好的生物相容性以及良好的透氧、透气等许多独特的物理化学性质[1-2],国内外很多学者现致力于以丝素蛋白用作生物医用材料方面的研究[3]。丝素蛋白的主要应用包括用作手术缝合线、药物缓释载体[4]、固定化酶载体[5]、生物传感器[6]、培育人造血管和抗凝血材料[7]、研制人造皮肤和功能性细胞培养基质等方面[8]。纯丝素溶液制备的丝素膜水溶失率大、强度低[9],为改善丝素膜的性能,近年来应用化学接枝、化学交联、共混等方法提高丝素材料柔韧性等性能方面开展了较深入研究[10-15],如丝素和明胶、壳聚糖、海藻酸钠、聚氨酯等的共混,丝素和PGDE的交联等。由于碱性成纤维细胞生长因子(basic fi broblast growth factor,bFGF)作为细胞分裂原,主要作用在起源于中胚层和神经外胚层的骨骼肌细胞、成纤维细胞和骨细胞等,其体外效应十分强烈,对成纤维细胞、骨细胞、软骨细胞、血管内皮细胞、肾上腺皮质和髓质细胞、神经元和神经胶质细胞等具有很强的促细胞分裂增殖活性。高相对分子质量的角蛋白具有很高的机械强度、优良的可加工性、可降解性和良好的生物相容性,是生物移植等应用领域极具潜力的新型生物医学材料[16-17]。因此,本研究制备了以丝素蛋白膜为对照,以FGF修饰的丝素蛋白交联膜和丝素蛋白-角蛋白共混膜,并通过MTT及荧光显微镜观察的方法检测上述三种丝素基材料对3T3细胞增殖的影响;通过傅立叶红外光谱FT-IR和接触角测定来表征材料的表面特征,以探索其对细胞黏附性变化和细胞增殖变化情况的相关性,进而为组织工程中采用丝素改性的方法制备生物相容性的材料提供一定的理论依据和技术支持。
材料与方法
一、主要材料与试剂
蚕茧,购于江西农科院;鼠胚胎成纤维细胞(3T3),实验室留存。DMEM无血清培养基(Hyclone),优级标准胎牛血清(杭州四季青),胰蛋白酶;0.01 g/ml乙二醇二缩水甘油醚(ethylene glycol diglycidyl ether,EGDE)溶液(含0.5%的甘油),1.0 mg/ml外用重组人bFGF(北京双鸬药业),8 mg/ml角蛋白溶液。
二、方法
1.丝素蛋白膜的制备[18]以及接种细胞前的灭菌处理:称取5 g经脱胶后的丝素蛋白,溶于100 ml CaCl2:H2O:C2H5OH(摩尔比1: 8 : 2)三元溶剂中,80℃水浴锅中搅拌溶解2 h。将溶解的丝素蛋白溶液装入透析袋中(截留分子量14 000、干燥半径28 mm),流动水中透析48 h,然后蒸馏水中透析24 h。透析后的溶液用布氏漏斗过滤,收集滤液即为丝素蛋白溶液。用干燥法测定溶液的丝素蛋白含量,然后用蒸馏水调整浓度至8 mg/ml。向96孔板底部每孔加50 μl、6孔板每孔加800 μl,上述丝素蛋白溶液,摇动使溶液在孔板里均匀铺展,之后放于50℃烘箱中6 h烘干成膜。
2. bFGF修饰的丝素蛋白交联膜的制备:取出上述铺有丝素蛋白膜的孔板,然后每孔分别加入pH值9的0.01 g/ml的EGDE溶液(含0.5%甘油),96孔加50 μl、6孔加800 μl,对丝素膜表面进行交联,37℃摇床中反应10 h,加入PBS清洗2 ~ 4遍。以下操作在超净台上进行。将铺膜孔板置于70%酒精缸中浸泡消毒30 min,之后用无菌水冲洗,紫外照射1 h消毒。然后加入浓度为1.0 mg/ml的bFGF溶液,使其与前述的交联有EGDE的丝素膜反应,37℃摇床中反应10 h。到时间点之后,加入PBS清洗2 ~ 4遍。
3.丝素蛋白-角蛋白共混膜的制备:称取3份400 mg的成人人发样品,此人发样品只经过洗涤而未经过其他处理,按照w(β-巯基乙醇)= 3%、w(SDS)= 2%、C(尿素)= 7 mol/L的还原溶液进行角蛋白提取,控制反应前溶胀时间2 h,反应过程中反应温度45℃、反应时间12 h。反应完后,10 000 × g离心30 min,滤液倒入截留相对分子质量为12-15 KDa的透析袋中,在w(巯基乙醇)= 0.08%的水溶液中透析36 h左右,离心后冷冻干燥得白色角蛋白粉末[19]。将得到的角蛋白粉末配制成8 mg/ml的角蛋白溶液,并与已制备的8 mg/ml的丝素蛋白溶液共混,制得一系列不同配比的蛋白混合液,使得角蛋白占总蛋白的浓度分别为0%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%,最后分别取50 μl(96孔)或800 μl(6孔)加入孔中,50℃烘箱中6 h干燥成膜。通过将铺膜孔板置于70%酒精缸中浸泡消毒30 min,之后用无菌水冲洗,在超净台内紫外照射1 h消毒,进而对比不同共混比例的丝素-角蛋白材料对3T3细胞生长的影响。
4.接触角测定:先用PBS对测试膜进行清洗。采用JC2000A静滴接触角(界面)张力测定仪(上海中晨公司)对清洗后的膜样品进行静态接触角测量,每个样品测3次,取平均值。
5. MTT法测定3T3细胞在三种丝素基材料上的黏附及增殖情况:成纤维细胞按照常规方法复苏,接种于含10%胎牛血清的DMEM培养液的培养瓶中,置于37℃、5%CO2饱和湿度培养箱内,待细胞生长至约80%融合度后,用0.25%的胰酶消化并用细胞计数板制成2 × 105个/ml的细胞悬液,作为接种细胞待用。
将细胞按照2 × 105个/ml的浓度接种于孔板中,每组设6个复孔,每孔加200 μl,3次重复,37℃,5%CO2培养箱中培养48 h后,每孔加20 μl 5 mg/ml MTT,继续培养4 h,弃培养上清,每孔加150 μl DMSO,摇床中振荡10 min使其充分溶解,MTT甲簪沉淀,酶标仪检测490 nm处光密度值(A)。
荧光显微镜观察3T3细胞在三种丝素基材料上的黏附及增殖情况。
三、统计学分析方法
采用SPSS13.0统计软件,SUVmax数据以±s表示。不同的丝素基材料对细胞增殖的促进情况以及接触角的测定2组间SUVmax比较采用两样本t检验,以P < 0.05为差异有统计学意义。
结 果
1.角蛋白的SDS-PAGE电泳图:图1可见,制备的角蛋白主要分子量范围为44 - 66 KDa,其中有两条明显的带和一条很细的条带,可能是因为在还原法处理人发样品时,有三种不同的肽单元结构所造成。
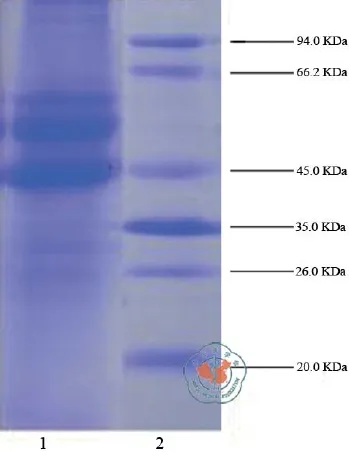
图1 角蛋白的SDS-PAGE电泳图
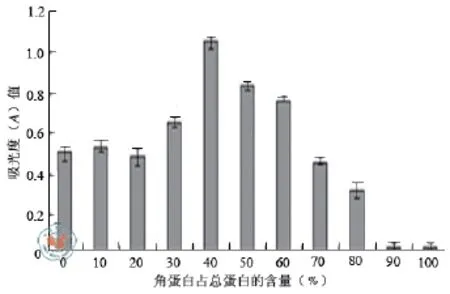
图2 不同角蛋白含量对3T3细胞生长的影响
2.丝素蛋白-角蛋白共混膜中不同角蛋白含量对3T3细胞生长的影响:通过图2可知,在用角蛋白与丝素蛋白溶液形成的共混材料上培养细胞时,角蛋白占总蛋白的浓度在0%~ 40%,细胞的数量趋于增加,在40%时达到最大;在40%~ 100%时,细胞的数量有明显降低的趋势。由此可知,当角蛋白占总蛋白含量40%时,能够明显促进细胞数量的增加,细胞的数量增加近1倍。实验中所用的角蛋白取材于成人的头发。
3.三种丝素膜材料表面接触角的测定结果:共混膜的接触角为(17.5 ± 1.6,P < 0.01)最小,交联膜的接触角为(47 ± 1.8,P < 0.01),丝素膜的接触角为(61 ± 1.5,P < 0.05),即共混膜黏附性最好。接触角的测定结果表明随着膜的改变,其接触角变化非常大。经bFGF修饰的丝素膜的接触角明显小于丝素膜的接触角,表明bFGF修饰的丝素膜的亲水性要比丝素膜好,而丝素蛋白-角蛋白共混膜的接触角又比交联膜的接触角明显降低,说明膜的亲水性又显著提高。
4.成纤维细胞在三种丝素基材料上的生长情况:图3和图4反映了3T3细胞在三种丝素基材料上的生长情况。其中,图3表明,与丝素膜、经bFGF修饰的丝素基膜相比,角蛋白-丝素蛋白共混膜对细胞数量的促进作用最为明显。通过MTT法检测细胞在48 h后经bFGF修饰的丝素蛋白膜、丝素蛋白-角蛋白共混膜与丝素蛋白膜上数量的对比情况,可计算其增长率分别为:17.64%和54.98%。经过48 h后细胞的形状及分布如图4,从中可以看到细胞在丝素蛋白-角蛋白共混膜、bFGF修饰的丝素蛋白膜的数量都要比单纯丝素膜上细胞数量要多。
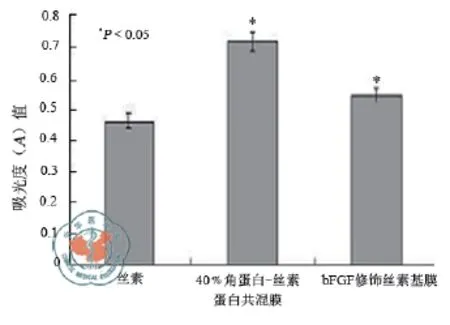
图3 三种不同的丝素基材料对3T3细胞增殖的影响

图4 荧光显微镜观察3T3细胞在三种丝素基材料上的黏附及增殖情况(×200)
讨 论
制备的角蛋白有两条明显的条带和一条很细的条带可能与Parry等[20]发现有关,指出动物毛发纤维的氨基酸重复单元中主要有两种基本的五肽环模式的重复单元,即:重复单元A(C-CX-P-X)和B(C-C-X-S/T-S/T),这里C代表半胱氨酸(Cys),P代表脯氨酸(Pro),S代表丝氨酸(Ser),T代表苏氨酸(Thr),X代表除这几种之外的构成蛋白质的任何一种氨基酸。在第一种重复单元中,A中又衍生出两种新的重复结构单元C-C-Q-P-X(A1)和C-C-R-P-X(A2)。
bFGF修饰的丝素基膜亲水性增加的变化可能是由于bFGF是重要的促有丝分裂因子,是细胞形态发生和分化的诱导因子有关,它促使靶细胞上的受体(FGFR)亲和性升高,而出现相应的亲水性增加的现象[21],进而其修饰的丝素膜材料与单纯丝素膜材料相比亲水性有一定程度的增强。角蛋白是一类材料力学特性良好的生物可降解高分子,它与大分子所形成的复合材料具有比较优异的生物相容性能,并且角蛋白纤维可用于制作人工腱等[22],因此它自身对于共混材料的结构变化起到一定的作用。
从实验结果可以看到,角蛋白与丝素蛋白溶液共混铺成的膜可以使膜的接触角明显降低,即膜的亲水性极大地得到了提高。因此,通过接触角测定表征、荧光显微镜观察及MTT法细胞学测定,所制备的40%的共混膜具有强的亲水性,其生物相容性优于bFGF修饰的丝素蛋白交联膜和纯丝素膜。这为组织工程中采用丝素蛋白基生物医用材料的制备提供了一定的理论依据和技术支持。
1 Minoura N, Tsukada M, Nagura M. Physico-chemical properties of silk fibroin membrane as a biomaterial[J]. Biomaterials, 1990, 11(6):430-434.
2 Zhang X, Baughman CB, Kaplan DL. In vitro evaluation of electrospun silk fibroin scaffolds for vascular cell growth[J]. Biomaterials, 2008, 29(14):2217-2227.
3 Yang Y, Chen X, Ding F, et al. Biocompatibility evaluation of silk fibroin with peripheral nerve tissues and cells in vitro[J]. Biomaterials, 2007, 28(9):1643-1652.
4 Altman GH, Horan RL, Lu HH, et al. Silk matrix for tissue engineered anterior cruciate ligaments[J]. Biomaterials,2002, 23(20):4131-4141.
5 张雨青. 家蚕丝素蛋白——一种天然的固定化酶载体[J]. 江苏蚕业, 1999, (2):1-5.
6 马芳, 邹凤竹. 丝素蛋白在生物材料领域的应用研究概况[J]. 山东农业大学学报, 2005, 36(4):632-636.
7 李春峰, 王韵. 丝素蛋白应用于生物医学领域的研究进展[J]. 蚕学通讯, 2005, 25(4):1-6.
8 朱正华, 朱良军, 闵思佳. 丝素蛋白膜的研究和应用进展[J]. 膜科学与技术, 2002, 22(3):48-51.
9 Minoura N, Tsukada M, Nagura M. Fine structure and oxygen permeability of silk fi broin membrane treated with met hanol[J]. Polymer, 1990, 31:265-269.
10 Lee KG, Kweon HY, Yeo JH, et al. Structural and physical properties of silk fi broinPalginate blend sponges[J]. J Appl Polym Sci, 2004, 93:2174-2179.
11 Arai T, Wilson DL, Kasai N, et al. Preparation of silk fibroin and polyallylamine composites[J]. J Appl Polym Sci, 2002, 84 (11):1963-1970.
12 Gotoh Y, Tsukada M, Minoura N, et al. Synthesis of poly(ethylene glycol)-silk fibroin conjugates and surface interaction between L-929 cells and the conjugates[J]. Biomaterials, 1997, 18(3):267.
13 Kweon HY, Um IC, Park YH. Structural and thermal characteristics of antheraea pernyi silk fibroin/chitosan blend fi lm[J]. Polymer, 2001, 42(15):6651.
14 Liang CX, Hirabayaahi K. Improvement of the physical property of fibroin[J]. Appl Polym Sci, 1992,45:1937-1942.
15 Altman GH, Diaz F, Jakuba C, et al. Silk-based biomaterials1[J]. Biomaterials, 2003, 24:401-416.
16 Lane EB, Hogan BL, Kurkinen M, et al. Co-expression of vimentin and cytokeratins in parietal endoderm cells of early mouse embryo[J]. Nature, 1983, 303(5919):701-704.
17 Sierpinski P, Garrett J, Ma JJ, et al. The use of keratin biomaterials derived from human hair for the promotion of rapid regeneration of peripheral nerves[J]. Biomaterials,2008, 29(1):118-128.
18 解尚云, 田三德, 吴艳娜. 丝素膜的制备及其用于细胞培养[J]. 陕西科技大学学报, 2007, 25(6):53-56.
19 周学琴, 刘东志, 由桂枫, 等. 还原法提取人发角蛋白[J]. 精细化工, 2008, 25(6):529-531.
20 Parry D, Smith TA, Rogers MA, et al. The Structure of keratins[J]. Bio, 2006, 155(2):361-369.
21 Gospodarowicz D, Cheng J, Lui GM, et al. Isolation of brain fibroblast growth factor by heparin-Sepharose affinity chromatography identity with Pituitary fibroblast growth factor[J]. Proc Natl Acad Sci USA, 1984,81(22):6963-6967.
22 Vasconcelos A, Freddi G, Cavaco-Paulo A. Biodegradable materials based on silk fibroin and keratin[J]. Biomacromolecules, 2008, 9(4):1299-1305.
Characteristics of silk fibroin membrane modified by basic fibroblast growth factor andkeratin
Diao Xiaojuan1, Zhao Dongxu1, Li Junshan1, Chen Guoling2. 1Beijing Institute of Technology Life College, Beijing 100081, China;2MedStar Georgetown University Hospital,Washington DC, USA
Zhao Dongxu, Email: 20806044@bit.edu.cn
Objective The biocompatibility of silk-based membrane basis which was modified by basic fibroblast growth factor (bFGF) and keratin was evaluated. Methods The water-soluble keratin was made from hair keratin via reduction reaction and blended with silk fibroin. Basic fibroblast growth factor (bFGF) was crosslinked to the surface of silk fibroin membrance. The effects of different silk fibrin-based materials on 3T3 cell proliferation were evaluated using MTT method and cells were observed by fluorescence microscopy. The hydrophilic property was characterized through the measurement of contact angle of the silk based materials. SUVmax was compared using two sample t test. Results Molecular weight of prepared keratin ranged between 44-66 KDa, and the strips were clear. MTT and microscopic observations showed that blended membrane (0.718 ± 0.03, P < 0.05) was most effective in promoting cell growth, followed by crosslinked membrane (0.545 ± 0.022, P < 0.05), and silk fibroin membrane (0.463 ± 0.027, P < 0.01). Blended membrane had the smallest contact angle(17.5 ± 1.6, P < 0.01) followed by the crosslinked membrane (47.5 ± 1.8, P < 0.01), and the silk fibroin membrance (61 ± 1.5, P < 0.05), so the blend membranes has the minimum contactangle. Conclusion The blend membrane had the best biocompatibility, then the silk fibroin cross-linked by bFGF, finally was the silk fibroin membrane.
Fibroblasts; silk;growth factor; keratin
2014-12-17)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2015.04.005
973计划课题(2005CB623906)
100081,北京理工大学生命学院1;美国MedStar Georgetown University Hospital2
赵东旭,Email:20806044@bit.edu.cn

