流式细胞仪在快速测定鲤春病毒血症病毒滴度中的应用
王津津,贾 鹏,史秀杰,于 力,阮周曦,郑晓聪,何俊强,兰文升,宋思静,刘 荭
(深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳 518045)
流式细胞仪在快速测定鲤春病毒血症病毒滴度中的应用
王津津,贾鹏,史秀杰,于力,阮周曦,郑晓聪,何俊强,兰文升,宋思静,刘荭
(深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳518045)
本研究建立了流式细胞仪快速检测鲤春病毒血症病毒(spring viraemia of carp virus,SVCV)滴度的方法。运用荧光激活细胞分选(fl uorescence-activated cell sorting, FACS)技术检测SVCV A1株对草鱼性腺细胞系(GCO)的感染情况。用SVCV病毒单克隆抗体为一抗,FITC标记的羊抗鼠抗体为二抗,运用FACS来检测感染后不同时间点,以及不同病毒接种量的阳性细胞率。感染第3天时为最佳的病毒滴度测定时间点,测得SVCV的病毒滴度为8.31×105FIU/mL,最低检测病毒滴度为(1000 FIU/mL),与传统空斑试验(plaque assay,PA)相比,两种方法测得的结果基本一致。实验结果表明,FACS是一种简捷、高效、直接的检测SVCV滴度的方法,是一种新型的病毒滴度测定方法。
鲤春病毒血症;草鱼性腺细胞系;流式细胞术;空斑试验;病毒滴度
鲤春病毒血症病毒(spring viraemia of carp virus,SVCV)是单链负义RNA病毒,弹状病毒科[1],主要感染鲤科鱼类,引起鲤科鱼类急性、出血性传染病,在春季大规模暴发时,染病鱼类死亡率高达90%[2],给养殖业造成巨大经济损失。因此,世界动物卫生组织将其列为必须申报疫病之一。
SVCV病毒滴度的经典测定方法是空斑试验(plaque assay,PA)[3],但在实际操作过程中存在细胞培养周期长,稳定性差,结果受实验者主观影响大等缺点,另一方面对于某些低毒力的SVCV毒株或者组织分离毒株,由于在细胞里增殖速度慢,造成出斑缓慢甚至不出斑,这个时候PA法测定病毒的缺点就更加明显。为应对这种情况,需要建立一种新的病毒滴度的测定方法。随着荧光激活细胞分选(FACS)技术的出现和普及,一种用FACS技术通过检测细胞中病毒抗原来计算受感染阳性细胞数从而确定病毒滴度的方法[4],目前已经广泛用于对虾白斑病、传染性胰脏坏死病毒、流感病毒、狂犬病毒等[5-9]病毒滴度的测定。
SVCV在体外可感染多种细胞,本试验以感染草鱼性腺细胞系(GCO)为例,运用FACS技术检测SVCV对GCO细胞感染量,并与PA法进行比较,建立一种快速、直观的测定SVCV滴度的新方法。
1 材料和方法
1.1病毒、细胞、 试剂和仪器
病毒为SVCV A1株,由深圳出入境检验检疫局鲤春病毒血症OIE参考实验室分离;草鱼性腺细胞系(GCO),由中科院(武汉)水生动物研究所赠送;细胞培养基采用GIBCO 的M199培养液;胎牛血清购自GIBCO公司;SVCV单克隆抗体购自BIOX公司,使用浓度为1∶200;FITC标记的荧光二抗购自Sigma公司,使用浓度为1∶200;流式细胞仪为BACOMAN公司生产;固定剂和破膜剂购自美国BD公司;甲基纤维素购自Sigma公司,使用时配置成0.75%溶液;结晶紫购自北京鼎国昌盛生物技术有限公司,使用时配置成0.8%溶液;细胞培养板和细胞培养瓶均购自BD公司。
1.2FACS试验测定滴度
将生长状态良好的GCO细胞以1x106的细胞数均匀接种于12.5cm2的细胞培养瓶中,待细胞达到80%~90%后,将SVCV(A1)株病毒悬液按10倍梯度稀释至10-6,感染GCO细胞,室温孵育1h,然后弃去病毒液,加入含2%胎牛血清的维持培养基,并设置不加病毒悬液的阴性对照。用胰蛋白酶消化细胞,制成细胞悬液,1500r/min离心5min,弃掉上清,PBS洗2次,加入500μL预冷的固定液室温孵育15min,1500r/min离心5min,弃掉上清,PBS洗一次,加入1mL破膜剂室温孵育10min,离心弃掉上清,加入50μL的anti-SVCV单克隆抗体(1∶200稀释),室温孵育1h,离心弃掉上清,PBS洗2次,加入70uL FITC标记的羊抗小鼠二抗(PBS 1∶400),室温避光孵育30min,离心弃掉上清,PBS洗1次,用固定剂1mL重悬细胞,上机检测。根据文献[10]采用如下公式计算FACS滴度:FACS感染单位(FIU/mL)=(阳性细胞百分率×该孔中的细胞总数×稀释倍数)/每孔接种的病毒量。
1.3病毒空斑试验(PA)测定滴度
根据参考文献[11-13]的改良方法,将生长良好的GCO细胞以每孔1x106的细胞数均匀的接种于12.5cm2培养瓶中,待细胞达到80%~90%后,将SVCV A1株病毒悬液按10倍梯度稀释至10-6感染GCO细胞,每个稀释度设置2个平行,每孔100μL;设置阴性对照,每瓶加入100μL不含血清的M199培养基模拟感染。于20℃吸附1h;弃去病毒液,每瓶加入含有0.75%甲基纤维素和2%胎牛血清的M199培养液4mL,于20℃培养箱中培养并观察病毒出斑情况。第3天后,弃去含有甲基纤维素的培养基,并将剩余液体全部吸出,每瓶加入2mL的0.8%结晶紫溶液,避光染色15min~20min,用流水洗掉结晶紫溶液,晾干,进行空斑计数,空斑数在10~100之间为宜,按下式计算,空斑滴度(PFU/mL)=(两稀释度空斑平均数/病毒液体积)×稀释倍数。
1.4统计学分析
FACS和PA法所测的滴度以重复三次独立试验后的均值表示。FACS阳性细胞百分率以均数和标准差X±S表示,不同感染时间组的FACS阳性细胞百分率的组间比较采用方差分析,以P<0.05为具有统计学意义。
1.5FACS法测定滴度与病毒空斑法测定滴度的比较
将病毒空斑法测定的病毒滴度将病毒液作10倍梯度稀释,共稀释5个梯度,然后每个采用FACS法测定滴度,并用Origin 7.5软件,对两种方法的相关性进行直线回归分析。
2 结果与分析
2.1SVCV A1株感染GCO后,不同时间段的FACS结果
用FACS对未感染组和第1天、第2天、第3天、第4天、第5天感染SVCV A1株的情况进行检测,各组阳性细胞百分率分别为(0.34±0.03)%、(0.44±0.08)%、(6.06±0.05)%、(36.38±0.42)%、(48.81±1.29)%、(49.04±1.39)%。由图1可知,随着时间的推移阳性细胞的百分率呈递增趋势。
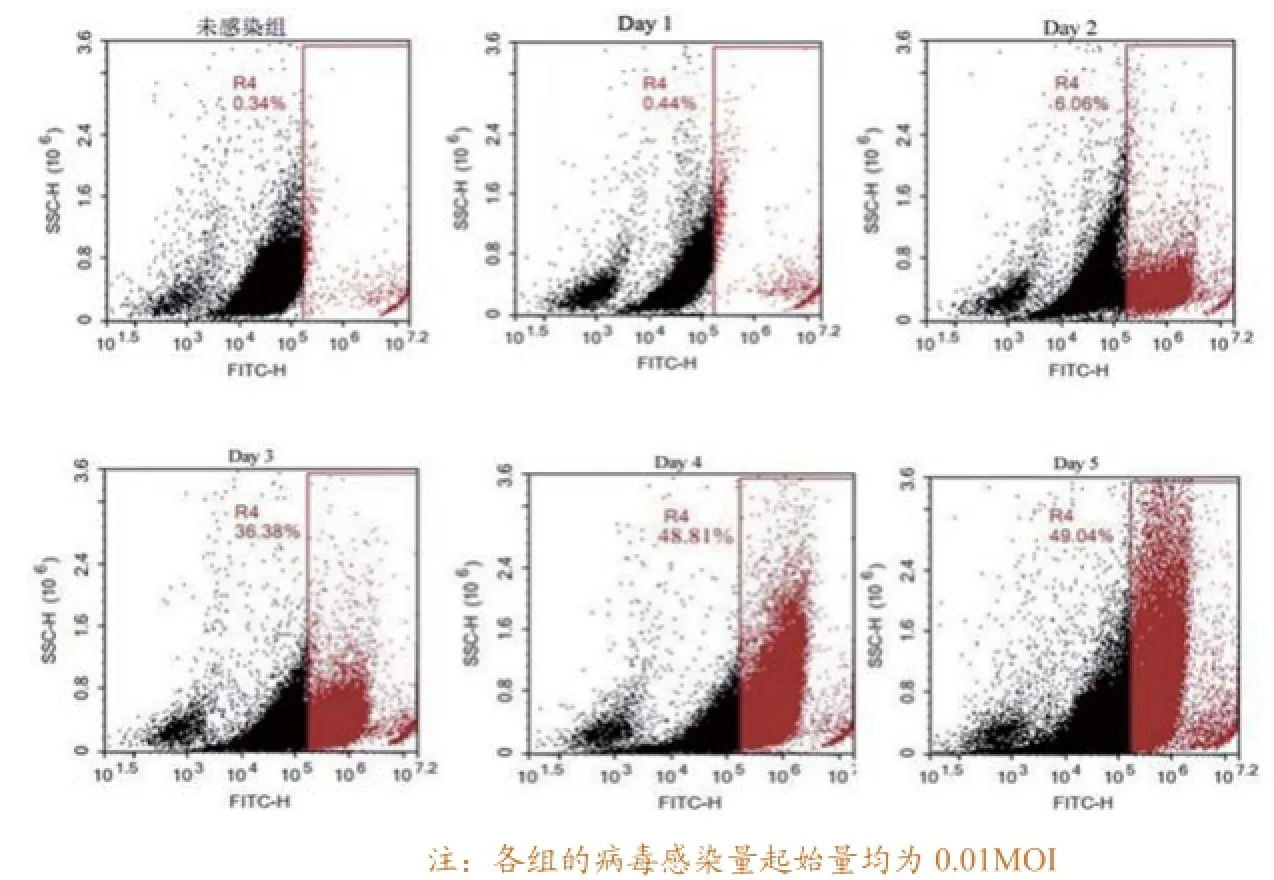
图1 SVCV A1株感染GCO细胞后不同时间的FACS散点图结果

图2 不同稀释度SVCV感染GCO细胞的FACS结果

图3 FACS滴定法和蚀斑滴定法测定SVCV A1株滴度的结果比较
收集不同感染时间点(第1天、第2天、第3天、第4天、第5天、第6天)细胞培养液上清,感染正常的GCO细胞,每天观察CPE,发现第1天、第2天和第3天的上清感染细胞后未出现CPE。而第4天、第5天和第6天的上清感染细胞后出现明显的CPE,说明感染第3天以后的上清中已经存在感染性的病毒颗粒。以上结果表明在感染第3天内为测定病毒滴度的最佳时间,超过三天后已经有新的病毒粒子包装完成,释放到培养上清中,不适合测定初始的病毒原液滴度。
2.2SVCV感染GCO后,不同病毒稀释度的FACS结果
对SVCV A1株病毒原液进行10倍的梯度稀释,然后感染GCO细胞,并在第3天检测FACS滴度,由图2可知,随着病毒稀释度的增加,FACS能够检测到的阳性细胞百分率呈递减趋势。采用1.2中的滴度计算公式计算得FACS法测定的SVCV A1株感染GCO细胞的滴度为8.31×105FIU/mL。
2.3病毒空斑法检测SVCV滴度
经结晶紫染色后,可见透明空斑,边缘清晰。计数空斑数量,采用1.3中的滴度计算公式计算得SVCV的空斑滴度为3.9×105PFU/mL。
2.4FACS法测滴度与病毒空斑法测滴度的比较
FACS的阳性百分率及其FIU与病毒的PFU之间存在线性对应关系(图3)。比较发现两种方法的精密性基本一致,都可以用来表达病毒感染细胞的滴度。从试验测定的数值来看,FACS法测定SVCV滴度的下限为每毫升病毒液1000个感染单位,而病毒空斑法测得的SVCV滴度的下限为390 PFU/mL。
3 讨论
病毒滴度测定是进行病毒学试验和研究的第一步,每一种病毒滴度测定的方法都是对病毒感染力的相对定量,根据不同的病毒特性要选择不同的滴度测定方法。
FACS法是通过流式细胞仪检测细胞中病毒抗原来计算受感染阳性细胞数,从而确定病毒滴度的方法。本试验运用FACS法,对SVCV A1株感染GCO细胞不同时间段的细胞感染数进行了测定,发现随着时间的推移感染病毒的阳性细胞的百分率呈递增趋势。试验中还发现SVCV感染GCO细胞后的3天内为测定病毒滴度的最佳时间,超过三天后已经有新的病毒粒子包装完成,释放到培养上清中,不适合测定初始的病毒原液滴度。同时,用不同稀释度的病毒感染GCO细胞,在第3天测定感染病毒的细胞数量,发现,随着病毒稀释度的增加,FACS能够检测到的阳性细胞的百分率呈递减趋势。最终,通过FACS法,测得SVCV A1株的滴度为8.31×105FIU/mL。
空斑法(PA)是测定SVCV滴度的经典方法[14],PA通过计数病毒形成的空斑单位可以直观的计算出病毒滴定,这种方法能真实反映病毒的毒力强弱。本实验对SVCV A1株进行了PA法滴定,测得滴度为3.9×105PFU/mL。
通过比较FACS法测定的SVCV A1株的滴度和PA法测得的滴度,发现两种方法成良好的线性关系,结果是一致的。说明FACS法是一种较好的病毒感染力研究方法。在试验过程中发现FACS法的最低检测量为每毫升1000个感染单位,低于PA法的最低检测线每毫升390 PFU,说明FACS法的灵敏性低于PA法。但是PA法存在一些难点和缺点,例如PA法测定病毒滴度时,需要病毒粒子在细胞内组装完成,再从一个细胞感染至另一个细胞,出现CPE时,才能进行滴度测定,整个实验周期较长,而且在空斑未形成之前细胞容易死亡,对于某些毒力较弱的毒株或者组织分离毒株,容易出现出斑慢甚至不出斑的情况,试验重复性差,覆盖物制备复杂等。这些缺点限制了PA法的应用[15]。而FACS法不需要依赖于病毒感染细胞而出现的CPE来判断病毒感染情况,它可以在24小时内检测到病毒的感染。正好弥补了PA法测定滴度的不足。
FACS法测定病毒滴度的技术优势可以有效的滴定不易产生CPE或者不易出现空斑的弱毒株和组织分离毒株,而且不受操作者主观因素影响[16-17]。这在病毒的早期感染诊断中具有重要意义。本文通过实验研究表明,FACS法是一种简捷、高效、直接的测定病毒滴度的新方法。
[1] M Gotesman,H Soliman, R Besch,et al. Inhibition of spring viraemia of carp virus replication in an epithelioma papulosum cyprinid cell line by RNAi [J].Journal of Fish Diseases,2015,38(2):197-207.
[2] Bjorklund H V,Higman K H, Kurath G .The glycoprotein genes and gene junctions of the fi sh rhabdoviruses spring viremia of carp virus and hirame rhabdovirus∶ analysis of relationships with other rhabdoviruses [J].Virus Res, 1996,42(1):65-80.
[3] 殷震,刘景华. 动物病毒学[M].2版.北京:科学出版社,1997:239-241.
[4] McSharry J J. Use of fl ow cytometry in virology[J].Clinical Microbiology Reviews,1994,7(4):576-604.
[5] 王轶南,战文斌,邢婧. 流式细胞术检测对虾白斑症病毒(WSSV)对克氏原螯虾血细胞的感染[J].中国海洋大学学报(自然科学版), 2008,38(3):384-388.
[6] Bordignon J, Ferreia S C P, Caporale G M M, et al. Flow cytometry assay for intracellular rebies virus detection[J]. Journal of Virological Methods,2002,105(1):181-186.
[7] Qin Q W,Gin K Y H, Lee L Y,et al. Development of a fl ow cytometry based method for rapid and sensitive detection of a novel marine fish iridovirus in cell culture[J]. Journal of Virological Methods,2005,125(1):49-54.
[8] Bordignon J, Ferreia S C P, Caporale G M M, et al. Flowcytometry assay for intracellular rebies virus detection[J]. Journal of Virological Methods,2002,105(1):181-186.
[9] Rønneseth A, Pettersen E F,Wergeland H I. Flow cytometry assay for intracellular detection of infectious pancreatic necrosis virus(IPNV)in Atlantic salmon(Salmo salar L)leucocytes[J]. Fish & Shellfi sh Immunology,2012 ,33(5):1292-1302.
[10] Lambeth C R, White L J, Johnston R E,et al. Flow Cytometry-Based Assay for Titrating Dengue Virus[J]. Journal of Clinical Microbiology,2005,43(7):3267-3272.
[11] Wu S J,Lee E M,et al. Detection of dengue viral RNA using a nucleic acid sequence-based amplifi cation assay[J]. Clin Microbiol,2002,39(8):2794-2798.
[12] Russell P K,Nisalak A,et al.A plaque reduction test for dengue virus neutralizing antibodies[J]. The Journal of Immunology,1967,99(2):285-290.
[13] Kochel T J, Watts D M,et al. Effect of dengue-1 antibodies on American dengue-2 viral infection and dengue haemorrhagic fever[J].The Lancet,2002,360(9329):310-312.
[14] Sandulache L,Stanciu C. Prevalence of Helicobacter pylori in liver cirrhosis complicated with hepatic encephalopathy[J]. Rev Med Chir Soc Med Nat Iasi,2009,113(4):1056-1060.
[15] Wu S L,Lee E M, Putvatana R,et al. Detection of Dengue Viral RNA Using a Nucleic Acid Sequence-Based Amplification Assay[J]. Journal of Clinical Microbiology, 2001, 39(8):2794-2798.
[16] Fu Y L,Hen Y L,Herve M,et al. Development of a FACS-based assay for evaluating antiviral potency of compound in dengue infected peripheral blood mononuclear cells[J]. Journal of Virological Methods,2014,196(1):18-24.
[17] Li Z J, Ling L N, Liu X H,et al. A fl ow cytometry-based immuno-titration assay for rapid and accurate titer determination of modified vaccinia Ankara virus vectors[J].Journal of Virological Methods,2014, 196(1):87-94.
(责任编辑:胡藕祥)
Flow Cytometry Assay for Titrating Spring Viraemia of Carp Virus
Wang Jinjin,Jia Peng,Shi Xiujie,Yu Li,Ruan Zhouxi,Zheng Xiaocong,He Junqiang,Lan Wensheng,Song Sijing,Liu Hong
(Shenzhen Exit & Entry Inspection and Quarantine Bureau,Shenzhen,Guangdong 518045)
A fl ow cytometry assay was established for rapid titrating spring viraemia of carp virus(SVCV). Fluorescence-activated cell sorting(FACS) was used to detect SVCV A1 strain-infected GCO cells. The infected cells reacted with anti-SVC monoclonal antibody before being covered with labeled fl uorescein-anti-mouse immunoglobulin. FACS was used to analyze the percentage of infected cells at different time points and different virus infections. The results demonstrate that day 3 was the best time to titer SVCV. The titers of SVCV A1 strain was 8.31×105FIU/mL. The lowest limit of detection by FACS was 1000 infectious units per milliliter of inoculum. Comparing the titers of SVCV A1 strain with FACS and plaque assay,similar titers were obtained with the two assays. The novel FACS is recommended as a simple, effi cient and direct assay for titrating SVCV and other virus.
spring viraemia of carp virus;grass carp ovary cell line;fl ow cytometry;plaque assay;virus titer
S941.41+6
B
1005-944X(2015)09-0082-05
国家质检总局科技计划项目(2014IK236)、国家质检总局公益性行业科研专项(201210055和20120214)、深圳检验检疫局科技计划项目(SZ2014202)通讯作者:刘 荭

