LAMP技术快速检测海产品副溶血弧菌的条件优化
纪懿芳,胡文忠,姜爱丽,冯 可(.大连工业大学食品学院,辽宁大连604;.大连民族学院生命科学学院,辽宁大连6600;.大连理工大学生命科学与技术学院,辽宁大连604)
LAMP技术快速检测海产品副溶血弧菌的条件优化
纪懿芳1,胡文忠2,*,姜爱丽2,冯可3
(1.大连工业大学食品学院,辽宁大连116034;2.大连民族学院生命科学学院,辽宁大连116600;3.大连理工大学生命科学与技术学院,辽宁大连116024)
本研究以副溶血弧菌不耐热溶血素tlh为目标基因设计特异性引物,优化反应条件,并对特异性、灵敏度进行了验证。LAMP最佳反应条件为,外内引物浓度比为1∶8,Mg2+反应浓度为4 mmol/L,dNTPs浓度为3.5 mmol/L,温度为65℃,反应时长为1 h,只对副溶血弧菌产生扩增反应,与其余细菌不产生扩增反应,细菌基因组DNA和纯培养物的灵敏度约为5.45×101fg/μL和140 cfu/mL,对人工污染食品样品进行检测,检出限为2.8×102cfu/mL。该方法反应时间短、特异性强、灵敏度高。
副溶血弧菌,LAMP,海产品,tlh
副溶血弧菌(Vibrio parahaemolyticus,VP),是一种主要的食源性致病菌,嗜盐的革兰氏阴性细菌,广泛分布于沿海、河口环境和鱼、虾、贝等海产品中[1-2]。在我国,副溶血弧菌引起的食物中毒在所有细菌性肠胃炎中占有较高的比重,对人们生命安全危害极大。在报道的食物中毒病例中,由副溶血弧菌引起的病例高达31.1%。副溶血弧菌引起的食物中毒临床上的主要发病症状为腹痛、呕吐、腹泻以及水样腹泻为主。每年的6~10月是副溶血弧菌食物引发中毒的高发期,海产品、咸菜、熟肉类等腌制品是其感染的主要对象[3-4]。传统的副溶血弧菌的检测方法耗时长,操作繁琐,灵敏度低。因此,研发精确先进的生物化学方法,以快速地检测副溶血性弧菌,对提高食品的安全性,确保人们的生命安全,减少损失显得尤为重要。目前,副溶血弧菌的分子生物学快速检测方法主要有普通PCR[5]、多重PCR[6]、荧光定量PCR[7]、脉冲场电泳[8]、基因芯片[9]等。但是这些方法操作繁琐需要复杂精密的仪器,不适合基层实验室。
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是Notomi等[10]在2000年研发的一种新型核酸恒温扩增方法,LAMP技术是在恒定的温度下,针对靶基因上的6个区域设计4条引物,在DNA聚合酶作用下进行扩增反应。LAMP在恒定温度下,不到1 h就能达到109~1010倍的扩增,具有特异性强、灵敏度高、操作简单等特点[11]。LAMP技术自2000年开发以来因其简便、快速、经济的特点被广泛应用于细菌、病毒病原体、真菌病原体检测等方面[12]。副溶血弧菌产生的各种毒力因子是导致致病过程产生的主要原因,溶血性毒素[13]、粘附因子[14]、侵袭力[15]、尿素酶[16]、外膜蛋白[17]等是至今为止发现的副溶血弧菌的主要毒力因子[18],针对溶血素设计的引物和探针不能同时检测所有的致病菌株。不耐热溶血毒素(tlh)是被Taniguchi H等[19]发现的主要存在于副溶血弧菌的胞外分泌,是一种具有非典型的磷脂酶,只有在卵磷脂存在的条件下才具有溶血活性,人和马的红细胞都能够被其溶解,在副溶血弧菌中的功能和致病性至今尚没有明确的理论依据,具有良好的种属特异性,可被用来当作副溶血弧菌的快速检测方法精确的检测依据。李志峰等[20]对副溶血弧菌的tlh基因进行基因序列分析和分子克隆,实验结果发现tlh可以作为特异性基因,在分子生物学检测中可作为靶基因对其设计特异性引物,对在副溶血弧菌分子检测和微生物监控等应用方面具有很好的价值,因此本研究以tlh为目标基因设计特异性引物,建立环介导等温扩增方法,并优化条件,为现场检测海产品提供可行性方法。
1 材料与方法
1.1材料与仪器
主要培养基3.5%氯化钠琼脂培养基,3%氯化钠碱性蛋白胨水,TCBS琼脂(青岛高科园海博生物技术有限公司);副溶血弧菌标准菌株(Vibrio Parahemolyticus,CICC 21617)中国工业微生物菌种保藏中心;VP1、VP2为实验室从海产品中提取鉴定传代保存的副溶血弧菌菌株,用于LAMP方法的特异性实验;霍乱弧菌标准菌株(Vibrio cholera,CICC23794)、金黄色葡萄球菌标准菌株(Staphyloccocus aureus,ATCC6538)、鼠伤寒沙门氏菌标准菌株(Salmo-nella typhimurium enes,ATCC19111)、单核细胞增多性李斯特菌标准菌株(L.monocytogenes,ATCC19111)、肠出血性大肠埃希氏菌标准菌株(Enteroh-emorrhage E.coli,CICC21530)、产肠毒素大肠埃希氏菌标准菌株(Enterotoxi-genic Escherichia coli,CICC10414)、伤寒沙门氏菌(Salmonella typhimuriu-m,CMCC(B)50071)、蜡样芽孢杆菌标准菌株[Bacillus cereus,CMCC(B63301)]、肠侵袭性大肠埃希氏菌标准菌株(EIEC,CICC10661)、创伤弧菌标准菌株标准菌株(Vibrio vulnificus,ATCC27562)、表皮葡萄球菌标准菌株(Staphylococcus,CMCC26069)、痢疾志贺氏菌标准菌株(Shigella,CMCC51105)、普通变形杆菌标准菌株(Proteusvulgaris,CMCC49027)、产气肠杆菌标准菌株(Enterobacteraerogenes,ATCC13048)由大连民族学院生命科学学院食品安全实验室提供;Bst DNA聚合酶、Thermopol反应缓冲液套装NEB公司;betaineSigma Aldrich公司;dNTP Mixture、MgSO4、100 bp DNA ladder Maker、细菌基因组DNA提取试剂盒大连宝生物工程有限公司。
DYY-11型电泳仪电源北京市六一仪器厂;DYCP-31F型电泳仪北京市六一仪器厂;TC-512型PCR仪Techne公司;BioSpectrum 310凝胶成像系统美国UVP公司。
1.2实验方法
1.2.1菌种活化在无菌的条件下将副溶血弧菌的冻干菌粉用液体培养基溶解,溶解后的菌悬液移至氯化钠碱性蛋白胨水液体培养基试管中混匀,30℃培养18~24 h,转接2~3次。
1.2.2DNA模板的制备取1 mL过夜培养的副溶血弧菌菌悬液,12000 r/min离心3 min,弃上清,重复2次,沉淀按照细菌DNA提取试剂盒说明,提取细菌基因组DNA。
1.2.3引物设计与合成从GenBank数据库中查找副溶血弧菌的高度保守序列不耐热溶血素tlh,根据引物在线设计软件设计Primer Explorer 4.0,设计一套LAMP引物,包括两条内引物和两条外引物,由宝生物工程(大连)有限公司合成,引物序列见表1。
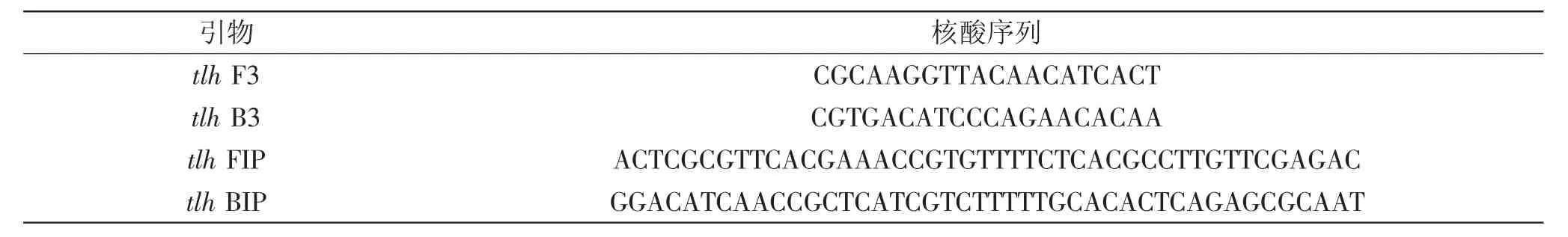
表1 副溶血性弧菌LAMP引物Table 1 The primer sequences of LAMP
1.2.4LAMP反应体系及条件优化
1.2.4.1LAMP扩增体系25 μL LAMP反应体系:10×反应缓冲液(New England Biolabs)2.5 μL,dNTPs Mixture(TaKaRa)1.4 mmol/L,外引物F3/B3各0.2 μmol/L,内引物FIP/BIP各1.6 μmol/L,MgSO4(New England Biolabs)1.5 μL,甜菜碱(Sigma)1 mol/L,Bst DNA聚合酶大片段(New England Biolabs)8 U,细菌DNA模板2 μL,ddH2O补足至25 μL,配制好混匀离心,于65℃温育60 min,80℃灭活10 min,产物于1.5%琼脂糖凝胶电泳分析,同时肉眼观察反应体系的浊度和颜色变化。
1.2.4.2反应条件的优化选择对LAMP反应影响较为重要的条件:内外引物浓度比,不同浓度梯度的Mg2+,dNTPs,反应温度和反应时间,当所考察的条件变化时,其余条件按照(1.2.4.1)的体系操作,电泳观察扩增结果,确立最佳反应条件。
a.内外引物浓度比值的确定取内外引物分别加ddH2O稀释到10 μmol/L和50 μmol/L,设定外引物的浓度始终为0.2 mmol/L,外内引物浓度比1∶2、1∶4、1∶6、1∶8,确定最佳反应浓度比。
b.Mg2+浓度的确定Mg2+浓度影响酶的活性,实验选取0、2、4、6、8、10、12 mmol/L的Mg2+进行LAMP实验,确定最佳Mg2+浓度。
c.dNTPs浓度的确定加入dNTPs至反应体系中,调节dNTPs的浓度为0、1.5、2.5、3.5、4.5 mmol/L进行LAMP实验,确定最佳dNTPs反应浓度。
d.反应温度的确定Bst酶的最适反应温度为65℃,取反应温度为61、63、65、67、69℃,确定最佳反应温度。
e.反应时间的确定选取反应时间为20、30、40、50、60、70、80 min,电泳观察扩增结果,确立最佳反应时间。
1.2.5特异性实验应用LAMP方法同时检测4株副溶血弧菌和大肠杆菌等14株非副溶血弧菌。
1.2.6灵敏度实验
1.2.6.1基因组DNA灵敏度检测用试剂盒提取副溶血弧菌基因组DNA,用酶标仪测定OD值计算DNA浓度,10倍比例稀释DNA原液到10-1~10-9,各浓度梯度进行LAMP扩增。DNA链上的碱基的苯环结构在紫光区在260 nm处具有较强的吸收峰。
1.2.6.2细菌纯培养物灵敏度检测取振荡过夜培养的副溶血弧菌菌悬液,用生理盐水进行10倍比例系列稀释至10-1~10-8,应用稀释平板法计算菌液浓度,同时各浓度梯度取1 mL提取细菌基因组DNA。
1.2.7人工污染副溶血弧菌食品检测取经国标方法检测不含副溶血弧菌的牡蛎样品25 g加入到225 mL的氯化钠碱性蛋白胨水中,用拍击式均质机均质2 min,制备成均质液。取8 mL均质液加入已知浓度(1.2.6.2)的每个稀释梯度的副溶血弧菌2 mL,各取1 mL用试剂盒法提取DNA。
2 结果与讨论
2.1LAMP反应条件的优化
2.1.1内外引物浓度比内外引物不同比来确定最佳的引物添加量,LAMP反应的内外引物浓度过低会导致反应不完全而使产物少,过高又会反应不充分,一般情况下取外内引物浓度比为1∶4~1∶8,实验保持外引物的浓度为0.2 μmol/L,通过改变内引物的浓度来改变二者的比例。如图1所示,当外引物和内引物浓度比为1∶6时出现扩增,当浓度比为1∶8时扩增效果最佳,确立最佳的外内引物浓度为,外引物各0.2 μmol/L,内引物各1.6 μmol/L。
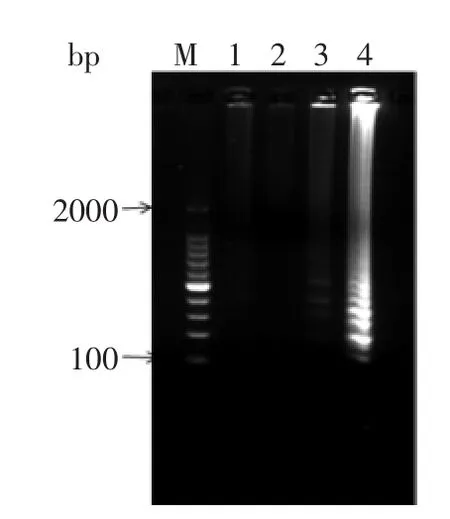
图1 内外引物浓度比对LAMP扩增的影响Fig.1 Effect of ratio of the concentration of the inner primers and outer primer on the LAMP reaction
2.1.2最适Mg2+浓度Mg2+的浓度影响反应产物的多少,对反应的特异性也有显著的影响,Mg2+是Bst DNA聚合酶的活性因子,浓度过低会影响聚合酶的活性,过高则会影响反应的特异性。如图2所示,当Mg2+浓度过低时没有出现扩增反应,而当Mg2+反应浓度为4 mmol/L时,扩增条带最明亮,效果最佳。
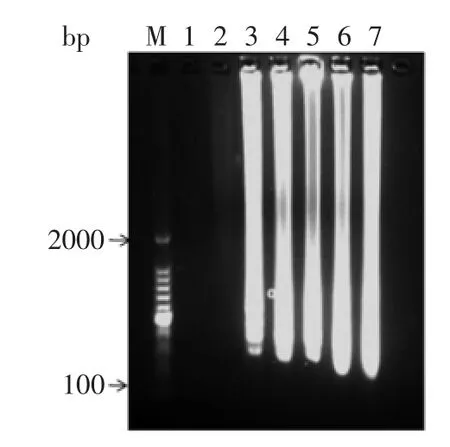
图2 Mg2+浓度对LAMP扩增的影响Fig.2 Effect of Mg2+concentrations on the LAMP reaction
2.1.3最适dNTPs浓度dNTPs的浓度选择5个浓度梯度,如图3所示,当dNTPs浓度为0时没有发生扩增反应,当dNTPs浓度为3.5 mmol/L扩增条带最亮,效果最佳。
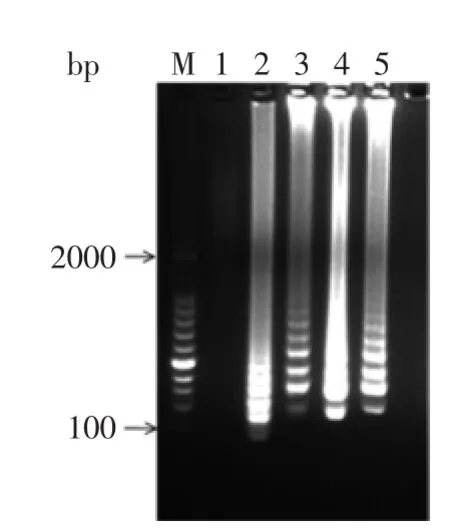
图3dNTPs浓度对LAMP扩增的影响Fig.3 Effect of dNTPs concentrations on the LAMP reaction
2.1.4反应温度如图4所示,在5种温度条件下都发生了扩增,但是扩增的产物量有所不同,当反应温度为65℃时反应条带最亮,所以选择65℃为最适反应温度。
2.1.5反应时间实验选取反应时间20~80 min,如图5所示,在20 min时候没有出现扩增,在30 min出现少量扩增,当反应时间达到50 min时扩增较为明显,为达到充分反应,选取60 min为反应完成时间。
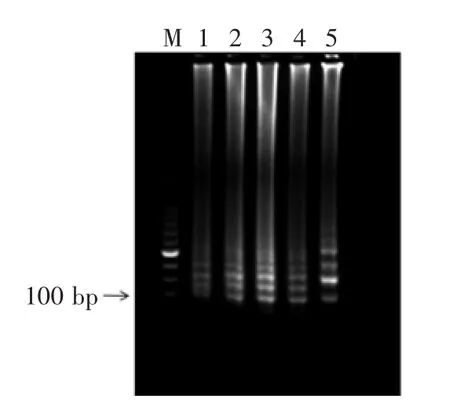
图4 反应温度对LAMP扩增的影响Fig.4 Effect of temperature on the LAMP reaction

图5 反应时间对LAMP扩增的影响Fig.5 Effect of time concentration on the LAMP reaction
2.2特异性实验
如图6所示,只有4株副溶血弧菌(泳道1、2、3、14)扩增出梯形条带,其他14株非副溶血弧菌(泳道2~ 11、15~20)均未出现特异性扩增条带,可见该方法具有较好的特异性。

图6LAMP特异性实验Fig.6 Specificity of LAMP assay
2.3灵敏度实验
2.3.1基因组DNA灵敏度副溶血弧菌基因组DNA浓度为5.45×106fg/μL,10倍比例稀释进行LAMP扩增,如图7所示,当基因组DNA浓度为5.45×101fg/μL时,LAMP反应仍可以看出扩增条带,所以LAMP检测副溶血弧菌基因组DNA检测限约为5.45×101fg/μL。
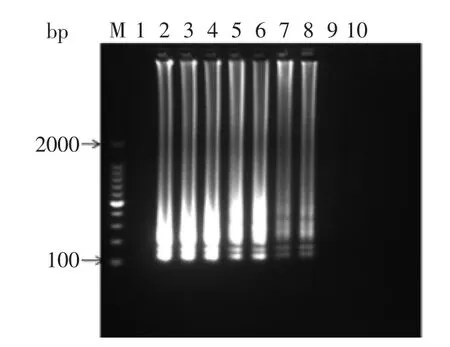
图7LAMP检测基因组DNA的灵敏度Fig.7 Detection limit of LAMP for genomic DNA
2.3.2副溶血弧菌纯培养物灵敏度如图8所示,原菌液浓度为1.4×108cfu/mL,将菌液10倍比例稀释各浓度梯度进行扩增,当菌液浓度为1.4×102~1.4×107cfu/mL时均出现扩增条带,当浓度为1.4×101cfu/mL时反应未出现扩增条带,电泳观察结果检测副溶血弧菌纯培养物灵敏度为140 cfu/mL。
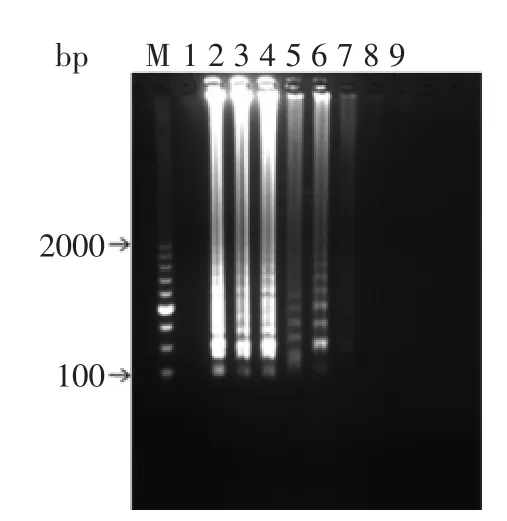
图8LAMP检测纯培养物灵敏度Fig.8 Detection limit of LAMP for pure cultures
2.3.3人工污染副溶血弧菌食品检测灵敏度如图9所示,人工污染副溶血弧菌的牡蛎样品中的菌液浓度为2.8~2.8×107cfu/mL,当菌液浓度为28 cfu/mL时,电泳反应未出现梯状条带,当菌液的浓度为2.8× 102cfu/mL时,可以看见扩增条带,因此,人工污染副溶血弧菌的牡蛎样品的最低检出限为2.8×102cfu/mL。
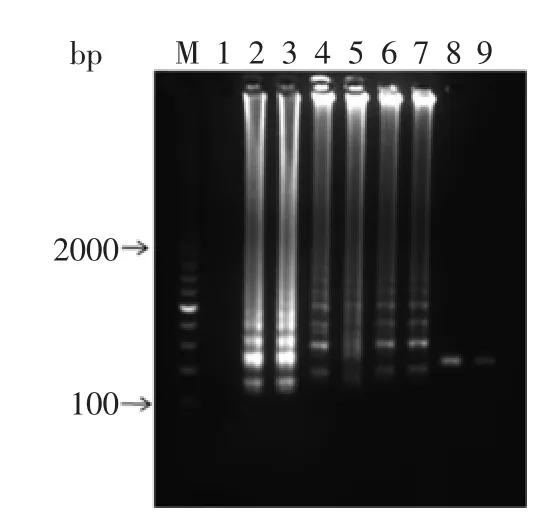
图9 人工污染食品样品LAMP检测结果Fig.9 The LAMP result of contaminated food samples
3 结论与讨论
近年来,全球所有被确诊的腹泻性肠胃炎病例中,有50%~70%的感染者是由于食用未煮熟的海产品而引发的副溶血弧菌食物中毒[1]。副溶血弧菌的国标检测方法要经过基础的分离、增菌、镜检和生化鉴定等繁琐步骤,现代进出口食品中副溶血弧菌标准检测方法常有实时荧光PCR、LAMP和MPCR-DHPLC法等,并结合传统方法进行鉴定。此外目前还有吖啶、橙染色法、高通量微生物鉴定仪、蛋白芯片法和电化学免疫传感器等实验室中使用的检测技术。现代分子生物技术因快速、准确、操作简便等特点已经逐步进入市场并占有主流地位。
LAMP技术作为分子生物学方法之一,具有特异性强、灵敏度高、操作简便、成本低等特点,并具有广泛的应用前景。但LAMP技术发展至今仍然存在着一些不足之处,主要有LAMP反应灵敏度极高,反应又是在恒温的条件下进行的,反应产生的气溶胶很容易污染接续实验,容易造成假阳性;技术原理和引物设计较为复杂也限制了该技术发展;不能有效区分活死细菌也不能进行定量检测;通量较小,每次只能检测一种致病菌;对产生的非特异性扩增不能有效的区分,只能判断产物是否发生扩增,必须做相应的空白实验。但是,LAMP技术在灵敏度和特异性以及反应时间都远远优于PCR反应,LAMP技术以后将沿着研制多重LAMP试剂盒、新型指示剂以及与其他技术相结合的方向发展,如LAMP和芯片结合,LAMP和横向流动试纸条等技术结合,向高通量、操作简便、成本更低的方向发展,更适用于现场快速检测与应用。LAMP反应有两对特异性引物,一对外引物和一对内引物,两对特异性引物能有效地识别靶序列上的六个区域,使LAMP反应有较高的特异性。
耐热溶血毒素tdh和耐热相关溶血毒素trh常被用作副溶血弧菌检测的目标基因,但是tdh和trh和其他细菌基因有很高的同源性[21]。DePaola等[22]发现副溶血弧菌的特异性基因tlh在环境分离株中均可发现。LAMP反应的内外引物浓度过低会导致反应不完全而使产物少,过高又会反应不充分,一般情况下取外内引物浓度比为1∶4~1∶8,体系中Mg2+影响聚合酶反应活性,浓度过低,酶的活性降低,而浓度过高特异性则会相对的降低,加入甜菜碱可以使双链DNA变得不稳定,容易被解离成单链DNA,Bst酶的最适反应温度为65℃。本研究在这些理论基础上对LAMP反应进行优化,并对特异性和灵敏度进行了检测。
本研究选择副溶血弧菌的不耐热溶血素tlh基因为目的基因,设计特异性引物。实验选择外内引物浓度比为1∶8,Mg2+反应浓度为4 mmol/L,dNTPs浓度为3.5 mmol/L,反应温度为65℃。LAMP反应可在1 h左右完成,同时检测副溶血弧菌和单增李斯特菌等食源性致病菌行LAMP扩增反应,只有副溶血弧菌产生扩增反应。实验证明,本研究建立的方法具有反应时间短、特异性强、灵敏度高,对于基因组DNA的检测限约为5.45×101fg/μL,细菌纯培养物检测限约为140 cfu/mL,这一结果与程晓艳[23]、徐芊等报道的检测结果基本相符[24],但是,优于祝孺刚[25]、刘琦等[26]报道的PCR检测方法。
[1]Wang L,Shi L,Su J,et al.Detection of Vibrio parahaemolyticus infoodsamplesusinginsituloop-mediatedisothermal amplification method[J].Gene,2013,515(2):421-425.
[2]蔡潭溪,蒋鲁岩,黄克和.副溶血弧菌的分子生物学研究进展[J].中国人兽共患病杂志,2006,21(10):914-916.
[3]林祥田.94起副溶血弧菌食物中毒流行病学特征分析[J].上海预防医学,2006,18(3):141-143.
[4]乔华林,章俊.副溶血弧菌的致病性及其检验和测定[J].水产科学,1999,18(4):28-30.
[5]刘琦,周德庆,柳淑芳,等.PCR快速检测水产品中副溶血性弧菌的方法研究[J].食品科学,2009,29(11):490-493.
[6]魏霜,冼钰茵,赵晖,等.多重PCR检测四种食源性病原弧菌[J].中国农业科学,2013,46(8):1682-1686.
[7]林强,李宁求,付小哲,等.牡蛎中副溶血弧菌荧光定量PCR检测方法的建立及其应用[J].中国水产科学,2011,18(1):96-102.
[8]KALNAUWAKUL S,ISHIBASHI M,NISHIBUCHI C M M. Prevalence and serodiversity of the pandemic clone among the clinical strains of Vibrio parahaemolyticgrs isolated in southern Thailand[J].Epidemiol Infect,2003,130:395-406
[9]Peacock S J,De Silva G D I,Justice A,et al.Comparison of multilocus sequence typing and pulsed-field gel electrophoresis astoolsfortypingStaphylococcusaureusisolatesina microepidemiological setting[J].Journal of clinical microbiology,2002,40(10):3764-3770.
[10]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic acids research,2000,28(12):e63-e63.
[11]单潇潇.利用等温核酸扩增法快速监测海产品中的副溶血性弧菌[D].广州:华南理工大学,2012.
[12]黄晨阳,于龙,王晓东.应用LAMP技术快速检测副溶血性弧菌研究进展[J].河南预防医学杂志,2013,24(4):265-267.
[13]李志峰,戴迎春.副溶血弧菌的溶血毒素研究现况[J].解放军预防医学杂志,2003,21(1):73-75.
[14]牟海津,李筠,包振民,等.副溶血弧菌胞外产物对中国对虾的致病性分析[J].海洋与湖沼,2000,31(3):273-280.
[15]宁喜斌,刘代新,张继伦.副溶血性弧菌的致病性及其快速检测[J].微生物与感染,2008,3(1):53-56.
[16]许斌福,林能锋,杨金先,等.大黄鱼副溶血弧菌的分离,鉴定及致病力分析[J].福建农业学报,2002,17(3):174-177.
[17]董传甫,林天龙,许斌福,等.电泳和免疫印迹分析副溶血弧菌和溶藻弧菌主要外膜蛋白和多糖抗原[J].中国人兽共患病杂志,2004,20(7):619-623.
[18]张金金,扈庆华,李连青.副溶血弧菌的致病性及检测方法[J].分子诊断与治疗杂志,2014(4):274-278.
[19]Taniguchi H,Hirano H,Kubomura S,et al.Comparison of the nucleotide sequences of the genes for the thermostable direct hemolysinandthethermolabilehemolysinfromVibrio parahaemolyticus[J].Microbial pathogenesis,1986,1(5):425-432.
[20]李志峰,聂军,陈义忠,等.一种快速检测副溶血弧菌的PCR方法[J].解放军预防医学杂志,2005,22(6):443-444.
[21]赵雪琴,胡薇薇,张睿.利用LAMP技术快速检测海产品中的副溶血性弧菌[J].中国卫生检验杂志,2013,14:023.
[22]DePaola A,Kaysner C A,Bowers J,et al.Environmental investigations of Vibrio parahaemolyticus in oysters after outbreaks in Washington,Texas,and New York(1997 and 1998)[J].Applied and environmental microbiology,2000,66(11):4649-4654.
[23]程晓艳,刘庆慧,黄倢.副溶血弧菌tdh基因LAMP检测技术的建立[J].中国食品学报,2012,12(8):156-162.
[24]徐芊,孙晓红,赵勇,等.副溶血弧菌LAMP检测方法的建立[J].中国生物工程杂志,2007,27(12):66-72.
[25]祝儒刚.海产品中致病性副溶血弧菌PCR快速检测体系建立及定量研究[D].沈阳:沈阳农业大学,2011.
[26]刘琦,周德庆,柳淑芳,等.PCR快速检测水产品中副溶血性弧菌的方法研究[J].食品科学,2009,29(11):490-493.
Optimize of Loop-mediated isothermal amplification technology in detection of Vibrio parahaemolyticus
JI Yi-fang1,HU Wen-zhong2,*,JIANG Ai-li2,FENG Ke3
(1.College of Food Engineering,Dalian Polytechnic University,Dalian 116034,China;2.College of Life Science,Dalian Nationalities University,Dalian 116600,China;3.College of Life Science and Biotechnology,Dalian University of Technology,Dalian 116024,China)
In this study,two pairs of primers were designed according to the heat-sensitive hemolysin gene tlh of V.parahaemolyticus and the LAMP amplification reaction conditions were optimized to develop the rapid detection method of V.parahaemolyticus,and verified the specificity and sensitivity.These results suggested that the LAMP mixture containing concentration ratio for outer primer and inner primer was 1 to 8,4 mmol/L Mg2+,3.5 mmol/L dNTPs,performed at 65℃ for 1 h.No crossreaction was found with other common bacteria which showed a good specificity.The detection limits of LAMP assay and pure cultures were 5.45×101fg/μL LAMP mixture of genomic DNA and 140 cfu/mL respectively.The detection limit of V.parahaemolyticus in food samples were 2.8×102cfu/mL.The result indicated that LAMP had the advantage of rapidity,specificity,and sensitivity.
Vibrio parahaemolyticus;LAMP;seafood;tlh
TS201.3
A
1002-0306(2015)20-0059-06
10.13386/j.issn1002-0306.2015.20.003
2015-02-02
纪懿芳(1989-),女,在读硕士研究生,研究方向:食品科学,E-mail:343158635@qq.com。
胡文忠(1959-),男,教授,研究方向:食品科学,E-mail:hwz@dlnu.edu.cn。
国家自然科学基金项目(31172009);国家科技支撑计划项目(2012BAD38B05);大连市金州新区科技计划项目(2012-A1-049)。

