重组人源胶原蛋白的分离纯化及其结构表征*
周爱梅,张静,邓爱鹏,高力虎,仲昭财,杨树林
(南京理工大学生物工程研究所,江苏南京,210094)
胶原蛋白是脊椎动物的主要结构蛋白,广泛分布于动物结缔组织、韧带、跟腱等,约占生物体自身总蛋白含量的30%[1-3]。同时,参与细胞的增殖、分化与迁移,使骨、腱、软骨和皮肤具有一定机械强度[4-6]。因具有其他合成材料无法比拟的生物相容性、可生物降解性以及可大规模生产的可行性等优点[7-8],胶原蛋白广泛应用于健康食品、化妆品、生物材料和医药工业[9-11]。目前,胶原蛋白主要来自于动物组织,如牛骨、牛皮或猪皮[12],但其品质,纯度和功能都具有不可预测性[13]。而且,动物源胶原蛋白可能带有传染性病原体(如疯牛病病毒、禽流感病毒)和引发机体免疫反应[14]。重组人源胶原蛋白技术的发展,使得高可靠性、高纯度、化学结构确定和低免疫源性胶原蛋白的获得成为可能。
研究发现,通过不同的编码基因进行编码,至少存在27 种不同的胶原蛋白分子[15-16],其中Ⅰ、Ⅱ、Ⅲ和Ⅴ型是纤维状的胶原蛋白[17]。通常,胶原蛋白带有3条多肽链(α链),每条α多肽链由甘氨酸充当氨基残基形成甘氨酸-X-Y(Gly-X-Y)重复结构[18-19],X和Y可以代表除了甘氨酸以外的其他氨基酸残基。Ⅲ型胶原蛋白的螺旋结构是一种同型三聚体[α1(Ⅲ)]3,能强化微血管强度与弹性,可提供细胞充足的养分,并且可以直接与血管母细胞结合,从而促进新血管形成[20]。因此,Ⅲ型胶原蛋白是一种极好的生物医学组织工程材料。
基于人源Ⅲ型胶原蛋白α1链胶原域Gly-X-Y的三肽重复序列特征,本实验室成功构建了巴氏毕赤酵母基因工程菌GS115/pPIC9KG6,进行高密度发酵,获得Ⅲ型重组人源胶原蛋白。本研究探索利用透析法、盐析-柱层析结合法对发酵上清液内RHSC进行纯化,同时对纯化获得的胶原蛋白进行结构表征。
1 材料与方法
1.1 材料
巴氏毕赤酵母基因工程菌GS115/pPIC9KG6,本实验室构建;透析袋14 kDa,南京宝灵科生物;Ⅲ型胶原蛋白,Sigma;Sephadex G100,Amersham Biosciences;其他均为国产分析纯试剂。
1.2 仪器与设备
冷冻干燥机(FDU-1200,日本Tokyo RIKAKIKAI公司);电泳仪(PROTEANⅡ,美国BIO-RAD);差示扫描量热仪(TA2100,美国TA公司);紫外可见分光光度计(Ultrospec 4300 pro,美国GE Healthcare);红外光谱仪(Nicolet iS10,Nicolet);核磁共振波谱仪(Bruker AVANCE 500,Bruker)。
1.3 实验方法
1.3.1 胶原蛋白获得
通过BMG培养基对巴氏毕赤酵母基因工程菌GS115/pPIC9KG6进行高密度发酵,甲醇低速流加诱导胶原蛋白表达。4℃,12 000 r/min离心5 min,实现菌体与菌液的分离,上清液-20℃保存。对菌体进行细胞裂解,之后细胞裂解液与发酵上清液进行SDS-PAGE电泳分析。
1.3.2 透析法纯化胶原蛋白
取10 mL的发酵上清液装入14 kDa的透析袋内,以去离子水作为交换液,置于4℃冰箱,每8 h更换去离子水,分别透析12,24,36和48 h,透析液冷冻干燥。
1.3.3 盐析-柱层析结合法纯化胶原蛋白
精确称取0℃时达到 20%、30%、40%、50%、60%、70%、80%、90%和100%饱和度的(NH4)2SO4沉淀所需(NH4)2SO4固体的量。冰水浴条件下,边缓慢搅拌边将硫酸铵固体慢慢加入到发酵上清液中,15 min内加完,继续搅拌15 min。4℃,10 000 r/min离心5 min,倾出上清液,将沉淀按原体积溶解备用。取40%饱和度硫酸铵沉淀的盐析溶解液经过凝胶柱Sephadex G100,去离子水洗脱,收集洗脱液,冷冻干燥。
1.3.4 分析方法
1.3.4.1 蛋白回收率测定
蛋白回收率测定采用二喹啉甲酸(BCA)检测法,以牛血清白蛋白(BSA)作为标准蛋白,562 nm处测得吸光度值做标准曲线。
按公式计算蛋白回收率(η):
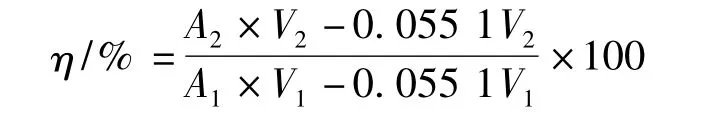
式中:A1,待纯化溶液的吸光度值;A2,纯化后溶液的吸光度值;V1,待纯化溶液的体积,L;V2,纯化后溶液的体积,L。
1.3.4.2 RHSC纯度分析
运用SDS-PAGE垂直电泳分析RHSC纯度,10%的分离胶和5%的浓缩胶,Tris-甘氨酸缓冲系统,80 V电压浓缩蛋白,120 V电压分离。考马斯亮蓝R-250染色,Quantity One 4.5.2 软件分析[21]。
1.4 结构表征
1.4.1 差示扫描量热法(DSC)分析
称取2~3 mg RHSC冻干样品与标准Ⅲ型胶原蛋白,分别密封于DSC坩锅中,以空坩埚作为参比,从30℃加热到80℃,升温速率为10℃/min[22],氮气在样品室中流量为20 mL/min。
1.4.2 紫外扫描分析
取RHSC冻干样与Ⅲ型胶原蛋白分别配制成1 g/L的胶原蛋白溶液,在200~400 nm的近紫外区进行光谱扫描。
1.4.3 傅里叶变换红外光谱(FT-IR)分析
胶原蛋白基团的特征吸收峰可以被红外光谱分析检测,试验取微量RHSC和Ⅲ型胶原蛋白分别与KBr研磨成粉后压片。室温下,在4 000-400 cm-1范围内扫描[23]。
1.4.41 H-NMR和13C-NMR
将RHSC冻干样溶于D2O中,形成浓度为0.1 mg/mL的NMR样品。NMR检测条件:恒温在298 K,氢谱和碳谱的观测频率分别为 500 MHz,125 MHz;采样次数分别为64次和8 000次。
2 实验结果
2.1 发酵液与菌体内的RHSC分析
如图1所示,在工程菌细胞裂解液中检测到了目的蛋白,但含量极少,并且其他杂蛋白含量很高,而发酵上清液中有大量目的蛋白存在。说明重组人源胶原蛋白是一种细胞外分泌型的胶原蛋白。经分析,在发酵液中RHSC主要以分子质量约为112 kDa的二聚体形式存在,同时还有部分分子质量为56 kDa的单体。

图1 重组酵母GS115表达重组人源胶原蛋白的SDS-PAGE分析Fig.1 SDS-PAGE profile of RHSC expressed by recombinant yeast GS115
2.2 RHSC的纯化
2.2.1 透析纯化结果
透析法是利用小分子物质在溶液中可通过半透膜,而大分子物质不能通过达到分离效果的方法[24]。发酵上清液中色素与小分子杂蛋白都属于小分子物质,可以透过半透膜以除去。试验发现,透析超过12 h后,透析袋内的液体颜色澄清,表明发酵上清液内的色素已除去。由表1蛋白的回收率与纯度关系可知,RHSC的纯度随着透析时间的增加而有所增高,说明小分子质量的杂蛋含量逐渐减少,而目大的蛋白均被截留。但透析时间超过24 h后,RHSC的纯度增加并不明显,而且透析时间过长会对蛋白的活性造成影响。图2为发酵上清液透析24 h后的SDS-PAGE谱图。从图2中可以看出,RHSC的单体与二聚体条带清晰,而分子质量低于56 kDa的小分子杂蛋白几乎没有条带,说明杂蛋白含量极低。由此可以判断,发酵上清液最佳的透析时间为24 h。
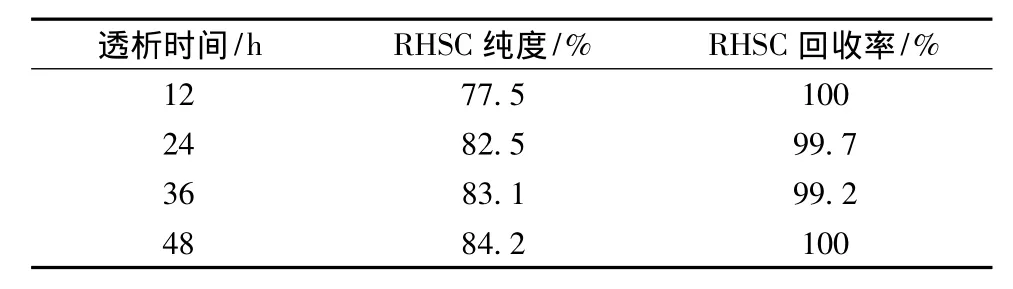
表1 RHSC的回收率与纯度Table 1 The recovery and purity of RHSC

图2 发酵液透析24h后的SDS-PAGE谱图Fig.2 SDS - PAGE profile of fermentation broth after dialysised 24 h
2.2.2 盐析-柱层析结合纯化结果
表2为发酵上清液经过不同饱和度硫酸铵沉淀后二聚体的纯度表。
由表2可知,硫酸铵饱和度为20%时不能将RHSC沉淀下来,而饱和度达到30%以后,二聚体能被沉淀出来,并且实现了二聚体与单体的分离。同时,上清液经40%饱和度的(NH4)2SO4沉淀,二聚体的纯度最高,之后,随着(NH4)2SO4浓度增高,二聚体纯度降低。因此,根据以上结果可以确定(NH4)2SO4沉淀的最佳饱和度为40%。图3为发酵上清液直接过Sephadex G100与40%饱和度(NH4)2SO4沉淀后经过Sephadex G100的SDS-PAGE电泳图谱,比较可以看出经过(NH4)2SO4沉淀后再过Sephadex G100层析柱,不仅实现了二聚体与单体的分离,而且得到的二聚体达到了电泳纯。
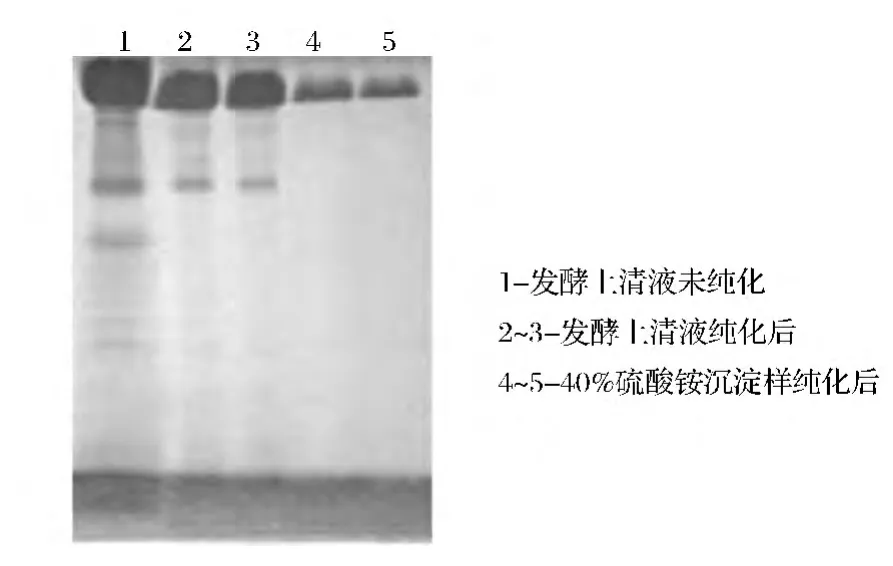
图3 RHSC经Sephadex G100纯化后的SDS-PAGE电泳图谱Fig.3 The SDS-PAGE spectrum of RHSC purified by Sephadex G100 columm chromatography
2.3 RHSC结构表征
2.3.1 DSC分析
DSC是测定蛋白质热稳定性常用的方法,其原理是通过测定物质在升温过程中的吸热,放热来反映此种物质的相变和化学反应的过程[25]。图4-(a)、图4-(b)分别为Ⅲ型胶原蛋白和RHSC的DSC图谱,可以看出RHSC的Tm40.68℃,与Ⅲ型胶原蛋白的Tm39.36℃基本相同,且测定的Tm值都在文献报导的胶原蛋白的变性温度范围内[26],表明RHSC与Ⅲ型胶原蛋白具有类似结构。

表2 不同饱和度硫酸铵沉淀后RHSC的纯度表Table 2 Purities of RHSC precipitated by ammonium sulfate
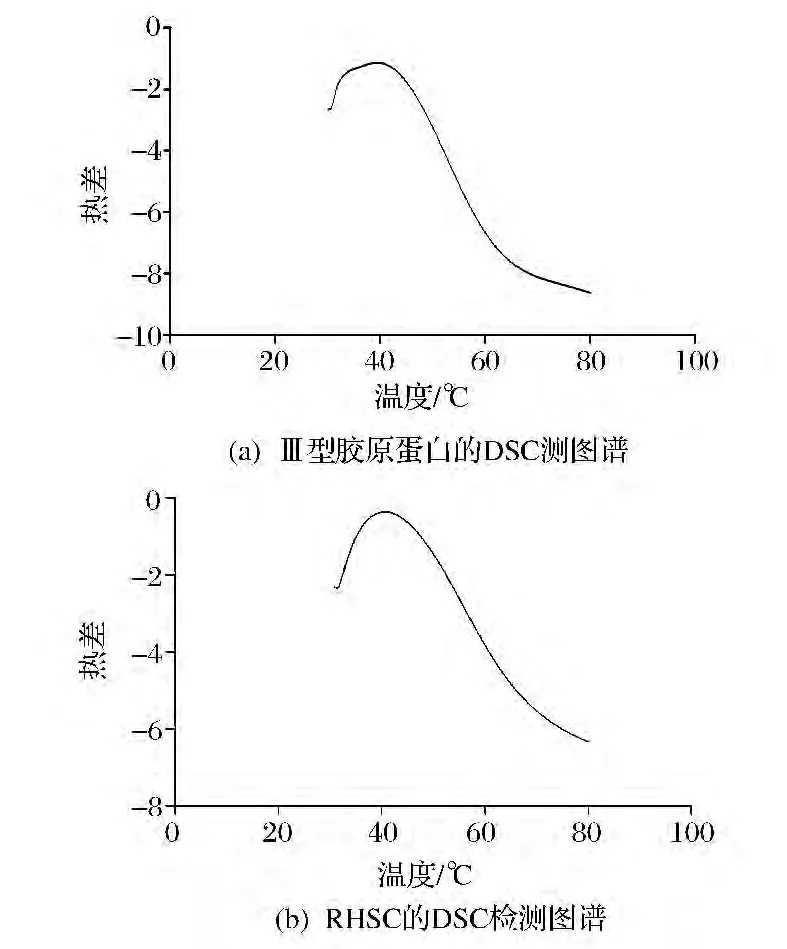
图4 胶原蛋白DSC图谱Fig.4 The DSC spectrums of collagen
2.3.2 紫外光谱分析

图5 胶原蛋白紫外扫描图Fig.5 UV scan of collagen
2.3.3 红外扫描分析
由图6可知,标准的Ⅲ型胶原蛋白的红外谱图中的主要峰在RHSC的红外谱图中都有所体现,说明两者微观结构存在着很大的相似性。在图6-(b)图中,3 307 cm-1附近吸收峰是酰胺A带N—H伸缩振动,并且N—H参与形成氢键[27]。3 080 cm-1附近是酰胺B带的C—H伸缩振动;1 661 cm-1处是酰胺Ⅰ带的CO伸缩强峰,并且伴随着氢键的作用;1 541 cm-1处吸收峰是酰胺Ⅱ带的N—H弯曲振动和酰胺基C—N伸缩振动;1 242 cm-1为酰胺Ⅲ带的N—H伸缩振动变形峰。
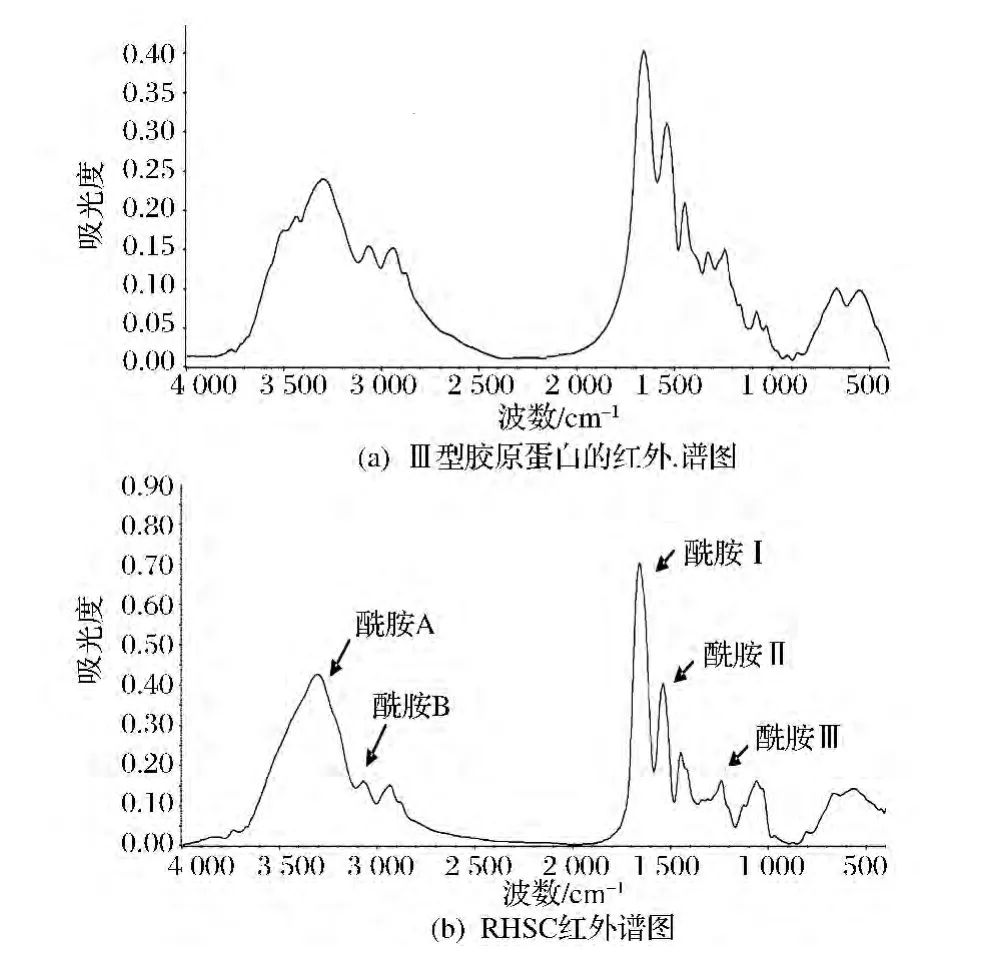
图6 胶原蛋白的红外谱图Fig.6 IR spectra of collagen
2.3.4 RHSC的1H-NMR和13C-NMR谱分析
对于蛋白质的结构研究,核磁共振谱将会显得越来越重要,它将提供更多的信息。目前,核磁共振谱在胶原蛋白上的应用还很少[28]。RHSC基因序列的设计是基于人Ⅲ型胶原蛋白α1链胶原域三肽重复序列特征,其编码的氨基酸主要包括天冬氨酸(Asp)、谷氨酸(Glu)、甘氨酸(Gly)、赖氨酸(Lys)、脯氨酸(Pro)和丝氨酸(Ser)等。本研究根据何有节等[29-30]提供的明胶标准氢谱和碳谱的谱线归属表,对RHSC的谱线进行归属。从表3、表4的结果可知,RHSC的氢谱与碳谱的主要峰和其含有的主要氨基酸产生的峰可以一一对应。因此,核磁共振波谱的结果从分子结构上佐证了发酵产生的RHSC即为目的蛋白。
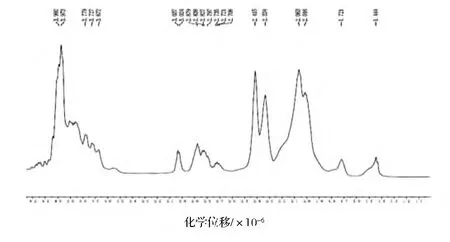
图7 RHSC的1H-NMRFig.7 1H-NMR of RHSC

表3 RHSC的1H-NMR谱峰归属Table 3 Attribute the1H-NMR to RHSC
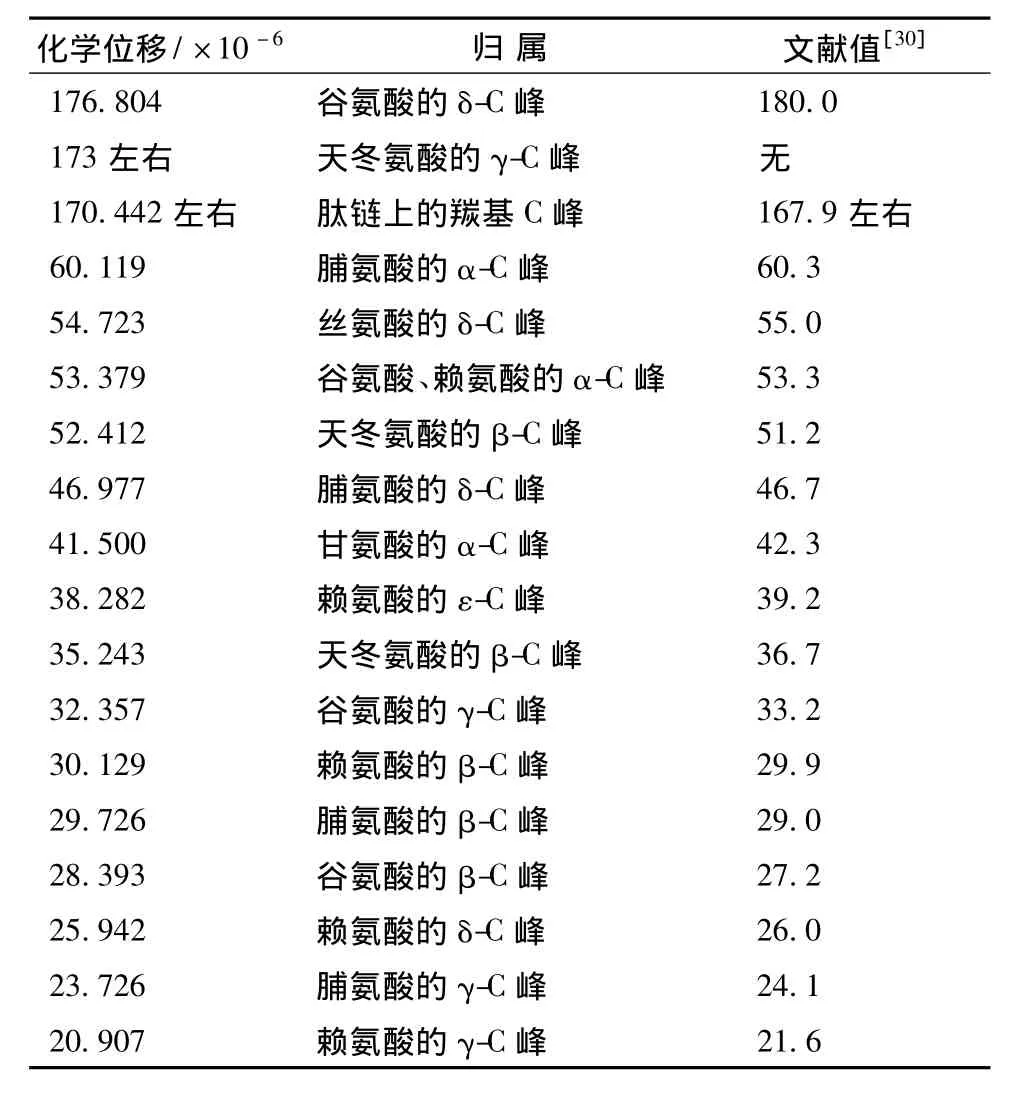
表4 RHSC的13C-NMR谱峰归属Table 4 Attribute13C-NMR to RHSC
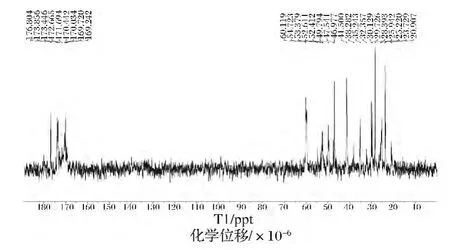
图8 RHSC的13C-NMR谱图Fig.8 13C-NMR of RHSC
3 结论与讨论
采用高密度发酵获得的RHSC量近于总蛋白量的60%,约为15 g/L,表达量丰富,利于扩大再生产。在整个发酵行业,分离纯化是限制发酵工业生产的因素,纯化费用约占整个产值的20%~30%,甚至更高,因而从发酵液中分离纯化出目蛋白显得尤为重要。本试验采用低温高速离心的方法分离菌体与菌液,并且运用2种纯化方法对发酵上清液进行纯化,获得不同的产物。通过透析法获得的RHSC混合物可用于食品和医药,其降解成小肽后也可应用于化妆品行业。而结合运用盐析-柱层析法纯化获得的高纯度二聚体可以作为生物医学组织工程材料的原料。同时对纯化的胶原蛋白进行了DSC、紫外和红外光谱分析,并与标准的Ⅲ型胶原蛋白进行比对,结果表明RHSC具有Ⅲ型胶原蛋白的特征结构。同时,NMR的结果从结构上也佐证了高密度发酵获得的胶原蛋白即为目的蛋白。
[1]Jus S,Stachel I,Schloegl W,et al.Cross-linking of collagen with laccases and tyrosinases[J].Materials Science and Engineering C,2011,31(5):1 068 -1 077.
[2]YAN Ming-yan,LI Ba-fang,ZHAO Xue.Isolation and characterization of collagen from squid(Ommastrephes bartrami)Skin[J].Oceanic and coastal Sea Research,2009,8(2):191-196.
[3]Sher Bahadar Khan,QIAN Zhong-ji,BoMi Ryu,et al.Isolation and biochemical characterization of collagens from seaweed pipefish,syngnathus schlegeli[J].Biotechnology and Bioprocess Engineering,2009,14(4):436 -442.
[4]付步芳,陈丹丹.胶原蛋白的鉴别及其杂蛋白检测技术[J].药物分析杂质,2010,30(7):1 351 -1 353.
[5]Sascha Heinemann,Hermann Ehrlich,Timothy Douglas,et al.Ultrastructural studies on the collagen of the marine sponge chondrosia reniformis nardo[J].Biomacromolecules,2007,8(11):3 452 -3 457.
[6]刘晓宁,刘安军,曹东旭,等.鱼鳞胶原蛋白的提取研究初探[J].食品研究与开发,2007,28(1):56 -59.
[7]JIA Yuan-jun,WANG Hai-bo,WANG Hai-yin,et al.Biochemical properties of skin collagens isolated from black carp(Mylopharyngodon piceus)[J].Food Sci Biotechnol,2012,21(6):1 585 -1 592.
[8]李国英,张忠楷,雷苏,等.胶原、明胶和水解胶原蛋白的性能差异[J].四川大学学报,2005,37(4):54-58.
[9]LI Chun-mei,ZHONG Zhao-hui,WAN Qiong-hong.Preparation and thermal stability of collagen from scales of grass carp(Ctenopharyngodon idellus)[J].Eur Food Res Technol,2008,227(5):1 467 -1 473.
[10]Phanat Kittiphattanabawon,Soottawat Benjakul,Wonnop Visessanguan,et al.Isolation and properties of acid-and pepsin-soluble collagen from the skin of blacktip shark(Carcharkinus limbatus)[J].Eur Food Res Technol,2010,230(3):475 -483.
[11]Ka-jeong Lee,Hee Yeon Park,Yeon Kye Kim,et al.Biochemical characterization of collagen from the starfish asterias amurensis[J].J Korean Soc Appl Biol Chem,2009,52(3):221-226.
[12]Shoshi Mizuta,Mayu Nishizawa,Fuuta Sekiguchi,et al.Enzymatic solubilization of collagen in the skin of diamond squid Thysanoteuthis rhombus:application of a fungal acid protease[J].Fish Sci,2013,79(5):841 - 848.
[13]YANG Chun-lin,Patrick J Hillas,Julio A Baez,et al.The application of recombinant human collagen in tissue engineering[J].Biodrugs,2004,18(2):103 -119.
[14]DU Chun-ling,WANG Ming-qi,LIU Jin-ying,et al.Improvement of thermostability of recombinant collagen-linke protein by incorporating a foldon sequence[J].Appl Microbiol Biotechnol,2008,79(2):195 -202.
[15]WU Ji-min,LI Zhi-hong,YUAN Xiao-yan,et al.Extraction and isolation of typeⅠ,Ⅲ andⅤ collagens and their SDS-PAGE analyses[J].Trans Tianjin Univ,2011,17(2):111-117.
[16]Nazeer R A,Kavitha R,Jai Ganesh R,et al.Detection of collagen through FTIR and HPLC from the body and foot of Donax cuneatus Linnaeus,1758[J].J Food Sci Technol,2014,51(4):750 -755.
[17]刘高梅,任海伟,王永刚.猪软骨Ⅱ型胶原蛋白的制备及结构表征[J].食品研究与开发,2012,33(8):47-50.
[18]Nasim A,Saeed A,Shahla J,et al.Purification and characterization of pepsin-solubilized collagen from skin of sea cucumber Holothuria parva[J].Appl Biochem Biotechnol,2014,173(1):143 -154.
[19]Olena S R,Peggy C,David L K.Collagen structural hierarchy and susceptibility to degradation by ultraviolet radiation[J].Materials Science and Engineering C,2008,28(8):1 420-1 429.
[20]Sailakshni G,Tapas Mitra,Gnanamani A,et al.Bonding interactions and stability assessment of biopolymer material prepared using typeⅢcollagen of avian intestine and anionic polysaccharides[J].J Mater Sci:Mater Med,2011,22(6):1 419 -1 429.
[21]雷静,李和生,张丽媛,孙楠楠.乌贼皮胶原蛋白的提取及结构表征[J].天然产物研究与开发,2012,24(5):575-580.
[22]Tapas M,Sailakshmi G,Gnanamani A,et al.Exploring the dual role of di-carboxyl1ic acids in the preparation of collagen based biomaterial[J].J Porous Mater,2013,20(4):647-661.
[23]Hee-Seok Jeong,Jayachandran Venkatesan,Se-Kwon Kim.Isolation and characterization of collagen from marine fish(Thunnus obesus)[J].Biotechnology and Bioprocess Engineering,2013,18(6):1 185 -1 191.
[24]Tsumoto K,Ejima D,Kumagai I,et al.Practical consideration in refolding proteins from inclusion bodies[J].Protein Expr Purif,2003,28(1):1 -8.
[25]Lee J M,Perira C A,Abdulla D,et al.A multisample denaturation temperature tester for collagenous biomaterials[J].Med Eng Phys,1995,17(2):115 -121.
[26]Akkasit J,Soottawat B.Isolation and characterization of acid and pepsin-solubilised collagens from the skin of Brownstripe red snapper[J].Food Chemistry,2005,93:475 -484.
[27]Doyle BB,Bendit EG,Blout ER.Infrared spectroscopy of collagen and collagen-like polypeptides[J].Biopoly,1975,14(5):937 -957.
[28]蒋挺大.胶原与胶原蛋白[M].北京:化学工业出版社,2006:171-173.
[29]何有节,张迈华,刘其则,等.明胶的标准1H和13CNMR谱[J].皮革科学与工程,1990(2):5-9.
[30]James C W,Wise W B.Natural abundance carbon-13 nuclear magnetic resonance study of gelatin[J].Biochemistry,1973(12):3 418.

