杂种偏分离的遗传和分子机理研究进展
范智权,孙加雷,单建伟,杨江义
杂种偏分离的遗传和分子机理研究进展
范智权,孙加雷,单建伟,杨江义
广西大学生命科学与技术学院,亚热带农业生物资源保护与利用国家重点实验室,南宁 530004
杂种偏分离是指杂交后代群体在某个位点的基因型分离比偏离了预期的孟德尔分离比例的一种现象,是来自不同杂交亲本基因之间的不兼容性所致。功能缺失型和功能获得型的基因间互作都可以导致杂种偏分离,其中前者的机理比较简单,即缺陷型的基因组合导致原有功能丧失而造成细胞死亡。功能获得型杂种偏分离系统是由多基因控制的遗传系统,包含两个基本成分:杀手(killer)因子和护卫(protector)因子,此外还有增强子(enhancer)、抑制基因(repressor)等修饰因子。功能获得型杂种偏分离有通用的遗传模型:具有传递优势的单倍型含有高活性的killer+和protector+;传递劣势的单倍型含有低活性的killer-和protector-;中性的单倍型(广亲和型)则含有killer-和protector+。该系统通过killer和protector间的紧密连锁、修饰因子的积累等途径得以在自然选择中保存下来。尽管不同功能获得型杂种偏分离系统的遗传机理有较高的相似性,但分子机制则大相径庭。文章综述了杂种偏分离的遗传和分子机理以及其与杂种不育的关系,以期为后续杂种偏分离研究提供参考。
偏分离;基因互作;广亲和;生殖隔离;杂种不育
偏分离(Segregation distortion, SD)是指观察到的基因型分离比偏离孟德尔分离比的一种现象[1]。偏分离现象广泛存在于生物界,是生物进化的主要动力之一[2]。宋宪亮等[3]从偏分离的表现、特征、原因、机制、其对遗传作图的影响及克服方法等方面分析了植物中的偏分离研究进展,并指出了目前植物偏分离研究中存在的问题,为在植物偏分离方面的研究提供了参考。根据来源,偏分离现象可分为杂种偏分离和非杂种偏分离两种类型。由于杂种中不同类型配子选择性败育、配子生存能力差异等原因[4]使得杂种后代基因型比例偏离孟德尔分离比,从而导致了杂种偏分离。在基因水平上,杂种偏分离是由两亲本基因之间的不兼容性所致,受多基因控制。而非杂种偏分离不是由杂交导致的,如配子体发育关键基因的突变导致的偏分离(突变型和野生型配子的生存或传递能力有差异)等,可由单基因控制。导致非杂种偏分离的原因多种多样,一般缺乏系统的研究。以果蝇和小鼠偏分离系统为代表的杂种偏分离已研究得较为清楚[5, 6],是偏分离研究的范例。近年来植物杂种偏分离研究也取得了较大进展,其中较有代表性的是Yang等[7]报道的水稻杂种偏分离系统。本文就杂种偏分离的遗传机理、分子机制以及其与杂种不育的关系进行了扼要介绍,以期为后续杂种偏分离研究提供参考。
1 杂种偏分离现象
杂种偏分离(Segregation distortion of hybrid progeny)是指杂交后代群体在某个位点的基因型分离比偏离预期的孟德尔遗传分离比的一种现象[1,8]。在远缘(如种间、亚种间)杂交中杂种偏分离尤其常见[9,10]。
如果某种基因型配子在世代间的传递能力高于(或低于)其他基因型的配子(即不满足孟德尔遗传分离的前提条件),则在其后代中各基因型个体所占比例不符合孟德尔比例,出现偏分离现象。导致杂种偏分离的原因有多种,如配子生存能力差异、配子的受精机会差异、后代合子存活力差异、选择性受精、后代合子选择等[1,3,4,8,11],其中主要原因是不同配子的生存或竞争能力的差异。
一般来说双亲遗传距离越远杂种偏分离越严重。Kianian等[12]用3个种内F2群体和1个种间F2群体进行了遗传作图研究,发现种间F2群体中59%的标记出现严重偏分离,而种内F2群体只有7%的标记出现严重偏分离。
在自然界中,杂种偏分离现象普遍存在。如黑腹果蝇()的偏分离系统、小鼠()中的单倍型偏分离系统[1,8,13],以及水稻(L.)籼/粳亚种间杂交中出现的偏分离现象[14]等。
2 杂种偏分离的类型
杂种偏分离是由基因互作所致[1, 8]。根据基因互作导致的功能变化,可以将基因互作分为功能缺失型和功能获得型两种类型。导致原有功能丧失的基因互作称为功能缺失型基因互作,而导致新功能出现的基因互作则称为功能获得型基因互作。功能缺失型基因互作导致的杂种偏分离(简称功能缺失型杂种偏分离)是指杂种后代中某些基因组合方式导致原有功能(杂交亲本中有此功能)丧失并进而导致该类型配子败育而引起的偏分离(图1B),其遗传和分子机制相对简单(两个或多个功能缺失型突变基因组合在一起而导致原有功能的丧失)。水稻重复隐性雄配子致死基因和导致的偏分离[15,16]都属于功能缺失型杂种偏分离。而功能获得型基因互作导致的杂种偏分离(简称功能获得型杂种偏分离)是指杂种后代中某些基因组合方式导致新功能(杂交亲本中无此功能)的出现并进而导致配子败育而引起的偏分离(图1A),其遗传和分子机制比较复杂。
鉴于功能缺失型杂种偏分离的机理(图1B)比较简单且易于理解,本文将重点阐述功能获得型杂种偏分离的遗传和分子机理。
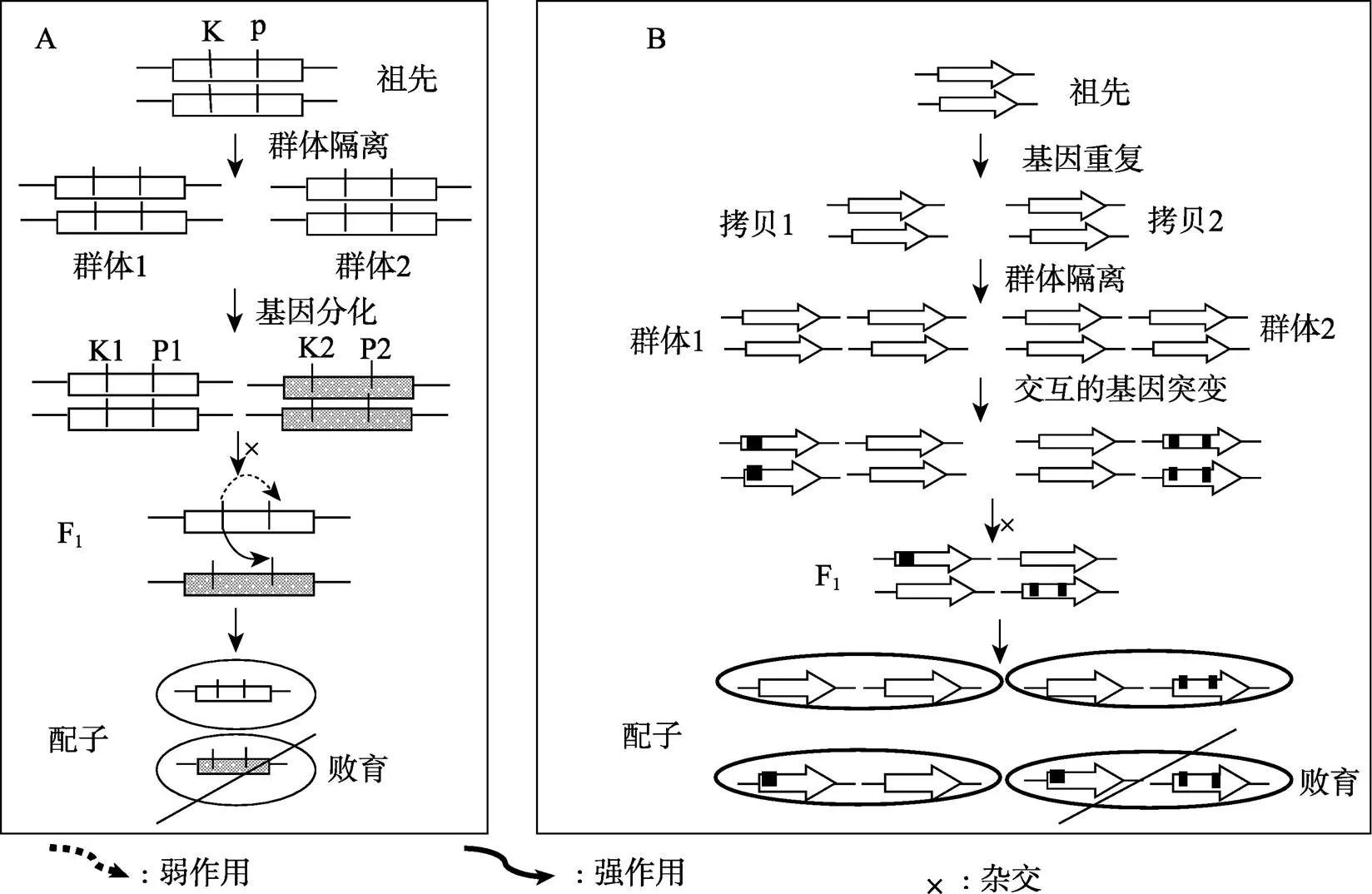
图1 基因互作导致偏分离的模式图
A:功能获得型偏分离。K/K1/K2为killer,P/P1/P2为protector,K1弱作用于P1而强作用于P2,最终导致含P2的配子败育;K2对P1和P2都是弱作用。B:功能缺失型偏分离。当配子携带的都是功能缺失的突变基因时,配子败育。
3 功能获得型杂种偏分离系统的遗传和分子机理研究
功能获得型杂种偏分离已在动物、植物和微生物中被发现,其中研究得最为清楚的是黑腹果蝇和小鼠的杂种偏分离[1,8,17]。近年来,水稻杂种偏分离研究也取得了较大进展[5,18]。已发表的杂种偏分离系统大多为控制雄配子的偏分离系统[1,8,18],Yang等[5]报道的水稻位点是第一个已克隆的控制雌配子的杂种偏分离系统。
3.1 黑腹果蝇杂种偏分离系统
3.1.1 黑腹果蝇杂种偏分离的遗传机制
位于黑腹果蝇第2染色体上的系统是杂种偏分离的典型代表。自1956年Yuichiro发现黑腹果蝇的眼色遗传具有偏分离现象[6]以来,人们对其开展了广泛研究。黑腹果蝇杂种偏分离是一个多组分系统,主要包括两个紧密连锁的基因(图2):(1)致畸基因():是果蝇杂种偏分离系统中最关键的基因,包括和Sd两种等位基因。相对于野生型Sd是一个突变基因,它是导致偏分离的前提条件,缺失掉染色体上的等位基因,偏分离会完全消失[6]。(2)应答基因():的靶标基因,由富含AT的120 bp串联重复序列组成,包括Rsp(不敏感型)和Rsp(敏感型)两种等位基因。串联重复序列的拷贝数决定了对的敏感性,拷贝数越多敏感性越强。其中不敏感型Rsp具有100~200个拷贝,而敏感型Rsp具有700个左右的拷贝[19]。除了和外,在染色体上还存在一些其他的修饰基因,包括增强子、改性基因和稳定剂基因。这些修饰基因共同协助的作用,增强偏分离程度。如果将这些修饰基因从染色体上敲除,导致的偏分离会减弱。
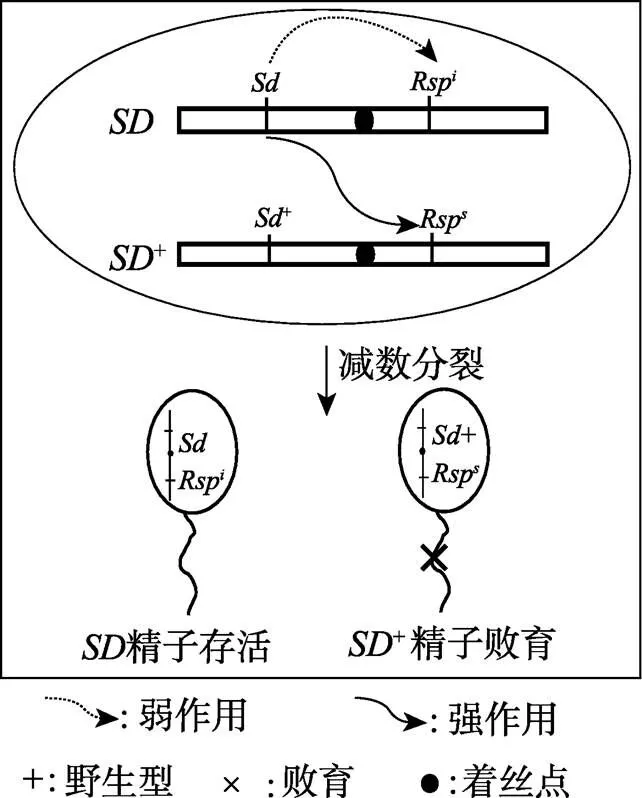
图2 果蝇杂种偏分离模式图(参考文献[6]并修改)
: segregation distorter,Rsp: insensitive responder,Rsp: sensitive responder。反式作用于导致携带敏感型Rsp的+精子败育。
和基因组成了果蝇杂种偏分离系统的核心。当与+通过杂交组合在一起时,反式作用于Rsp,使携带+染色体的精子败育。所以在/+杂合雄果蝇中,带有Rsp的配子可以传递到后代,而带有Rsp的配子则不能传递到后代。使得杂合雄性个体(/+)中超过95%的配子为型配子[6]。典型的SD+染色体(含Sd)带有敏感的应答基因Rsp,而所有的染色体(含)和极少数的+染色体(含Sd)带有不敏感的应答基因Rsp[1,8,20]。
3.1.2 黑腹果蝇杂种偏分离的分子机制
果蝇的杂种偏分离是由基因编码的Sd-RanGAP蛋白与Rsp相互作用所致[21]。RanGAP蛋白位于细胞质,具有酶的活性,能水解Ran-GTP得到Ran-GDP。正常情况下,细胞核内外的Ran-GTP和Ran-GDP总浓度维持动态平衡。其中细胞核内Ran-GTP的浓度较高,细胞质内Ran-GDP的浓度较高,核膜内外的Ran-GTP/Ran-GDP浓度梯度对核运输至关重要[22]。在正常的Ran-GTP/Ran-GDP浓度梯度下,核运输正常,染色质修饰因子通过核运输进入到细胞核浓缩染色质,精细胞正常发育[22]。在果蝇杂种偏分离系统中,基因编码的Sd-RanGAP是一个截短的RanGAP蛋白,缺少准确定位的结构域,会错误定位到细胞核[21,22]。Sd-RanGAP在核内将Ran-GTP水解为Ran- GDP,不恰当的增加了核内Ran-GDP的浓度,打破了核膜两侧原有的Ran-GTP/Ran-GDP浓度梯度,核运输被破坏,染色质修饰因子不能进入到细胞核完成染色质凝聚,精细胞不能正常发育[6,22]。
目前有3种Sd-RanGAP和相互作用方式的分子模型:(1)Sd-RanGAP与直接互作[21,23]。该模型中Sd-RanGAP能与直接结合。由于Rsp具更多的拷贝而能够与较多的Sd-RanGAP结合,破坏了+型配子核膜两侧的Ran-GTP/Ran-GDP浓度梯度,导致核运输功能异常,使得染色质修饰因子不能进入到细胞核内完成染色质的浓缩,所以+型精细胞功能异常。(2)Sd-RanGAP与间接互作[21,23]。Sd-RanGAP会破坏所有精细胞的Ran-GTP/Ran-GDP浓度梯度,但是携带Rsp的精细胞比携带Rsp的精细胞具有更多的拷贝,对此种浓度梯度的改变更为敏感。最终Rsp位点结合有限的染色质修饰因子,而Rsp位点可以募集大量的染色质修饰因子而阻止了染色质的正常浓缩[21,23],引起+型精细胞功能异常。(3)RNAi模型。能够产生重复相关的小片段干涉RNA(Repeat-associated small interfering RNAs, rasiRNA)[24]。rasiRNA由细胞核运出到细胞质与蛋白质结合形成核糖核蛋白复合体(RNP complexes)后再返回细胞核参与减数分裂后的染色质重塑[25,26],最终使染色质修饰因子定位到位点,完成染色质凝聚。当杂合雄性在精子形成过程中遭受核运输破坏时,RNP不能有效运回核内。Rsp受RNP缺乏的影响较Rsp更大[27,28],结果Rsp型精细胞染色质浓缩失败,+型精细胞功能异常。
3.2 小鼠杂种偏分离系统
3.2.1 小鼠杂种偏分离的遗传机制
1927年,小鼠复合体(-complex)被发现[29]。复合体位于小鼠第17号染色体上,约占基因组的1%[30],由很多倒转重复序列组成。单倍型(-haplotype)是复合体的变异形式。
与果蝇的偏分离系统一样,小鼠的单倍型也是一个多组分系统,也包含distorter(T complex distorter,)和responder(T complex responder,)(图3)。单倍型致畸基因反式作用于其受体()导致小鼠的杂种偏分离现象[8,31]。与果蝇不同的是,小鼠有1个responder(图3中的)和至少3个distorter(图3中的、和)[30]。杂合雄鼠可以产生等比例的和雄配子(即精子),但通过损伤型精子鞭毛的功能[32,33]使得+型精子鞭毛功能异常而不能参与受精(可能是由于运动能力差)。而型精子中的Tcr能够弥补这一损伤,使型精子的鞭毛功能正常,最终90%以上的子代含染色体[34]。此外,小鼠杂种偏分离系统中的3个distorter(、和)之间有加性效应。虽然单个的distorter就可以导致偏分离,但distorter越多偏分离越严重[27]。
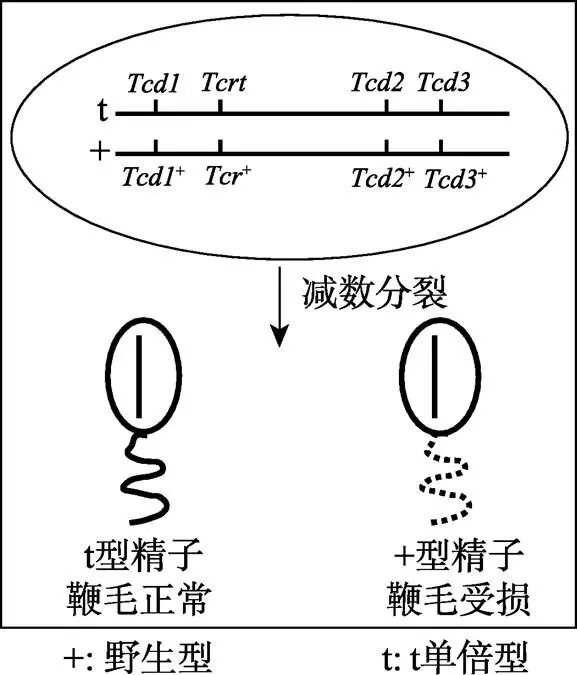
图3 小鼠偏分离遗传模式图(参考文献[31]并修改)
:complex distorter;Tcr:complex responder;、、反式作用于导致野生型精子的活性异常。
3.2.2 小鼠杂种偏分离的分子机制
通过对的图位克隆研究得知,是一个蛋白激酶基因家族的成员,其所编码的蛋白激酶(Smok1)是一个精子活力激酶,参与精子活力调控[35]。致畸基因和通过两个Rho信号通路来调节Smok1活性,从而引起了小鼠偏分离[7,31]。和分别编码产生Tagap1和Fgd2。在精细胞中,Tagap1通过下调Smok1的抑制通路而减少对Smok1的抑制作用,Fgd2则通过上调Smok1的激活通路来增加Smok1的活性[36](图4)。在单倍型中,Tagap1和Fgd2对Smok1活性的增强作用,被Tcr基因编码的Smok1的低催化活性抵消[36]。结果型精子鞭毛功能正常,能到达卵细胞完成受精。而+型精子中,Tcr编码的Smok1具高催化活性,经过Tagap1和Fgd2的增强作用后Smok1过度活跃,最终+型精子鞭毛过度耗能而不能到达卵细胞,使受精失败[36]。故而在子代中出现偏向于携带染色体的现象。
3.3 水稻杂种偏分离系统
3.3.1 水稻功能获得型杂种偏分离遗传研究进展
植物中也存在杂种偏分离现象,但与动物相比,目前在植物杂种偏分离方面的研究深度不够。近年来在植物杂种偏分离方面有不少成果[7,37],其中研究较为深入的是水稻亚种间的杂种偏分离[7]。
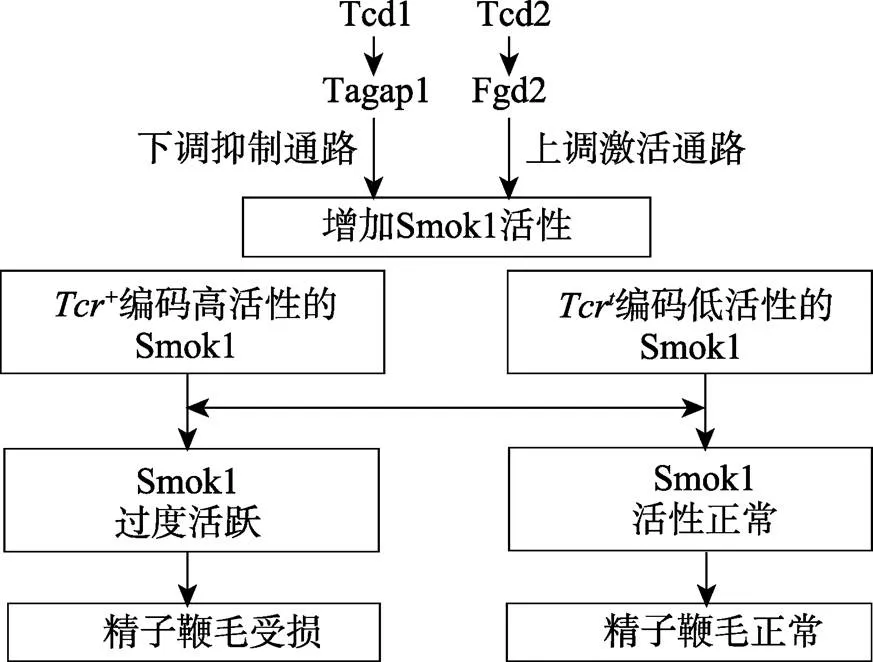
图4 小鼠杂种偏分离分子机制模式图
Tagap1:T-cell activation Rho GTPase-activating protein-1;Fgd2:faciogenital dysplasia-2;Smok1:sperm motility kinase-1。
水稻杂种不育及广亲和位点最初由日本学者Ikehashi等[38]报道,并将其初步定位到第6染色体上[38]。Liu等[39]最先采用RFLP分子标记对进行定位。此后Wang等[40]和Song等[41]的研究也证明了位点的存在,并明确该位点是通过引起胚囊败育造成杂种不育,而对雄配子没有影响。Chen等[42]在Qiu等[43]精细定位的基础上最终克隆了该基因。水稻位点偏分离系统是一个由雌配子不育导致的杂种偏分离系统。前人的研究[38,42~44]认为位点是由一个基因导致雌配子不育的,而Yang等[5]的研究表明位点的不育系统由紧密连锁的3个基因组成,分别为杀手基因、帮凶基因和护卫基因。有3种等位基因,分别是显性的、隐性的和无功能的[42]。和都只有两种等位基因[5],显性的用+表示(即和),隐性的用-表示(即和)。基因在基因的协助下作用于基因。其中和为孢子体型的作用方式(即和对所有配子都能发挥作用),而则是配子体型作用方式(即只能对携带该基因的配子起作用,不会作用于其他配子)。和共同决定了是否具有杀雌配子作用(相当于配子杀手Gamete killer)。和组成功能型gamete killer(具杀配子作用),而其他的和等位基因组合则组成了无功能型gamete killer。决定了雌配子是否会被杀死,充当配子护卫(Gamete protector)。带有的雌配子不会被gamete killer杀死,而带有的雌配子则会被杀死(图5)。
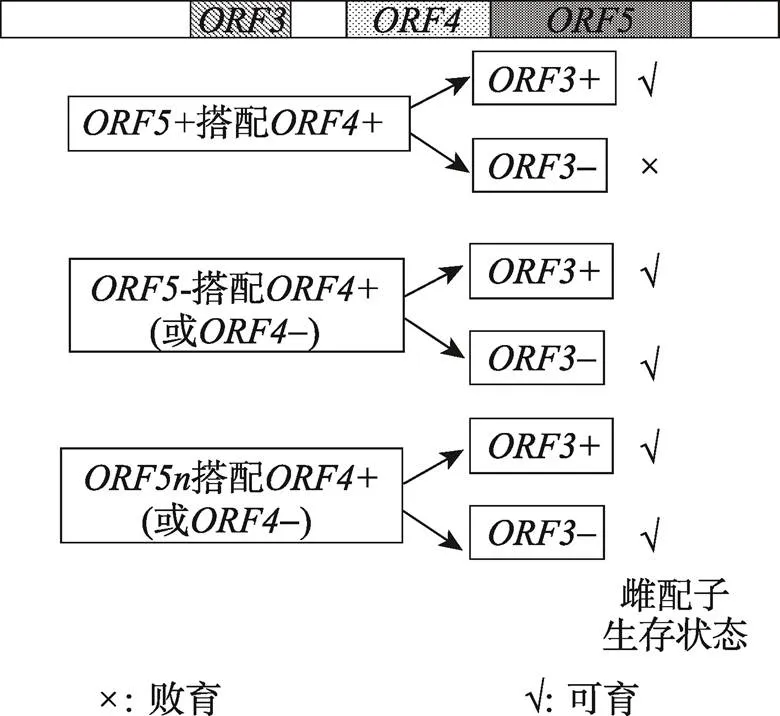
图5 水稻S5位点杂种偏分离遗传模式图
、和为位点的3个紧密连锁基因,“+”为显性,“-”为隐性,n为无功能型。和共同作用能杀死具的配子。
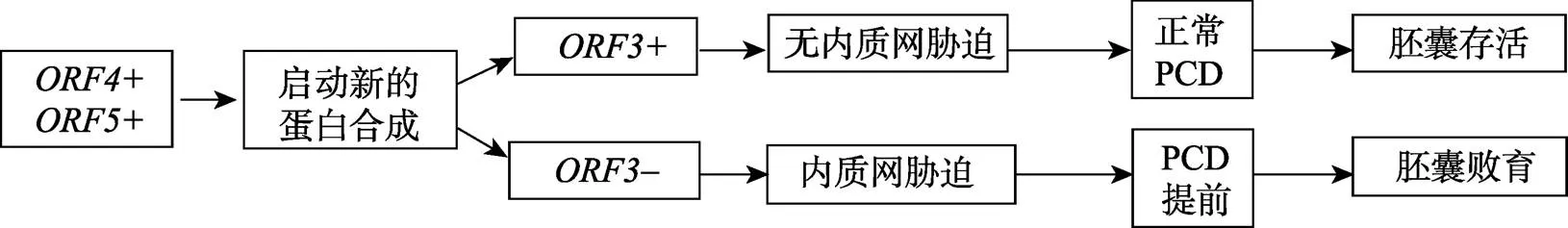
图6 水稻S5位点杂种偏分离分子机制模式图
ER(Endoplasmic reticulum)为内质网,PCD(Programmed cell death)为细胞程序性死亡。
与黑腹果蝇的单基因gamete killer ()和小鼠中具加性效应的多基因组成的gamete killer(多个)不同[1,8],像这样由两个非加性的基因(和)组成的gamete killer在其他物种中还未被发现。其非加性效应表现为只有当和同时存在时才有杀配子作用,单独的(如跟组合)或者单独的(如跟组合)都没有杀配子作用(图5)。
3.3.2 水稻功能获得型杂种偏分离的分子机制
位点偏分离涉及3个紧密连锁的开放阅读框—、和,它们分别被注释为DnaK类Hsp70蛋白、功能未知蛋白和含天冬氨酸蛋白酶域的蛋白[5]。在只有(缺乏)的情况下,和的共同作用会增加内质网的折叠负担并导致内质网胁迫(ER stress)。持续的内质网胁迫会造成程序性细胞死亡(Programmed cell death, PCD)提前,最终导致胚囊败育[5]。当细胞中存在时,阻止了内质网胁迫,PCD正常,胚囊正常发育(图6)。
4 功能获得型杂种偏分离系统的通用遗传模型
综上所述,功能获得型杂种偏分离系统是由多基因控制的遗传系统,包含两个基本成分:杀手因子(killer)和护卫因子(protector)。killer为孢子体型作用方式,而protector为配子体型作用方式。此外还有增强子(enhancer)、抑制基因(repressor)等修饰因子。修饰因子出现与否取决于物种差异或研究材料间的遗传分化程度。这里所说的“因子”既可以由单个基因构成,也可由多个基因构成。
最基本的偏分离遗传模型为:具有传递优势的单倍型(简称H单倍型)含有高活性(High-activity)的杀手因子(killer+)和护卫因子(protector+);传递劣势的单倍型(简称L单倍型)含有低活性(Low-activity)的杀手因子(killer-)和护卫因子(protector-);中性的单倍型(Neutral haplotype, 简称N单倍型)含有低活性的杀手因子(killer-)和高活性的护卫因子(Protector+)。killer+有杀配子作用,而protector+则有保护配子的作用;killer-不能杀配子,protector-也不能保护配子。在水稻中,中性单倍型也称为广亲和类型,即该类型水稻与籼粳稻杂交,杂种都可育[45]。
当H单倍型通过杂交与L单倍型组合在一起的时候,L单倍型的protector-不能抵消killer+的杀配子作用,使得L单倍型配子败育,表现出杂种偏分离现象。当H单倍型与N单倍型组合在一起的时候,killer+仍具有杀配子活性,但是由于H和N单倍型都携带protector+,能够抵抗killer+的作用,所以杂种可育。当L单倍型与N单倍型组合在一起的时候,由于没有killer+,故不会出现杀配子现象,杂种可育。后两种情况不会出现杂种偏分离现象,而第一种情况会由于protector-配子的选择性败育表现出杂种偏分离现象。
5 功能获得型杂种偏分离系统的适应机制
杂种偏分离系统经过自然选择的淘汰机制仍能够保存下来必定存在其特定的优势。果蝇的杂种偏分离系统之所以能够在自然选择压力下保留下来,有几方面的原因。首先,一个系统形成的首要条件是位点和其靶位点紧密连锁[46,47],这种紧密连锁保证了位点和其靶位点间的连锁不平衡(Linkage disequilibrium, LD)。LD是指在某一群体中,不同位点的等位基因出现在同一条单元型上的频率与预期的随机频率之间存在明显差异的现象[48,49],即群体内不同位点等位基因间的非随机性组合的关系。遗传因素和非遗传因素综合作用决定群体的 LD水平,其中重组是降低染色体内部连锁不平衡强度最主要的因素[49]。由于减数分裂过程中基因会发生重组,当被重组到Rsp染色体上时,Sd-Rsp组合形成了一个“自杀式重组体”[50,51],这样的组合很快就被自然选择所淘汰。所以和基因的紧密连锁对偏分离系统的保存至关重要。其次,偏分离系统形成后与基因连锁的各种修饰基因也参与到连锁不平衡中,增强子辅助基因作用,而抑制子则抵抗基因的作用[47,52]。第三,位点和其修饰位点之间倒转重复序列的增加降低了该区域染色体重组的频率[46]。染色体重组的减少使得、和Rsp紧密连锁,获得进化上的优势。这也解释了几乎所有染色体的右臂或着丝粒周围都具有一个或者更多的倒转重复序列的事实[53]。
虽然不连锁或者连锁不紧密的修饰因子会降低系统的偏分离强度,但是每当偏分离染色体处于适应劣势的时候,自然选择会偏向于保留不连锁或者连锁不紧密的修饰因子[54]。当有证据显示雄性的生殖适应性下降时,自然选择会倾向于的非连锁抑制因子去恢复雄性杂合体的生殖能力。所以具有抑制作用的等位基因比非抑制等位基因产生了更具适应性的后代,而且会因此产生更多的后代。此外,在一个合适的适应性参数、致畸动力和连锁关系的情况下,偏分离系统能够达到一个稳定平衡的状态[46,47,54],即配子水平的偏分离优势被个体水平的适应性劣势中和,从而阻止了Sd-Rsp的稳固性,结果在系统得以保留的同时,在同一个自然种群中Rsp和能够同时存在[46]。这就解释了为什么能在具有染色体的群体中发现高频率的Rsp。
6 杂种不育与杂种偏分离现象的关系
杂种不育是一种合子后生殖隔离(Postzygotic reproductive isolation),指两种不同的生物杂交后能够形成合子并发育为成熟的F1杂种,但F1代不能产生后代的生物学现象。种间或种内的杂交后代能够通过继承亲本的优势性状,获得一个更好的生物特性(即杂种优势),在生物的进化和多样性方面具有重要作用[55]。但是杂种不育妨碍了作物,尤其是以收获种子为目标的作物的远缘杂种优势在育种中的应用。
从本质上讲,杂种不育和杂种偏分离现象是同一个问题的不同表现。杂种不育往往同时伴随着偏分离现象[56,57]。如在水稻亚种间杂交组合中偏分离现象十分普遍,常与杂种不育相伴发生[57]。在籼粳杂合体中,几乎只有携带籼型等位基因的雌配子可以传递到子代[5,58]。这意味着杂种不育源自粳型雌配子的选择性败育,从而在杂种后代中引起偏分离的表型。
如果不同等位基因配子的生存能力有差异,两种具不同等位基因的亲本杂交,其杂交后代中生存能力低的配子败育,使得后代偏向于生存能力强的等位基因类型。这种由于配子差异性死亡导致的偏分离现象同时伴随着杂种不育现象。而当各基因型配子同等程度死亡时,杂交后代就不会出现杂种偏分离现象,但此时则会导致杂种不育现象。由于染色体结构或数目差异以及异常温度等造成雌雄配子死亡而影响了杂种后代的育性,但是不会出现杂种偏分离现象。所以,出现杂种偏分离必定同时伴随着杂种不育,但出现杂种不育不一定会出现杂种偏分离现象。由于杂种不育常常伴随着偏分离现象,研究清楚偏分离的机理有助于杂种不育的机理的研究。偏分离研究可以深化人们对杂种不育的认识,为杂种不育的研究提供新的思路。以偏分离为切入点进行杂种不育的研究更有利于发掘杂种不育现象的根本原因和机理。
7 问题与展望
早期的杂种偏分离研究主要以果蝇和小鼠为研究对象。果蝇和小鼠作为模式物种,其大多数克隆到的偏分离相关基因都是已知功能的基因,故基因克隆之后其分子机制也就基本清楚了。但是在水稻、小麦、玉米等农作物方面,其杂种偏分离机制研究不够深入。虽然近年来水稻杂种偏分离研究取得了较大的进展,但与果蝇和小鼠相比,水稻作为禾本科模式植物其基因功能的研究还处于初级阶段。大量的水稻基因都不知其生物学功能,这给分子机制的研究带来了困难。同时,由于偏分离相关基因紧密连锁,给基因的精细定位带来了极大的困难。因此,在后续的研究中应更注重偏分离位点的定位方法,如借助遗传分析和比较测序等手段开展研究。这将有助于发现更多的偏分离位点,为远缘杂种优势利用中杂种不育问题的解决提供方法,并有助于指导育种工作。
[1] Lyttle TW. Segregation distorters., 1991, 25: 511–557.
[2] Charlesworth B. Driving genes and chromosomes., 1988, 332(6163): 394–395.
[3] 宋宪亮, 孙学振, 张天真. 偏分离及对植物遗传作图的影响. 农业生物技术学报, 2006, 14(2): 286–292.
[4] Vogl C, Xu SZ. Multipoint mapping of viability and segregation distorting loci using molecular markers., 2000, 155(3): 1439–1447.
[5] Kusano A, Staber C, Chan HYE, Ganetzky B. Closing the (Ran)GAP on segregation distortion in., 2003, 25(2): 108–115.
[6] Bauer H, Willertbirgit J, Koschorz B. The t complex-encoded GTPase-activating protein Tagap1 acts as a transmission ratio distorter in mice., 2005, 37(9): 969–973.
[7] Yang JY, Zhao XB, Cheng K, Du HY, Ouyang YD, Chen JJ, Qiu SQ, Huang JY, Jiang YH, Jiang LW, Ding JH, Wang J, Xu CG, Li XH, Zhang QF. A killer-protector system regulates both hybrid sterility and segregation distortion in rice., 2012, 337(6100): 1336–1340.
[8] Burt A, Trivers R. Genes in conflict: the biology of selfish genetic elements. London: Belknap Press, 2006.
[9] Whitkus R. Genetics of adaptive radiation in Hawaiian and Cook Islands species of Tetramolopium (Asteraceae). Ⅱ. Genetic linkage map and its implications for interspecific breeding barriers., 1998, 150(3): 1209–1216.
[10] Lin SY, Ikehashi H, Yanagihara S, Kawashima A. Segregation distortion via male gametes in hybrids between Indica and Japonica or wide-compatibility varieties of rice (L.)., 1992, 84(7–8): 812–818.
[11] Xu X, Li L, Dong X, Jin W, Melchinger AE, Chen S. Gametophytic and zygotic selection leads to segregation distortion throughinduction of a maternal haploid in maize.2013, 64(4): 1083–1096.
[12] Kianian SF, Quiros CF. Generation of acomposite RFLP map: linkage arrangements among various populations and evolutionary implications., 1992, 84(5–6): 544–554.
[13] Lyon MF. Transmission ratio distortion in mice., 2003, 37: 393–408.
[14] Harushima Y, Kurata N, Yano M, Naganmura Y, Sasaki T, Minobe Y, Nakagahra M. Detection of segregation distortions in anrice cross using a high-resolution molecular map., 1996, 92(2): 145– 150.
[15] Yamagata Y, Yamamoto E, Aya K, Win K, Doi K, Sobrizal, Ito T, Kanamori H, Wu J, Matsumoto T, Matsuoka M, Ashikari M, Yoshimura A. Mitochondrial gene in the nuclear genome induces reproductive barrier in rice., 2010, 107(4): 1494–1499.
[16] Mizuta Y, Harushima Y, Kurata N. Rice pollen hybrid incompatibility caused by reciprocal gene loss of duplicated genes., 2010, 107(47): 20417– 20422.
[17] Flachs P, Mihola O, Šimeček P, Gregorová S, Schimenti JC, Matsui Y, Baudat F, de Massy B, Piálek J, Forejt J, Trachtulec Z. Interallelic and intergenic incompatibilities of the) gene in mouse hybrid sterility., 2012, 8(11): e1003044.
[18] Long YM, Zhao LF, Niu BX, Su J, Wu H, Chen YL, Zhang QY, Guo JX, Zhuang CX, Mei MT, Xia JX, Wang L, Wu HB, Liu YG. Hybrid male sterility in rice controlled by interaction between divergent alleles of two adjacent genes., 2008, 105(48): 18871–18876.
[19] Pimpinelli S, Dimitri P. Cytogenetic analysis of segregation distortion in: the cytological organization of the responder () locus., 1989, 121(4): 765–772.
[20] Presgraves DC. Does genetic conflict drive rapid molecular evolution of nuclear transport genes in?, 2007, 29(4): 386–391.
[21] Merrill C, Bayraktaroglu L, Kusano A, Ganatzky B. Truncated RanGAP encoded by thelocus of., 1999, 283(5408): 1742–1745.
[22] Kusano A, Staber C, Ganetzky B. Nuclear mislocalization of enzymatically active RanGAP causes segregation distortion in., 2001, 1(3): 351–361.
[23] Kusano A, Staber C, Ganetzky B. Segregation distortion induced by wild-type RanGAP in., 2002, 99(10): 6866–6870.
[24] Saito K, Nishida KM, Mori T, Kawamura Y, Miyoshi K. Specific association of Piwi with rasiRNAs derived from retrotransposon and heterochromatic regions in thegenome., 2006, 20(16): 2214–2222.
[25] Pal-Bhadra M, Leibovitch BA, Gandhi SG, Rao M, Bhadra U, Birchler JA, Elgin S. Heterochromatic silencing and HP1 localization inare dependent on the RNAi machinery., 2004, 303(5658): 669–672.
[26] Kavi HH, Birchler JA. Interaction of RNA polymerase II and the small RNA machinery affects heterochromatic silencing in., 2009, 2(1): 15.
[27] Tao Y, Masly JP, Araripe L, Ke YY, Hartl DL. A sex-ratio meiotic drive system insimulans. Ⅰ: An autosomal suppressor., 2007, 5(11): e292.
[28] Ferree P, Barbash D. Distorted sex ratios: a window into RNAi-mediated silencing., 2007, 5(11): e303
[29] Willison KR, Lyon MF. A UK-centric history of studies on the mouse-complex., 2000, 44(1): 57–63.
[30] Fraser LR, Dudley K. New insights into the-complex and control of sperm function., 1999, 21(4): 304–312.
[31] Hermann B, Nathalie V, Jürgen W, Bernhard GH. The-complex-encoded guanine nucleotide exchange factor Fgd2 reveals that two opposing signaling pathways promote transmission ratio distortion in the mouse., 2007, 21(2): 143–147.
[32] Katz DF, Erickson RP, Nathanson M. Beat frequency is bimodally distributed in spermatozoa from T/t mice., 1979, 210(3): 529–535.
[33] Olds-Clarke P, Johnson LR.haplotypes in the mouse compromise sperm flagellar function., 1993, 155(1): 14–25.
[34] Ardlie K. Putting the brake on drive: meiotic drive ofhaplotypes in natural populations of mice., 1998, 14(5): 189–193.
[35] Herrmann BG, Koschorz B, Wertz K, Mclaughlin KJ, Kispert A. A protein kinase encoded by thecomplex responder gene causes non-mendelian inheritance., 1999, 402(6758): 141–146.
[36] Véron N, Bauer H, Weiße AY, Lüder G, Werber M, Herrmann BG, Martin Werber B. Retention of gene products in syncytial spermatids promotes non-Mendelian inheritance as revealed by the., 2009, 23(23): 2705–2710.
[37] Macaya-Sanz D, Suter L, Joseph J, Barbará T, Alba N, González-Martínez SC, Widmer A, Lexer C. Genetic analysis of post-mating reproductive barriers in hybridizingspecies., 2011, 107(5): 478–486.
[38] Ikehashi H, Araki H. Genetics of F1sterility in remote crosses of rice. In: IRRI, eds. Rice Genetics. Manila, Philippines: International Rice Research Institute, 1986: 119–130.
[39] Liu KD, Wang J, Li HB, Xu CG, Liu AM, Li XH, Zhang Q. A genome-wide analysis of wide compatibility in rice and the precise location of thelocus in the molecular map., 1997, 95(5–6): 809–814.
[40] Wang J, Liu KD, Xu CG, Zhang Q. The high level of wide-compatibility of variety ‘Dular’ has a complex genetic basis., 1998, 97(3): 407–412.
[41] Song X, Qiu SQ, Xu CG, Li XH, Zhang Q. Genetic dissection of embryo sac fertility, pollen fertility, and their contributions to spikelet fertility of intersubspecific hybrids in rice., 2005, 110(2): 205–211.
[42] Chen JJ, Ding JH, Ouyang YD, Du HY, Yang JY, Cheng K, Zhao J, Qiu SQ, Zhang XL, Yao JL, Liu KD, Wang L, Xu CG, Li XH, Xue YB, Xia M, Ji Q, Lu JF, Xu ML, Zhang QF. A triallelic system ofis a major regulator of the reproductive barrier and compatibility of indica-japonica hybrids in rice., 2008, 105(32): 11436–11441.
[43] Qiu SQ, Liu K, Jiang JX, Song X, Xu CG, Li XH, Zhang Q. Delimitation of the rice wide compatibility geneto a 40-kb DNA fragment., 2005, 111(6): 1080–1086.
[44] Ji Q, Zhang MJ, Lu JF, Wang HM, Lin B, Liu QQ, Chao Q, Zhang Y, Liu CX, Gu MH, Xu ML. Molecular basis underlying the-dependent reproductive isolation and compatibility ofrice hybrids., 2012, 158(3): 1319–1328.
[45] Ikehashi H, Araki A. Varietal screening of compatibility types revealed in F1fertility of distant crosses in rice., 1984, 34(3): 304–313.
[46] Charlesworth B, Hartl DL. Population dynamics of the segregation distorter polymorphism of., 1978, 89(1): 171–192.
[47] Prout T, Bundgaard J, Bryant S. Population genetics of modifiers of meiotic drive. Ⅰ. The solution of a special case and some general implications., 1973, 4(4): 446–465.
[48] 江玉梅, 杨桂玲. 连锁不平衡的研究与应用. 江西植保, 2004, 27(2): 61–63.
[49] 巢素珍. 水稻中连锁不平衡的研究进展. 科技经济市场, 2011(6): 14–15.
[50] Hartl DL. Genetic dissection of segregation distortion. Ⅰ. Suicide combinations ofgenes., 1974, 76(3): 477–486.
[51] Sandler L, Hiraizumi Y, Sandler I. Meiotic drive in natural populations of. Ⅰ. The cytogenetic basis of segregation-distortion., 1959, 44(2): 233–250.
[52] Hartl DL. Meiotic drive in natural populations of. Ⅸ. Suppressors ofin wild populations., 1970, 12(3): 594–600.
[53] Hartl DL, Hiraizumi Y. Segregation distortion. New York: Academic Press, 1976.
[54] Crow JF. Why is Mendelian segregation so exact?, 1991, 13(6): 305–312.
[55] Bezault E, Rognon X, Clota F, Gharbi K, Baroiller JF, Chevassus B. Analysis of the meiotic segregation in intergeneric hybrids of, 2012, 2012: Article ID 817562.
[56] Kulmuni J, Seifert B, Pamilo P. Segregation distortion causes large-scale differences between male and female genomes in hybrid ants., 2010, 107(16): 7371–7376.
[57] Lin SY, Ikehashi H. A gamete abortion locus detected by segregation distortion of isozyme locuscrosses of rice (L.)., 1993, 67(1–2): 35–40.
[58] Matsubara K, Ebana K, Mizubayashi T, Itoh S, Ando T, Nonoue Y, Ono N, Shibaya T, Ogiso E, Hori K, Fukuoka S, Yano M. Relationship between transmission ratio distortion and genetic divergence in intraspecific rice crosses., 2011, 286(5–6): 307–319.
(责任编委: 吴为人)
Research progress on genetic and molecular mechanisms of hybrid segregation distortion
Zhiquan Fan, Jialei Sun, Jianwei Shan, Jiangyi Yang
Segregation distortion (SD) is defined as abnormal segregation ratio of hybrid offsprings at some genetic loci deviating from the Mendelian ratio. SD results from the incompatibility among genes from different parents, which could be due to loss-of-function or gain-of-function gene interactions. The mechanism for loss-of-function SD is relatively simple: defective gene combination leads to loss of the original function and eventual cell death. The gain-of-function hybrid SD system is a multi-gene genetic system, comprising two basic components: the killer and the protector. Additional modifiers, such as enhancers and repressors, are also involved. There is a general genetic model for gain-of-function hybrid SD: haplotypes with transmission advantage possess high-activity killer+ and protector+; those with transmission disadvantage possess low-activity killer- and protector-;neutral haplotypes (wide compatibility types) possess killer- and protector+. Depending upon close linkage between the killer and the protector and the accumulation of modifiers, the SD system survived through natural selection. Although the genetic mechanisms are highly similar, different gain-of-function hybrid SD systems have distinctive molecular mechanisms. In this review, we summarize the genetic and molecular mechanisms of hybrid SD, and the relationship between hybrid SD and hybrid sterility.
segregation distortion; gene interaction; wide compatibility; reproductive isolation; hybrid sterility
2014-07-02;
2014-10-21
国家自然科学基金项目(编号:31471476)资助
范智权,硕士研究生,专业方向:遗传学。E-mail: fanzhiquan123@mail.gxu.cn
杨江义,博士,教授,研究方向:植物分子生物学。E-mail: yangjy598@163.com
10.16288/j.yczz.14-217

