长效促胰岛素降糖酵母的构建及其对糖尿病模型小鼠的治疗效果
吴日,马超,李晓丹,段会坤,姬艳丽,王宇,姜苹哲,王海松,屠培培,李淼,尼钢钢,马百成,李明刚
长效促胰岛素降糖酵母的构建及其对糖尿病模型小鼠的治疗效果
吴日1,马超1,李晓丹1,段会坤1,姬艳丽1,王宇1,姜苹哲1,王海松1,屠培培1,李淼1,尼钢钢1,马百成2,李明刚1
1. 南开大学生命科学学院,教育部生物活性材料重点实验室,天津 300071;2. 天津市儿童医院,天津 300074
益生菌生物药物是指通过口服表达药用多肽(蛋白)的重组益生菌活细胞达到治疗疾病的新型口服给药系统。为了构建一种能有效防治2型糖尿病的酵母生物药物,文章首先构建了酿酒酵母()整合型表达载体pNK1-PGK,并且通过绿色荧光蛋白(GFP)证明其表达功能正常,利用该载体将GLP-1 (Glucagon-like peptide-1)基因转化到酿酒酵母INVSc1中,通过营养缺陷型和Western blotting成功筛选出表达10´GLP-1的长效促胰岛素降糖酵母(Long-acting GLP-1 hypoglycemic yeast,LHY)。该酵母生长迅速,外源基因GLP-1表达稳定,表达量达到1.56 mg/g细胞湿重。通过链脲佐菌素和高脂高糖饮食联合诱导的方法构建了2型糖尿病小鼠模型,用LHY对其进行口服灌胃治疗,证明LHY具有较好疗效,明显降低血糖水平。
2型糖尿病;胰高血糖素样肽-1(GLP-1);长效促胰岛素降糖酵母(LHY);重组酿酒酵母;糖尿病小鼠模型
糖尿病是由内分泌和代谢失调导致的一种慢性疾病,主要临床表现是“三多一少”,并且血糖表现出异常升高。糖尿病还会导致一些并发症,如心脑血管疾病、肾脏疾病、眼部疾病、神经系统疾病等,严重危害人体的健康。近年来,随着人们生活水平的提高,糖尿病的发病率也在逐年升高,并且增长速度越来越快。根据世界卫生组织的统计结果,2013年世界糖尿病患者已经达到3.82亿人,预计2035年将达到5.92亿人[1]。我国糖尿病患病人数已经超过一亿人,成为世界糖尿病第一大国[2]。因此,研发合理有效的糖尿病治疗药物,已经成为全球的研究热点和难点。2型糖尿病是一种进行性疾病,仅使用二甲双胍等化学药物很难长期控制患者糖化血红蛋白(HbA1c)上升,胰腺β细胞功能会以每年4%的速度进行性衰退。因此,研发服用方便、能改善β细胞功能、持久控制血糖的药物极为重要。
胰高血糖素样肽-1(Glucagon-like peptide-1, GLP-1)是由肠道L细胞分泌的一种肠促胰岛素激素,其活性形式由30个氨基酸组成。研究证明,GLP-1对2型糖尿病具有独特的治疗作用,具有葡萄糖浓度依赖性降糖作用,还可以保护胰腺β细胞,延缓2型糖尿病发展[3]。首个GLP-1类似肽“艾塞那肽注射液”已由美国FDA(Food and drug administration)和中国SFDA(State food and drug administration)同时批准上市。但长期打针注药会给患者身心带来诸多痛苦和不便,难以被糖尿病患者广泛接受。
南开大学生物技术与新药实验室率先克隆了抗二肽基肽酶IV(DPP-IV)和胰蛋白酶降解的重组口服长效基因(recombinant oral long-acting GLP-1,),并实现了其在大肠杆菌()、毕赤酵母()等不同宿主的高效表达,已证明其具有良好的口服降血糖效果[4, 5]。随着糖尿病等慢性疾病的流行和快速发展,用益生菌活细胞作为缓释“胶囊”的新型给药系统正悄然兴起,给糖尿病患者带来了康复的希望。酿酒酵母()是一种食用最为安全的益生菌,其本身富含维生素、消化酶,能调节肠胃功能并对消化酶降解具有一定抵抗作用,从而对其内容物可起到缓释“胶囊”的作用[6]。
本研究利用前期克隆的10拷贝串联的基因(GLP-1)[7],以酿酒酵母作为宿主细胞,通过整合型表达载体pNK1-PGK将GLP-1转入酿酒酵母进行胞内表达,制备表达GLP-1的长效促胰岛素降糖酵母(Long-acting GLP-1 hypoglycemic yeast,LHY),并研究其对2型糖尿病的治疗作用。
1 材料和方法
1.1 材料
pNK1-TPI载体由本实验室构建,具体构建方法见参考文献[8];大肠杆菌DH5α、酿酒酵母INVSc1、载体pMD-T-10×GLP-1和pMD-T-GFP由本实验室保存;载体YEpPGK由Watanabe惠赠;小鼠C57BL/6购自中国军事医学科学院实验动物中心;人神经母细胞瘤SH-sy5y细胞系购自American Type Culture Collection(ATCC);rolGLP-1由本实验室在大肠杆菌中表达纯化获得,具体方法见参考文献[7]。
1.2 方法
1.2.1 表达载体pNK1-PGK的构建
利用pNK1-TPI作为出发质粒构建pNK1-PGK载体。pNK1-TPI是一个穿梭质粒,具有大肠杆菌的复制起点()和氨苄青霉素抗性基因(AP),可在大肠杆菌中进行复制扩增(图1A)。该质粒具有一个基因,其编码产物可使酿酒酵母INVS1在无尿嘧啶的培养基上生长,以便进行营养缺陷筛选;还具有一个酿酒酵母磷酸丙糖异构酶(TPI)表达单元,可使目的基因在TPI启动子的驱动下进行表达。此外,该载体还含有两段酿酒酵母的rDNA同源序列AB和CD,它们可以通过同源重组的方式将基因和TPI表达单元整合到酿酒酵母的基因组中,从而使目的基因稳定表达。
为进一步提高目的基因的表达效率,本文使用强启动子PGK表达单元替换pNK1-TPI载体中的TPI表达单元,构建了高效整合型表达载体pNK1-PGK(图1B)。首先根据酿酒酵母磷酸甘油酸激酶(PGK)表达单元的序列设计引物,并且分别在5¢和3¢端加入Ⅰ和Ⅰ酶切位点,引物序列为:
上游引物:5¢-GGTACCAGGAGCTTGGAAAGATG-3¢;
下游引物:5¢-TCTAGAGACCAGCTTTAACGAACGC-3¢。
以载体YEpPGK为模板,使用不同的复性温度(52℃、53℃、54℃和55℃)进行梯度PCR,扩增得到PGK表达单元,然后将PGK表达单元与T载体连接,转化大肠杆菌DH5α,从转化平板上挑取4个单菌落于LB液体培养基中,过夜振荡培养,然后通过菌液PCR鉴定阳性转化子,随后提取阳性转化子的质粒,进一步进行双酶切鉴定。
用Ⅰ和Ⅰ酶切PGK表达单元,再将酶切后的PGK表达单元与经过相同内切酶酶切的载体pNK1-TPI连接,构建得到载体pNK1-PGK。
1.2.2 表达载体pNK1-PGK-GFP和pNK1-PGK-10× rolGLP-1的构建
使用限制性内切酶HⅠ和Ⅱ酶切载体pMD-T-GFP,回收得到GFP编码序列,然后将其与经过HⅠ酶切的pNK1-PGK连接,转化大肠杆菌DH5α,从转化平板上挑取6个单菌落于LB液体培养基中,过夜振荡培养,然后通过菌液PCR鉴定阳性转化子,随后提取阳性转化子的质粒,进一步进行双酶切鉴定,筛选出正向连接的表达载体pNK1-PGK-GFP。
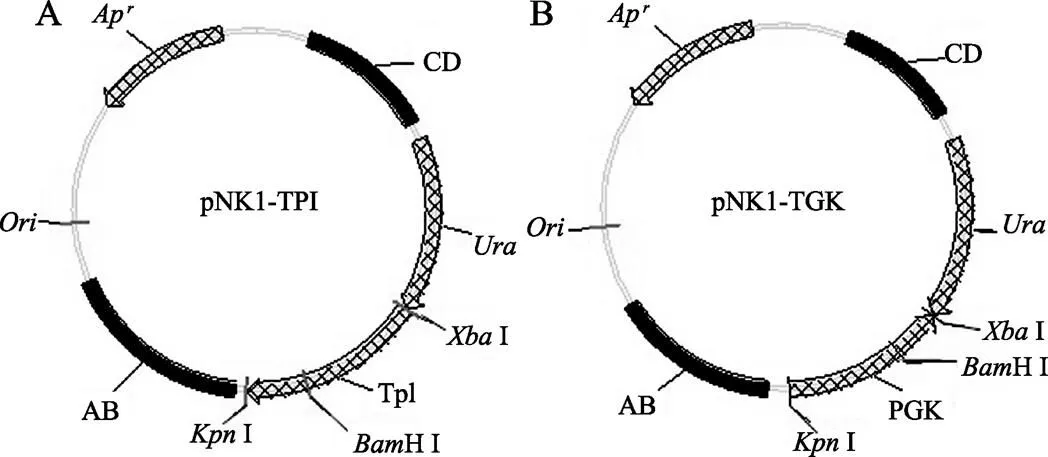
图1 表达载体pNK1的结构图谱
A:pNK1-TPI载体结构图谱;B:pNK1-PGK载体结构图谱。
同样,使用HⅠ酶切载体pMD-T-10×GLP-1,回收得到10×GLP-1编码序列,然后将其与经过HⅠ酶切的pNK1-PGK连接,转化大肠杆菌DH5a,从转化平板上挑取6个单菌落于LB液体培养基中,过夜振荡培养,然后通过菌液PCR鉴定阳性转化子,随后提取阳性转化子的质粒,进一步进行双酶切鉴定,筛选出正向连接的表达载体pNK1-PGK- 10×GLP-1。
1.2.3 大肠杆菌的转化
使用CaCl2制备感受态大肠杆菌细胞并转化,具体步骤见参考文献[9]。
1.2.4 酿酒酵母的转化和重组蛋白的检测
酿酒酵母INVSc1感受态的制备和转化使用醋酸锂转化法,具体方法见参考文献[10]。pNK1-PGK- 10´rolGLP-1转化酿酒酵母INVSc1,使用尿嘧啶缺陷型固体培养基筛选转化子,转化3~4 d后平板上长出菌落,挑取单菌落到液体筛选培养基中30℃、200 r/min培养24~48 h,然后接种到YPD培养基中培养24~48 h,离心收集20 mg左右的菌体,用酵母裂解液处理后,吸取20 μL裂解液进行SDS-PAGE,用GLP-1抗体通过Western blotting检测不同酵母转化子中10´rolGLP-1的表达情况[11]。
1.2.5 稳定性检测
酿酒酵母的代时为1~3 h[12]。INVSc1作为一种快速增长的酿酒酵母,其代时约为120 min,即每24 h约为10代,参照以上标准,将新构建的长效促胰岛素降糖酵母168(laGLP-1 hypoglycemic yeast,LHY168)接种于YPD培养基中,每隔2 d转接新鲜培养基。每隔24 h取样,稀释后涂布YPD固体培养基,待菌落长出后,随机挑取同一菌落分别点种于YPD固体培养基和尿嘧啶缺陷筛选培养基,30℃培养,观察两个平板上菌落的生长情况,计算未丢失外源基因的酵母菌落数占总菌落数的百分比。按照相同方法每隔24 h挑取一次,共挑取5次。
1.2.6 疗效学研究
对C57BL/6小鼠采用链脲佐菌素(STZ)和高脂高糖饮食联合诱导的方法构建2型糖尿病小鼠模型[13],然后分组并进行治疗。治疗方案如下:正常组(8只),口服1 mL生理盐水/d;药物治疗组(6只),口服300 mg二甲双胍/kg/d;阴性对照组(6只),口服1 mL生理盐水/d;非重组酵母饲喂组(6只),口服6 g非重组酵母/kg/d;重组酵母饲喂组(6只),口服6 g重组酵母/kg/d(约9.36 mg rolGLP-1/kg/d)。连续口服治疗16 d,期间每隔一段时间测量小鼠的体重、摄食量、饮水量和血糖水平。
1.2.7 MTT法检测rolGLP-1对细胞活性的影响
将细胞分为调零对照组(Blank)、空白对照组(PBS)、阴性对照组(200 μmol/L 30% H2O2)、阳性对照组(1 μmol/L BSA)、实验组1(1 nmol/L rolGLP-1)、实验组2(500 nmol/L rolGLP-1)和实验组3(1 μmol/L rolGLP-1),每组5孔细胞。除了Blank组,其余各组按照1.2×105细胞/mL密度接种细胞到96孔板中,培养至细胞数目达到2.4×104细胞/孔(200 μL),每孔加入不同剂量的相应处理物质10 μL,继续培养24 h。然后每孔加20 μL MTT溶液,在细胞培养箱内继续孵育4~6 h后,每孔加入100 μL DMSO,再在细胞培养箱内继续孵育直至在普通光学显微镜下观察发现蓝紫色结晶甲瓒(Formazan)全部溶解。使用酶标仪在570 nm测定吸光度。
1.2.8 细胞计数法检测rolGLP-1对细胞活性的影响
将细胞分为空白对照组(PBS)、阴性对照组(200 μmol/L 30% H2O2)、阳性对照组(1 μmol/L BSA)、实验组1(1 nmol/L rolGLP-1)、实验组2(500 nmol/L rolGLP-1)和实验组3(1 μmol/L rolGLP-1),每组3孔细胞,各按照1.2×105细胞/mL密度接种细胞到96孔板中,培养至细胞数目达到2.4×104细胞/孔(200 μL),每孔加入不同剂量的相应处理物质10 μL,继续培养24 h。然后吸去培养基用DMEM洗一遍,Trypsin 37℃消化15 min,每孔约加20 μL台昐蓝(Trypan Blue)染色,显微镜下观察细胞并用血球计数板计数。
1.2.9 统计学方法
各组实验数据以平均数±标准误差(Mean±SE) 计量,数据采用SPSS V13.0 统计软件进行分析,组间差异采用检验分析。
2 结果与分析
2.1 表达载体pNK1-PGK的构建与功能检测
2.1.1 PGK表达单元的克隆
以质粒YEpPGK为模板,PCR扩增PGK表达单元(约1000 bp),结果如图2A所示,不同复性温度均能扩增出1000 bp左右的特异性条带,但综合考虑,选取55℃作为扩增PGK表达单元的最佳复性温度。将PCR扩增得到的PGK表达单元与T载体连接,菌液PCR鉴定结果如图2B所示,只有4号泳道样品扩增出1000 bp左右的特异性条带,初步鉴定为阳性转化子。提取4号样品质粒,进一步进行双酶切鉴定,双酶切产物通过1%琼脂糖凝胶电泳检测(图2C),酶切得到1000 bp左右的特异性条带,对样品进行测序,结果证明序列完全正确,说明已经成功克隆了PGK表达单元,并将其插入T载体中,构建了pMD-T-PGK载体。
2.1.2 表达载体pNK1-PGK的构建
菌液PCR鉴定构建的pNK1-PGK如图2D所示,2、3、4、6和7号泳道样品分别扩增出1000 bp左右的特异性条带,初步鉴定成功构建了pNK1-PGK。提取4个样品质粒,进一步进行双酶切鉴定并通过1%琼脂糖凝胶电泳检测,结果如图2E所示,2、3、5、7、9号泳道5个样品酶切得到1000 bp左右的特异性条带,说明已经成功构建了表达载体pNK1-PGK。
2.1.3 表达载体pNK1-PGK的功能检测
首先构建表达载体pNK1-PGK-GFP,菌液PCR鉴定结果如图2F所示,6个样品都扩增出700 bp左右的特异性条带,初步鉴定为阳性转化子。随机选取4个样品提取质粒,进一步进行双酶切鉴定,结果如图2G所示,2号和4号泳道样品酶切得到700 bp左右的特异性条带,为正向连接,3号和5号泳道样品酶切得到1400 bp左右的条带,为反向连接。将正向连接的载体pNK1-PGK-GFP转化入酿酒酵母INVSc1,用荧光显微镜观察GFP表达情况,结果如图2H所示。可以看出,重组酿酒酵母在紫外激发光下可发出不同强度的绿色荧光,说明pNK1-PGK表达载体在酿酒酵母细胞内能够正常行使功能,可以用于异源蛋白的表达。
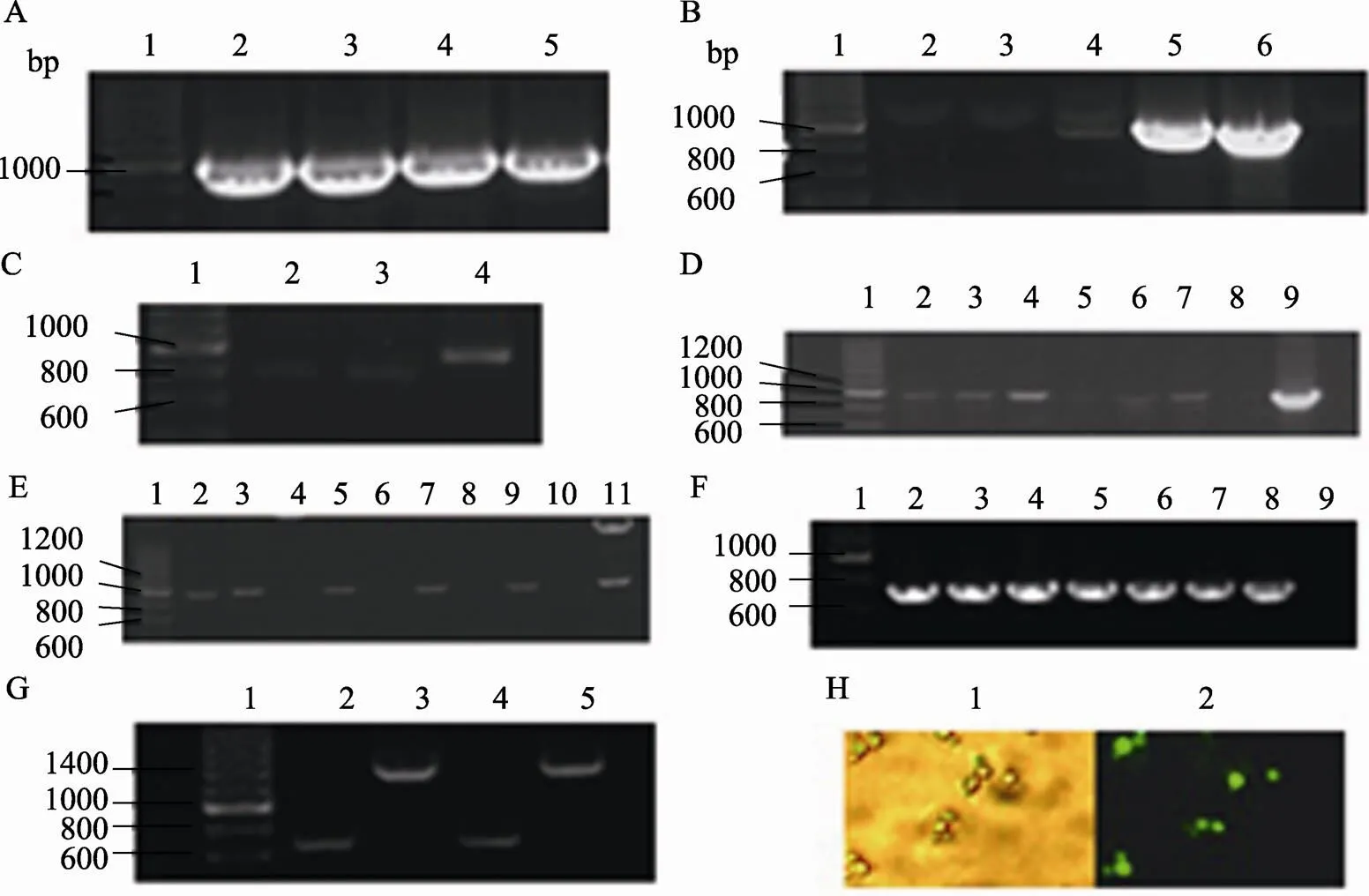
图2 表达单元克隆、表达载体构建及功能检测结果
A:PGK表达单元梯度PCR产物琼脂糖电泳结果。泳道1: 200 bp DNA Marker;泳道2~5:不同复性温度的PCR产物。B:pMD-T-PGK菌液PCR鉴定结果。泳道1:200 bp DNA Marker;泳道2~5:样品1、2、3、4菌液PCR产物;泳道6:阳性对照。C:pMD-T-PGK双酶切鉴定结果。泳道1:200 bp DNA Marker;泳道2~4:pMD-T-PGK双酶切产物。D:pNK1-PGK菌液PCR鉴定结果。泳道1:200 bp DNA Marker;泳道2~7:1~6号样品菌液PCR产物;泳道8:阴性对照;泳道9:阳性对照。E:pNN1-PGK酶切鉴定结果。泳道1:200 bp DNA Marker;泳道2、3、5、7、9:质粒酶切产物;泳道4、6、8、10:质粒对照;泳道11:阳性对照。F:pNK1-PGK-GFP的菌液PCR鉴定结果。泳道1:200 bp DNA Marker;泳道2~7:1~6号样品菌液PCR产物;泳道8:阳性对照;泳道9:阴性对照。G:pNK1-PGK-GFP双酶切鉴定结果。泳道1:200 bp DNA Marker;泳道2~5:载体pNK1-PGK-GFP酶切产物。H:转入pNK1-PGK-GFP的重组酵母在白光和紫外激发光下的显微照相结果。1:白光照射下的重组酵母;2:紫外光照射下的重组酵母。
2.2 长效促胰岛素降糖酵母(LHY)的构建和筛选
2.2.1 表达载体pNK1-PGK-10´GLP-1的构建
表达载体pNK1-PGK-10´GLP-1菌液PCR鉴定结果如图3A所示,1~4号样品扩增出1000 bp左右的特异性条带,初步鉴定为阳性转化子。分别提取4个样品的质粒,进一步进行酶切鉴定,结果如图3B所示,3号泳道的1号样品酶切得到700 bp左右的特异性条带,为正向连接,4号泳道的2号样品酶切得到1700 bp左右的条带,为反向连接,选取正向连接的载体进行下一步的实验研究。
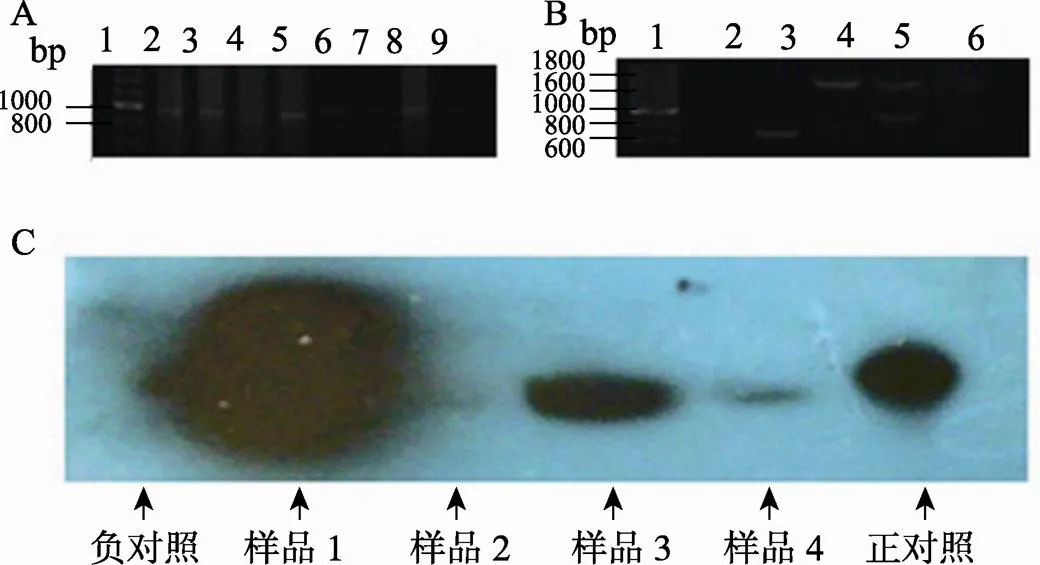
图3 表达载体pNK1-PGK-10´GLP-1的构建、鉴定及转化子筛选结果
A:pNK1-PGK-10´GLP-1的菌液PCR鉴定结果。泳道1:200 bp DNA Marker;泳道2~7:1~6号样品的菌液PCR产物;泳道8:阳性对照;泳道9:阴性对照。B:pNK1-PGK-10´GLP-1酶切鉴定结果。泳道1:200 bp DNA Marker;泳道3~6:1~4号样品酶切产物。C:重组酿酒酵母的GLP-1抗体Western blotting检测结果。负对照:未转化载体pNK1-PGK-10GLP-1的酿酒酵母裂解物;样品1~4:转化载体pNK1-PGK-10GLP-1的重组酿酒酵母裂解物;正对照:10´GLP-1纯化样品。
2.2.2 10´rolGLP-1重组酵母的筛选
Western blotting检测结果如图3C所示,样品1、3和4中均有10´GLP-1表达,说明本研究成功筛选到了能够表达10´GLP-1的重组酿酒酵母,其中样品1表达量较高,将其命名为长效促胰岛素降糖酵母168(laGLP-1 hypoglycemic yeast, LHY168),用于下一步的实验研究。
遗传稳定性检测结果如表1所示,10´GLP-1已经整合到了酿酒酵母基因组中,外源基因保存率100%,可以进行稳定的遗传。
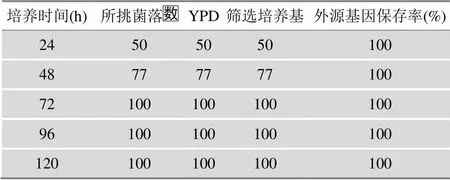
表1 重组酿酒酵母稳定性实验结果
将长效促胰岛素降糖酵母LHY168按照1:100的比例接种于100 mL YPD液体培养基中,每隔8 h取样测量600,绘制LHY168的生长曲线,结果表明LHY168的生长状况良好,其生长曲线与非重组酵母的生长曲线基本一致(图略),表明GLP-1基因的引入未影响酵母的正常生长和功能。
使用酵母裂解液裂解重组酿酒酵母LHY168,提取胞内蛋白,然后使用ELISA双抗体夹心法测量GLP-1的表达量,从标准曲线(图略)测得长效促胰岛素GLP-1的表达量为1.56 mg/g细胞湿重。
2.3 长效促胰岛素降糖酵母(LHY)对2型糖尿病小鼠的治疗作用
2.3.1 2型糖尿病小鼠模型的构建
本研究采用高脂高糖饮食联合注射STZ的方法诱导小鼠成2型糖尿病模型,给小鼠连续注射3次STZ以后,小鼠体重发生了明显变化,如图4A所示。正常组小鼠体重从造模前的24.9±1.48 g增加到25.85±1.67 g,增加不明显,而糖尿病组小鼠体重从造模前的26.66±2.12 g降低到24.84±1.72 g(<0.05),下降了6.82%。
造模前后小鼠的摄食量也发生了明显变化,如图4B所示。正常组小鼠摄食量,由原来每天的3.12±0.1 g/d增加到3.84±0.7 g/d,摄食量增加不明显,无统计学意义;糖尿病组的小鼠的摄食量也由原来的3.89±0.1 g/d增加到5.66±0.1 g/d (<0.05),增加了45.5%,相比之下糖尿病组小鼠的摄食量显著高于对照组(<0.01),大约提高47.4%。
造模后小鼠饮水量也发生了变化,如图4C所示。正常组小鼠的饮水量由造模前的3.8±0.3 mL/d增加到5.21±0.5 mL/d,无明显差异。糖尿病组小鼠饮水量由造模前的3.39±0.3 mL/d明显增加到9.08± 0.5 mL/d (<0.01),增加了167.85%,增加显著。并且糖尿病组小鼠的饮水量显著高于正常组小鼠(<0.01)。造模后小鼠的血糖明显升高,如图4D所示。正常组小鼠血糖值一直维持在3.6±0.4 mmol/L,没有明显变化。而造模后,糖尿病组小鼠血糖值为20.1± 6.4 mmol/L,明显高于造模前小鼠的血糖水平。造模后小鼠摄食、饮水上升,体重下降,并且血糖升高,超过了11.0 mmol/L,符合2型糖尿病模型的要求,证明2型糖尿病小鼠模型建造成功。
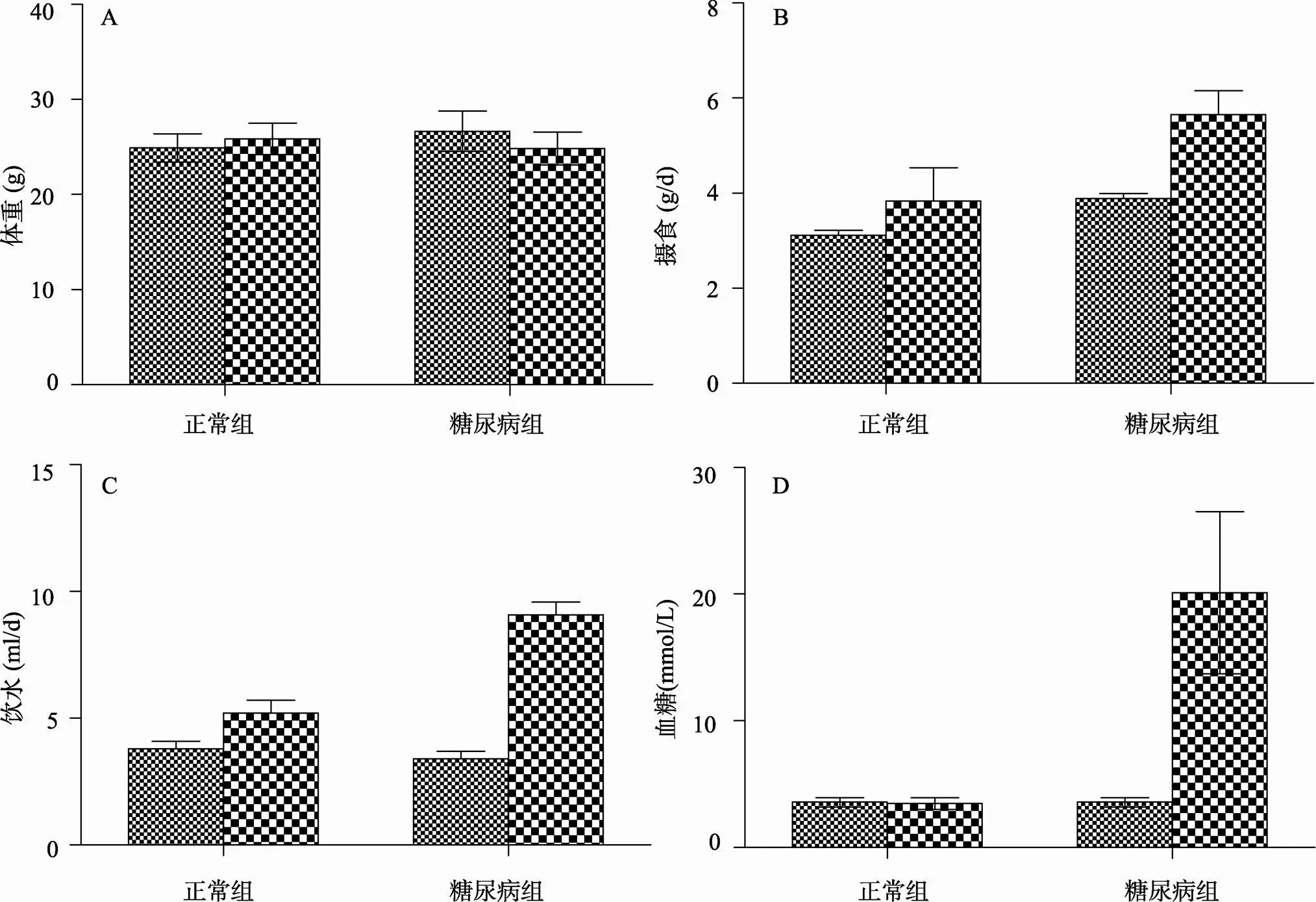
图4 造模前后小鼠各项指标的变化
A:体重;B:摄食量;C:饮水量;D:血糖。造模前;造模后。
2.3.2 长效促胰岛素降糖酵母(LHY)对2型糖尿病的疗效
小鼠在治疗过程中摄食量的变化如图5A所示。正常组小鼠饮食基本保持不变,阴性对照组和非重组酵母治疗组小鼠的摄食量有所下降,但下降幅度较小,药物治疗组和重组酵母治疗组小鼠的摄食量在治疗7 d后呈现明显的下降,并且在之后的治疗中一直维持较低的水平,这说明对于摄食的控制,LHY可以达到与糖尿病治疗对照药物相同的效果。
治疗过程中小鼠饮水量的变化如图5B所示。正常组小鼠饮水基本保持稳定,阴性对照组小鼠的饮水量呈上升趋势,非重组酵母治疗组小鼠的饮水量无明显规律,但一直保持在较高的水平,超过了15 mL/d,药物治疗组和重组酵母治疗组小鼠的饮水量呈现稳中有降的趋势,接近正常组小鼠的饮水量。这说明LHY可以改善糖尿病小鼠的高饮水量症状。
随着治疗时间的延长,小鼠的体重也发生了变化,如图5C所示。正常组的小鼠体重随年龄的增长有所增加,但是增加不明显,而阴性对照组和非重组酵母治疗对照组小鼠体重一直存在下降趋势,而阳性药和重组酵母治疗组小鼠体重呈上升趋势,但在统计学上无显著差异,这在一定程度上说明了本研究构建的LHY对糖尿病有一定的疗效,可以阻止糖尿病小鼠体重的减轻。

图5 治疗前后小鼠各项指标的变化
A:摄食量;B:饮水量;C:体重;D:血糖水平。1:正常组;2:药物治疗组;3:阴性对照组;4:非重组酵母对照组;5:重组酵母治疗组。
经过16 d的治疗后,小鼠血糖的变化如图5D所示。正常组小鼠的血糖水平基本保持稳定,阴性对照组和非重组酵母治疗组小鼠的血糖表现出显著的上升,而药物治疗组和重组酵母治疗组小鼠的血糖比对照组显著下降,但未恢复到正常水平。综上所述,本研究构建的长效促胰岛素降糖酵母(LHY)对糖尿病小鼠的体重、摄食、饮水和血糖都有明显的改善作用。
2.4 重组rolGLP-1对细胞活性的影响
本研究使用在大肠杆菌中表达纯化得到的rolGLP-1处理SH-sy5y细胞,然后通过MTT法和细胞计数法检测细胞增殖情况,结果如图6所示。可以看到,经过不同浓度rolGLP-1处理后的细胞数目比对照组明显增多,说明rolGLP-1能够促进细胞增殖,具有良好的细胞生理活性。
3 讨 论
本文成功构建了酿酒酵母整合型高效表达载体pNK1-PGK,并且通过表达绿色荧光蛋白(GFP)证明其表达功能正常(图1,图2),随后使用该载体将GLP-1基因转化到酿酒酵母INVSC1中,通过营养缺陷型和Western blotting成功筛选出了表达10´GLP-1的长效促胰岛素降糖酵母(LHY)(图3),其生长迅速,表达稳定(表1),表达量达到了1.56 mg/g细胞湿重。通过链脲佐菌素(STZ)和高脂高糖饮食联合诱导的方法构建了2型糖尿病小鼠模型(图4),使用长效促胰岛素降糖酵母(LHY)对其进行口服灌胃治疗,发现其具有较好疗效,治疗后血糖水平明显降低(图5)。同时,利用在生理环境下,GLP-1通过与细胞表面的GLP-1受体(GLP-1R)相互作用,激活胞内cAMP-蛋白激酶A信号通路和PI3K信号通路,从而促进细胞增殖和抑制细胞凋亡的功能,本文使用可以在细胞表面表达GLP-1R的SH-sy5y研究重组GLP-1的相关活性,得到良好结果(图6)[14]。
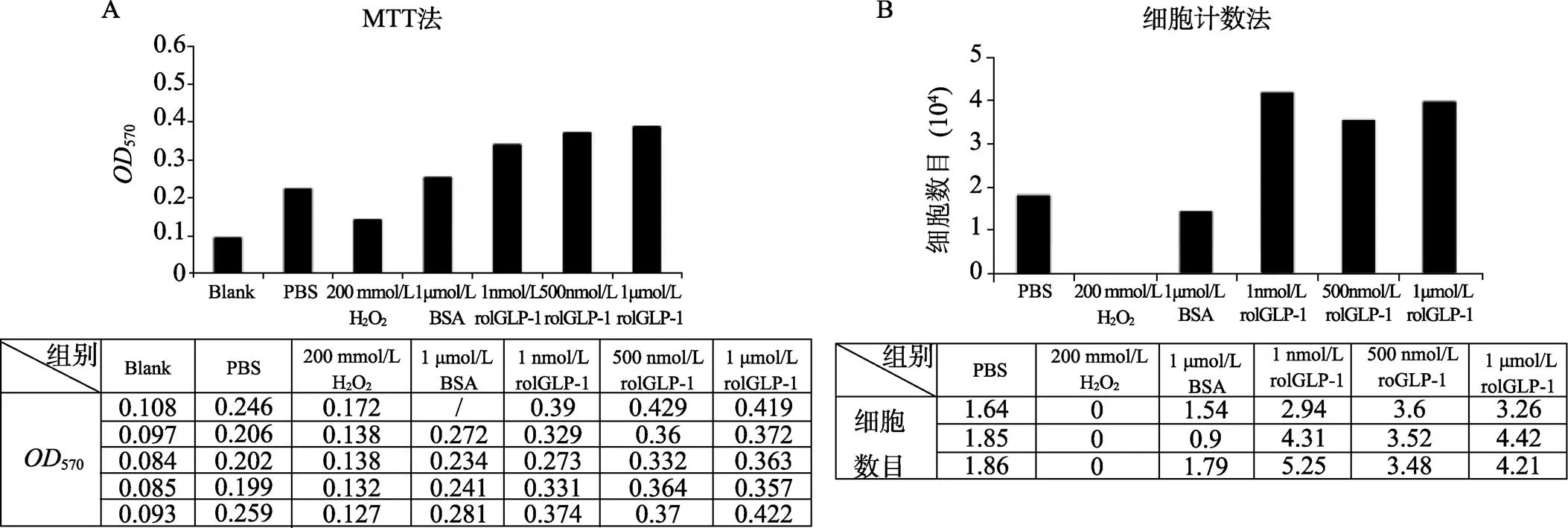
图6 rolGLP-1对细胞活性影响的检测结果
A:细胞经过不同浓度rolGLP-1处理后MTT检测结果;B:细胞经过不同浓度rolGLP-1处理后的细胞计数结果。
随着糖尿病等慢性疾病的流行和快速发展,人们投入了越来越多的物力和财力开发有效治疗糖尿病的药物。GLP-1作为一种新型的生物药物,与目前使用的一些化学类药物相比,其能够从多个方面调节人体内的血糖平衡,对糖尿病起到一个综合的治疗作用,并且其能够抑制胰腺β细胞的凋亡,促进胰腺β细胞的增殖和分化,恢复胰腺功能,在“治标”的同时达到“治本”的效果。
目前,用益生菌活细胞作为缓释“胶囊”的新型给药系统悄然兴起,给糖尿病患者带来了康复希望。酿酒酵母是一种食用最为安全的益生菌,其本身富含维生素、消化酶,能调节肠胃功能并对消化酶降解具有一定抵抗作用,从而对其内容物起到缓释“胶囊”的作用[6]。本研究构建的长效促胰岛素降糖酵母(LHY) 采用整合型表达载体pNK1-PGK将10´GLP-1基因整合到酿酒酵母基因组,使其成为酿酒酵母基因组的一部分,像自身基因一样稳定表达长效促胰岛素(表1)起到降糖作用,并且其本身富含维生素、消化酶,能调节肠胃功能。与目前上市的艾塞那肽(Exendin4)、利拉鲁肽(Liraglutide)等药物相比,虽然用药量较大,但其口服给药方便,避免了长期打针注药的痛苦,无需分离纯化有效成分,易于制备,是一种简便、经济、实用型较为理想的糖尿病治疗药物。但是,对其药物代谢动力学、安全性及人体用药量等方面尚需进一步深入研究。
[1] International Diabetes Federation. IDF diabetes atlas. 6th ed. Brussels, Belgium: International Diabetes Federation, 2013.
[2] Yang WY, Lu JM, Weng JP, Jia WP, Ji LN, Xiao JZ, Shan ZY, Liu J, Tian HM, Ji QH, Zhu DL, Ge JP, Lin XL, Chen L, Guo XH, Zhao ZG, Li Q, Zhou ZZ, Shan GL, He J, China National Diabetes and Metabolic Disorders Study Group. Prevalence of diabetes among men and women in China., 2010, 362(25): 1090–1101.
[3] Laurie LB, Daniel JD. Biology of incretins: GLP-1 and GIP., 2007, 132(6): 2131–2157.
[4] Hou JH, Yan RX, Ding DF, Yang LQ, Wang CY, Wu ZQ, Yu XJ, Li WD, Li MG. Oral administration of a fusion protein containing eight GLP-1analogues produced inBL21(DE3) in streptozotocin- induced diabetic rats., 2007, 29(10): 1439–1446.
[5] Hou JH, Yan RX, Yang LQ, Wu ZQ, Wang CY, Ding DF, Li N, Ma CX, Li MG. High-level expression of fusion protein containing 10 tandem repeated GLP-1 analogs in yeastand its biological activity in a diabetic rat model., 2007, 71(6): 1462 -1469.
[6] Wu ZQ, Jia NB, Li N, Ma BC, Li MG. Construction ofstrain stably expressing a fusion protein containing ten tandem recombinant human glucagon-like peptide-1 analogues., 2009, 25(6): 882–886.
[7] Ma B, Tu P, Zhao X, Zhang Y, Wang Y, Ma C, Ji Y, Li X,Abbas SA, Li M. Expression and purification of optimized rolGLP-1, a novel GLP-1 analog, inBL21(DE3) and its good glucoregulatory effect on type 2 diabetic mice., 2013, 14(11): 985–994.
[8] 武志强, 贾耐兵, 李娜, 王瑞菊, 马百成, 王翠艳, 李明刚. 酵母整合型载体的构建及其功能分析. 生物学通报, 2008, 43(5): 47–50.
[9] Sambrook J, Russell DW, 黄培堂译. 分子克隆实验指南(第三版). 北京: 科学出版社, 2002.
[10] Amberg DC, 霍克克译. 酵母遗传学方法实验指南(第二版). 北京: 科学出版社, 2009.
[11] Yin X, Wei D, Yi L, Tao X, Ma Y. Expression and purification of exendin-4, a GLP-1 receptor agonist, in., 2005, 41(2): 259–265.
[12] Lopes TS, de Wijs IJ, Steenhauer SI, Verbakel I, Planta RJ. Factors affecting the mitotic stability of high-copy-number integration into the ribosomal DNA of., 1996, 12(5): 467–477.
[13] Okamoto T, Kanemoto N, Ohbuchi Y, Okano M, Fukui H, Sudo T. Characterization of STZ-induced type 2 diabetes in Zucker fatty rats., 2008, 57(4): 335–345.
[14] Li Y, Tweedie D, Mattson MP, Holloway HW, Greig NH. Enhancing the GLP-1 receptor signaling pathway leads to proliferation and neuroprotection in human neuroblastoma cells., 2010, 113(6): 1621–1631.
(责任编委: 吕红)
Construction of yeast strains expressing long-acting glucagon-like peptide-1 (GLP-1) and their therapeutic effects on type 2 diabetes mellitus mouse model
Ri Wu1, Chao Ma1, Xiaodan Li1, Huikun Duan1, Yanli Ji1, Yu Wang1, Pingzhe Jiang1, Haisong Wang1, Peipei Tu1, Miao Li1, Ganggang Ni1, Baicheng Ma2, Minggang Li1
Probiotics, i.e., bacteria expressing therapeutic peptides (protein), are used as a new type of orally administrated biologic drugs to treat diseases. To develop yeast strains which could effectively prevent and treat type 2 diabetes mellitus, we firstly constructed the yeast integrating plasmid pNK1-PGK which could successfully express green fluorescent protein (GFP) in. The gene encoding ten tandem repeats of glucagon-like peptide-1() was cloned into the vector pNK1-PGK and the resulting plasmids were then transformed into theINVSc1. The long-acting GLP-1 hypoglycemic yeast (LHY) which grows rapidly and expresses 10×GLP-1 stably was selected by nutrition screening and Western blotting. The amount of 10×GLP-1 produced by LHY reached 1.56 mg per gram of wet cells. Moreover, the oral administration of LHY significantly reduced blood glucose level in type 2 diabetic mice induced by streptozotocin plus high fat and high sugar diet.
type 2 diabetes mellitus; glucagon-like peptide-1(GLP-1); long-acting GLP-1 hypoglycemic yeast (LHY); recombinant yeast; mouse model of type 2 diabetes mellitus
2014-06-25;
2014-12-03
天津市科技支撑重点计划项目(编号:14ZCZDSY00013)资助
吴日,教育部公派访问学者,金日成综合大学平壤医学院副教授。E-mail: tj20110901@163.com马超,硕士研究生,专业方向:生物技术与新药。E-mail: mac1002@outlook.com吴日和马超并列第一作者。
李明刚,教授,博士生导师,研究方向:生物技术与新药。E-mail: mgl@nankai.edu.cn
10.16288/j.yczz.14-206
网络出版时间: 2014-12-30 9:41:59
URL: http://www.cnki.net/kcms/detail/11.1913.R.20141230.0941.001.html

