高原藏族胃癌患者缺氧诱导因子-1a及缺氧诱导因子-2a表达水平及其作用机制的研究*
刘晓丽,刘科,朱敏侠
(1.西藏民族大学生命科学基础实验室,陕西 咸阳 712082;2.西藏军区总医院普通外科,西藏 拉萨 850000)
·临床论著·
高原藏族胃癌患者缺氧诱导因子-1a及缺氧诱导因子-2a表达水平及其作用机制的研究*
刘晓丽1,刘科2,朱敏侠1
(1.西藏民族大学生命科学基础实验室,陕西 咸阳 712082;2.西藏军区总医院普通外科,西藏 拉萨 850000)
目的研究缺氧诱导因子-1a(HIF-1a)及缺氧诱导因子-2a(HIF-2a)在高原藏族胃癌患者组织中的表达水平,并探索两者对下游靶基因血管内皮生长因子(VEGF)影响的分子机制。方法采用实时定量PCR的方法对比胃癌患者癌组织及癌旁组织中HIF-1a、HIF-2a的差异表达,并探讨两者与临床分期的相关性。对胃腺癌细胞SGC7901中HIF-1a、HIF-2a分别进行小RNA干扰后,利用RT-PCR法检测VEGF的表达水平以及利用CCK-8方法检测细胞的增殖情况。结果胃癌患者组织中表达HIF-1a、HIF-2a的mRNA水平显著高于癌旁组织,差异有统计学意义(P<0.05);胃癌患者组织中表达HIF-1a的mRNA水平与胃癌的临床分期显著正相关(P<0.05),而胃癌组织中HIF-2a的mRNA水平与胃癌的临床分期无显著相关性(P>0.05);胃癌细胞中低表达HIF-1a后,VEGF的表达水平以及细胞的增殖水平均显著降低(P<0.05),而低表达HIF-2a后,VEGF的mRNA表达水平以及细胞的增殖水平均无显著变化(P>0.05)。结论HIF-1a对于高原藏族胃癌的形成具有促进作用,可能与促进VEGF表达及癌细胞增殖功能密切相关。
HIF-1a;HIF-2a;胃癌;VEGF
胃癌(gastric cancer)是消化系统高发病率的恶性肿瘤之一,发病率和病死率呈逐年上升趋势,且显著高于前列腺癌、乳腺癌和结肠癌等其他实体瘤。胃癌因早期隐匿性强,约60%~70%患者确诊即为中晚期,而这些患者外科手术和抗肿瘤治疗未能明显地改善胃癌的不良预后,5年生存率仅为5%~17%[1]。因此,早发现、早诊断、早治疗是目前胃癌治疗方面急需解决的临床难题。高原地区也是我国胃癌高发地区之一,其胃癌病死率居全国之首,达40.62/10万[2]。藏族是在高原生活的特有少数民族,其机体在高原环境适应过程中形成了特有的免疫体系。低氧既是高原环境下的一种重要的环境因子,也是一种主要的刺激原,机体对低氧的应激反应异常是导致各种高原适应不全和高原疾病的重要原因。研究认为,低氧诱导因子-1(hypoxia-inducible fac tor 1,HIF-1)是目前发现的唯一一个高度特异性的,在缺氧状态下可以发挥活性的核转录因子,是专一调节氧稳态的关键性介质[3-4]。目前,HIF-1在高原胃癌患者中的表达情况及其机制的相关研究尚少报道。本研究通过观察HIF家族两个亚型——HIF-1a及HIF-2a在高原藏族胃癌患者组织中的表达水平,同时分析两者与胃癌临床分期的关系,并探讨其对癌细胞增殖的影响,以期为高原胃癌基础研究及临床治疗提供研究依据。
1 材料与方法
1.1 患者标本
所有组织来源于2013年12月-2015年3月期间来西藏军区总医院行胃癌手术的84例藏族患者的肿瘤组织标本,同时取癌旁组织(距离癌组织大约5 cm)。其中男49例,女35例,年龄45~78岁,平均(62.11±9.97)岁,术前未做过任何放疗及化疗。
1.2 实验材料与试剂
不完全DMEM低糖培养基以及胎牛血清(FBS)购自Gibco公司(美国),Trizol试剂盒购自英骏公司(上海),cDNA逆转录试剂盒购于Femantes公司(美国),PCR试剂盒、DNA Marker、DEPC、青霉素与链霉素(PS双抗)均购于南京生兴生化科技有限公司。
1.3 细胞转染
采用脂质体LipofectamineTM2000对胃癌细胞SGC7901转染siRNA-HIF-1a、siRNA-HIF-2a以及HIF-1a、HIF-2a过表达质粒(上海吉玛公司)。分为3组:空位组、对照组(加入乱序序列)、实验组(分别加入HIF-1a或者HIF-2a的siRNA靶向序列)。HIF-1a的siRNA靶向序列为5'-TACGTTGTGAGTGGTAT TATT;HIF-2a的siRNA靶向序列为5'-CCCGGATA GACTTATTGCCAA[5];对照序列为5'-AATTCTCCGA ACGTGTCACGT。用RT-PCR技术验证转染效率。
1.4 细胞总RNA提取及逆转录反应
细胞转染48 h后,收集胃癌细胞,加入1 ml Trizol后,按照说明书的要求抽提总RNA,所得RNA溶于30 ml DEPC处理水。提取的总RNA经紫外分光光度计(NanoDrop ND-1000)进行定量及检测纯度。对所得RNA进一步采用Thermo逆转录试剂盒逆转录成cDNA。本实验使用美国ABI公司的7300型号Real-time PCR仪器进行扩增,PCR反应条件:95℃变性20 s,然后60℃20 s和70℃1 s进行40个循环,使用2-ΔΔCt法进行相对定量分析结果。
1.5 CCK-8法检测细胞增殖水平
待SGC7901细胞汇合度达到50%~60%左右,加入转染control和HIF-1a或HIF-2a siRNA,并分别于培养后0、24、48和72 h每孔按1∶10体积比混合完全DMEM和cell counting Kit-8(CCK-8,cell signling,USA),采用分光光度计测定450 nm波长OD值,并制作细胞生长曲线。
1.6 统计学方法
采用SPSS 18.0统计软件进行数据分析,计量资料以均数±标准差±s)表示,组间比较用两独立样本t检验,相关分析用Spearman法,P<0.05为差异有统计学意义。
2 结果
2.1 高原藏族胃癌患者组织中HIF-1a、HIF-2a的mRNA表达水平
与癌旁组织比较,高原藏族胃癌患者组织中HIF-1a与HIF-2a的mRNA水平均显著增加(P<0.05),提示缺氧诱导因子的表达异常可能是参与高原低氧环境下藏族胃癌患者致病的重要因子。
2.2 高原藏族胃癌患者组织中HIF-1a、HIF-2a的mRNA表达水平与胃癌TNM分期的关系
Spearman相关分析结果显示,胃癌组织中HIF-1a的mRNA表达水平与胃癌的TNM分期显著正相关(r=0.657,P<0.05)(见表1),而胃癌组织中HIF-2a的mRNA表达水平与胃癌的TNM分期无显著相关(r=0.312,P>0.05)(见表2),说明HIF-2a与胃癌的临床分期等级无显著相关,而HIF-1a表达越高,胃癌的临床分级越高(见表2)。

表1 引物的序列
表2 高原藏族胃癌患者组织中HIF-1a与HIF-2a的mRNA表达水平(±s)
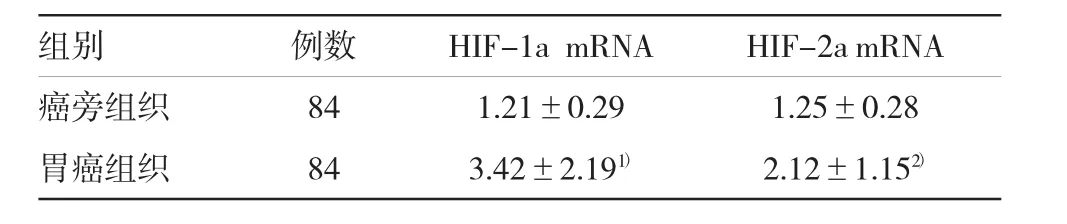
表2 高原藏族胃癌患者组织中HIF-1a与HIF-2a的mRNA表达水平(±s)
注:1)与癌旁组织比较,t=6.74,P<0.05;2)与癌旁组织比较,t= 9.17,P<0.05
组别例数HIF-1a mRNAHIF-2a mRNA癌旁组织841.21±0.291.25±0.28胃癌组织843.42±2.191)2.12±1.152)
2.3 低表达HIF-1a对胃癌细胞增殖水平的影响
与对照组比较,胃癌细胞转染HIF-1a siRNA后,HIF-1a mRNA水平显著降低(见图1A),与对照组比较,干扰HIF-1a后的胃癌细胞的增殖水平显著降低(见图1B),差异有统计学意义(P<0.05)。此外,与对照组比较,干扰HIF-1a后的胃癌细胞中血管内皮生长因子(vascular endothelial growth factor,VEGF)的mRNA水平显著降低(见图1C),差异有统计学意义(P<0.05)。
表3 高原藏族胃癌患者组织中HIF-1a、HIF-2a mRNA水平与胃癌TNM分期关系(±s)

表3 高原藏族胃癌患者组织中HIF-1a、HIF-2a mRNA水平与胃癌TNM分期关系(±s)
注:1)与胃癌的TNM分期比较,r=0.657,P<0.05;2)r=0.312,P>0.05
TNM分级例数胃癌组织(HIF-1a)胃癌组织(HIF-2a)Ⅰ253.19±0.412.51±0.36Ⅱ193.71±0.782.46±0.33Ⅲ224.46±0.683.35±0.45Ⅳ185.19±0.791)2.29±0.672)
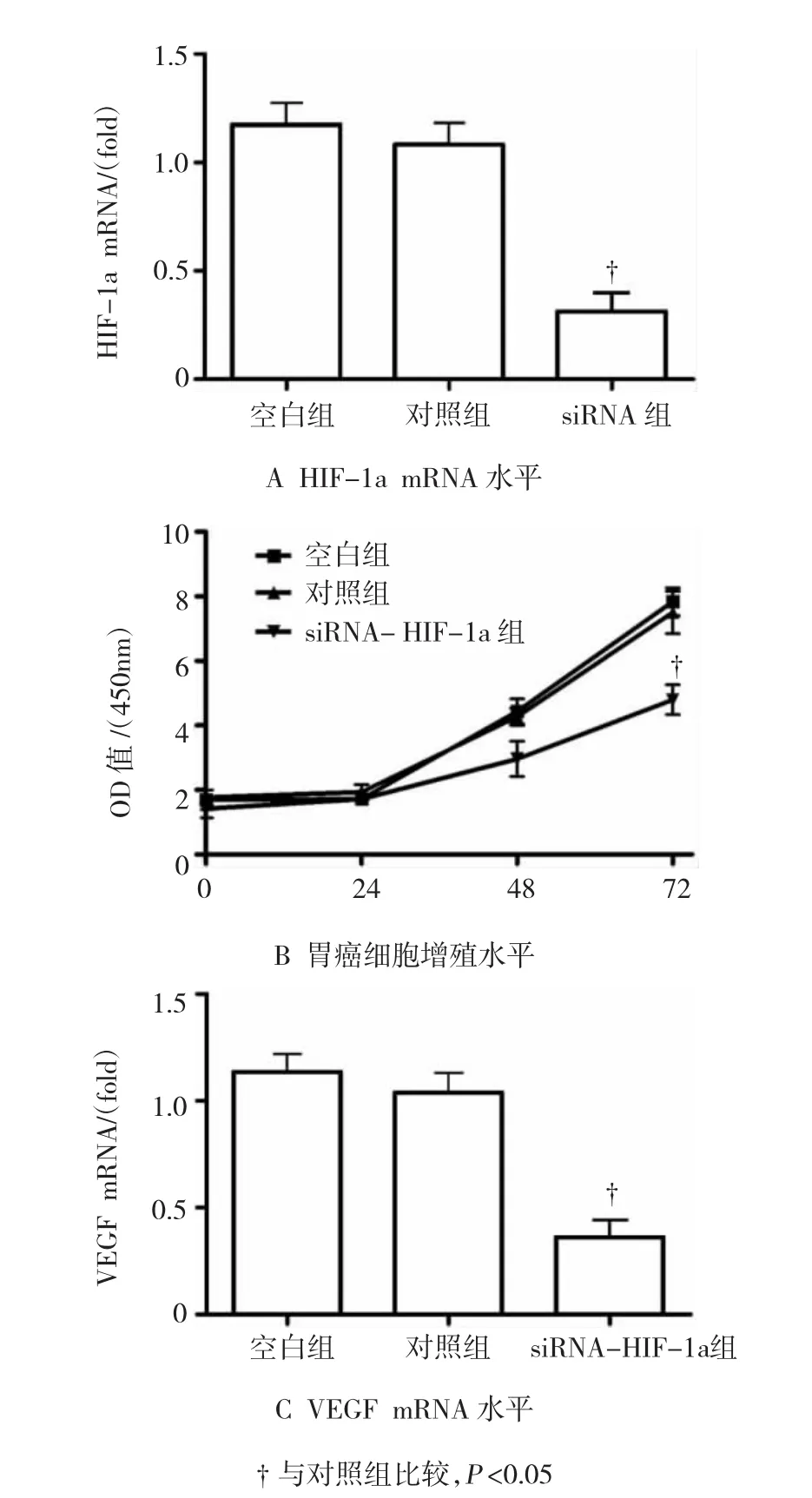
图1 低表达HIF-1a对胃癌细胞增殖水平的影响
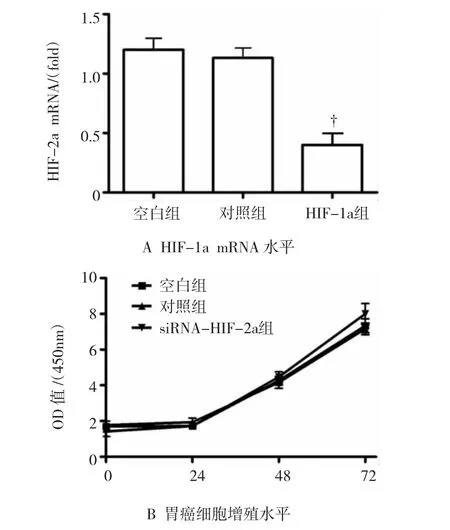
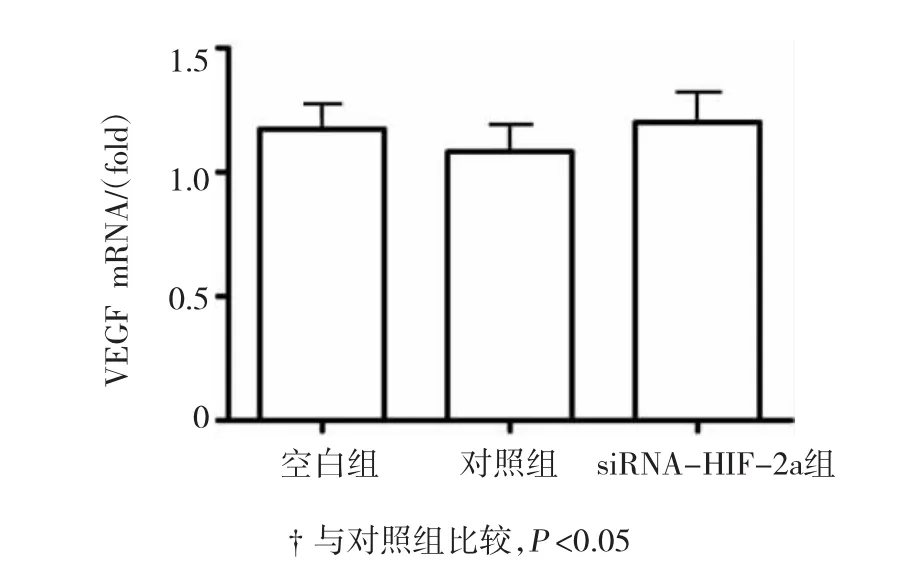
图2 低表达HIF-2a对胃癌细胞增殖水平的影响
2.4 低表达HIF-2a对胃癌细胞增殖水平的影响
与对照组比较,胃癌细胞转染HIF-1a siRNA后,HIF-1a mRNA水平显著降低(见图2A),提示干扰效果成功。与对照组比较,干扰HIF-1a后的胃癌细胞的增殖水平无显著变化(见图2B)(P>0.05),干扰HIF-1a的胃癌细胞中VEGF的mRNA水平亦无显著变化(见图2C)(P>0.05)。
3 讨论
缺氧是实质性肿瘤微环境的基本特征之一,同时也是肿瘤发生恶性转化甚至转移的启动因子。高原地区也是我国胃癌高发地区之一,其胃癌死亡率居全国之首。我国藏族是在高原生活的特有少数民族,其机体在高原环境适应过程中形成特有的免疫体系。高原环境下,低氧是一种环境因子,也是一种主要的刺激原,机体对低氧的应激反应异常是导致各种高原适应不全和高原疾病的重要原因。大量的临床研究均表明,高原环境肿瘤组织中存在的缺氧状态是肿瘤预后不良的重要指标[6]。缺氧首先是通过一种名为缺氧诱导因子的蛋白物质来发挥作用,缺氧诱导因子是可以受缺氧诱导的,并且在缺氧状态下稳定存在[7-9]。研究认为,缺氧诱导因子在肿瘤的发生、发展以及肿瘤的转移中起着核心功能,并在评价肿瘤治疗及预后中发挥重要的作用。
缺氧诱导因子家族中,HIF-1a和HIF-2a是近年来新发现的能结合DNA的蛋白质分子,在多种肿瘤细胞中表达,是缺氧条件下肿瘤细胞产生的核转录因子,并在肿瘤血管生成中起着核心调控作用[10]。研究认为,HIF-1a与以胃癌的浸润程度、淋巴结以及远处转移为依据的临床TNM分期呈正相关,同时与平均生存时间及5年生存率也存在密切相关。其原因主要是由于肿瘤组织的快速生长导致血管紊乱、肿瘤的血液供应能力下降、氧气消耗增加,由于患者处于贫血状态,血红蛋白下降使得血液携氧能力下降,最终导致胃癌的低氧环境[10-11]。然而至今,HIF-1a、HIF-2a在藏族高原胃癌患者这一类低氧环境中特殊人群的潜在作用及其机制尚少了解。
本研究观察我国藏族高原的胃癌患者体内HIF-1a、HIF-2a基因的表达情况,并通过低表达胃癌细胞系中HIF-1a、HIF-2a基因水平后,探讨两者基因修饰对胃癌的发生、发展的影响。结果发现,藏族高原胃癌的患者组织中HIF-1a、HIF-2a基因的表达显著高于癌旁组织,从而初步提示HIF-1a、HIF-2a在高原藏族胃癌患者的发病中可能发挥着重要的作用。原因可能是,在胃癌肿瘤的发生、发展的进程中,造成局部组织缺氧,显著促进HIF-1a、HIF-2a的表达[11-12],而处在缺氧、严寒等环境下的高原,低氧血症是最主要的病生变化,造成机体高表达HIF-1a、HIF-2a[13-14]。但它作为一种原发打击因素或急性持续性地刺激因素成为一种非特异性刺激原,并且用以激活机体内的炎症细胞因子、介质、基因等极端复杂的网络系统,使全身多器官、组织、细胞处于预激状态,而高原胃癌肿瘤在这个特殊环境中,其造成局部组织缺氧可能更加严重,从而可能更加显著地促进HIF-1a、HIF-2a的表达。笔者进一步分析胃癌组织中HIF-1a、HIF-2a的mRNA表达水平与胃癌的TNM分期的关系,结果发现,HIF-1a与胃癌分期显著正相关,而胃癌组织中HIF-2a的mRNA表达水平与胃癌的TNM分期程度无相关,提示了高原胃癌组织中HIF-1a表达越高,胃癌的分期越高,也就说明HIF-1a的高表达与高原胃癌肿瘤的恶性行为及不良的预后有着密切的关系。而高原胃癌组织中HIF-2a与胃癌的分期无显著相关,同时CHEN等人[15]发现胃癌患者发生肝转移的组织中HIF-1a的表达水平显著增加,也从侧面支持本研究的结论。
进一步采用小RNA干扰技术干扰胃癌细胞系中HIF-1a、HIF-2a后发现,低表达HIF-1a的胃癌细胞的增殖水平显著降低,而低表达HIF-2a的胃癌细胞的增殖水平无显著变化,提示HIF-1a可能影响着胃癌细胞的增殖能力,从而提示胃癌细胞中HIF-1a表达水平在胃癌诊断及预后评价中可能有着一定的作用。研究认为,HIF-1a被激活后可以调节多种肿瘤相关的基因,尤其是VEGF等[16-19],从而使细胞对缺氧环境产生应激反应、更好地适应缺氧环境。本研究结果亦发现,低表达HIF-1a的胃癌细胞的VEGF表达水平显著降低,而低表达HIF-2a的胃癌细胞的VEGF表达水平无显著变化,提示HIF-1a可能通过调节VEGF基因参与胃癌的发生、发展。
综上所述,HIF-1a的表达水平在胃癌的发生、进展、浸润、转移等过程中起着重要的作用。胃癌组织中HIF-1a呈高表达,可能的机制是通过调节VEGF以及促进癌细胞的增殖实现的,因此研究高原藏族胃癌患者组织中的HIF-1a的表达水平可能对高原地区胃癌患者诊断、治疗及其预后具有一定的临床意义。
[1]KEIGHLEY MR.Gastrointestinal cancers in Europe[J].Alimentary Pharmacology&Therapeutics,2003,18(3):7-30.
[2]马颖,才熊,杨卫红.青海省胃癌高发区幽门螺杆菌特异蛋白与胃癌的关系[J].临床床荟,2004,6(19):329-330.
[3]CUNINGHAME S,JACKSON R,ZEHBE I.Hypoxia-inducible factor 1 and its role in viral carcinogenesis[J].Virology,2014, 456-457,370-383.
[4]UEDA M,SAJI H.Radiolabeled probes targeting hypoxia-inducible factor-1-active tumor microenvironments[J].The Scientific World Journal,2014,2014:165461.
[5]CARROLL VA,ASHCROFT M.Role of hypoxia-inducible factor (HIF)-1 alpha versus HIF-2 alpha in the regulation of HIF target genes in response to hypoxia,insulin-like growth factor-I,or loss of von Hippel-Lindau function:implications for targeting the HIF pathway[J].Cancer Research,2006,66(12):6264-6270.
[6]SHENBERGER JS,ZHANG L,POWELL RJ,et al.Hyperoxia enhances VEGF release from A549 cells via post-transcriptional processes[J].Free Radical Biology&Medicine,2007,43(5):844-852.
[7]BROGI E,SCHATTEMAN G,WU T,et al.Hypoxia-induced paracrine regulation of vascular endothelial growth factor receptor expression[J].The Journal of Clinical Investigation,1996,97(2): 469-476.
[8]JANSSENHL,HAUSTERMANSKM,SPRONGD,etal. HIF-1a,pimonidazole,and iododeoxyuridine to estimate hypoxia and perfusion in human head-and-neck tumors[J].International Journal of Radiation Oncology Biology Physics,2002,54(5):1537-1549.
[9]KITAJIMA Y,MIYAZAKI K.The Critical Impact of HIF-1a on Gastric Cancer Biology[J].Cancers,2013,5(1):15-26.
[10]NAM SY,KO YS,JUNG J,et al.A hypoxia-dependent upregulation of hypoxia-inducible factor-1 by nuclear factor-kappa B promotes gastric tumour growth and angiogenesis[J].British Journal of Cancer,2011,104(1):166-174.
[11]SONG G,OUYANG G,MAO Y,et al.Osteopontin promotes gastric cancer metastasis by augmenting cell survival and invasionthroughAkt-mediatedHIF-1alphaup-regulationand MMP9 activation[J].Journal of Cellular and Molecular Medicine, 2009,13(8B):1706-1718.
[12]ROHWER N,LOBITZ S,DASKALOW K,et al.HIF-1 alpha determines the metastatic potential of gastric cancer cells[J]. British Journal of Cancer,2009,100(5):772-781.
[13]O'DONNELL JL,JOYCE MR,SHANNON AM,et al.Oncological implications of hypoxia inducible factor-1 alpha(HIF-1 alpha)expression[J].Cancer Treatment Reviews,2006,32(6):407-416.
[14]GORT EH,GROOT AJ,DERKS VAN DE VEN TL,et al.Hypoxia-inducible factor-1alpha expression requires PI 3-kinase activity and correlates with Akt1 phosphorylation in invasive breast carcinomas[J].Oncogene,2006,25(45):6123-6127.
[15]CHEN L,SHI Y,YUAN J,et al.HIF-1 alpha overexpression correlates with poor overall survival and disease-free survival in gastric cancer patients post-gastrectomy[J].PloS One,2014,9(3): e90678.
[16]KELLY BD,HACKETT SF,HIROTA K,et al.Cell type-specific regulation of angiogenic growth factor gene expression and induction of angiogenesis in nonischemic tissue by a constitutively active form of hypoxia-inducible factor 1[J].Circulation Research,2003,93(11):1074-1081.
[17]HUANG JH,LEE FS,PASHA TL,et al.Analysis of HIF-1a anditsregulator,PHD2,inretroperitonealsarcomas:clinico-pathologic implications[J].Cancer Biology&Therapy,2010,9(4): 303-311.
[18]OLADIPUPO SS,HU S,SANTEFORD AC,et al.Conditional HIF-1inductionproducesmultistageneovascularizationwith stage-specific sensitivity to VEGFR inhibitors and myeloid cell independence[J].Blood,2011,117(15):4142-4153.
[19]KAIDI A,WILLIAMS AC,PARASKEVA C.Interaction between beta-catenin and HIF-1 promotes cellular adaptation to hypoxia [J].Nature Cell Biology,2007,9(2):210-217.
(张蕾 编辑)
Level of hypoxia inducible factor-1a and-2a in Tibetan Plateau patients with gastric cancer and its mechanism*
Xiao-li LIU1,Ke LIU2,Min-xia ZHU1
(1.Basic Laboratory of Life Sciences,Tibet National University,Xianyang,Shanxi 712082, P.R.China;2.Department of General Surgery,the General Hospital of Tibet Military Command,Lhasa,Tibet 850000,P.R.China)
【Objective】To study hypoxia inducible factor(HIF)-1a and HIF-2a levels in the tissues of patients with gastric cancer in the Tibetan Plateau,and to explore its molecular mechanism.【Methods】Realtime-PCR was used to detect the expression of HIF-1a and HIF-2a in gastric cancer tissue and pericancerous tissue and the correlation of HIF-1a and HIF-2a with the clinical staging was explored.Small interfering RNA(siRNA)was used to inhibit the expression of HIF-1a and HIF-2a in gastric cancer cells SGC7901,the expression level of VEGF was detected by RT-PCR and proliferation of the cells was detected by CCK-8.【Results】In the patients with gastric carcinoma,HIF-1a and HIF-2a mRNA levels were significantly higher in the cancerous tissue than in the adjacent tissue,the difference was statistically significant(P<0.05).The HIF-1a mRNA level in the gastric cancer tissue was significantly and positively correlated with gastric cancer staging(P<0.05).After knockdown of HIF-1a in gastric cancer cells,VEGF expression and the cell proliferation were significantly decreased(P<0.05);however,after knockdown of HIF-2a in gastric cancer cells,the VEGF mRNA level and cell proliferation did not significantly change(P>0.05).【Conclusions】The level of HIF-1a has a promoting effect on the formation of gastric cancer in Tibetan Plateau,which may be related topromoted VEGF expression and cancer cell proliferation.
hypoxia inducible factor(HIF)-1a;HIF-2a;gasrtric cancer;VEGF
R735.2
A
1005-8982(2015)30-0023-05
2015-06-10
2015年西藏自治区科技厅自然科学基金立项项目(No:2015ZR-13-15)

