酶制剂对刺参生长、体成分、免疫能力及氨氮胁迫下免疫酶活力和热休克蛋白70含量的影响
武明欣 王际英 李宝山 张德瑞 蔡胜昌 王世信 孙永智 张利民*
(1.上海海洋大学水产与生命学院,上海 201306;2.山东省海洋生态修复重点实验室,山东省海洋资源与环境研究院,烟台 264006;3.山东升索渔用饲料研究中心,烟台 265500)
饲用酶制剂是一种以酶为主要功能性因子,通过特定生产工艺加工而成的饲料添加剂。饲用酶制剂可刺激内源消化酶分泌,降低肠道食糜黏度,提高饲料转化率;减少或消除饲料中的抗营养因子;提高机体免疫抵抗能力,促进水产动物健康生长[1]。目前,酶制剂在饲料中的应用主要集中于畜禽方面,在水产饲料中的应用仅见于草鱼[2-3]、异育银鲫[4-5]、尼罗罗非鱼[6]、大黄鱼[7-8]等少数种类,在刺参上的应用鲜有报道。
刺参属海参纲(Holothuroidea),海参科(Holothuriidae)。近年来随着刺参食用和药用价值不断被发现[9],其越来越受到养殖者和消费者青睐。随着刺参养殖规模的扩大,各种病害及环境胁迫影响也愈渐显著,给刺参养殖业带来巨大损失。酶制剂作为一种绿色环保、无药物残留的新型饲料添加剂,可有效提高养殖动物的生长性能和疾病抵抗能力,得到了许多研究者的关注[10]。刺参饲料中含有大量的纤维素和半纤维素,很难被直接吸收利用。酶制剂能破坏植物细胞壁,将植物纤维分解为容易被吸收利用的小分子多糖或葡萄糖,促进内源酶的分泌,提高饲料利用率[11]。本试验拟通过研究几种单体酶及其复合酶对刺参生长、体成分、免疫能力及氨氮胁迫下免疫酶活力和热休克蛋白70(heat shock protein 70,HSP70)含量的影响,以期为酶制剂在刺参配合饲料中的应用提供基础数据,促进绿色饲料添加剂的发展。
1 材料与方法
1.1 试验设计
试验设5个组,分别为对照组、木聚糖酶组、纤维素酶组、淀粉酶组和复合酶组,每个组3个重复,每个重复放养体重(4.02±0.04)g的幼参40头。试验所用木聚糖酶、纤维素酶和淀粉酶活力分别为10 000、1 000、2 000 U/g。共配制粗蛋白质含量为20%的5种试验饲料,首先配制不添加酶制剂的基础饲料作为对照,然后分别以0.04%木聚糖酶、0.10% 纤维素酶、0.01% 淀粉酶、0.15%复合酶(由0.04%木聚糖酶、0.10%纤维素酶和0.01%淀粉酶组成)等量替代基础饲料中的α-淀粉。饲料组成及营养水平见表1。固体原料超微粉碎过200目标准筛,按配比称重,加入新鲜鱼油及适量蒸馏水混匀,用小型颗粒饲料挤压机制成直径为0.3 cm的颗粒,60℃烘干,用小型粉碎机破碎,筛选粒度在80~100目之间的颗粒备用。
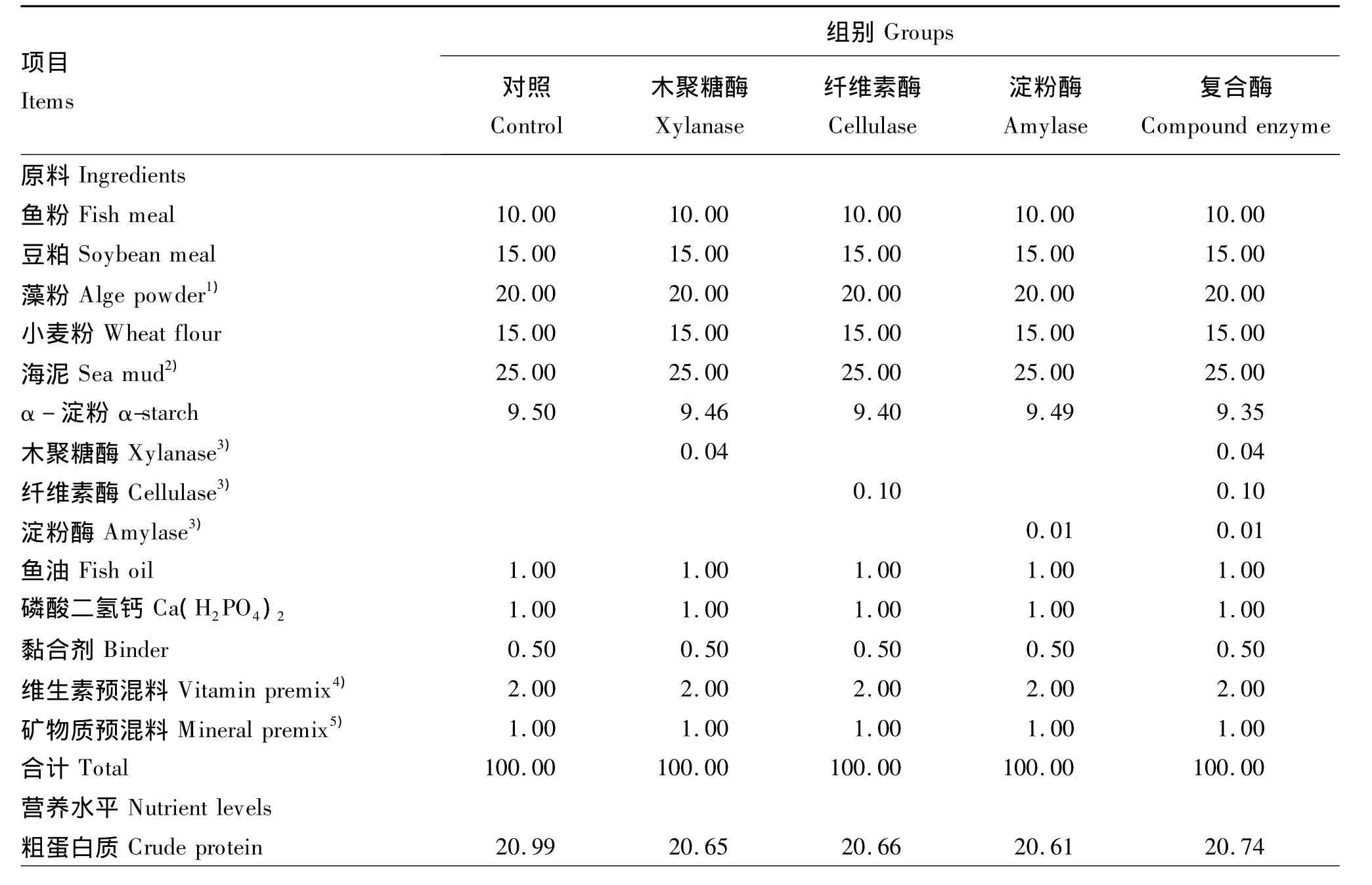
表1 试验饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air-dry basis) %
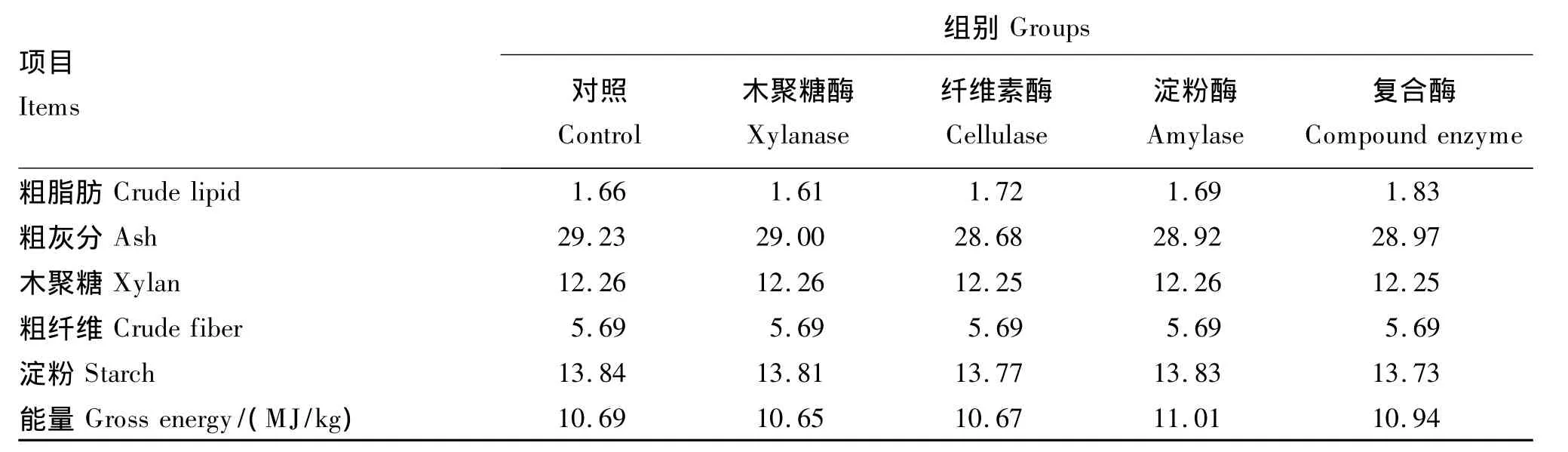
续表1
1.2 饲养管理
饲养试验在山东省海洋资源与环境研究院东营试验基地循环水养殖系统中进行,试验用刺参为该基地当年繁育的同一批参苗。试验开始前,将1 000头刺参幼参放养于养殖系统中,暂养15 d,期间投喂基础饲料,待其完全适应饲养条件后,选择体质健壮、体重(4.02±0.04)g的刺参幼参600头,平均放养于15个圆柱形玻璃钢养殖桶中。每种饲料投喂3个养殖桶,试验期为56 d。试验在微流水环境中进行,采用充气增氧,保证溶氧浓度>7 mg/L,控制水温在18~20 ℃,pH 7.8~8.2,盐度24 ~26,亚硝酸氮浓度 <0.05 mg/L、氨氮浓度 <0.05 mg/L。养殖试验持续56 d,每天投喂2次(08:00、16:30),日投喂量为刺参体重的2%,根据试验刺参摄食情况及时调整投喂量。每隔2 d吸底1次,用虹吸法将残饵及粪便吸出。
1.3 样品收集
试验结束后,禁食48 h,记录每桶刺参总数并称量总重,用于成活率、增重率及特定生长率的计算。每桶取10头刺参,用滤纸轻轻吸干体表水分,称体重,待其自然舒展后量体长,用于肥满度的计算。用2 mL无菌注射器抽取体腔液后,置冰盘上解剖,分别称量体壁与肠道重量,并测量肠道长度。体腔液在4℃条件下,以3 000 r/min离心15 min,取上清液分装于2 mL的离心管中,同体壁、肠道样品一同保存于-80℃冰箱,待测。
1.4 氨氮胁迫试验
样品收集后,封闭循环水系统,用氯化铵(NH4Cl)调节养殖水氨氮浓度约为5 mg/L,继续饲养试验刺参 5 d,并分别在试验的 0、24、48、72、96、120 h采集试验刺参的体腔液,用于免疫酶活力和HSP70含量的测定。
1.5 测定指标和方法
1.5.1 生长指标

1.5.2 饲料及体壁基本营养成分的测定
饲料及体壁基本营养成分采用常规方法测定:干物质含量采用105℃烘干至恒重法(GB/T 6435—2006);粗蛋白质含量采用杜马斯燃烧法(Leco-FP528);粗脂肪含量采用索氏抽提法(GB/T 6433—1994);粗灰分含量采用550℃马福炉灼烧法(GB/T 6438—2007);木聚糖含量采用分光光度法;粗纤维含量采用过滤法(GB/T 6434—2006);淀粉含量采用旋光法(GB/T 20194—2006);能量采用燃烧法(PARR,6100)。
1.5.3 免疫酶活力的测定
溶菌酶(LZM)活力采用空白对照比浊法测定;超氧化物歧化酶(SOD)活力采用羟胺法测定,定义为每毫升反应液中SOD抑制率达50%时所对应的SOD量为1个活力单位(U);过氧化氢酶(CAT)活性采用可见光分光光度计法测定,定义为每毫升体腔液每秒钟分解1μmol的过氧化氢(H2O2)的量为1个活力单位(U)。以上指标均采用南京建成生物工程研究所的试剂盒进行测定。
1.5.4 HSP70 含量的测定
HSP70含量采用上海拜沃生物科技有限公司的试剂盒以酶联免疫吸附试验(ELISA)法进行测定。将标准品、待测样品加入到纯化的海参HSP70单克隆抗体包被的微孔板中,加入酶联亲和物,37℃孵育60 min,洗涤除去未结合的成分。依次加入底物 A 和 B,底物 3,3',5,5'- 四甲基联苯胺(TMB)在辣根过氧化物酶(HRP)催化下先转化为蓝色后变为黄色。在450 nm波长下测定光密度(OD)值,根据标准品和样品的OD值计算样品中HSP70的含量。
1.6 数据统计
试验所得数据采用Microsoft Excel 2007及SPSS 11.0软件进行单因素方差分析(one-way ANOVA),结果以平均值±标准差(mean±SD)表示,差异显著(P<0.05)时用Duncan氏法进行多重比较分析。
2 结果
2.1 酶制剂对刺参生长性能的影响
由表2可见,饲料中添加木聚糖酶、纤维素酶和复合酶均能显著提高刺参的增重率和特定生长率(P<0.05),且添加木聚糖酶和复合酶的促生长效果尤其明显,其增重率分别比对照组提高了17.38%和20.75%。木聚糖酶组的脏体比和肠长比均显著高于对照组(P<0.05),纤维素酶组的脏体比显著高于对照组(P<0.05),淀粉酶组的肥满度显著高于对照组(P<0.05),复合酶组的肥满度、脏体比、肠体比和肠长比均显著高于对照组(P<0.05)。饲料中添加单体酶和复合酶对成活率也有一定提高,但影响不显著(P>0.05)。
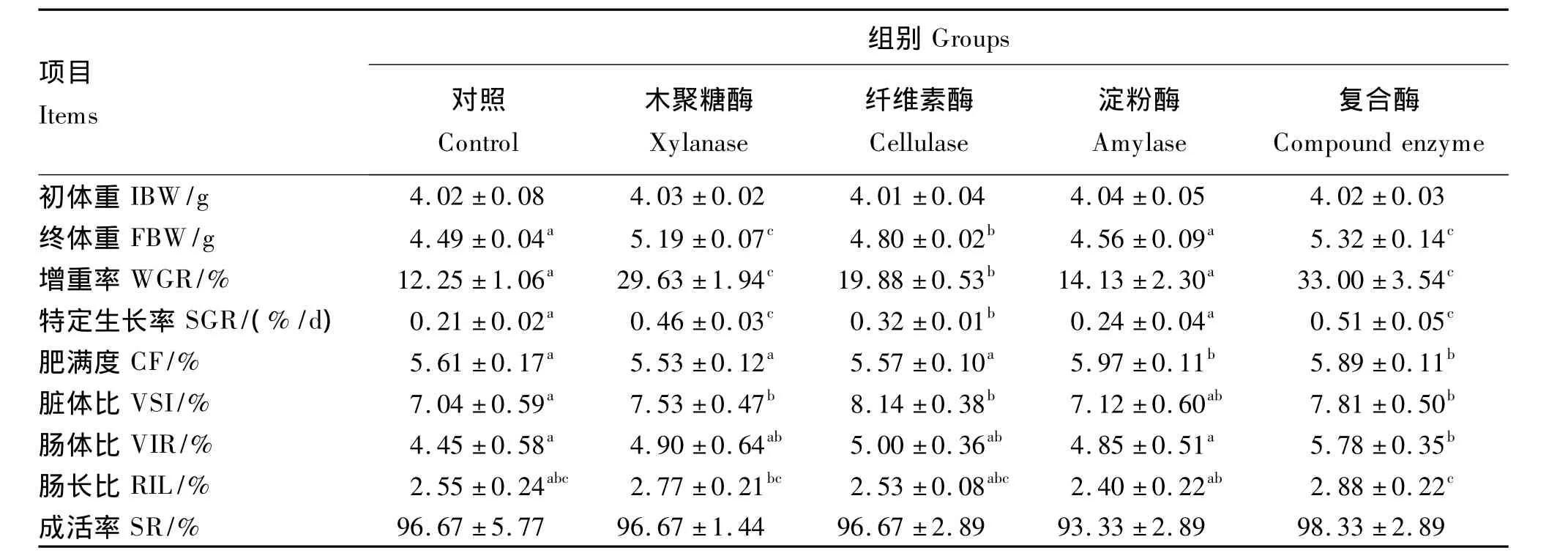
表2 酶制剂对刺参生长性能的影响Table 2 Effects of enzyme preparation on growth performance of Apostichopus japonicus
2.2 酶制剂对刺参体壁基本营养成分的影响
由表3可见,饲料中添加不同酶制剂对刺参体壁水分含量无显著影响(P>0.05),但添加木聚糖酶、纤维素酶、淀粉酶和复合酶均显著提高了体壁粗蛋白质和粗灰分的含量(P<0.05),添加淀粉酶和复合酶均显著提高了体壁粗脂肪的含量(P<0.05)。
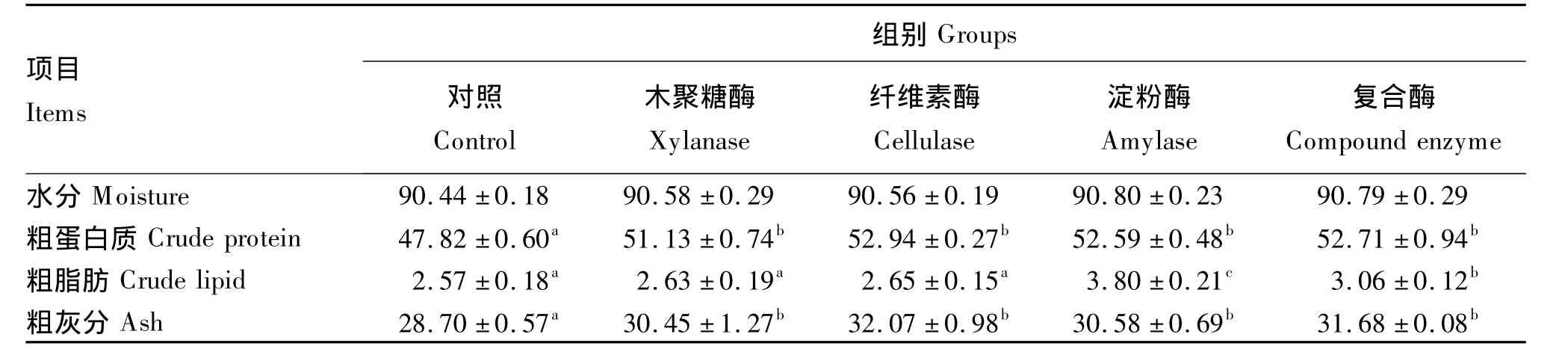
表3 酶制剂对刺参体壁基本营养成分的影响Table 3 Effects of enzyme preparation on basal nutritional components of body wall of Apostichopus japonicas %
2.3 酶制剂对刺参免疫能力的影响
由表4可见,饲料中添加木聚糖酶、纤维素酶和复合酶均显著提高了体腔液中过氧化氢酶的活力(P<0.05);添加淀粉酶显著提高了体腔液中溶菌酶、超氧化物歧化酶、过氧化氢酶活力(P<0.05)。体腔液中溶菌酶和超氧歧化酶活力均以淀粉酶组最高,过氧化氢酶活力以复合酶组最高。
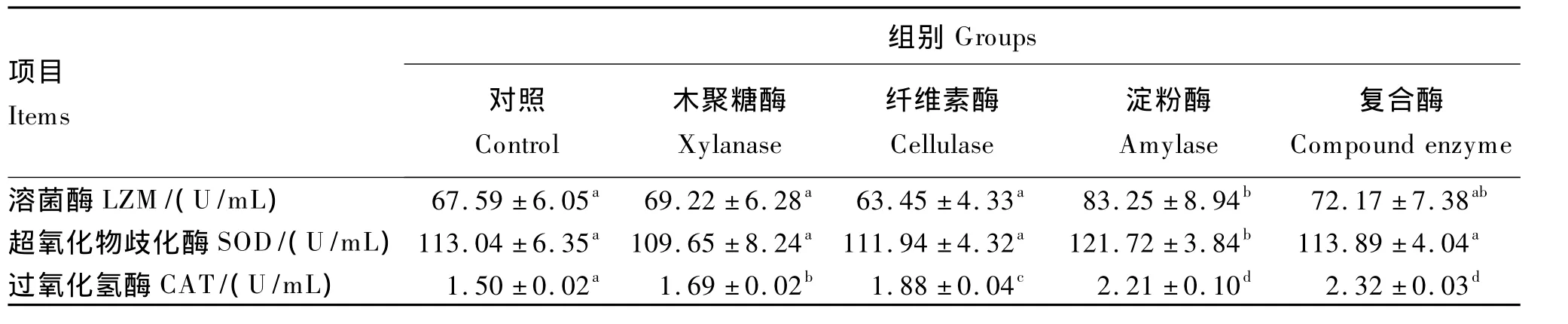
表4 酶制剂对刺参体腔液中免疫酶活力的影响Table 4 Effects of enzyme preparation on immune enzyme activities in coelomic fluid of Apostichopus japonicus
2.4 酶制剂对氨氮胁迫下刺参体腔液中免疫酶活力和HSP70含量的影响
由图1可见,氨氮胁迫过程中各组刺参体腔液中溶菌酶活力的总体趋势是先升高后降低,对照、木聚糖酶、纤维素酶、淀粉酶、复合酶组最大值分别出现在72、72、96、96 和 96 h。其中,淀粉酶、复合酶组的最大值要高于其余各组。氨氮胁迫过程中各组刺参体腔液中SOD活力均先升高,并均在24 h达到最大值,之后降低并于48 h后趋于稳定,且其稳定值略低于初始值。氨氮胁迫过程中各组刺参体腔液中CAT活力均呈现先升高后降低的趋势,并均在96 h达到最大值,其中淀粉酶组的最大值要高于其他各组。
氨氮胁迫下,试验初期复合酶组刺参体腔液中HSP70含量明显高于其他各组。木聚糖酶组刺参体腔液中HSP70的含量呈现一直升高的趋势,其余各组均呈现先升高后降低的趋势。复合酶组体腔液中HSP70含量比其他组率先达到最高点,且在96 h后趋于稳定。对照、纤维素酶、淀粉酶组体腔液中HSP70含量于96 h达到最大值。除纤维素酶组外,其余加酶组体腔液中HSP70含量的最大值均高于对照组。
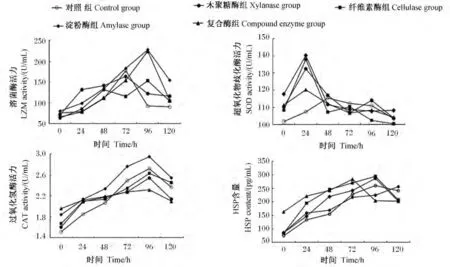
图1 氨氮胁迫过程中刺参体腔液溶菌酶、超氧化物歧化酶、过氧化氢酶活力及HSP70含量的变化Fig.1 Changes of LZM,SOD and CAT activities and HSP70 content in coelomic fluid under the stress of ammonia nitrogen of Apostichopus japonicus
3 讨论
3.1 酶制剂对刺参生长性能和体成分的影响
本研究表明,饲料中添加酶制剂显著提高了刺参的增重率和特定生长率,这与在鲫鱼[12]、尼罗罗非鱼[13-15]、黄河鲤[16]和大西洋鲑[17]上的研究结果相一致。酶制剂促进刺参生长,可能有以下几方面原因:1)饲料中添加木聚糖酶能有效降低肠道食糜黏度,降解非淀粉质抗营养因子,提高养殖动物对营养物质的消化吸收,从而改善养殖动物的生产性能[18-19]。2)纤维素酶能破坏细胞壁、降低饲料密集黏度,同时刺激内源酶的分泌,从而提高水产动物对营养成分的消化吸收[20]。3)饲料中添加淀粉酶起作用的主要为α-淀粉酶和糖化酶。α-淀粉酶为内切酶,将淀粉大分子水解成易溶解的中等和低分子物质,有利于糖化酶的水解。糖化酶为内切酶,其活性的高低直接影响到动物的生长[21]。4)复合酶综合了几种单体酶的作用,又不仅仅是单个酶作用的复合。邓岳松[22]在研究中发现由纤维素酶、淀粉酶、蛋白酶等组成的复合酶对饲料中的一些抗营养因子具有灭活作用,可消除草鱼对营养物质的消化和吸收困难,从而提高鱼体的生长性能。黄峰等[23]研究表明,添加复合酶促进异育银鲫生长的效果稍好于单一添加木聚糖酶,这可能得益于复合酶的叠加效应和协同效应。本试验结果也表明,添加复合酶的促生长效果优于添加单体酶。
本研究表明,饲料中添加酶制剂对刺参体壁粗蛋白质、粗脂肪和粗灰分含量均有显著影响。这与王俊丽等[13]、黄燕华等[24]的研究结果相一致。饲料中添加木聚糖酶能提高肠道蛋白酶活力,增加肠道内游离氨基酸和小肽数量,从而促进蛋白质的合成和积累。同时,添加木聚糖酶降低了肠道食糜黏度,肠道活动增强,从而促进了对脂肪的吸收,增加了体壁中脂肪的沉积。添加木聚糖酶使肠道中低聚木糖增加,低聚木糖的代谢降低了肠道pH,增强了钙盐的溶解性,促进了钙的吸收,从而提高了粗灰分的含量[13]。而钟国防等[6]、张璐等[7]的研究证明,饲料中添加酶制剂对养殖动物的基本营养成分均无显著影响。这可能与添加酶的种类、活力及养殖动物种类有关。
3.2 酶制剂对刺参免疫能力的影响
刺参没有完善的特异性免疫,溶菌酶、超氧化物歧化酶及过氧化氢酶在其免疫及抗氧化过程中起着重要作用[25]。溶菌酶活力的高低直接反映出溶菌能力的强弱[26],超氧化物歧化酶活力与生物体免疫水平密切相关[27],过氧化氢酶保护机体组织免受损害[25]。本试验结果表明,饲料中添加酶制剂对刺参各免疫指标均有促进作用。其中,木聚糖酶组体腔液中溶菌酶和过氧化氢酶活力与对照组相比有显著提高;淀粉酶体腔液中溶菌酶、超氧化物歧化酶及过氧化氢酶活力均较对照组有显著提高。这与黄燕华等[24]、钟国防等[15]、黄峰等[4-5]的研究结果一致。黄燕华等[24]研究证实,饲料中添加淀粉酶能显著提高对虾血清超氧化物歧化酶活力。钟国防等[15]研究表明,在尼罗罗非鱼饲料中添加木聚糖酶和复合酶能显著提高鱼体肝脏和脾脏中超氧化物歧化酶和溶菌酶活力。目前关于刺参体腔液中溶菌酶、超氧化物歧化酶及过氧化氢酶正常活力范围的研究并不充足,尤其是酶活力升高的机理尚不清楚,因此不能单纯依据酶活力来评定其免疫及抗氧化能力的强弱,但是在大菱鲆等鱼类上的研究表明,鱼体抗病能力的提高往往伴随着溶菌酶、超氧化物歧化酶及过氧化氢酶活力的升高[28],由此可以推测在一定范围内,上述3种酶活力的升高提高了机体的抗逆性。
3.3 酶制剂对氨氮胁迫下刺参体腔液中免疫酶活力和HSP70含量的影响
热休克蛋白是一种应激反应的指示器,它能使细胞处于保护状态,它的产生能使细胞抵抗致死性损伤,增强细胞对外界损害的耐受力[25]。本试验过程中,在5 mg/L的氨氮浓度胁迫下,各组刺参体腔液中免疫酶活力均表现出一定的上升趋势。这主要是由于氨氮胁迫增强了刺参体内水解系统的活性,表现出明显的毒物兴奋作用[29]。本试验研究发现,饲料中添加酶制剂能提高刺参的免疫性能,因此在短时间内各加酶组表现出比对照组更迅速和强烈的免疫抵抗反应。随着胁迫时间的延长,刺参自身的水解系统活性降低,抵抗力下降[25],因此各组免疫酶活力随后表现出下降趋势。氨氮胁迫72 h内,各组刺参体腔液中HSP70含量均呈上升趋势。这说明,刺参通过提高HSP70的表达量,增强抗逆性,以适应氨氮胁迫的环境[25]。氨氮胁迫开始前(即0 h),复合酶组刺参体腔液中HSP70的含量明显高于其他各组,其次为木聚糖酶组。氨氮胁迫48 h内,纤维素酶、淀粉酶和复合酶组刺参体腔液中HSP70含量与对照组相比表现出较快的升高,且复合酶组更早的达到最高点。这可能与酶制剂促进刺参自身免疫和胁迫抵抗有关。
4 结论
①饲料中适量添加木聚糖酶、纤维素酶、淀粉酶或其复合酶均能提高刺参的生长,提高免疫能力,并对刺参体壁粗蛋白质、粗脂肪和粗灰分的含量也有一定影响,且木聚糖酶的促生长作用更明显,而淀粉酶的促免疫作用更明显。
②氨氮胁迫下,饲料中适量添加聚糖酶、纤维素酶、淀粉酶或其复合酶均能使刺参更迅速和强烈的表现出免疫抵抗反应。
[1] 明建华.酶制剂在水产动物饲料中的应用[J].饲料工业,2007,28(10):17 -19.
[2] 黄峰,施培松,文华,等.外源酶对草鱼鱼种生长及饲料表观消化率的影响[J].安徽农业科学,2008,36(3):1057-1059.
[3] 高春生,刘忠虎,肖传斌.木聚糖酶对草鱼生长性能和消化率的影响[J].饲料研究,2006(8):48-49.
[4] 黄峰,张丽,周艳萍,等.复合酶制剂对异育银鲫生长、SOD和溶菌酶活性的影响[J].华中农业大学学报,2008,27(1):96 -100.
[5] 黄峰,张丽,周艳萍,等.外源木聚糖酶对异育银鲫生长、超氧化物歧化酶及溶菌酶活性的影响[J].淡水渔业,2008,38(1):44 -48.
[6] 钟国防,周洪琪.木聚糖酶和复合酶制剂 PS对尼罗罗非鱼生长性能、消化率以及肌肉营养成分的影响[J].浙江海洋学院学报:自然科学版,2005,24(4):324-329.
[7] 张璐,麦康森,艾庆辉,等.饲料中添加植酸酶和非淀粉多糖酶对大黄鱼生长和消化酶活性的影响[J].中国海洋大学学报,2006,36(6):923 -928.
[8] 张春晓,麦康森,艾庆辉,等.饲料中添加外源酶对大黄鱼和鲈氮磷排泄的影响[J].水生生物学报,2008,32(2):231 -236.
[9] MOON J H,RYU H S,YANG H S,et al.Antimutagenic and anticancer effects of glycoprotein and chondroitin sulfates from sea cucumber(Stichopus japonicus)[J].The Korean Society of Food Science and Nutrition,1998,27(2):350 -358.
[10] 石军,陈安国.木聚糖酶的应用研究进展[J].中国饲料,2002(4):10-12.
[11] 施培松,黄峰,魏开建.酶制剂在水产养殖上的应用研究概况[J].水利渔业,2005,25(4):5 -6,15.
[12] 张玲,聂国兴,周洪琪.木聚糖酶对鲫鱼生长性能和小肠绒毛的影响[J].浙江海洋学院学报:自然科学版,2006,25(2):133 -137.
[13] 王俊丽,于广丽,刘凯,等.饲料中添加木聚糖酶对尼罗罗非鱼生长性能的影响[J].华北农学报,2007,22(3):178 -182.
[14] 聂国兴,王俊丽,周洪琪.饲料中添加木聚糖酶对尼罗罗非鱼生长及血清激素水平的影响[J].中国水产科学,2007,14(2):251 -256.
[15] 钟国防,周洪琪.木聚糖酶和复合酶制剂PS对尼罗罗非鱼生长性能、非特异性免疫能力的影响[J].海洋渔业,2005,27(4):286 -291.
[16] 李红岗,郭德姝,李辉.木聚糖酶添加量对黄河鲤血糖水平及增重率的影响[J].河南水产,2010(2):33-34.
[17] CARTER C G,HOULIHAN D F,BUCHANAN B,et al.Growth and feed utilization efficiencies of seawater Atlantic salmon,Salmon salar L.,fed a diet containing supplementary enzymes[J].Aquaculture Research,1994,25(1):37 -46.
[18] 何云,崔金忠,郑素玲,等.木聚糖酶在水产养殖中的应用研究进展[J].广东农业科学,2008(10):100-101.
[19] 林少珍,刘伟成,单乐州.酶制剂在水产养殖饲料中的应用[J].水产科学,2009,28(12):798 -800.
[20] 高春生,范光丽,李建华,等.纤维素酶对草鱼生长性能和饲料消化率及体成分的影响[J].中国农学通报,2006,22(10):473 -475.
[21] 王琤韡,瞿明仁.浅谈几种常见酶制剂的研究及其应用[J].饲料工业,2006,27(24):55 -59.
[22] 邓岳松.耐高温酶制剂对草鱼生长的影响[J].内陆水产,2005,30(6):45 -46.
[23] 黄峰,张丽,周艳萍,等.木聚糖酶在制粒前后的热稳定性及对异育银鲫生长的影响[J].粮食与饲料工业,2008(1):29-31.
[24] 黄燕华,王国霞,黄文庆,等.酶制剂对南美白对虾幼虾生长、体组成及非特异免疫的影响[C]//饲料酶制剂的研究与应用.北京:中国畜牧兽医学会动物营养学分会,2009:165-170.
[25] 臧元奇,田相利,董双林,等.氨氮慢性胁迫对刺参免疫酶活性及热休克蛋白表达的影响[J].中国海洋大学学报,2012,42(增刊):60 -66.
[26] BAYNE C J,GERWICH L.The acute phase response and innate immunity of fish[J].Developmental and Comparative Immunology,2001,25(8/9):725 -743.
[27] FRIDOVICH I.Superoxide dismutases:an adaptation to aparmagnetic gas[J].The Journal of Biological Chemistry,1989,264(14):7761 -7764.
[28] 郝甜甜,王际英,李宝山,等.饲料中添加糖萜素对大菱鲆幼鱼生长、免疫及热休克蛋白70含量的影响[J].浙江大学学报:农业与生命科学版,2014,40(3):338-347.
[29] STEBBING A R.Hormesis:the stimulation of growth by low levels of inhibitors[J].Science of the Total Environment,1982,22(3):213 - 234.

