西伯利亚鲟肝脏中过氧化物酶体增殖物激活受体α、脂蛋白脂酶、肝脂酶基因全长cDNA克隆与序列分析
艾立川 于晓彤 王 嘉* 薛 敏,2吴秀峰 郑银桦 韩 芳
(1.中国农业科学院饲料研究所,国家水产饲料安全评价基地,北京 100081;2.农业部饲料生物技术重点开放实验室,北京 100081)
过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)是一类由配体激活的核受体转录因子,属于核激素受体超家族,包括3个亚型——α、β/δ和 γ,在脂肪细胞分化、脂肪代谢和脂肪沉积过程中起着重要信号转导和调控作用[1-2]。PPARs作为调节机体脂肪代谢过程中的关键因子,其通过与某些基因上游特异的DNA反应元件(peroxisome proliferator response element,PPRE)相互作用来调控基因的表达。近年来的研究表明PPARα在调节过氧化物酶体增值、能量代谢、脂肪代谢等过程中发挥着重要作用,PPARα可以调节与脂肪酸氧化相关酶基因的表达,被相应的配体激活后可促进脂肪酸的β氧化,调节细胞对脂肪酸的摄取、活化和代谢[3-5]。以往的研究表明,PPARα在体内的许多组织和器官中均有表达[6],其在脂肪代谢过程中发挥作用,同时也参与调控体内的炎症反应[7]及胆红素的体内平衡[8]。
脂酶的主要作用是水解甘油三脂(triglyceride,TG)、磷脂和胆固醇脂等一些非水溶性物质中的脂键,在脂肪的吸收、脂蛋白的代谢过程中发挥着重要作用,虽然甘油三脂脂酶家族各成员之间结构相似,但是在脂质代谢的过程中却具备不同功能,这些成员包括脂蛋白脂酶(lipoprotein lipase,LPL)、肝脂酶(hepatic lipase,HL)、内皮脂酶(endothelial lipase,EL)和胰脂酶(pancreatic lipase,PL)等[9-11]。LPL 是脂蛋白代谢的关键酶之一,其生理功能是催化乳糜微粒(chylomicron,CM)和极低密度脂蛋白(very low density lipoprotein,VLDL)核心的TG分解为甘油和脂肪酸,以供组织氧化供能和贮存,LPL还参与VLDL和高密度脂蛋白(high density lipoprotein,HDL)之间的载脂蛋白和磷脂的转换。HL是肝素化血浆中存在的一种脂酶,属于与血液循环中内源性TG代谢有关的酶之一,主要催化CM、VLDL代谢残粒及HDL中的TG和磷脂的代谢。LPL、HL均为脂质代谢中的关键酶,与机体的脂质代谢及肥胖与否密切相关,不同组织器官其基因的表达水平的高低直接决定这些组织器官脂质底物配额的多少[12]。LPL、HL有助于清除体内过多的TG并与动脉粥样硬化的发生发展有密切关系,在心血管疾病研究领域是近几十年来的研究热点问题[13-14]。
与哺乳动物不同,鱼类能优先利用脂类作为能源物质,是研究脂质代谢理想的试验材料。鱼体脂肪的含量和脂肪酸的构成是影响肉质、口感以及营养价值的重要标准。西伯利亚鲟(Acipenser baerii)属鲟形目,鲟科,是一类古老的软骨硬鳞鱼类,在鱼类进化史上占有重要地位,常常被作为鱼类生物学的模型动物[15]。同时,西伯利亚鲟是我国重要的经济鱼类,其生长速度快,食用价值高,受到许多国家和地区消费者的青睐。但是由于养殖规模的扩大和饲料中脂类含量及构成的不合理,其脂肪堆积的问题日渐突出,这不仅影响了肉质的口感,同时也对亲鱼健康状况和繁殖性能产生了影响。PPARα、LPL、HL均在脂肪酸转运、脂肪酸β氧化、脂蛋白分解等过程中发挥重要作用,有报道表明,不同种类及不同饱和度的脂肪酸可以通过影响PPARs而进一步调控LPL mRNA在肝脏中的表达丰度[16]。因此,本研究拟通过简并引物反转录聚合酶链式反应(RT-PCR)和cDNA末端快速扩增(RACE)技术相结合的方法,克隆西伯利亚鲟肝脏中 PPARα、LPL、HL基因的全长cDNA序列,并与其他物种进行同源性比较和系统发生进化树分析,为进一步研究西伯利亚鲟脂肪代谢机理奠定分子生物学基础。
1 材料与方法
1.1 试验材料
试验所用西伯利亚鲟取自北京市水产科学研究所房山基地。待试验鱼被麻醉后,在冰盘上分离出肝脏组织,立即置于液氮中,随后转移至-80℃超低温冰箱中保存。
1.2 引物的设计与合成
根据NCBI GenBank中已知其他物种的PPARα的氨基酸保守序列,利用CODEHOP原理,设计出简并引物,克隆西伯利亚鲟PPARα基因的保守片段。再根据克隆出来的基因的保守片段,利用 Primer 5.0设计用于 3’-RACE 和 5’-RACE扩增的特异性引物。LPL、HL基因参考 NCBI GenBank中其他鲟鱼的基因保守序列设计用于扩增西伯利亚鲟LPL、HL核心序列的特异性引物。再根据克隆出来的核心序列,利用Primer 5.0设计用于3’-RACE和5’-RACE扩增的特异性引物。所有引物均由生工生物工程(上海)有限公司合成。本试验中所用到的引物序列及相应的退火温度(Tm)见表1。
1.3 总RNA的提取
取西伯利亚鲟的肝脏组织,经液氮研磨后,采用TaKaRa公司的RNAiso Plus试剂从肝脏中提取总RNA。将总RNA进行变性琼脂糖凝胶电泳,显示18S和28S条带,检验所提取的总RNA的完整性。并采用PowerwayTMXS2全波长酶标仪(BioTek,美国)检测其在260 nm处的吸光度值与在280 nm处的吸光度值的比值(A260/A280),并对所提取的总RNA进行定量。

表1 本试验中所用引物序列及相应的退火温度Table 1 Primer sequences and Tm used in this experiment
1.4 cDNA第1链合成和保守片段克隆
cDNA第1链的合成采用TaKaRa公司的PrimerScriptⅡ 1stStrand cDNA Synthesis Kit试剂盒,每个反转录反应使用大约 1.0μg肝脏总RNA,操作步骤参照说明书进行。分别采用之前设计好的各基因的对应引物进行保守片段聚合酶链式反应(PCR)扩增,PCR反应体系包括合成的cDNA 第 1 链 1 μL、10×PCR Buffer 2.5 μL,TaKa-Ra Ex taq 0.625 U,dNTP 200 μmol/L,上游、下游引物[P01F、L01F、H01F、P02R、L02R、H02R(表1)]各 0.4 μmol/L,加灭菌水至总体积 25 μL。扩增条件为:94℃预变性 3 min,94℃,30 s,Tm,30 s,72℃,1 min;共 35个循环;最后 72℃延伸10 min。PCR产物经过琼脂糖凝胶电泳检测,在紫外灯下切取与目的序列大小一致的条带,采用TaKaRa公司的 Agarose Gel DNA Purification Kit Ver.2.0胶回收试剂盒对目的片段进行纯化,操作步骤按照说明书进行。纯化产物与PMD19-T Vctor(TaKaRa,大连)连接,转化入大肠杆菌(E.coli)JM109感受态细胞(TaKaRa,大连)中,经过蓝白斑筛选后,选取阳性克隆进行测序(北京华大基因服务公司)。
1.5 3’-RACE 扩增
根据得到的西伯利亚鲟 PPARα、LPL、HL的cDNA核心片段设计3’-RACE上游嵌套引物P3’01F、P3’02F、L3’01F、L3’02F、H3’01F、H3’02F(表 1),下游引物采用 3’-Full RACE Core Set Ver.2.0 试剂盒(TaKaRa,大连)所提供的引物,按照说明书进行3’-RACE扩增。首先称取1.0 μg肝脏总 RNA,以 3’RACE Adaptor为引物合成cDNA第1链,然后以试剂盒提供的引物3’-RACE Outer Primer(表 1)分别与引物 P3’01F、L3’01F、H3’01F进行首次 PCR 扩增,反应条件为:94 ℃ 预变性 3 min,94 ℃,30 s,Tm,30 s,72℃,1.5 min;共 35个循环;最后 72 ℃ 延伸10 min。再以1 000倍稀释的Outer PCR产物为模板,分别以试剂盒提供的3’-RACE Inner Primer(表 1)和所设计的引物 P3’02F、L3’02F、H3’02F进行第2轮PCR扩增,反应条件与第1轮相同。对Inner PCR产物进行电泳、切胶纯化、克隆测序。
1.6 5’-RACE 扩增
根据得到的西伯利亚鲟 PPARα、LPL、HL的cDNA核心片段和SMARTTMRACE cDNA Amplifiction Kit试剂盒(Clontech,美国)要求设计下游嵌套引物 P5’01R、P5’02R、L5’01R、L5’02R、H5’01R、H5’02R(表 1),上游引物由试剂盒提供。称取 1.0μg肝脏总 RNA、5’-CDS Primer A和SMARTⅡ A Oligo合成cDNA第1条链,以Advertange 2 PCR Enzyme System(Clontech,美国)、UPM 引物(表 1)和 P5’01R、L5’01R、H5’01R引物进行 PCR扩增,扩增采用 Touch Down PCR 程序:94 ℃,30 s,72 ℃,2 min;5个循环;94 ℃,30 s,70 ℃ ,30 s,72 ℃ ,2 min;5 个循环;94 ℃,30 s,68 ℃,30 s,72 ℃ ,2 min;25 个循环;再以1 000倍稀释首次PCR产物,以试剂盒提供的NUP 引物(表 1)、P5’02R、L5’02R、H5’02R 引物进行第2次PCR扩增,扩增条件为:94℃,30 s,72 ℃,2 min;5 个循环;94 ℃,30 s,70 ℃,30 s,72 ℃,2 min;5 个循环;94 ℃,30 s,68 ℃,30 s,72℃,2 min;30个循环。对PCR产物进行电泳、切胶纯化、克隆测序。
1.7 序列分析、同源性比对及系统进化树构建
通过将测序所获得的核心片段、3’和5’区域拼接获得西伯利亚鲟肝脏中PPARα、LPL、HL基因cDNA的全长序列。将拼接结果与GenBank中的已知序列作blastx同源性分析,用DNAMAN(VERSION 5.2.2)软件分析所得 cDNA 序列及开放阅读框,预测编码氨基酸序列。根据GenBank中已报道的各基因编码氨基酸序列用Lasergene 7.0程序中MegAlign进行多序列比对和一致性数值计算。采用 MEGA 5.1软件,选择邻接法(neighbor joining,NJ)构建系统进化树[17]。
2 结果
2.1 西伯利亚鲟肝脏中 PPARα、LPL、HL基因全长cDNA序列
西伯利亚鲟肝脏中PPARα基因全长cDNA序列及其推测编码的氨基酸序列见图1。cDNA全长 1 736 bp,包括 158 bp的 5’非翻译区、1 401 bp的开放阅读框及177 bp的3’非翻译区;其中开放阅读框编码1个由466个氨基酸组成的蛋白质,预测其分子质量为 52.3 ku,等电点为5.78,多聚腺甘酸(polyA)加尾信号为 AATAA。将该序列提交至GenBank获得登录号为KJ534588。
西伯利亚鲟肝脏中LPL全长cDNA序列及其推测编码的氨基酸序列见图2。cDNA全长1 760 bp,包括 163 bp的 5’非翻译区、1 506 bp的开放阅读框以及3’非翻译区91 bp;其中开放阅读框编码1个由501个氨基酸组成的蛋白质,预测分子质量为57.1 ku,等电点 8.54。polyA 加尾信号为AATAAA。将该序列提交至GenBank获得登录号为KJ720972。
西伯利亚鲟肝脏中HL全长cDNA序列及其推测编码的氨基酸序列见图3。cDNA全长1 740 bp,包括 124 bp的 5’非翻译区、1 500 bp的开放阅读框以及3’非翻译区116 bp;其中开放阅读框编码1个由499个氨基酸组成的蛋白质,预测分子质量为 56.4 ku,等电点 8.94。polyA 加尾信号为AATAAA。将该序列提交至GenBank获得登录号为KJ720973。
2.2 多序列比对分析
将西伯利亚鲟PPARα氨基酸序列与其他物种的PPARα氨基酸序列进行比对,西伯利亚鲟PPARα氨基酸序列2个重要的功能区域——DNA结合区域(DBD)和配体结合区域(LBD),与其他物种相比变化并不大。特别是DNA结合区域,只有少数氨基酸发生变化,结果见图4。同源性分析表明,西伯利亚鲟 PPARα氨基酸序列与真鲷(Pagrus major)相似度最高,为82.4%;与斑马鱼(Danio rerio)、大西洋鲑(Salmo salar)、非洲爪蟾(Xenopus laevis)、鸡(Gallus gallus)、小鼠(Mus musculus)、人(Homo sapiens)的相似度分别为78.4%、81.5%、75.5%、80.3%、76.3%、79.7%。
在西伯利亚鲟LPL、HL氨基酸序列中均发现有催化位点、N-糖基化位点、4个保守的半胱氨酸残基位点以及脂质结合位点和多肽“盖”结构。将西伯利亚鲟LPL氨基酸序列与其他物种的LPL氨基酸序列进行相似度比对,结果见图5。同源性分析表明,西伯利亚鲟LPL氨基酸序列与非洲爪蟾的相似度最高,为 66.9%;与鲤鱼(Cyprinus carpio)、罗非鱼(Oreochromis niloticus)、鳜鱼(Siniperca chuatsi)、鸡、小鼠、人的相似度分别为62.3%、60.3%、66.2%、64.3%、61.2%、61.2%。

图1 西伯利亚鲟肝脏中PPARα全长cDNA序列和预测的氨基酸序列(GenBank登录号KJ534588)Fig.1 Liver PPARα full length cDNA sequence and deduced amino acid sequence of Acipenser baerii(GenBank accession No.KJ534588)
将西伯利亚鲟HL氨基酸序列与其他物种的HL氨基酸序列进行相似度比对,结果见图6。同源性分析表明,西伯利亚鲟HL氨基酸序列与海龟(Chelonia mydas)的相似度最高,为67.1%;与金头鲷(Sparus aurata)、斜带石斑鱼(Epinephelus coioides)、非洲爪蟾、鸡、小鼠、人的相似度分别为59.3%、59.5%、62.8%、64.9%、55.9%、55.4%。

图2 西伯利亚鲟肝脏中LPL全长cDNA序列和预测的氨基酸序列(GenBank登录号KJ720972)Fig.2 Liver LPL full length cDNA sequence and deduced amino acid sequence of Acipenser baerii(GenBank accession No.KJ720972)

图3 西伯利亚鲟肝脏中HL全长cDNA序列和预测的氨基酸序列(GenBank登录号KJ720973)Fig.3 Liver HL full length cDNA sequence and deduced amino acid sequence of Acipenser baerii(GenBank accession No.KJ720973)

图4 西伯利亚鲟与其他物种PPARα氨基酸序列比对结果Fig.4 Alignment results of PPARα amino acid sequences between Acipenser baerii and other species
2.3 系统进化树分析
PPARα氨基酸序列进化树结果见图7。如图所示,西伯利亚鲟PPARα以bootstrap值为100的支持度与陆生脊椎动物形成一支,再以bootstrap值为100的支持度与其他鱼类合并为一支。LPL氨基酸序列进化树结果见图8。如图所示,西伯利亚鲟以bootstrap值为100的支持度与史氏鲟(Acipenser schrenckii)形成一支,再与鳜鱼(Siniperca chuatsi)、牙鲆(Paralichthys olivaceus)、罗非鱼(Oreochromis niloticus)、鲤鱼、斑点叉尾 (Ictalurus punctatus)形成一支,最后以bootstrap值为99的支持度与其他陆生脊椎动物形成一支。HL氨基酸序列进化树结果见图9。如图所示,西伯利亚鲟与中华鲟(Acipenser sinensis)和史氏鲟形成一支,再以bootstrap值为82的支持度与金头鲷、真鲷、斜带石斑鱼、日本鳗鲡(Anguilla japonica)形成一支,最后以bootstrap值为100的支持度其他陆生脊椎动形成一支。

图5 西伯利亚鲟与其他物种LPL氨基酸序列比对结果Fig.5 Alignment results of LPL amino acid sequences between Acipenser baerii and other species
3 讨论
本研究中,我们成功克隆了西伯利亚鲟肝脏中PPARα基因全长cDNA序列,通过与其他物种的多序列比对发现,西伯利亚鲟PPARα与其他鱼类及陆生脊椎动物的同源性均大于78.4%,而且在从鱼类到哺乳动物的演化过程中DBD和LBD这2个重要的功能区域都具有较高的保守性,这与贾成霞等[18]在虹鳟中的报道类似。有意思的是,在系统进化树分析结果中显示,西伯利亚鲟PPARα并没有优先与其他鱼类的聚合分支形成一支,而是独立形成一支,并优先与其他高等陆生脊椎动物汇成一支,再与鱼类的分支聚合成一支,这说明西伯利亚鲟PPARα与陆生脊柱动物的亲缘关系比与鱼类的亲缘关系要近,在关于西伯利亚鲟的热休克蛋白(HSP70)[19]以及生长激素(GH)、生长激素受体(GHR)基因[20]的报道中也存在类似的现象,这可能与鲟鱼特殊的进化地位有关。同时,本研究首次克隆了西伯利亚鲟肝脏中LPL和HL基因全长cDNA序列,通过比较西伯利亚鲟与人、小鼠、鸡、爪蟾、鱼类等LPL、HL氨基酸序列的一级结构以及系统进化树的构建,发现西伯利亚鲟LPL、HL基因与陆生脊柱动物相似度均低于真骨鱼类,这与亲缘关系远近相一致,这也说明西伯利亚鲟LPL、HL在进化过程中均相对保守。结构功能分析表明,成熟的LPL和HL蛋白质都有N-末端和C-末端2个结构域,并且西伯利亚鲟LPL基因编码的氨基酸序列存在与HL基因编码的氨基酸序列相同的保守区域:脂质结合位点、催化位点、保守的半胱氨酸残基位点和N-糖基化位点(图5、图6),这也说明 LPL和HL起源祖先相同并且有着类似的作用机制。在与已知物种LPL和HL的氨基酸序列比对分析时发现丝氨酸-天冬氨酸-组氨酸(Ser-Asp-His)组成的三联体催化中心与真骨鱼类及其他脊椎动物的N-末端区域高度保守,此位点主要负责水解TG[21]。

图6 西伯利亚鲟与其他物种HL氨基酸序列比对结果Fig.6 Alignment results of HL amino acid sequences between Acipenser baerii and other species
内源性脂肪酸及其代谢产物是PPARs的天然配体,激活后的PPARα与视黄醇X受体形成异源二聚体,通过结合在DNA序列中的特异性序列来调控参与脂肪酸β氧化相关酶的基因活化表达以及脂肪酸转运相关酶的基因活化表达,如编码脂肪酸结合蛋白、磷酸烯醇式丙酮酸羧激酶、脂蛋白脂酶等基因[22]。在给脊椎动物饲喂富含n-3高不饱和脂肪酸的饲料后,肝脏中脂肪酸β氧化增强,大量的氧化产物会进一步促进PPARs的表达[23]。戚晓红等[24]研究表明,在发生肝细胞中毒性脂肪肝时,肝脏中PPARα的表达量减少,导致肝脏中脂肪酸代谢发生障碍,造成脂质蓄积。LPL和HL是脂肪酶家族中重要的成员,它们直接参与生物体内脂肪的代谢过程,是脂肪代谢中的关键酶[25]。在近期的研究中发现,草鱼在饥饿48 h后,LPL基因表达量显著提高,再次投喂,12 h后回到初始水平,说明草鱼LPL基因的表达受到摄食状况的调控[26]。梁旭方等[27]、Oku 等[28]在真鲷的试验中证实了LPL基因在成鱼肝脏中存在营养诱导性表达,饥饿、高脂饲料都是其表达的诱导因子,但给真鲷饲喂高脂食物时并未对其腹腔肠系膜脂肪组织LPL基因的表达造成影响。郑珂珂等[29]以5种不同脂肪水平的饲料饲喂瓦氏黄颡鱼(Pelteobagrus vachelli)早期幼鱼30 d后发现,肝脏LPL基因表达量随着饲料脂肪水平的提高有上升的趋势。早期的研究表明,离体小鼠巨噬细胞LPL基因表达可以受不同种类脂肪酸的影响,并证明PPARs受体参与此过程的调控[30]。梁旭方等[16]证实,真鲷肝脏LPL基因表达量的高低与饲料添加脂肪酸的不饱和度完全一致,说明脂肪酸通过氧化代谢来促进PPARs基因的表达并进一步促进真鲷肝脏LPL基因的表达。此外,内源性脂肪酸需要达到一定浓度才能激活PPARα,有证据表明VLDL可以通过分解提供大量的不饱和脂肪酸作为激活PPARα的配体,而VLDL的分解主要靠LPL、HL等脂蛋白脂肪酶的催化作用来进行分解,因此LPL、HL的活性在激活PPARα过程中至关重要[31]。西伯利亚鲟作为一种古老的软骨硬鳞鱼,无论在物种保护还是在作为经济鱼种的研究对象,均处于非常重要的地位,本试验成功克隆到西伯利亚鲟肝脏中PPARα、LPL、HL基因的全长cDNA序列,这为进一步研究其脂肪代谢奠定了分子生物学基础。

图7 西伯利亚鲟和其他物种PPARα氨基酸序列系统进化树聚类分析Fig.7 Cluster analysis of phylogenetic tree of PPARα amino acid sequence between Acipenser baerii and other species
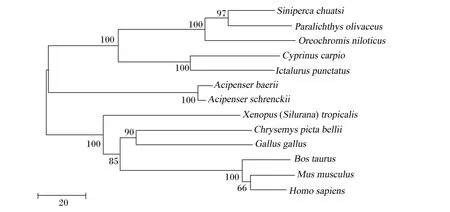
图8 西伯利亚鲟和其他物种LPL氨基酸序列系统进化树聚类分析Fig.8 Cluster analysis of phylogenetic tree of LPL amino acid sequence between Acipenser baerii and other species

图9 西伯利亚鲟和其他物种HL氨基酸序列系统进化树聚类分析Fig.9 Cluster analysis of phylogenetic tree of HL amino acid sequence between Acipenser baerii and other species
4 结 论
①本试验成功克隆得到西伯利亚鲟肝脏中PPARα、LPL、HL基因的全长 cDNA序列,通过多序列比较发现其与其他物种对应基因具有较高的相似性。
②通过构建系统发育进化树发现,西伯利亚鲟PPARα与高等脊椎动物的亲缘关系较近,LPL、HL与鱼类亲缘较近。
[1] VARGA T,CZIMMERER Z,NAGY L.PPARs are a unique set of fatty acid regulated transcription factors controlling both lipid metabolism and inflammation[J].Biochimica et Biophysica Acta:Molecular Basis of Disease,2011,1812(8):1007-1022.
[2] ABBOTT B D.Review of the expression of peroxisome proliferator-activated receptors alpha(PPARα),beta(PPARβ),and gamma(PPARγ)in rodent and human development[J].Reproductive Toxicology,2009,27(3/4):246-257.
[3] GOTO T,LEE J Y,TERAMINAMI A,et al.Activation of peroxisome proliferator-activated receptor-alpha stimulates both differentiation and fatty acid oxidation in adipocytes[J].The Journal of Lipid Research,2011,52(5):873-884.
[4] MOTTILLO E P,BLOCH A E,LEFF T,et al.Lipolytic products activate peroxisome proliferator-activated receptor(PPAR)αandδin brown adipocytes to match fatty acid oxidation with supply[J].Journal of Biological Chemistry,2012,287(30):25038-25048.
[5] LATRUFFE N,MALKI C M,NICOLAS-FRANCES V,et al.Regulation of the peroxisomalβ-oxidation-dependent pathway by peroxisome proliferator-activated receptor α and kinases[J].Biochemical Pharmacology,2000,60(8):1027-1032.
[6] TSAI M L,CHEN H Y,TSENG M C,et al.Cloning of peroxisome proliferators activated receptors in the cobia(Rachycentron canadum)and their expression at different life-cycle stages under cage aquaculture[J].Gene,2008,425(1/2):69-78.
[7] MEI C L,HE P,CHENG B,et al.Chlamydia pneumoniae induces macrophage-derived foam cell formation via PPARαand PPARγ-dependent pathways[J].Cell Biology International,2009,33(3):301-308.
[8] BIGO C,KAEDING J,EL HUSSEINI D,et al.PPARα:a master regulator of bilirubin homeostasis[J].PPAR Research,2014,2014:1-11.
[9] WONG H,SCHOTZ M C.The lipase gene family[J].The Journal of Lipid Research,2002,43(7):993-999.
[10] MUKHERJEE M.Human digestive and metabolic lipases—a brief review[J].Journal of Molecular Catalysis B:Enzymatic,2003,22(5/6):369-376.
[11] JIN W J,BROEDL U C,MONAJEMI H,et al.Lipase H,a new member of the triglyceride lipase family synthesized by the intestine[J].Genomics,2002,80(3):268-273.
[12] 黄燕,梁旭方,王琳,等.中华鲟及六种淡水养殖鱼类脂蛋白脂酶和肝脂酶基因克隆及系统进化分析[J].动物学研究,2010,31(3):239-249.
[13] 张晓刚.脂蛋白脂酶、肝脂酶与动脉粥样硬化的研究——机理与防治[D].博士学位论文.重庆:重庆医科大学,2002.
[14] CHANG C L,TORREJON C,JUNG U J,et al.Incremental replacement of saturated fats by n-3 fatty acids in high-fat,high-cholesterol diets reduces elevated plasma lipid levels and arterial lipoprotein lipase,macrophages and atherosclerosis in LDLR-/-mice[J].Atherosclerosis,2014,234(2):401-409.
[15] 宫官,薛敏,王嘉,等.西伯利亚鲟糖异生途径关键酶基因全长cDNA的克隆和序列分析[J].动物营养学报,2013,25(7):1504-1518.
[16] 梁旭方,李月琴,李贵生,等.真鲷脂蛋白脂肪酶基因顺式元件PPRE及在肝脏活体调控作用[J].热带海洋学报,2004,23(4):49-55.
[17] TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28(10):2731-2739.
[18] 贾成霞,张照斌,张清靖,等.虹鳟PPARα基因克隆、序列分析及其组织表达分布[J].中国水产科学,2012,19(4):707-714.
[19] 田照辉,徐绍刚,王巍,等.西伯利亚鲟热休克蛋白HSP70 cDNA的克隆、序列分析和组织分布[J].大连海洋大学学报,2012,27(2):150-157.
[20] 张志勇.花鲈和西伯利亚鲟利用植物蛋白源的差异及GH/IGF-I轴调节机制的比较研究[D].硕士学位论文.北京:中国农业科学院,2013:16-24.
[21] RAISONNIER A,ETIENNE J,ARNAULT F,et al.Comparison of the cDNA and amino acid sequences of lipoprotein lipase in eight species[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1995,111(3):385-398.
[22] RAKHSHANDEHROO M,KNOCH B,MÜLLER M,et al.Peroxisome proliferator-activated receptor alpha target genes[J].PPAR Research,2010,2010:1-20.
[23] LOCK E A,MITCHELL A M,ELCOMBE C R.Biochemical mechanisms of induction of hepatic peroxisome proliferation[J].Annual Review of Pharmacology and Toxicology,1989,29(1):145-163.
[24] 戚晓红,张昭萍,李晓宇,等.过氧化物酶体增殖物激活受体α在实验性大鼠脂肪肝中的表达[J].中国病理生理杂志,2003,19(9):1206-1209.
[25] HOLMES R S,VANDEBERG J L,COX L A.Comparative studies of vertebrate lipoprotein lipase:a key enzyme of very low density lipoprotein metabolism[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics,2011,6(2):224-234.
[26] 吉红,苏尚顺,刘茜,等.草鱼LPL基因的表达及饥饿和再投喂对其影响[J].水产学报,2009,33(6):980-986.
[27] 梁旭方,OKU H,OGATA H Y,等.海水鱼真鲷脂蛋白脂肪酶基因cDNA序列与组织表达[J].中国生物化学与分子生物学报,2002,18(6):712-719.
[28] OKU H,KOIZUMI N,OKUMURA T,et al.Molecular characterization of lipoprotein lipase,hepatic lipase and pancreatic lipase genes:effects of fasting and refeeding on their gene expression in red sea bream Pagrus major[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2006,145(2):168-178.
[29] 郑珂珂,朱晓鸣,韩冬,等.饲料脂肪水平对瓦氏黄颡鱼生长及脂蛋白脂酶基因表达的影响[J].水生生物学报,2010,34(4):815-821.
[30] MICHAUD S É,RENIER G.Direct regulatory effect of fatty acids on macrophage lipoprotein lipase potential role of PPARs[J].Diabetes,2001,50(3):660-666.
[31] RUBY M A,GOLDENSON B,ORASANU G,et al.VLDL hydrolysis by LPL activates PPAR-αthrough generation of unbound fatty acids[J].The Journal of Lipid Research,2010,51(8):2275-2281.

