软组织支架3D打印/压印成形工艺研究
王振,王亚宁,陈冬,郑兆波,刘亚雄,贺健康,王玲,李涤尘,靳忠民
(西安交通大学机械制造系统工程国家重点实验室,710049,西安)
软组织支架3D打印/压印成形工艺研究
王振,王亚宁,陈冬,郑兆波,刘亚雄,贺健康,王玲,李涤尘,靳忠民
(西安交通大学机械制造系统工程国家重点实验室,710049,西安)
针对当前采用3D打印技术制作软组织工程支架效率低、对细胞损伤大、圆形流道成形精度低等问题,提出了压印与打印技术相结合的直接成形新方法。首先采用压印方法结合光交联固化方法来制造具有流道结构的单层软组织支架,之后利用打印方法沿着流道注入明胶等温敏材料,通过低温环境使流道内的明胶等温敏材料固化起支撑作用,并逐层累积形成立体结构,最后利用温度控制使流道内的明胶融化,形成管道,最终形成具有流道结构的软组织支架。针对该工艺,研制开发出了相应自动化成形设备,结果表明,当扫描间距为51 mm时,光强均匀度最高,用该工艺制作出来的支架,圆弧形流道结构清晰平滑,流道相通性很好。研究结果有利于软组织工程支架微结构的精确制造,可望进一步用于细胞打印并提高细胞成活率和成形效率。
流道结构;压印/打印成形;分层制造;软组织工程
软组织工程是组织工程的一个重要分支,目前在皮肤、膀胱等简单结构组织的再造方面取得了较大的进展,已经进入临床或临床试验阶段[1-2]。但是,在较大的复杂组织的再生制造方面依然困难重重,主要原因在于厚度较薄的组织可以通过营养物质的渗透来为细胞提供营养,而厚度较大的组织需要通过血管运输营养物质给细胞。所以,模拟自然血管网络构建带有流道的三维支架,为细胞的生长提供所需的条件,引导组织器官的再生是十分重要的[3]。
文献[4]利用三维打印装置将细胞和琼脂糖混合,制造出管径小于3 mm的血管网。文献[5]采用3D打印技术,将肝细胞与壳聚糖明胶混合物进行三维受控组装,成型出具有一定三维结构的肝组织前体。但是,这些方法都采用逐点扫描打印,效率低、耗时长,对细胞损伤大,成形后的支架精度低。目前有研究提出利用基于数字光处理技术技术的光固化3D打印技术来制作组织支架[6-7]。这些方法虽然能提高支架成形的效率,但仍仅限于单材料、单细胞的光交联固化方式的成形,而且成形精度较低。压印具有以下几点优势:①具有模压成型的特点,效率高,特别适合重复性结构的制造;②在制作精细结构方面,精度较高,成形精度取决于模具的精度,特别适合具有一定圆弧度的流道成形;③压印对材料的交联固化方式没有要求,可以光交联,也可以温度交联;④压印对生物材料的生物学性能影响很小,对打印材料中的细胞基本没有压力、热源以及化学物质等造成的损伤。为此,本文提出了3D打印与压印相结合的工艺方法,并研制开发了相应的自动化成型设备。
1 成型原理与平台构建
1.1 压印/打印原理
图1所示为压印/打印工艺流。采用两种材料:一种是光敏性、水溶性材料,作为压印材料,可以单独用于制造支架,也可以复合实质细胞后一起压印,采用光交联固化方法,构建支架主体部分;另外一种是温敏性、水溶性材料,作为支撑和牺牲材料,构建流道,也可以复合内皮细胞后一起打印。具体流程如下:①用计算机设计出具有微流道的支架模型,并制作出硅胶(PDMS)模具;②向成形槽内灌注一定量的压印材料溶液,用上一步制作的PDMS模具压出结构,紫外光透过模具照射压印材料,使其固化,固化后脱模,获得带有流道结构的单层支架;③沿着上一步制作出来的流道边走边打印牺牲材料,利用低温环境使其固化;④重复前两步,直到层数达到要求;⑤将获得的三维结构置于温度较高的环境,使流道内的牺牲材料融化,即可获得带有流通管道的三维支架。

图1 压印/打印集成工艺流程图
1.2 压印/打印装置的组成

(a)运动方案设计

(b)压印/打印平台实物图图2 压印/打印实验平台
针对上述工艺过程,本文开发了相应的硬件设备,运动方案如图2a所示,实物图如图2b所示。它主要有以下几个部分组成:打印和压印喷头、40 mm×40 mm面光源、PDMS模具、干冰盒,成型槽及6轴移动台。在计算机程序的控制下,注射泵可实现打印、压印喷头的灌注操作。包含支架微结构的PDMS模具置于X2、Y2二层,干冰盒用来盛放干冰,固定在X2、Y2二层。打印喷头的管子采用聚四氟乙烯管,和自限温伴热带缠绕在一起,进行保温,防止管道里的材料固化。成型槽(内径100 mm)采用聚丙烯材料,成型槽活塞杆顶部采用倒锥角结构,起到固定支架的作用。
2 工艺实验
2.1 实验材料及设备
实验材料:聚乙二醇双丙烯酸酯水凝胶PEG(400)DA(上海宝曼生物科技有限公司),引发剂I-1173(2-羟基-甲基苯基丙烷-1-酮,陕西化玻器械有限公司),明胶,戊二醛,半透明硅胶等。
实验设备:真空注塑机(陕西恒通智能机器有限公司),磁力搅拌机,紫外辐照度计。
2.2 溶液的制备
(1)PEG(400)DA溶液(光敏材料)的配备[8]:量取一定体积的PEG(400)DA单体溶于去离子水中,配制体积分数30%的PEG(400)DA单体溶液,每组加入体积分数为0.5%的光引发剂I-1173,磁力搅拌10 min。
(2)明胶溶液(温敏材料)的配置:称取一定量的明胶粉末,用去离子水溶解,得到质量分数10%的明胶溶液,将溶液置于40 ℃水浴中加热至明胶粉末完全溶解。配置0.25%的戊二醛溶液,按体积比32∶1在明胶溶液中加入戊二醛溶液,搅拌30 min。
2.3 模具的制备
利用Pro/Engineer软件,设计出具有流道结构的支架CAD模型,并将CAD模型导成3D模型文件格式(标准模板库)数据格式。利用快速成型机将CAD模型加工成树脂支架,将树脂支架粘在具有平整底面的容器上,有结构的面朝上,同时将模具固定板置于支架的上方,模具固定板采用有机玻璃制作,有机玻璃板上开有适量道锥孔,用来固定PDMS模具,如图3所示。将PDMS与固化剂以质量100∶2的比例混合均匀,在真空条件下灌入容器内,在室温下放置12 h使PDMS完全固化,脱模后即可获得包含支架结构负型的PDMS模具。

图3 压印模具
2.4 光强的均匀性优化
2.4.1 光强测定 制作出来的压印模具是由有机玻璃和PDMS组成的,各个点的透光率必然是不同的,因此有必要先对光强分布进行测定,方法如下:采用40 mm×40 mm面光源透过压印模具照射,光源底部距离模具顶部15 mm,在模具底部,沿着一条直线上均匀选择15个点,每个点间距10 mm,测定光强,用Matlab进行插值拟合,如图4所示(图4上的15个点为测量数据)。
由图4可知,光强中间部分较强,两端光强较弱。用该光源对内径较大的成型槽(如内径100 mm)进行照射,光强会分布很不均匀。因此,对于较大面积支架成形采取光源扫描固化的方式。

(a)光强测定示意图

(b)光强分布图4 光强分布测定
2.4.2 光强扫描优化 由前文得到的光强分布,用Matlab对相邻两光强分布进行优化,得到合适的光源扫描间距,如图5所示。当两个波峰之间的间距为54 mm时,不均匀度δ最小,为1.36%,表达式为
(1)


图5 光强合成分布
2.4.3 实验验证 由于压印模具各个位置点的透光率不同,因此对上一步优化的结果有必要进行实验验证。扫描方法如图6所示,扫描间距分别取48、51、54、57、60 mm,对于每一组扫描间距,在模具下方连续取7个测量点,间距为H/6。对于每一个测量点,光源透过模具沿着图示扫描路径进行扫描照射,扫描速度为5 mm/s,每隔2 s采集一次紫外线照度计的数值,在光源扫描路径1和2上分别采集12个时间点,对时间积分得到各个测量点的曝光量,结果如图7所示。曝光量不均匀度δe为
(2)

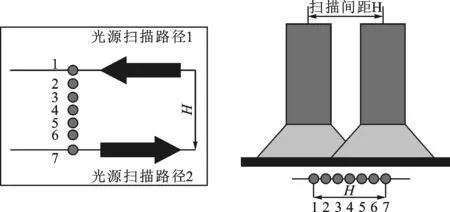
图6 光源扫描测定光强
由图7可知,当扫描间距为51 mm时,曝光量不均匀度为5.02%,比其他几组扫描间距的不均匀度低,实验结果和理论值比较接近,但还是存在一些差距。压印模具是由有机玻璃和PDMS组成,有机玻璃分布一些倒锥孔,用来固定PDMS,因此各个点的透光率不同,测量的结果也不会有严格的变化趋势,如图7所示的对于每个扫描间距的7个测量点的曝光量变化趋势是存在差异性的。透光率的不同主要是由有机玻璃(透光率高)和PDMS(透光率低)的组合造成的,因此只需要通过改进压印模具的有机玻璃和PDMS的组合结构就可以进一步改善各个点的透光率。在本实验中,扫描间距为51 mm,曝光量不均匀度已经满足条件,因此扫描间距设定为51 mm。

图7 不同扫描间距对曝光量不均匀度的影响
2.5 工艺试验结果
将明胶溶液和PEG(400)DA溶液分别倒入溶液槽内,将干冰切成块状,放入干冰盒,打开计算机软件,设置每层溶液的添加量、冷冻时间、单层支架厚度,按照压印/打印平台的成型槽最大尺寸和单层最大厚度来制作支架。按照设备最大极限尺寸Φ100 mm和单层最大厚度3 mm制作的支架如图8所示,充分显示了压印/打印工艺的高效率,这种大面积的支架可以用于皮肤软组织及其支架的成形。在一般生物学实验中,仅需制作较小的支架(如Φ10 mm,高度10 mm的支架)。
从图8可以看出,用打印/压印技术制作出来的的支架流道结构清晰可见,圆弧状流道比较平滑,充分体现了压印在制作精细流道结构方面的优势,而且层与层之间的连接比较紧密,形状保持良好。以上结果表明,用该方法制作立体微流道支架是完全可行的。
3 讨 论
软组织体积较大,血管是软组织的重要组成部分。如何模拟自然器官血管网络构建三维流道支架是当前研究的重点。支架内部的流道为细胞提供营养物质,运走新陈代谢产物,对支架的生物性能有关键影响[9-11]。本文提出的压印/打印技术具有以下优势。
(1)本工艺成形效率高。传统组织工程主要依赖于手工操作,造成支架的成形效率低、结构保持性以及重复性差。组织工程支架多具有重复性结构,而目前基于点扫描方式的3D打印技术多采用逐点扫描、逐点固化的方式,效率较低,耗时长,不利于细胞的存活。压印具有模压成型的特点,在制造重复性结构上效率高,而且不改变材料的性能,对细胞的损伤小。

(a)三维支架

(b)剖切外圆周的三维支架

(c)支架局部流道放大图图8 用打印/压印技术制作的支架
(2)本工艺对材料没有特殊的要求,可以实现材料的多种交联固化方式,并且可以复合细胞进行多材料、多细胞的打印成形。基于DLP技术的光固化3D打印技术,虽然成形效率较高,但是目前无法实现多材料、多细胞的精确分布和个性化成形,材料的固化方式仅限于光交联固化方法。本文实验选择两种生物材料,一种是光敏材料,可以复合肝细胞等实质细胞,作为支架的主体;一种是温敏材料,作为牺牲材料,可以复合内皮细胞,用来构建流道,起到支撑下一层结构的作用,在支架完成之后,通过温控方法使其融化,形成流道,此时会有部分内皮细胞贴壁生长,有利于血管的形成。本文提出的压印/打印成形方法,还可适用于两种温敏材料的成型,如胶原与明胶,胶原在pH值为7.0、温度高于0 ℃会自发成胶,因此可以把胶原作为压印材料,复合肝细胞等实质细胞,把明胶作为牺牲材料,复合内皮细胞来制作软组织支架。通过改造设备,增加喷头数量,还可实现多种压印材料和多种牺牲材料的一体化成形,制造出的软组织支架的每层结构的材料都不一样。
(3)支架流道结构取决于模具,如果模具的结构越小,理论上制作出来的支架流道也就越小。且压印可以制作出半圆形的流道,流道表面的平滑程度取决于模具表面的平滑程度,流道越平滑越有利于内皮细胞的爬壁生长。如果是具有多种形状结构的模具,可以制作出每一层结构都不一样的支架,流道网络也就很丰富。
(4)该工艺有望进一步拓展模具材料的可选择范围。文献[12]提出使用冰制模具来制造多孔肝组织支架,实验结果表明,引入冰制模具实现了微流道结构和与外界空间完全连通的多孔结构,有利于细胞初始接种率和后期培养中细胞的活性表达。速冻液的快速发展降低了细胞材料一体化低温成形的难度,因此模具可以尝试用冰模代替PDMS,压印材料用温度交联固化方法,如水凝胶、肝细胞和速冻液混合,利用超低温冰模制作软组织支架。
本文实验中使用了光交联固化方式,紫外光对细胞是有损伤的,不同类型的细胞对紫外光的耐受力不同,本文采用的模具是由PDMS和有机玻璃组成,需要进一步改进模具的组合构造,来提高模具各个点的透光均匀性,以此减少紫外光对支架和细胞成形的损伤。
虽然采用本文搭建的3D打印/压印实验平台能够制作出三维微流道支架,但还是有很多工艺需要进一步深入研究。例如:如何进一步提高压印精度;明胶融化后对支架层间连接强度的影响;本文提出的工艺在后期需要复合细胞进行实验,观察细胞的生长情况,针对不同的细胞,改变压印模具来改善各个点的透光均匀性,并且通过实验严格控制好紫外光曝光量和曝光时间,使软组织支架在成型行过程中,细胞具有较高的存活率;为进一步提高细胞存活率,后期还可以通过更换可见光光源以及光敏材料来实现。
4 结 论
(1)针对采用3D打印技术成形软组织支架效率低、对细胞损伤大、圆形流道成型精度低等难题,本文提出了压印/打印集成技术工艺方法。研制开发了相应的自动化成形平台,进行了光强均匀性优化的工艺分析,得到扫描间距为51 mm时光强均匀度最高的结果。
(2)采用该工艺方法制作出来的软组织支架,层与层之间连接紧密,流道结构清晰平滑,且形状保持良好。研究结果表明,这种方法制作立体微流道支架是完全可行的,制作效率较高,并且有希望用于细胞打印研究。
[1] ATALA A, BAUER S B, SOKER S, et al. Tissue-engineered autologous bladders for patients needing cystoplasty [J]. The Lancet, 2006, 367(9518): 1241-1246.
[2] GROEBER F, HOLEITER M, HAMPEL M, et al. Skin tissue engineering: in vivo and in vitro applications [J]. Advanced Drug Delivery Reviews, 2011, 63(4/5): 352-366.
[3] 王烨, 贺健康, 刘亚雄, 等. 三维微流道支架直接成形压印方法 [J]. 西安交通大学学报, 2012, 46(10): 116-120. WANG Ye, HE Jiankang, LIU Yaxiong, et al. Direct imprinting of three-dimensional microfluidic scaffolds [J]. Journal of Xi’an Jiaotong University, 2012, 46(10): 116-120.
[4] MIRONOV V, KASYANOV V, MARKWALD R R. Organ printing: from bioprinter to organ biofabrication line [J]. Curr Opin Biotechnol, 2011, 22: 667-673.
[5] YAN Y, WANG X, PAN Y, et al. Fabrication of viable tissue-engineered constructs with 3D cell-assembly technique [J]. Biomaterials, 2005, 26(29): 5864-5871.
[6] LIU T V, CHEN A A, CHO L M, et al. Fabrication of 3D hepatic tissues by additive photopatterning of cellular hydrogels [J]. Faseb J, 2007, 21(3): 790-801.
[7] LIN H, ZHANG D, ALEXANDER P G, et al. Application of visible light-based projection stereolithography for live cell-scaffold fabrication with designed architecture [J]. Biomaterials, 2013, 34(2): 331-339.
[8] 朱林重, 连岑, 靳忠民, 等. PEGDA水凝胶的光固化成形工艺及其性能评价 [J]. 西安交通大学学报, 2012, 46(10): 121-126. ZHU Linzhong, LIAN Qin, JIN Zhongmin, et al. Fabrication and evaluation of PEGDA hydrogel using stereo-lithography for cartilage tissue engineering application [J]. Journal of Xi’an Jiaotong University, 2012, 46(10): 121-126.
[9] HE J K, LI P C, LIU Y X, et al. Preparation of chito san-gelatin hybrid scaffolds with well organized microstructures for hepatic tissue engineering [J]. Acta Biomaterialia, 2009, 5(1): 453-461.
[10]DADO D, LEVENBERG S. Cell scaffold mechanical interplay within engineered tissue [J]. Seminars in Cell & Developmental Biology, 2009, 20(6): 656-664.
[11]SONG Y S, LIN R L, MONTESANO G, et al. Engineered 3D tissue models for cell-laden microfluidic channels [J]. Analytical and Bioanalytical Chemistry, 2009, 395(1): 185-193.
[12]MAO M, HE J K, LIU Y X, et al. Ice-template-induced silk fibroin-chitosan scaffolds with predefined microfluidic channels and fully porous structures [J]. Acta Biomaterialia, 2011, 8(6): 2175-2184.
[本刊相关文献链接]
罗楠,王泉,刘红霞.一种快速3D打印分层方向确定算法.2015,49(5):140-146.[doi:10.7652/xjtuxb201505022]
张文友,贺健康,刘亚雄,等.韧带-骨支架仿生界面设计与制造方法.2014,48(10):137-142.[doi:10.7652/xjtuxb201410 022]
岳桂华,滕奇志,何小海,等.岩心三维图像修复算法.2014,48(9):37-42.[doi:10.7652/xjtuxb201409007]
张琳彦,朱利.以多幅图像非几何约束线段匹配重建建筑物外立面三维线段模型.2014,48(4):15-19+25.[doi:10.7652/xjtuxb201404003]
朱琳,贺健康,刘亚雄,等.琼脂糖/胶原复合水凝胶的制备及性能研究.2013,47(10):121-126.[doi:10.7652/xjtuxb2013 10021]
李世泽,魏正英,杜军,等.微压印中抗蚀剂填充行为研究.2013,47(9):126-133.[doi:10.7652/xjtuxb201309021]
王烨,贺健康,刘亚雄,等.三维微流道支架直接压印成形方法.2012,46(10):116-120.[doi:10.7652/xjtuxb201210020]
朱林重,连芩,靳忠民,等.PEGDA水凝胶的光固化成形工艺及其性能评价.2012,46(10):121-126.[doi:10.7652/xjtuxb201210021]
郝星,贺健康,高琨,等.蚕丝蛋白/明胶多孔肝组织支架的制备及性能研究.2011,45(11):121-126.[doi:10.7652/xjtuxb 201111023]
赵倩,刘亚雄,高琨,等.肝组织工程支架的仿生设计与有限元分析.2011,45(8):108-112.[doi:10.7652/xjtuxb201108 019]
(编辑 杜秀杰)
3D Printing/Imprinting Molding Process of Soft Tissue Scaffolds
WANG Zhen,WANG Yaning,CHEN Dong,ZHENG Zhaobo,LIU Yaxiong,HE Jiankang,WANG Ling,LI Dichen,JIN Zhongmin
(State Key Laboratory for Manufacturing Systems Engineering, Xi’an Jiaotong University, Xi’an 710049, China)
Focusing on the low efficiency, lager cell damage and low forming accuracy of circular channel in soft tissue scaffolds construction by 3D printing technology, a novel method is presented to fabricate scaffolds by combining imprinting with 3D printing techniques. The imprinting technique is combined with light crosslinking method to make single-layer soft tissue scaffold with flow channel structure. Then, gelatin, a kind of temperature-sensitive material, is injected along the flow channel by printing technique to cure in the low temperature environment to support the upper layers. A stereoscopic structure is formed via the layer-by-layer accumulation. The gelatin is finally melted in the flow channel by temperature control to form pipelines. An automatic fabrication device is developed to realize the strategy. The results demonstrate that the light uniformity reaches the maximum when the scanning interval reaches 51 mm, and that the arc-type flow channel structure is clearly visible and interlinked. The approach is beneficial to accurate manufacture of soft tissue scaffolds, and it can be expected to improve cell survival rate and forming efficiency in cell printing.
channel structure; imprinting/printing; layer-by-layer fabrication; soft tissue engineering
2015-01-31。 作者简介:王振(1990—),男,硕士生;刘亚雄(通信作者),男,教授,博士生导师。 基金项目:国家自然科学基金资助项目(51275387);中央高校基本科研业务费专项资金资助项目。
时间:2015-06-29
10.7652/xjtuxb201508023
Q811.2
A
0253-987X(2015)08-0141-06
网络出版地址:http:∥www.cnki.net/kcms/detail/61.1069.T.20150629.1137.005.html

