铜色牛肝菌活性胞外多糖的发酵优化研究
许春平,刘远上,李萌姗,赵姗姗,史超文
(1.郑州轻工业学院食品与生物工程学院,河南郑州450002,2.河南农业大学生命科学学院,河南郑州450002)
铜色牛肝菌活性胞外多糖的发酵优化研究
许春平1,刘远上1,李萌姗1,赵姗姗1,史超文2
(1.郑州轻工业学院食品与生物工程学院,河南郑州450002,2.河南农业大学生命科学学院,河南郑州450002)
选择发酵液中的胞外多糖含量为生物指标,对其进行培养基(碳源、氮源、无机盐)和环境条件(pH、温度)的优化,最后确定了蔗糖50 g/L,酵母粉5 g/L的最优培养基和温度=25℃,pH=6的最优培养条件;用优化后的条件通过5 L式发酵罐发酵培养铜色牛肝菌,5天后胞外多糖产量达1.84 g/L。胞外多糖经除蛋白后,通过ABTS、DPPH、临二氮菲法测其抗氧化性,结果表明其胞外多糖具有很好的抗氧化能力。
铜色牛肝菌;胞外多糖;液体发酵;优化;抗氧化
铜色牛肝菌(Boletusaereus Fr.ex Bull)伞菌目、牛肝菌科、牛肝菌属,夏秋季生于栎等林中地上,可以食用,味道好,是一种食药用真菌,属于外生菌根菌。但是不能人工栽培,可用菌丝体进行深层发酵培养[1]。
食药用真菌具有有抗氧化、抗肿瘤、降血压、降血糖、抗病毒等功效,而这些功效的发挥与真菌多糖有着密切的关系[2]。真菌多糖是由10个以上的单糖通过糖苷键连接而成的高分子多聚物,具有复杂的生物活性和功能[3],可提高免疫力调节身体的各项机能[4]。真菌多糖分为胞内多糖和胞外多糖,胞外多糖主要从发酵液中提取,因为液体发酵可以实现大规模生产多糖,生产周期短,操作简单等优点,现在工业化生产多糖大多采用液体发酵法[5-7],尤其是铜色牛肝菌,只能通过液体深层发酵获得大量多糖。
本文主要是对铜色牛肝菌深层发酵培养基和环境条件进行优化,为工业化生产铜色牛肝菌多糖提供理论依据,并且通过临二氮菲法、DPPH法、ABTS法测定铜色牛肝菌胞外多糖的抗氧化性,探索其对各种自由基的清除能力。
1 材料与方法
1.1 材料
1.1.1 菌种
铜色牛肝菌菌种来自于河南省生物菌种保藏中心。
1.1.2 培养基
PDA培养基(马铃薯25%,葡萄糖1%,琼脂1.5%~2.0%),液体种子培养基(葡萄糖3%,蛋白胨0.3%)。
1.1.3 试剂
乙醇、浓硫酸、DPPH、邻二氮菲、1.5%过氧化氢、FeSO4均为分析纯;ABTS试剂盒:碧云天生物技术研究所。
1.1.4 仪器
JYT-5QYC200恒温振荡摇床:上海福玛实验设备有限公司;5L搅拌式真菌发酵罐:上海百伦科技有限公司;METTLER 4E200电子分析天平:上海沛欧分析仪器有限公司;RE-52AA旋转蒸发器:上海亚荣生化仪器厂;CF16RXⅡ日立离心机:日本HITACHI;UV-17001C紫外分光光度计:上海凤凰光学科仪有限公司。
1.2 实验方法
1.2.1 菌种活化
将保存于试管斜面培养基中的铜色牛肝菌菌丝块接种于PDA平板培养基上,26℃下培养7 d[8]。
1.2.2 液体种子培养
用打孔器打取活化好的PDA铜色牛肝菌丝块(约1 cm2)两块接入含50mL种子培养基的250mL三角瓶中,置于于26℃160 r/min恒温振荡摇床中培养4d。然后加入灭过菌的玻璃珠置于磁力搅拌器上将菌丝块打碎后备用。
1.2.3 葡萄糖标准曲线的测定
精密称取105℃干燥至恒重的葡萄糖标准品1 g,溶解稀释后定容到100mL容量瓶中,配成10mg/mL的葡萄糖贮备液,精密吸取贮备液1mL定容至100mL,配成0.1mg/m L的葡萄糖标准液。精密移取葡萄糖标准液0.0、0.2、0.4、0.6、0.8、1.0μL,于25mL具塞刻度试管中,加蒸馏水至1.0mL,再各加5%苯酚溶液1mL摇匀,迅速加入浓硫酸溶液5m L,放在振荡器上震荡均匀,置沸水浴中加热15 min,取出再置于冰水中15 min,用紫外分光光度计于490 nm,以蒸馏水代替葡萄糖溶液作为对照测定吸光值。
1.2.4 单因素实验
探究不同碳源、氮源、无机盐、pH、温度对铜色牛肝菌胞外多糖含量的影响,基础培养基为3%葡萄糖,0.3%蛋白胨,每组实验设3个平行试验,培养时间为8 d,摇床转速为160 r/min,接种量为4%,pH=5。碳源选用的是3%的葡萄糖、麦芽糖、蔗糖、果糖、木糖、乳糖;氮源选用的是0.3%的牛肉膏、蛋白胨、酵母粉、大豆粉、磷酸铵、硝酸钾;无机盐选用的是FeSO4、MnCl2、MgSO4、CaCl2、K2HPO4和空白对照(3%葡萄糖,0.3%蛋白胨);pH=3、4、5、6、7、8、9;温度=20、25、28、30℃。
1.2.5 碳源浓度和C/N比实验
在单因素实验基础上,探究碳源浓度和碳氮比对铜色牛肝菌胞外多糖含量的影响。碳源浓度分别为1%、2%、3%、4%、5%、6%;碳氮比分别为1∶1、10∶1、20∶1、30∶1。每组实验设3个平行试验,培养时间为8 d,摇床转速为160 r/min。
1.2.6 菌丝干重的称量和胞外多糖含量的测定
用抽滤法[9]将菌丝和发酵液分离,将滤纸和菌丝置于70℃的烘箱至干燥后称量,再除去滤纸干重即为菌丝干重。
菌体含量(g/L)=菌丝干重(g)/发酵液体积(m L)× 1 000
把发酵液浓缩后加入4倍乙醇,置于4℃冰箱过夜处理,第2天把处理液放在转速为10 000 r/min离心机中离心10min后弃去上清,用蒸馏水溶解沉淀定容至250mL,然后用苯酚硫酸法[10]测发酵液中的多糖含量。
1.2.7 铜色牛肝菌在发酵罐中的培养
根据单因素优化和交互作用实验确定的培养基配方配制3 L于5 L发酵罐中,接种量4%,通气量2 vvm,搅拌速度160 r/min,培养8 d,然后将发酵液浓缩后醇沉[11]出胞外多糖冷冻干燥以备后用。
1.2.8 胞外多糖的抗氧化作用
ABTS法测定铜色牛肝菌胞外多糖的总抗氧化力。ABTS在一定的氧化剂作用下可以氧化成绿色的ABTS,当有抗氧化物存在时ABTS的氧化就会被抑制,在734 nm或405 nm测定ABTS的吸光度即可测定并计算出样品的总抗氧化能力[12]。Trolox是一种维生素E的类似物,具有和维生素E相近的抗氧化能力,可以作为其它抗氧化物总抗氧化能力的参照物。
DPPH法测定胞外多糖对DPPH的清除率。DPPH在有机溶剂中是一种稳定的自由基,有自由基清除剂存在时,DPPH的单电子被捕捉而使其颜色变浅,在最大光吸收波长处的吸光值下降,且下降程度呈线性关系,吸光度水平的降低表明抗氧化性的增加,从而可以计算出样品的抗氧化能力[13]。
临二氮菲法测定胞外多糖对·OH的清除率[14],以前是利用邻二氮菲可与Fe2+生成橙红色有色物用来检测样品中Fe2+的方法。由于H2O2在Fe2+的催化作用下生成具有高反应活性的羟基自由基(Fenton反应)能够氧化反应体系中的Fe2+,因此出现了用来检测Fenton反应产生羟自由基的邻二氮菲法。
2 结果分析
2.1 葡萄糖标准曲线的绘制
以葡萄糖浓度为横坐标,吸光度值为纵坐标绘制标准曲线,如图1所示。
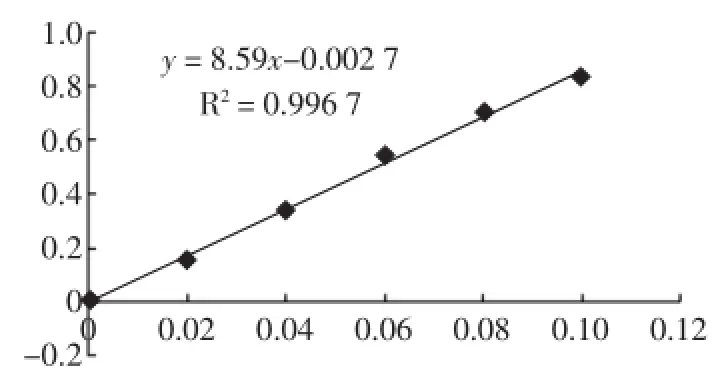
图1 葡萄糖标准曲线图Fig.1 Glucose standard curve graph
2.2 碳源、氮源、无机盐对多糖含量的影响
碳源、氮源、无机盐对多糖含量的影响见表1。
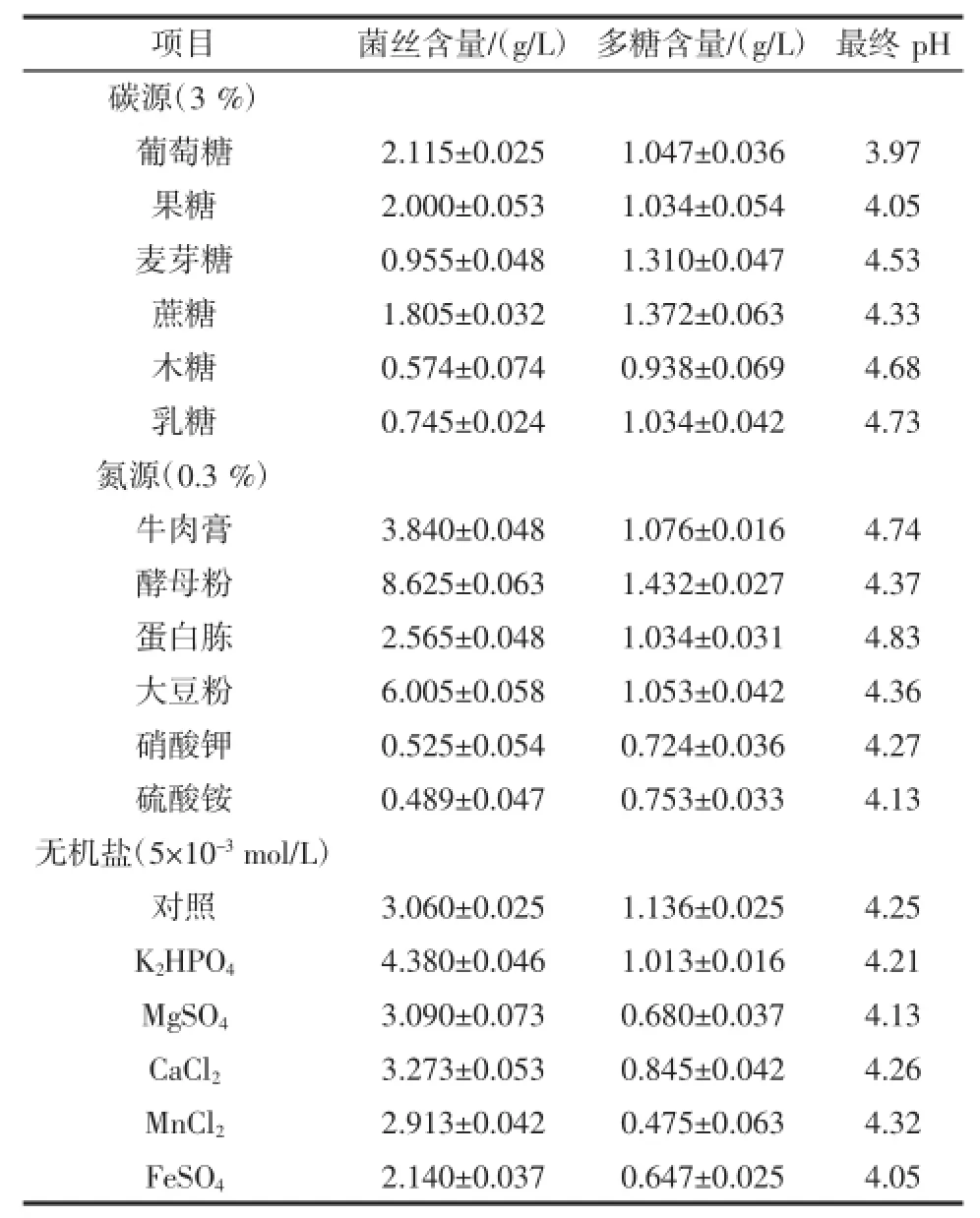
表1 不同碳源、氮源、无机盐对铜色牛肝菌菌丝含量和胞外多糖含量的影响*Table1 Effect of carbon,nitrogen and mineral source on mycelial growth and EPS production by B.aereus in shake flask cultures*
由表1分析可知,蔗糖>麦芽糖>葡萄糖>果糖=乳糖>木糖,麦芽糖和蔗糖作为碳源都能获得较高的多糖含量,但是在工业化生产中,蔗糖的成本更低,而且能产得更多的菌丝,所以选择蔗糖作为最优碳源,葡萄糖、果糖、乳糖、木糖作为碳源,胞外多糖含量比较接近。
在氮源的优化过程中,可以观察到,铜色牛肝菌在有机氮源的培养基中生长很好,在无机氮源的培养基中生长很慢并且菌丝很少,说明铜色牛肝菌不能很好的利用无机氮源。而在有机氮源中富含各种氨基酸,这些氨基酸可以直接被菌丝吸收加以利用,因此利用这种氮源时,菌丝生长较快,胞外多糖产量相对较高[15]。无论是选择发酵液中的胞外多糖含量还是菌丝含量作为生物指标,都应该选酵母粉作为最适氮源。
无机盐的加入并没有提高铜色牛肝菌胞外多糖的产量,所以在实验中不再添加无机盐。
2.3 环境条件对胞外多糖含量的影响
2.3.1 初始pH对胞外多糖含量的影响
以液体种子培养基为基础培养基,其他条件保持不变,培养基pH分别为3、4、5、6、7、8、9,确定最适pH。结果如图2(A)所示,铜色牛肝菌在pH=3-9都能生长,最适pH为6。
2.3.2 培养温度对胞外多糖含量的影响
以液体种子培养基为基础培养基,初始pH=5,其它条件不变,温度分别为20、25、28、30℃,结果如图2(B)所示,温度为25℃时菌丝含量和多糖含量都是最高,而其它3个温度差异不明显。
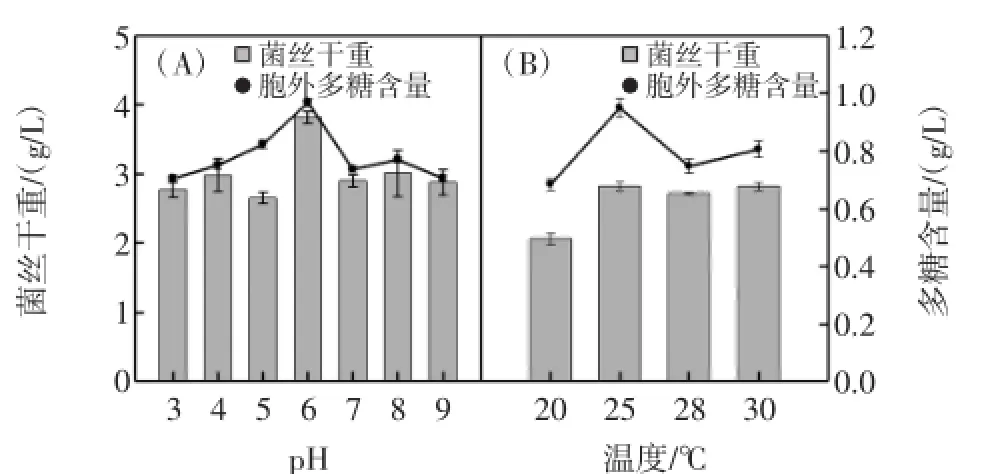
图2 不同pH和温度条件对铜色牛肝菌菌丝含量和胞外多糖含量的影响Fig.2 Effect of pH and temperature on mycelial growth and EPS production by B.aereus in shake flask cultures
2.4 不同碳源浓度和碳氮比对胞外多糖含量的影响
改变碳源浓度,其它条件不变,每组实验设3个平行实验,结果见图3和图4。
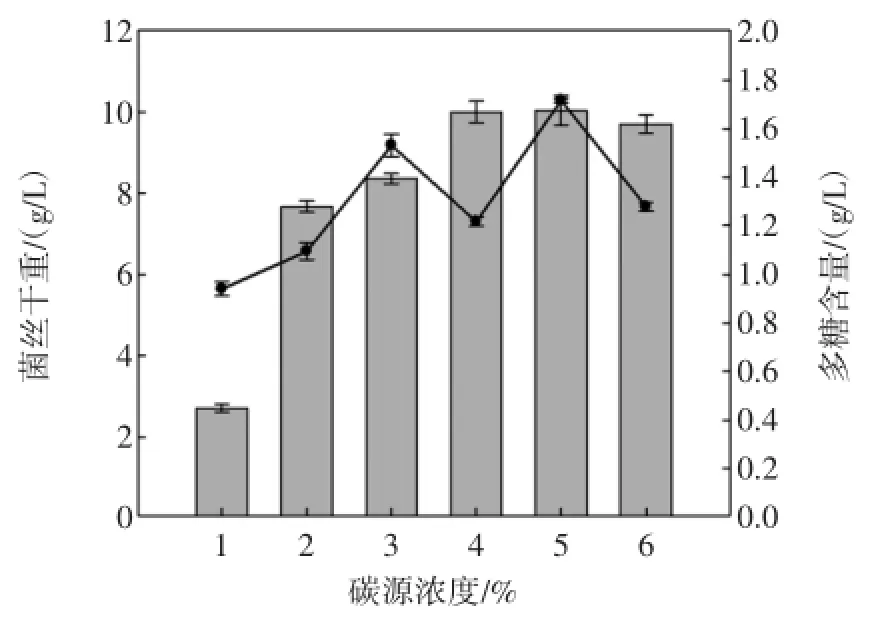
图3 不同碳源浓度对铜色牛肝菌菌丝含量和胞外多糖含量的影响Fig.3 Effect of Carbon concentration on the mycelial growth and EPS production by B.aereus
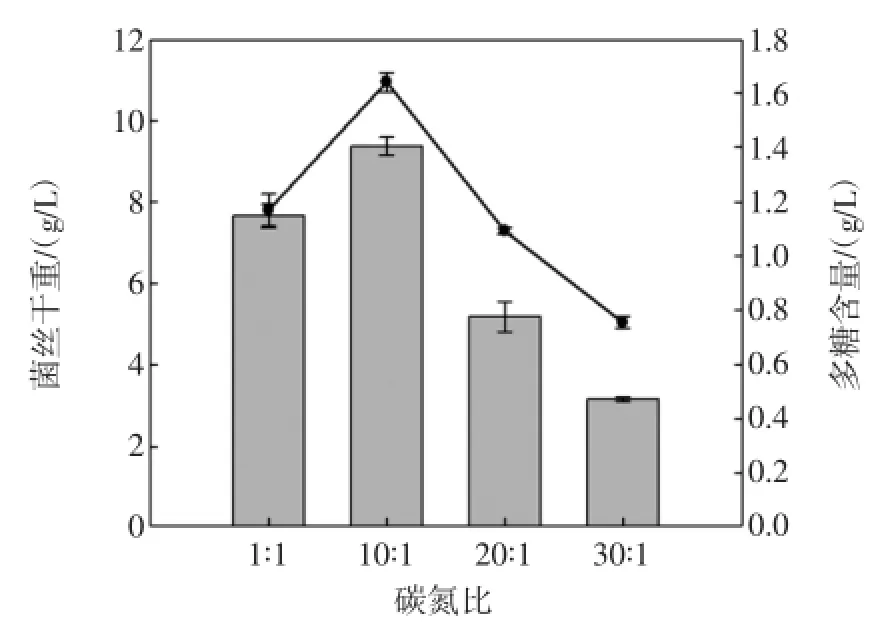
图4 不同的碳氮比对铜色牛肝菌菌丝含量和胞外多糖的影响Fig.4 Effect of C/N ratio on the mycelial growth and EPS production by B.aereus
由图3分析可知,质量分数5%的蔗糖试验组的菌丝含量和胞外多糖含量最高,而质量分数1%、2%、3%、4%的蔗糖试验组碳源不足,菌丝体干重和胞内外多糖含量较低;质量分数6%的碳源存在时,则抑制菌丝的生长和胞外多糖的合成。所以,质量分数5%为最适碳源浓度。
图4为不同的碳氮比对铜色牛肝菌菌丝含量和胞外多糖的影响,蔗糖与酵母粉比例达到10:1时,菌丝含量和胞外多糖含量都达到最高水平。正如Yuan et al的实验结果,赤芝的碳氮比也是10∶1[16]。综上所述,最适碳源及浓度为蔗糖:50 g/L,最适氮源及浓度为5 g/L。
2.5 铜色牛肝菌发酵罐实验
发酵时间与pH、菌丝干重、残糖和EPS产量等指标的相关变化情况见图5。
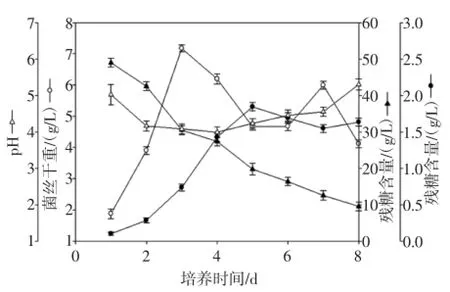
图5 利用5L发酵罐发酵过程中菌丝干重、胞外多糖、pH和残糖随时间的变化图Fig.5 Time course of the mycelial growth,EPS production,pHand residual glucose in 5-L stir red-tank bioreactor.
由图5分析可知,发酵液EPS含量从接种首日开始就逐渐升高,在第5天达到最大值(1.84 g/L),此后含量趋向平稳。而菌丝干重随时间的增加而快速升高,在第3天达到最大值,随后降低。残糖含量在发酵过程中不断减少,但pH变化不是很明显。
2.6 铜色牛肝菌胞外多糖抗氧化性研究
如图6(A)所示,总抗氧化力随着多糖浓度的增加而增大,呈现一定的相关性,最后当胞外多糖浓度到10 g/L时,其总抗氧化力与0.171mM Trolox相等,同样,铜色牛肝菌胞外多糖清除DPPH和·OH自由基的能力都随着多糖浓度的增大而增强,如图6(B),多糖浓度由6 g/L到8 g/L的斜率明显大于2 g/L到6 g/L的斜率,当多糖浓度为10 g/L时,,清除DPPH自由基高达62.23%。并且清除·OH自由基能力也随着多糖浓度的增加而逐渐增强,如图6(C)所示,最高清除率达到61.37%。结果表明铜色牛肝菌胞外多糖具有很好的抗氧化能力,这种能力是因为其分子中有大量的羧基(-COOH)、羰基(C=O)、醚基(-O-)以及其它基团。这些基团与自由基发生反应时可以提供电子使自由基以一种更稳定的形式存在,或者使自由基引起的链式反应停止[12]。
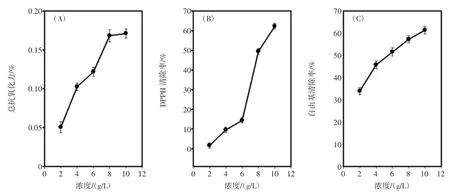
图6 铜色牛肝菌胞外多糖抗氧化效果图Fig.6 Antioxidant activity of B.aereus polysaccharides.
3 结语
本实验以胞外多糖含量为指标,对铜色牛肝菌的发酵培养基进行优化,最适培养基为:蔗糖50 g/L,酵母粉5 g/L,pH=6,温度25℃。将优化结果应用于5 L式发酵罐,培养8 d后处理发酵液得到胞外多糖,然后通过ABTS、DPPH、临二氮菲法测其抗氧化性,结果表明铜色牛肝菌胞外多糖具有很好的抗氧化能力。
[1]卯晓岚.中国大型真菌[M].郑州:河南科技出版,2000
[2]李小定,荣建华,吴谋成.真菌多糖生物活性研究进展[J].食用菌学报,2002,9(4):50-58
[3]孟庆虹,张守文.真菌多糖的研究进展[J].粮食与食品工业,2003 (3):42-44
[4] HE Q T,ZHANG S.Advances in the stueies on the mechanism of immuno-potentiation effect of polysaccharides from edible-medicinal fungi[J].Europe Pub Med Central,2004,11(2):52-58
[5]李艳玲,苏延友,苗苗,等.泰山蛹虫草菌产胞外多糖发酵工艺的研究[J].泰山医学院学报,2007,28(12):942-944
[6]FANG Q H,ZHONG J J.Submerged fermentation of higher fungus Ganoderma lucidum for production of valuable bioactive metabolites—ganoderic acid and polysaccharide[J].Biochemical Engineering Journalc,2002,10(1):61-65
[7]赵翾.灵芝菌丝体液体深层发酵研究进展[J].食品研究与开发, 2011,32(12):225-228
[8] 陈文强,邓百万.美味牛肝菌深层发酵的研究[J].四川大学学报, 2005,42(2):368-372
[9]柯轶,巫文政,毛宁.一株虫草类真菌的液体发酵产胞内多糖培养基的优化[J].海峡科学,2010(7):3-5
[10]Dubois M,Gilles K A,Hamilton J K.Colorimetric Method for Determination of Sugars and Related Substances[J].Analytical Chemistry,1956,28(3):350-356
[11]曾念开,王秋颖,苏明声.鲍氏针层孔菌生产菌丝体及胞外多糖的液体发酵培养[J].中国中药杂志,2008,33(15):1798-1801
[12]Leung PH,Zhao S,Ho KP.Chemicalproperties and antioxidant activity of exopolysaccharides from mycelialculture of Cordy cepssinensisfungusCs-HK1[J].Food Chemistry,2010,114(4):1251-1256
[13]林恋竹,赵谋明.反应时间对DPPH·法、ABTS+·法评价抗氧化性结果的影响[J].食品科学,2010,31(5):63-67
[14]任莉颖,刘康,李宏婧.发酵炮制对红花抗氧化活性的影响[J].中国临床医学杂志,2005,6(8):47-49
[15]韩茂慧.柳小皮伞胞外多糖液体发酵培养基的优化研究[J].安徽农学通报,2006,12(10):58-60
[16]Yuan B J,Chi X Y,Zhang R J.Optimization of exopolysaccharides production from a novel strain of Ganoderma lucidum cau5501 in submerged culture[J].Brazilian Journal of Microbiology,2012,43(2): 490-497
Optimization of Active Exopolysaccharides Production by Submerged Culture of Boletus Aereus
XU Chun-ping1,LIU Yuan-shang1,LI Meng-shan1,ZHAO Shan-shan1,SHI Chao-wen2
(1.College of Food and Biological Engineering,Zhengzhou University of Light Industry,Zhengzhou 450002,Henan,China;2.College of Life Science,Henan Agricultural University Zhengzhou 450002,Henan,China)
In this paper,optimization of liquid culture medium components (carbon and nitrogen sources,mineral salt)and fermentation condition (pH and temperature)to produce exopolysaccharides (EPS)was carried out.The optimum medium was sucrose 50 g/L,yeast extract5 g/L,temperature 25℃,with initial pH at 6.Under the optimized culture conditions in a 5-Lstirred-tank reactor,the EPS was obtained upto 1.84 g/Lat5 d. After after removing protein,the antioxidant activity of EPS was measured by ABTS,DPPH,phenanthroline method.The results showed that the EPS has good antioxidant capacity.
Boletus aereus;exopolysaccharides;liquid fermentation;optimization;antioxidant
10.3969/j.issn.1005-6521.2015.03.033
2013-07-15
国家教育部国际合作与交流司“留学人员回国科研启动基金”教外司留[2012]940
许春平(1977—),男(汉),教授,博士,研究方向:生物化工和烟草工程。

