生物钟与衰老退行性变关系的研究
何本进 梁庆华 胡才友 孙 亮 朱小泉 原惠萍 杨 帆 李星慧 秦娇琴
贾春媛2 韩 晶2 杜建财2 张翻弟2 杨 泽2
2.北京医院 北京老年医学研究所 100730
国家科技部十二五支撑计划(2012BAI10B01);北京市科技新星计划(Z12133002512058)
生物钟与衰老退行性变关系的研究
何本进1,2梁庆华1※胡才友1※孙亮2朱小泉2原惠萍2杨帆2李星慧2秦娇琴1,2
贾春媛2韩晶2杜建财2张翻弟2杨泽2
2.北京医院北京老年医学研究所100730
国家科技部十二五支撑计划(2012BAI10B01);北京市科技新星计划(Z12133002512058)
【摘要】在自然环境下,生物体内的生物钟接受外界光-暗和温度等周期信号,调整自身的时相,与外界环境保持同步。生物钟控制着昼夜节律,使其具有内源性和自我维持运转的特点。通过裸藻野生型和突变株系在生理生化等方面节律的变化,进一步分析起决定性作用的生物钟成分,从而深入剖析生物钟与昼夜节律之间的机制,及生物钟与衰老退行性变关系,本文对此进行了综述。
【关键词】生物钟昼夜节律细胞分裂周期纤细裸藻
几乎所有生物的许多生理活动和生化反应都表现出一种内源性的近似1小时的昼夜节律现象,昼夜节律是自然界最普遍的一种现象,可使生物体的生理、生化、行为等生命现象发生周而复始的节律性变化。这些昼夜节律现象受生物钟调节,内源性生物钟是产生昼夜节律的基础。裸藻是介于动物和植物之间的单细胞真核生物, 有光条件下叶绿体产生类囊体, 有光合功能产生, 成为自养型代谢;暗条件下叶绿体不能发育形成类囊体结构, 只能进行异养型的代谢。本文综述了在裸藻野生型与突变株系中昼夜节律对细胞分裂节律的影响以及生物钟与昼夜节律振荡器之间的作用机制。
1.野生型和突变裸藻的细胞分裂节律性
许多藻类、真菌和原生动物的细胞分裂周期显示出细胞分裂或“孵化”的持续昼夜节律[1]。细胞分裂只发生在特定的昼夜循环相位——经常有恒定的黑暗或光照(人工黑夜),相当于同步化昼夜循环中的黑暗间隔。这种“阀门效应器”现象反映一种昼夜振荡器(CO)和细胞分裂周期(CDC)之间的相互关系,在裸藻中已经被广泛研究[2]。因为其将作为一种基本的机制分析,通过实现生物钟与细胞周期之间耦合,所以我们要深入探讨节律的种类。
1.1野生型株系昼夜生物钟的典型特性——通过白天而不是1小时光照和温度循环、持久性、起始反应性、可移动性、相位奇点和温度补偿来导引——发现可以用来描述在光合自养生长、绿色野生型株系中细胞分裂的节律[3~5]。其中后两个特性更值得一提。
1.2奇异点数学研究已经预测,昼夜振荡器可能被描述为无节律的,显示为无相性、静止状态——在昼夜周期特定时间(把这个“奇异点”叫S*)给予一定强度和持续时间的临界相[6,7]。随着刺激强度的增加,过渡期从1型(弱脉冲)到0型(强脉冲),复位在特定阶段的点必需是不连续的,这个“断点”是相当于唯一的奇点。这种预测已经在一些昼夜系统的光和化学干扰中得到证明,潜在的细胞分裂节律的时钟也不例外。
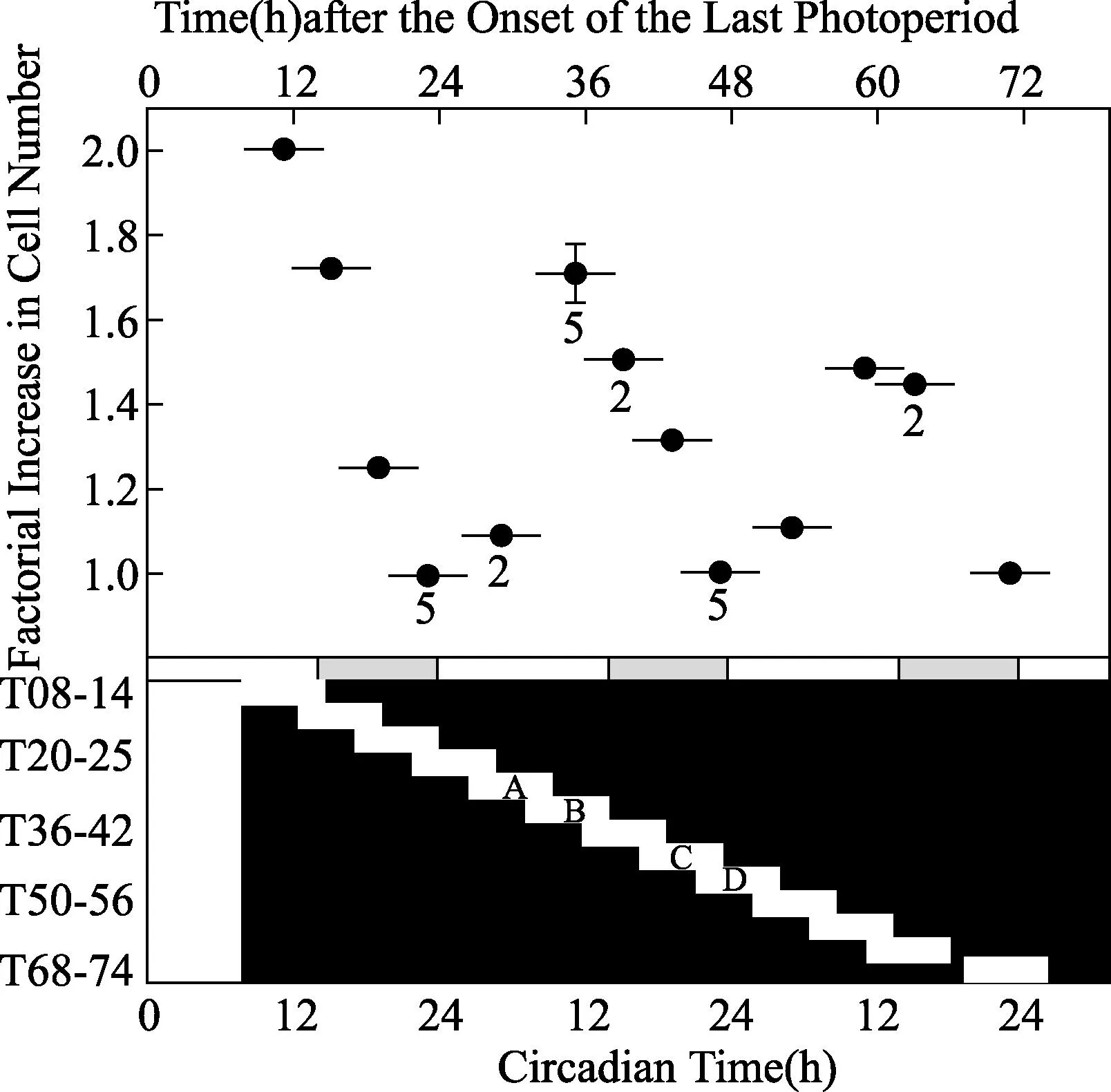
奇异点的定位在纤细裸藻光合自养生长的细胞,细胞分裂的昼夜振荡器潜在不同步的节律行为受一种“临界的” 3小时光信号所干扰。最初三个同相位、一起分裂的细胞都被利用,在一种3小时光照:3小时黑暗生活规则中,每一个细胞显示一个约19小时稳定的τ。在昼夜时间(CT)0.4里,3小时的700勒克斯信号干扰细胞A而细胞B仅被3小时的190勒克斯干扰(在施加的昼夜循环里,每替换正常光间隔中的一个,就有7500勒克斯的强度,用阴影箭头代表)。而前者的信号引出一个相位漂移(ΔΦ) +11.2小时(以1为模式)昼夜时间(实时等于14.0小时),与之相比较的,见到7500勒克斯光信号,尽管在群体中细胞分裂继续,但后者更弱的光脉冲(曲线B)诱导无节律性。如果三分之一细胞(曲线C)被一个与190勒克斯相同强度的3小时信号所干扰,在一个轻微不同的昼夜时间(CT21.5)里却被加强,尽管相位在某种程度上观察到7500勒克斯脉冲时被延迟(ΔΦ=-8.0小时,CT实时等于-10.0小时),但细胞分裂节律继续。(摘自Malinowski JR, Laval-Martin DL, Edmunds Jr LN.J Comp Physiol B,1185,155:257-267.ⓒ Springer-Verlag.)图1 相位漂移节律
这个“临界脉冲”的存在和其相对应的S*不仅更加支持裸藻这种昼夜振荡器调节细胞分裂周期的假设,也表明起搏器可能限制循环动力学。因为结果是由细胞群体获得,所以在单个细胞中我们不能推断振荡器的这种状态。细胞的无节律性也许就是单个细胞分裂周期位相分散的结果(细胞不连贯),引起脉冲不同地相位漂移同步化的细胞。或者,临界脉冲也许已停止由群体组成的每一个昼夜节律时钟(但不是继续进行的细胞分裂周期)。
1.3光诱导定型与光周期的控制裸藻和绿色裸藻更早的研究工作表明细胞分裂周期由两个连贯的过程组成[10~14]:预定型阶段和定型阶段。在细胞分裂周期的G1期,前者的过程将依赖光合作用生长。A点表示G1期细胞的生长进程是依赖光的时间,而T点代表细胞甚至在晚上都能完成细胞分裂周期的时间。如果预定型阶段的细胞转移到连续黑暗,细胞分裂会被立即阻止在A点与T点间某处,而当定型阶段的细胞转移到连续黑暗,细胞分裂周期的剩余时间继续进行,直到接下来的周期停止在A点[10]。裸藻细胞分裂周期进程中的光合作作用规则就类似于异养型生物的营养控制。酿酒酵母或粟酒裂解酵母的营养匮乏,使细胞分裂周期停留在G1期或者G2期[15~17],而前进已经超出了“开始”(在G1/S边界)或者控制大小检测点的酵母细胞致力于完成细胞分裂周期,即使它们正在经受饥饿[18]。
一项裸藻在对数线期能进行光合自养生长的细胞分裂周期进程中昼夜效应的研究,Hagiwara等[19]证明黑暗诱导细胞分裂周期停滞和光诱导定型向细胞周期转变。不仅在G1期,也在后G1期发现光依赖的限制点。因此,如果营养从连续光照转移到连续黑暗,在G1, S 或者G2期的一些(定型的)细胞甚至在连续黑暗时就能经历一个或两个细胞分裂周期过渡,最终停滞在S期、G2期或有丝分裂G1后期。其他(未定型的)细胞在细胞分裂周期是不能继续前进的。接受更高强度光照的定型细胞,更可能在连续黑暗时经历细胞周期转变,以及在每个细胞分裂周期中更早地定型。在细胞分裂周期的G1, S 或 G2期的固定相点不能完成定型。
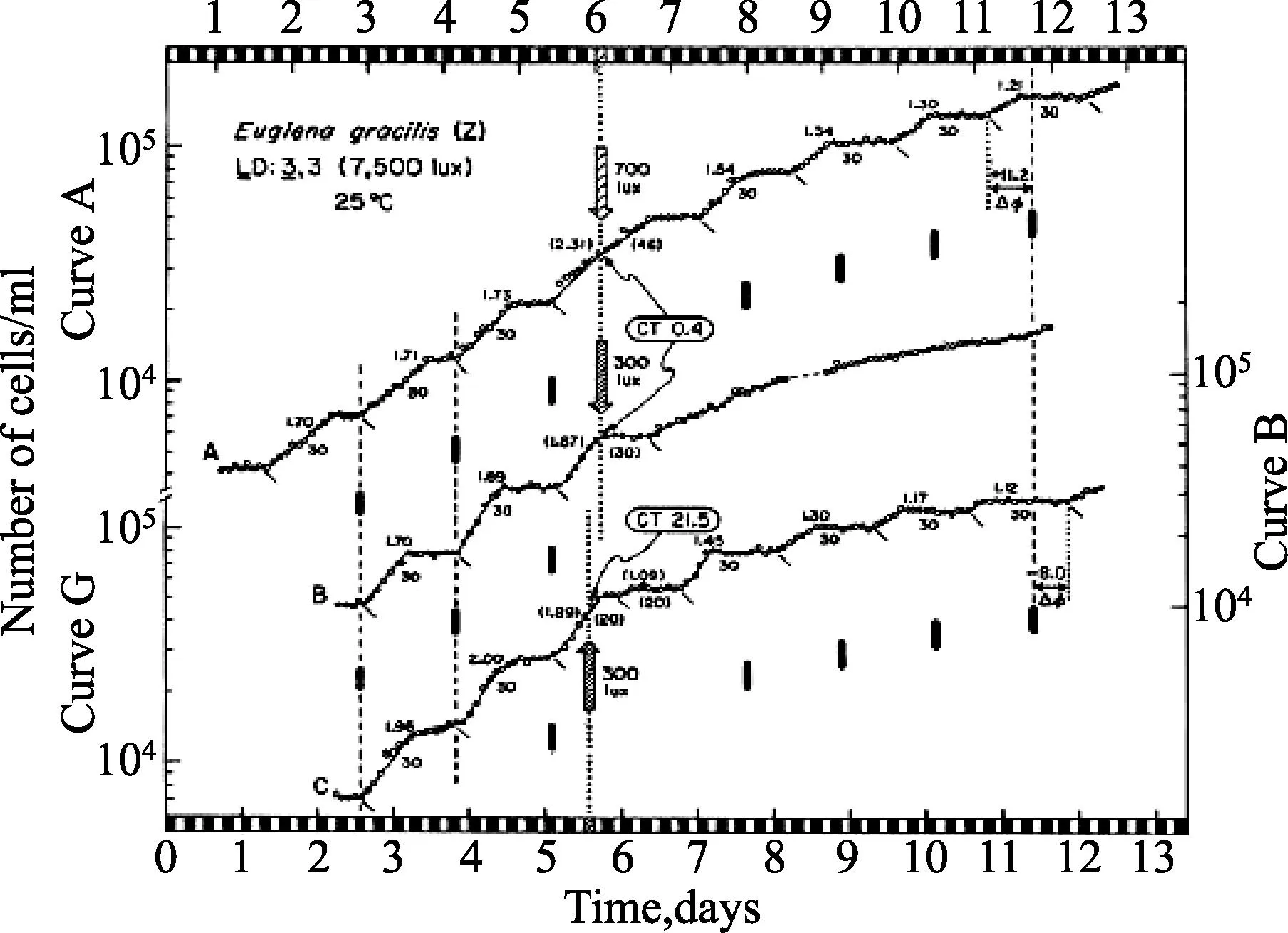
因此,裸藻细胞分裂周期转变的定型,由光强度组成细胞周期相位的成熟度控制。另外,Hagiwara等[20]已经证明,昼夜振荡器可以调节这些细胞分裂周期相位转变定型的光响应。当裸藻细胞被14小时光照:10小时黑暗调节,然后被转移到连续黑暗时,在最后昼夜光周期的第8个小时,细胞就停滞在G1、S或G2期。随后这些在不同昼夜时间暴露6小时光脉冲的暗停滞细胞,在细胞分裂周期以依赖脉冲的昼夜时间方式允许它们进一步推进(图2)。光诱导的最大值发生在微暗的环境(昼夜时间CT12)。这些结果证明有一种细胞周期转变定型的光诱导的昼夜阀门效应器,不只是细胞分裂,也更早涉及这些部分——细胞繁殖的光周期调节。应用除草剂敌草隆(DCMU)、DBMIB、甲基紫精(TMPD)和CCCP作抑制试验的结果显示:细胞分裂G2期细胞的光诱导定型,在非周期性光合作用的电子传递中,需要源自上游信号的光,特别是细胞色素b6-f,但不需要进程中所要求的能量代谢[20]。
纤细裸藻Z细胞分裂光诱导定型的昼夜阀门效应器和光周期的控制。细胞被调节到14小时光照:10小时黑暗,然后给予最后一个在释放到连续黑暗之前缩短到8小时的光周期。随后,细胞在不同的昼夜时间(所谓“暗期干扰”试验)给予一个6小时的光照间隔。上图:在细胞群生长中因子增加(ss) 是由光脉冲诱导。下图:每行代表在延伸夜晚的连续黑暗之间,6小时光照间隔的时间设置[T范围,“人工的”昼夜循环开始后数小时,在面板之间由白色和阴影线条显示,表示前面的14小时光照:10小时黑暗循环仍在继续。在黑暗间隔中间绘制数据(封闭空间)],通过这些数据,横线显示它们的持续时间(6小时)。每一数据点下的数字表示试验重复次数; SEM 很小以致误差线都被隐藏在数据点内。(摘自 Hagiwara S, Bolige A, Zhang Y et al.Photochem Photobiol,2002,27:31-39.ⓒ American Society for Photobiology.)图2 细胞分裂周期的光诱导定型与光周期
1.4突变株系为了消除生物钟可能存在的细胞间区和排除之前常引起节律性及提供生长能量的可能信号影响,我们已经选了无叶绿素的裸藻ZC突变株——一种必需的有机异养型生物——一系列用来平行于那些在野生型株系中开展的研究[16]。细胞分裂节律可能被12小时光照:12小时黑暗调节,或甚至由单脉冲架构的光周期调节(1小时光照:23小时黑暗),节律跟随着连续黑暗自由振荡至少8天(τ=25.5小时),提供总的增长速率或世代时间(g)>1小时(图5)。类似地,从其他裸藻光合作用的突变株中很少获得这样的结果,比如白色、热褪色、无叶绿素的W6ZHL株系和紫外光诱发P4ZUL突变株[1,13,15]。ZC突变株光信号的0型相位反应期曲线是从15个相位漂移试验中生成[16](图3);这条相位反应曲线(图4)类似于先前用野生型株系获得的结果[9]。这些研究为细胞分裂周期控制中昼夜振荡器的作用,提供了更加确凿的证据,有效避免了施加昼夜循环双用途的问题:作为生长的能源或者“基质”和作为潜在生物钟的时间暗示(授时因子)。
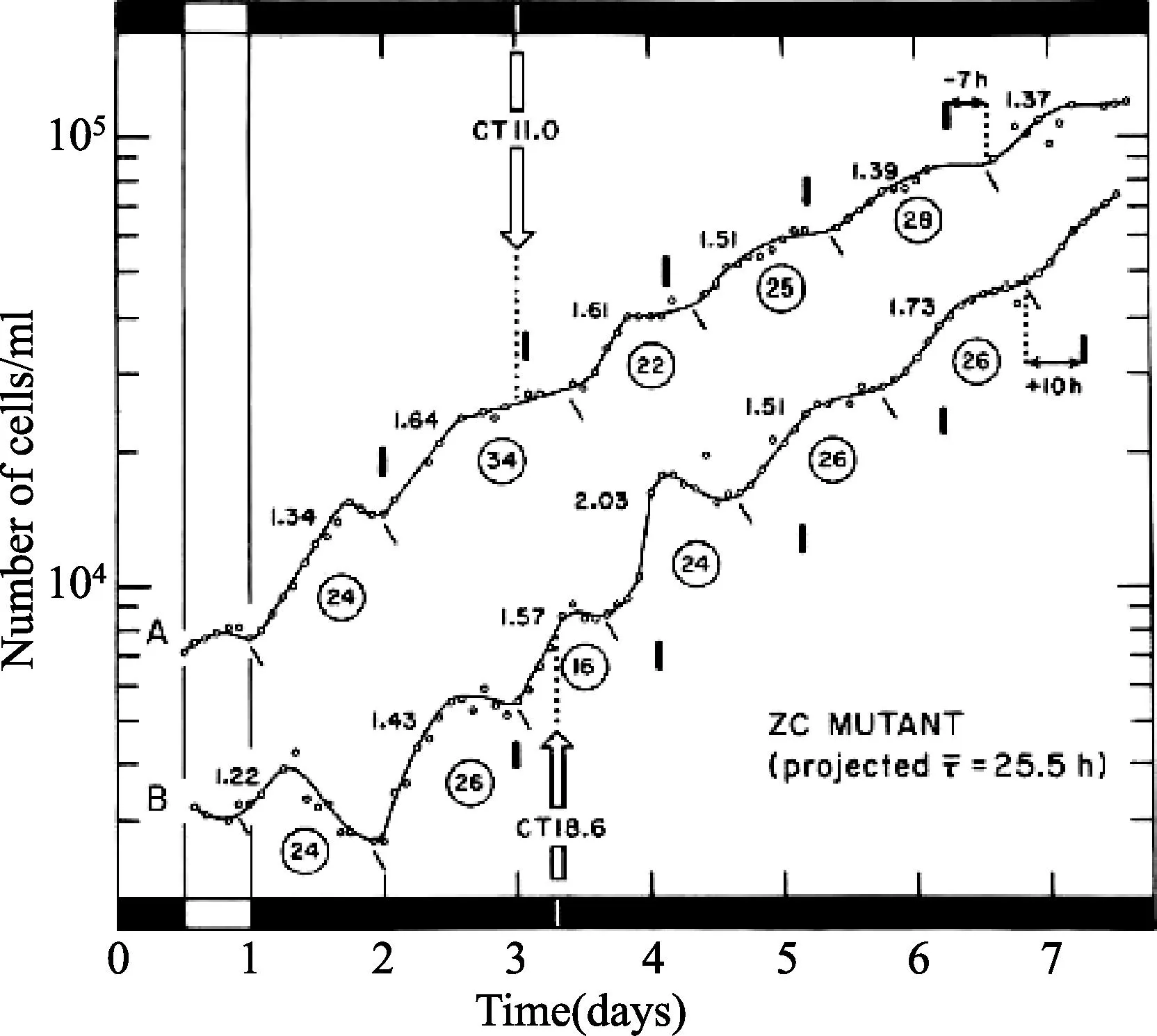
先前被12小时光照:12小时黑暗调节,纤细裸藻(Z株系)无叶绿素的ZC突变株,在连续黑暗里,不同昼夜时间给予1小时光信号(1900勒克斯)调节,在添加乙醇的矿质培养基中16.5℃批量培养(0.1%),在连续黑暗中同时区分的两种细胞A、B被光脉冲干扰,其中间发生在1.5小时或者7.0小时(分别对应于昼夜时间11.0或昼夜时间18.6),接着发生细胞分裂(在昼夜时间12下降)。瞬态减弱后,振荡器的τ值约为25.5小时。这种在相位节律(垂直虚线)和被预测(实线标记)节律之间的相位(ΔΦ)有区别,在它被干扰之前能够被测量到,认为代表由光信号产生的稳态ΔΦ。τ (25.5小时)值以前用于计算未干扰节律的相位,是由全部试验获得的合并均值。在相应梯级左边给予的步长(ss,通常少于2个,表示不是每个细胞分裂都会被分开),每个振荡器的估计时间(τ,细胞分裂的连续发生间隔)表示1个周期。(摘自 Carré I, Oster AS, Laval-Martin DL et al.Curr Microbiol,1189,19:223-221.ⓒ Springer-Verlag.)图3 细胞分裂的相位漂移不同步节律
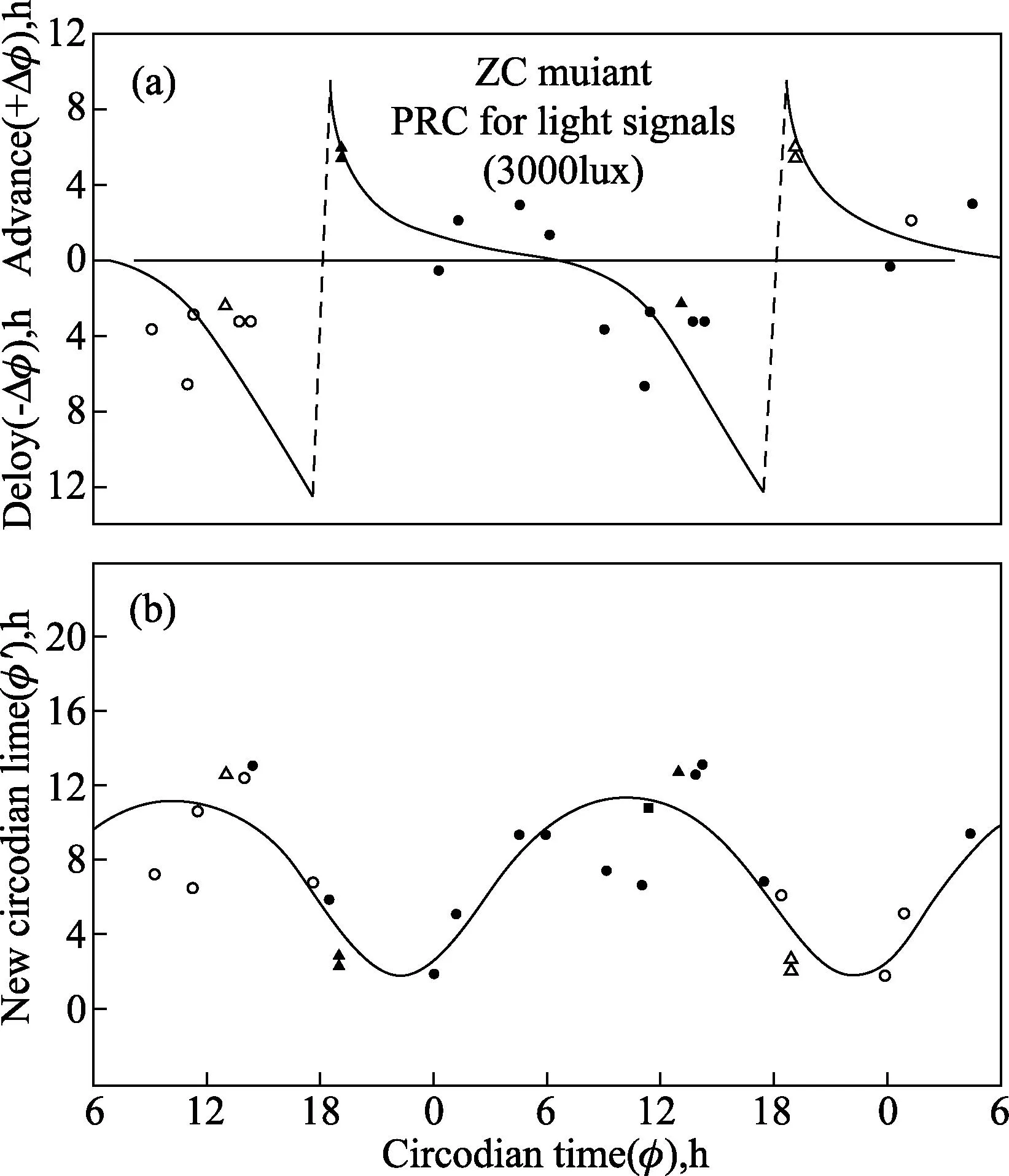
在纤细裸藻无叶绿素ZC突变株的细胞分裂的不同步节律上,对于光信号(1900勒克斯)的重置操作,相位反应曲线(A)维持在连续黑暗中。稳态相位漂移(±Δ)由1-h (·)产生和3-h(H)脉冲由如(图3)描述所决定,向1小时规范化。结果是双绘制的(开符号),作为昼夜时间(以1小时为模)的功能 ,其中信号的中点是已经给予。不连续性(“断点”或“时相陡变”由虚线表示)是这种绘图所固有的。在曲线B中,新合成的昼夜时间(’=±Δ)随着干扰,由昼夜时间()的功能绘制,其中信号已经给予,结果是平滑的正弦曲线。(摘自 Carré I, Oster AS, Laval-Martin DL, et al.Curr Microbiol,1189,19:223-221.ⓒ Springer-Verlag.)图4 光合作用的昼夜节律
因此昼夜振荡器在裸藻的细胞分裂周期控制中起到很重要的作用,作为其他真核细胞的代表。有丝分裂不是一个振荡器重要的组成部分,但却位于其下游。细胞分裂的阻断不应让这个系统停止振荡[21,22]。因此细胞分裂会是潜在生物钟的一只“手”。我们已经用两种方法在野生型中检验了这个假说:①如果不同步的分裂节律由于Vit B12原始水平低下而停止,而如果这种抑制随后通过B12重新向媒介释放,节律又能在未被干扰的控制中重新开始。②若给不同步的细胞以乳酸的脉冲,暂时加速细胞分裂周期和覆盖昼夜振荡器[13],当补充的基质被耗尽后,节律期最终恢复,节律期又处在平静控制的阶段。这些结果与之前发现的结果相符,因为通过向媒介加入含硫化合物,在连续光照里, P4ZUL突变体不同步的节律性同步恢复[15]。
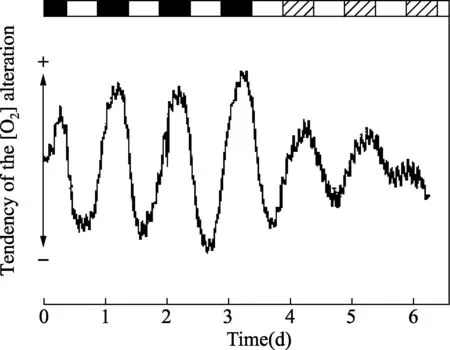
在细胞媒介里自由氧浓度的规范数据,由12小时光照:12小时黑暗导引,然后释放到连续光照里。(摘自Wolff D, Künne A.J Plant Physiol,2000,156:52-59.ⓒ Urban & Fischer Verlag.)图5 裸藻无色突变株呼吸活动的昼夜节律
1.5无色裸藻突变株的呼吸活动光合作用的昼夜节律在纤细裸藻野生型Z培养物中已被报道[23],其中媒介里的自由O2浓度用克拉克电极连续测量。中午产氧达峰值,节律在连续光照里持续至少8个周期,从而更早证实发现的结果[24,26]。这些数据被延伸到缺乏功能叶绿体的无色突变株[23],但就这个株系,节律相位在野生型菌株中却是相反的,在(人工的)黑夜,媒介中出现氧气浓度的最高值(图5)。突变株细胞的节律直接对更复杂的昼夜循环起反应,红光(>518nm)和蓝光(<550nm)在调节呼吸活动与给定的白光相比,如8小时光照:8小时黑暗(同步化这些细胞)同样有效。因此,能量的需求要么由光合作用,要么由呼吸作用提供,取决于细胞的类型,这都是受光和昼夜节律生物钟两者的控制。光合作用节律的起源,可能位于与这两个光合系统相关的光捕获蛋白(LHCPs)的光诱导综合体内,这个综合体受生物钟控制,人工白天显示增加高达20倍(见下面部分)[27]。
2.昼夜节律振荡器与细胞周期生物钟之间的耦合
我们已经回顾了裸藻细胞分裂周期的生物钟控制的证据(与其他微生物一样)。这种“阀门效应器”现象反映的是昼夜振荡器和细胞分裂周期之间的相互关系。如果不是作为振荡器自身的一个要素,而是作为输入输出信号通路的连接环,这种耦合可受cAMP影响,在细胞分裂周期的调节和生物钟功能中已经涉及[18]。
真核细胞的细胞分裂周期是一个复杂的级联事件,以细胞复制为顶点[28]。从一种调节状态到另一种开始的这些转变,是它们自身的反馈控制,决定细胞物理状态的底物修饰。由遗传和生化分析阐述的基本机制,已经在以下生物体中保守,如酵母菌、非洲爪蟾蜍、蛤蚌、海星受精卵、培养的人类细胞和高等植物[29]。
两个重要转变控制点存在细胞分裂周期G1/S 和 G2/M边界。M期被描述为激酶的激活(MPF,成熟促进因子,当注入爪蟾卵细胞时,以诱导细胞分裂的能力命名),其中包含两个组件子单元。一个是p34cdc2蛋白(S.非洲粟酒基因cdc2或同族体的产物,S.啤酒的CDC28),其能使体内的酪蛋白及组蛋白H1磷酸化和在有丝分裂有最大的激酶活性。另一个是细胞周期蛋白,其浓度在细胞分裂周期之间波动。它在细胞间期逐步地累积,形成p34cdc2复合体和激活蛋白激酶;在有丝分裂中降解,灭活激酶和MPF的活性。 因此,细胞周期蛋白-cdc2/CDC28 (MPF) 系统就像一个振荡器或者“生物钟”,在有丝分裂时重设到细胞间期和其似乎组成一个通用的细胞分裂循环的“引擎”[29]。现在我们知道细胞周期蛋白的整个家族,p34cdc2周期性地把调节细胞分裂周期进程的蛋白激酶活性联系起来造成连续波动,在植物和动物的细胞分裂周期中, cdc2关联基因的确切种类得到不同表达。
2.1环腺苷酸(cAMP)的作用众所周知,cAMP在细胞的调节中起着关键作用[30],可影响昼夜振荡器和p34cdc2——细胞周期蛋白通路之间的耦合,(可能和其他参与者一致)参与细胞分裂周期活动的阀门效应器到昼夜周期的特定相位。
甚至,cAMP 似乎有能力控制细胞分裂周期进程中某些限速步骤,刺激一些细胞的增值,但在其他细胞,却有相反的效果,或一点效果都没有[31,32]。在很多细胞类型中, cAMP的短暂增加与G1/S 和 G2/M边界的细胞周期转变有关。酵母菌的遗传试验和哺乳动物的药学研究[30,33]已经显示,cAMP水平的一过性升高和接着下降,对于DNA的合成和MPF的诱导酪氨酸-脱磷酸作用激活的启动是有必要的[34],第二次cAMP剧增与完成相关,从有丝分裂中退出[35]。细胞分裂周期不同相位中,cAMP 浓度的相似变化已在裸藻中出现[36]。这些信号分别与p34cdc2-p60 (G1细胞周期蛋白)蛋白激酶复合物和p34cdc2-细胞周期蛋白B (有丝分裂细胞周期蛋白) 蛋白激酶复合物功能相一致。
因此,在动物和酵母菌中, cAMP 浓度波动代表细胞分裂周期进程,信号转导的重要环节。在真核细胞里,AC信号通路的转录调节下刺激受cAMP-响应核因子家族调整。这些因子包含基本的结构域/亮氨酸拉链模序和cAMP-反应元件(CRE)二聚体。CRE-结合蛋白(CREB)的功能由cAMP依赖性蛋白激酶的磷酸化作用调整。
2.2环腺苷酸(cAMP)对细胞分裂节律的干扰如果周期性的信号在裸藻细胞分裂节律的产生中起作用,通过昼夜振荡器,干扰或覆盖cAMP水平的控制这一条件应该在下游活动中引起扰乱[18]。用了这种药(图6A),依靠细胞分裂周期的相位,引起细胞分裂周期的缩短或加长,通过外源性cAMP,其振荡的干扰导致了来自昼夜定时器细胞分裂周期的暂时解耦合。当在CT16 和 CT22之间给予cAMP时,能观察到前进;当在CT03和 CT09之间给予cAMP时,能获得下一个同步分裂步骤(相当于9小时)的延迟。在CT06-08和 CT18-20时获得最大效应,相当于内源性cAMP 水平是最低的时间。在昼夜时间已经获得细胞分裂周期的最大+ΔΦs 或者 -ΔΦs,也可得到计量反应曲线。仅仅1 nM cAMP足以干扰细胞分裂周期运输。与细胞分裂周期的细胞周期蛋白生物钟相比,不像可兴奋组织,其cAMP的确能相位漂移信号输出节律[37,38],昼夜振荡器不用通过添加cAMP来重置:分裂节律回到原始位相(图6B)。
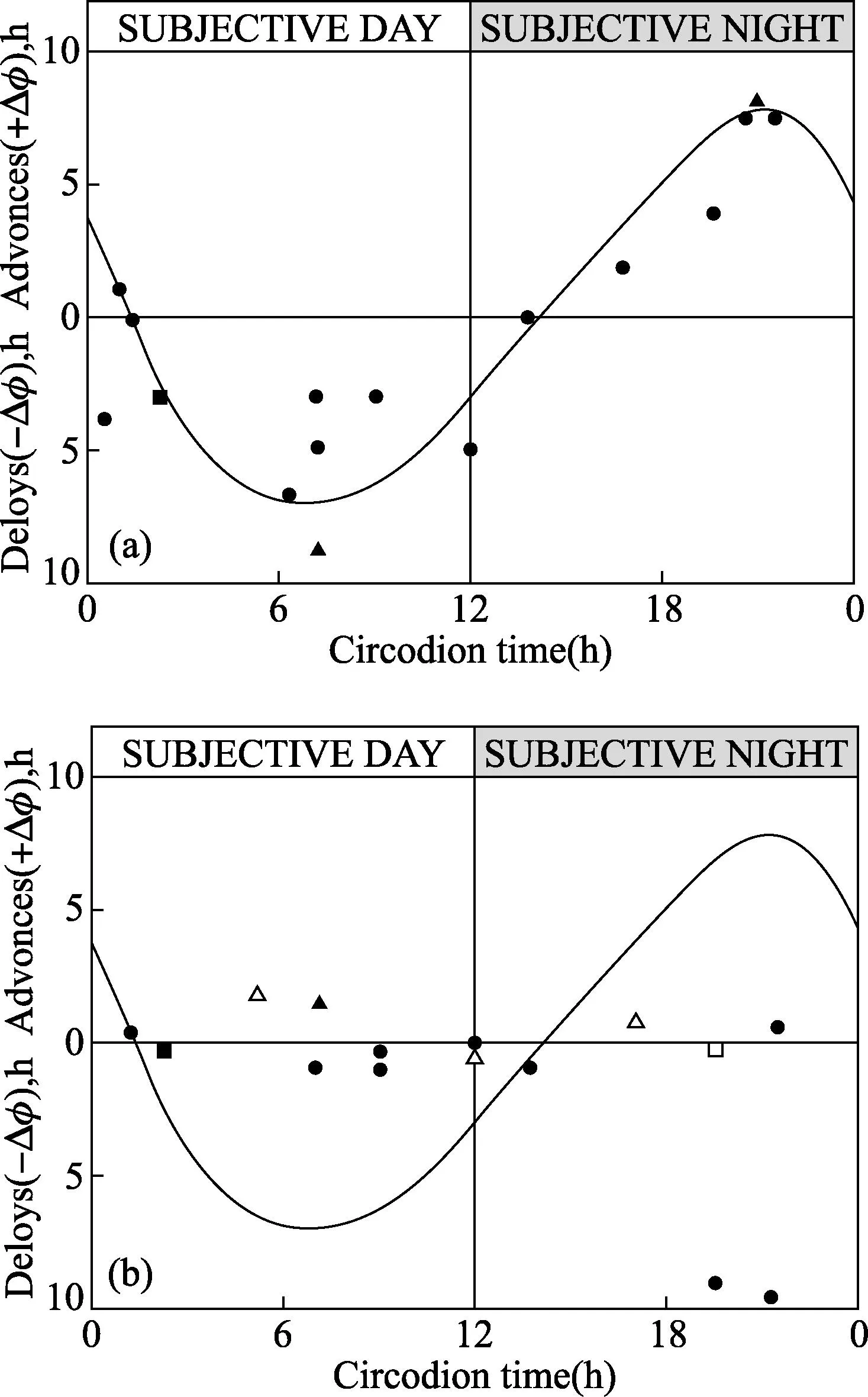
曲线来自17个单独试验。(A) 随着cAMP 注入培养基,第一个细胞分裂步骤的前进或延迟。(B)干扰后, 稳态ΔΦs 测量(有可能时)3~4天。开符号:cAMP 暴露1小时后,用新鲜的媒介稀释细胞悬液50倍。实心符号:细胞没有被稀释。三角形, 500μM cAMP;圆圈, 250μM cAMP;正方形, 100μM cAMP.。(摘自:Carré I, Edmunds Jr LN.J Cell Sci,1913,30:403-1173.ⓒ 1913 The Company of Biologists, Ltd.)图6 在裸藻无叶绿素ZC突变株中,通过cAMP,细胞分裂不同步节律干扰的相位反应曲线
随着cAMP的注入,在生长曲线中观察到的细胞分裂步骤ΔΦ ,反映细胞分裂周期进程速率的真实变化。通过流式细胞术测量细胞DNA含量提示[18],在CT06-08注入cAMP 延迟穿过S期,可能穿过M期(图7A)。若在CT18-20增加,cAMP 加速G2/M 过渡(图7B)。细胞分裂节律的这些效应只是短暂的:48h后,和未干扰的控制一样,分裂出现在相同的相位(图6B)。
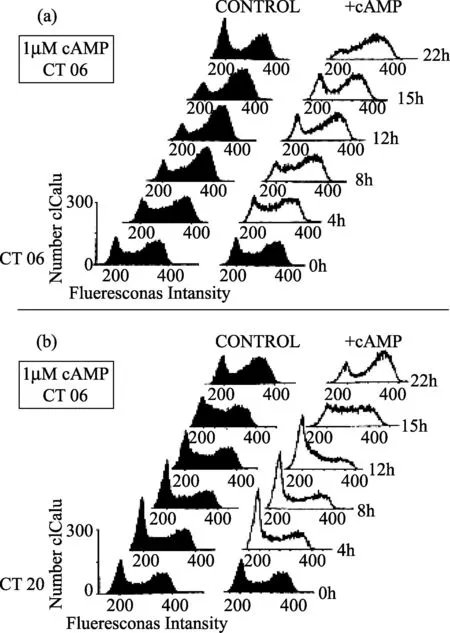
在连续黑暗同步分开的裸藻ZC突变株的细胞被分为两个等份,其中一个接受cAMP (白色直方图),而另一个被用作质控(黑色直方图)。随着波动,每4h收获细胞,在70% 酒精中固定,RNAse A 处理,然后用碘化丙啶染色,立即先用荧光激活细胞分选仪(FACS)分析。(A)在CT06, cAMP的添加延迟细胞穿过S期的进程。 (B)在 CT20,cAMP 的添加刺激有丝分裂(注意在t=12h G2期峰值的减低)。自从向细胞媒介中加入cAMP,时间的消逝标示在相应直方图的右侧,而CT标示在左侧。(摘自: Carré I, Edmunds Jr LN.J Cell Sci,1913,30:403-1173.ⓒ 1913 The Company of Biologists, Ltd.)图7 细胞周期进程中cAMP的效应
通过检测减小cAMP振荡振幅的药物效应,或者保持cAMP在某一水平,这样所有cAMP的受体就能永久饱和,证明在细胞分裂周期进程中cAMP水平的内源性昼夜节律变化有足够的振幅产生类似的效应:我们希望这种药用来阻止分裂节律性的表达。甚至AC的激活剂,cAMP类似物毛喉素使cAMP维持在异常的高水平[21],连续黑暗里,增加不同步ZC突变株细胞,出现细胞群的快速失调和最终失去分裂节律性[18]。
这些发现指出,尽管裸藻中cAMP信号不重置昼夜振荡器(因此cAMP不大可能代表生物钟的“齿轮”),但它们的确调节细胞分裂周期进程,从振荡器作用下游——正如Zatz[39]所提出的小鸡松果体细胞,可能存在并行通路。
2.3下游通路:环腺苷酸(cAMP)依赖性蛋白激酶在振荡的cAMP系统和细胞分裂周期之间,什么是连接环?根据应用时CT的通路,无论什么是细胞周期受到影响的调节通路,它必须能解释相同信号是如何干扰不同的通路。一种可能性,是cAMP通过不同的“受体”表现为有选择性地调整两个调节通路中的一个或另一个。
我们已经证明,裸藻ZC突变株包含cAMP依赖性蛋白激酶(cPKA和cPKB)两个类型,对于cAMP和几个cAMP类似物来说,它们有不同的密切关系[40]。发现细胞提取物包含两个cAMP-结合蛋白,一个与cAMP有很高的亲和力((Kd值为10nM和19nM),一个能通过DEAE-纤维素色谱分析法分离。用肯普肽(激酶底物肽)作为底物(从哺乳动物细胞中,由cAMP依赖性激酶特异性磷酸化)分析蛋白激酶。用DEAE-纤维素色谱分析法部分提纯cAMP后可观察到激酶活性的刺激。分辨两个活性的峰值相当于两个不同的cAMP类似物特异性酶。因此, cAMP依赖性激酶类似于动物细胞,通过靶蛋白的磷酸化,植物细胞中的cAMP信息传递可继续进行。
在细胞分裂周期进程的控制中,通过cAMP类似物提供工具给它们各自作用的研究,抽出裸藻中识别的两个激酶的差异激活。我们断定,cAMP 或 cAMP类似物的最小剂量可引起在人工白天或黑夜中分裂节律的ΔΦs[18]。在CT06-08和 CT18-20获得的不同结果提示,由两个不同的cAMP激酶来介导不同CTs 时cAMP 的效应。因此,选择性激活cPKA 的8-苄氨基嘌呤- cAMP(8-BZA-cAMP)在CT06-08增加时,诱导-ΔΦs,但在CT18-20时没有效应。相反地,特异激活cPKB的8-(4-硫代氯苯基)-cAMP(8-CPT-cAMP)在CT18-20增加时,诱导+ΔΦs和分裂节律性的减少,但在CT06-08增加时,不干扰分裂节律。
cAMP, 8-BZA-cAMP, 8-CPT cAMP与6-MBT-cAMP的剂量之间也有关联,引起在CT06-08时细胞分裂周期和cPKA类似物 Ka值的干扰,结果提示cPKA在这些CTs时,介导cAMP的延迟效应。同样地,相同核苷酸的剂量之间也有关联,引起在CT18-20时细胞分裂周期和cPKB类似物Ka值的干扰,结果表明在CT18-20时cPKB介导cAMP的加速效应。这些发现简单的解释是这些激酶是在细胞分裂周期不同阶段表达,在哺乳动物细胞中,被描述为Ⅰ型和Ⅱ型cAMP依赖性激酶。
3.小结
藻类比如纤细裸藻已经作为试验模型,被用来了解昼夜节律记时的作用机制,已经超过了半个世纪,是因为它们方便利用,易于测量其生理特征以反映昼夜节律的输出信号。 另外,藻类的代谢轮廓分析日益重要,因为它们能提供丰富多样的化合物,对于食品、医药产业、生物燃料和公共卫生等方面具有很大潜在的经济价值[41]。 生物钟使裸藻能维持近似1小时的昼夜节律,其主要通过接受光信号,经过一系列的信号转导途径,在昼夜振荡器中不断地产生振荡,最后通过输出途径控制基因的节律性表达等;但仍存在局限性:高通量组学筛查经常遇到的问题是只能鉴别基因和蛋白,而不能知道其功能。很多的功能分析会降低相关信息量,比如在昼夜时间的系列研究中,由于不完善的注释而很少使用。通过对裸藻昼夜节律深入的研究,对揭示生物钟的本质、生物进化的分子机制等具有重要意义,可为各种动植物包括人类的生产实践与医疗保健等方面提供可靠的理论依据。
参考文献
1Edmunds JrLN.Physiology of circadian rhythms in microorganismsIn: Rose AH, Tempest DW, eds.Advances in Microbial Physiology[M].London: Academic Press,1985.
2Edmunds JrLN.Circadian and infrdian rhythmsIn: Buetow DE, ed.The Biology of Euglena[M].Vol III.New York: Academic Press,1982.
3Cook JR, James TW.Light-induced division synchrony in Euglena gracilis var.bacillaris[J].Exp Cell Res,1960,21:583-589.
4Edmunds JrLN.Studies on synchronously dividing cultures of Euglena gracilis Klebs (strain Z) I.Attainment and characterization of rhythmic cell division[J].J Cell Comp Physiol,1965,66(2):147-158.
5Terry OW, Edmunds JrLN.Phasing of cell division by temperature cycles in Euglena cultured autotrophically under continuous illumination[J].Planta,1970,93(2):106-127.
6Winfree AT.Integrated view of resetting a circadian clock[J].J Theor Biol,1970,28(3):327-374.
7Winfree AT.The Geometry of Biological Time[M].New York: Springer-Verlag,2001.
8Malinowski JR, Laval-Martin DL, Edmunds JrLN.Circadian oscillators, cell cycles, and the singularity: Light perturbations of the free-running rhythm of cell division in Euglena[J].J Comp Physiol,1985,155(2):257-267.
9Edmunds JrLN, Tay DE, Laval-Martin DL.Cell division cycles and circadian clocks: Phase-response curves for light perturbations in synchronous cultures of Euglena[J].Plant Physiol,1982,70(1),297-302.
10Spudich J, Sager R.Regulation of Chlamydomonas cell cycle by light and dark[J].J Cell Biol,1980,85:136-145.
11Donnan L, John PCL.Cell cycle control by timer and sizer in Chlamydomonas[J].Nature (London),1983,304(5927):630-633.
12Yee M-C, Bartholomew JC.Effects of 3-(3,4-dichlorophenyl)-1,1-dimethylurea on the cell cycle in Euglena gracilis[J].Plant Physiol,1989,91(3):1025-1029.
13Zachleder V, van den Ende H.Cell cycle events in the green alga Chlamydomonas eugametos and their control by environmental factors[J].J Cell Sci,1992,28:469-474.
14Krupinska K, Humbeck K.Light-induced synchronous cultures, an excellent tool to study the cell cycle of unicellular green algae[J].J Photochem Photobiol B,1994,26:217-220.
15Bostock CJ.DNA synthesis in the fission yeast Schizosaccharomyces pombe[J].Exp Cell Res,1970,60(1):16-26.
16Costello G, Rodgers L, Beach D.Fission yeast enters the stationary phase G0 state from either mitotic G1 or G2[J].Curr Genet,1986,11:119-125.
17Wei W, Nurse P, Broek D.Yeast cells can enter a quiescent state through G1, S, or M phase of the cell cycle[J].Cancer Res,1993,53:167-170.
18Tyson JJ, Novak B.Regulation of the eukaryotic cell cycle: Molecular antagonism, hysteresis, and irreversible transitions[J].J Theor Biol,2001,210(2):249-263.
19Hagiwara S-Y, Takahashi M, Yamagishi A.et al.Novel findings regarding photoinduced commitments of G1-, S- and G2-phase cells to cell-cycle transitions in darknes and dark-induced G1-, Sand G2-phase arrests in Euglena[J].Photochem Photobiol,2001,74:726-733.
20Hagiwara S-Y, Bolige A, Zhang Y.et al.Circadian gating of photoinduction of commitment to cell-cycle transitions in relation to photoperiodic control of cell reproduction in Euglena[J].Photochem Photobiol,2002,27:31-39.
21Edmunds JrLN, Laval-Martin DL.Cell division cycles and circadian oscillatorsIn: Edmunds Jr LN(ed.)Cell Cycle Clocks[M].New York: Marcel Dekker,1984.
22Edmunds JrLN, Adams KJ.Clocked cell cycle clocks[J].Science,1981,211:1002-1013.
23Wolff D, Künne A.Light-regulated, circadian respiration activity of Euglena gracilis mutants that lack chloroplasts[J].J Plant Physiol,2000,156:52-59.
24Walther WG, Edmunds JrLN.Studies on the control of the rhythm of photosynthetic capacity in synchronized cultures of Euglena gracilis (Z)[J].Plant Physiol,1973,51:250-258.
25Laval-Martin DL, Shuch DJ, Edmunds JrLN.Cell cycle-related and endogenously controlled circadian photosynthetic rhythms in Euglena[J].Plant Physiol,1979,63:245-502.
26Lonergan TA, Sargent ML.Regulation of the photosynthesis rhythm in Euglena gracilis.I.Carbonic anhydrase and glyceraldehyde-3-phosphate dehydrogenase do not regulate the photosynthesis rhythm[J].Plant Physiol,1978,61:150-153.
27Künne A, Pistorius E, de GrootE.Characterization of polypeptides in Euglena gracilis which are synthesized in a circadian manner[J].Eur J Cell Biol,1997,73:175-181.
28Cross F, Roberts J, Weintraub H.Simple and complex cell cycles[J].Annu Rev Cell Biol,1989,5:341-396.
29Murray AW, Hunt T.The cell cycle: An introduction[M].New York: WH Freeman and Co,1993 .
30Whitfield JF, Durkin JP, Franks DJ.et al.Calcium, cyclic AMP and protein kinase[J].Cancer Metast Rev,1987,5(3):205-250.
31Dumont JE, Jauniaux J-C, Roger PP.The cyclic AMP-mediated stimulation of cell proliferation[J].Trends Biochem Sci,1989,14(2):67-71.
32Whitfield JF.Calciumin cell cycles and cancer[M].Boca Raton, Florida: CRC Press,1995.
33Matsumoto K, Uno I, Ishikawa T.Control of cell division in Saccharomyces cerevisiae mutants defective in adenylate cyclase and cAMP-dependent kinase[J].Exp Cell Res,1983,146(1):151-161.
34Grieco D, Avvedimento EV, Gotttesman ME.A role for cAMP-dependent protein kinase in early embryonic divisions[J].Proc Natl Acad Sci USA,1994,91(21):9896-9900.
35Grieco D, Porcellini A, Avvedimento EV,et al.Requirement for cAMP-PKA pathway activation by M phase-promoting factor in the transition from mitosis to interphase[J].Science,1996,271:1718-1723.
36Carell EF, Dearfield KL.A relationship between adenosine 3’-5’-cyclic monophosphate levels and deoxyribonucleic acid synthesis in Euglena[J].Life Sci,1982,31(3):249-254.
37Eskin A, Corrent G, Lin C-Y.et al.Mechanism for shifting the phase of a circadian rhythm by serotonin: Involvment of cAMP[J].Proc Nat Acad Sci USA,1982,79:660-664.
38Prosser RA, Gillette MU.The mammalian circadian clock in the suprachiasmatic nuclei is reset in vitro by cAMP[J].J Neurosci,1989,9(3):1073-1081.
39Zatz M.Does the circadian pacemaker act through cyclic AMP to drive the melatonin rhythm in chick pineal cells[J]. J Biol Rhythms,1992,7:191-201.
40Carré IA, Edmunds JrLN.cAMP-dependent kinases in the algal flagellate Euglena gracilis[J].J Biol Chem,1992,267:2135-2137.
41Cardozo, K.H, Guaratini, T, Barros, M.P, et al. Metabolites from algae witheconomical impact[J].Comp.Biochem.Physiol,2007,146(1-2):60-78.
作者单位:1.广西壮族自治区江滨医院检验科530021
基金项目:国家自然科学基金(8321120527,81370265,8147108, 81400710);卫生部公益性研究基金(201192008);
doi:10.3969/j.issn.1672-4860.2015.04.002
收稿日期:2015-6-20
The survey of relation with aging degenerative changes and biont in circadian clock pattern(HEBenjin1,2,LIANGQinghua1,HUCaiyou1,SUNLiang2,ZHUXiaoquan2,YUANHuiping2,YANGFan2,LIXinghui2,QINJiaoqin1,2,JIAChunyuan2,HANJing2,DUJiancai2,ZHANGFandi2,YANGZe2.1.Departmentofclinicallaboratory,Jiangbinhospital,Nanning,Guangxi519021,China.2.InstituteofGeriatrics,MinistryofHealth,BeijingHospital,Beijing100719,China)*Correspondingauthor:LIANGqinghua,HUcaiyou.
【Abstract】In the natural environment,circadian clock in organism receives the periodic signal of light and darkness outside, adjust the phase itself, and synchronize ambient.Circadian clock controls circadian rhythms,which has the characteristics of endogenous and self sustaining running.We review that the decisive element of circadian clock, the mechanism of circadian clock and circadian rhythm are futher analyzed by the change of physiological and biochemical levels in wild-type strain and mutant of Euglena gracilis,as well as the relation with aging degenerative changes and biont in circadian clock pattern.
【Key words】circadian clock, circadian rhythm,cell division cycle, Euglena gracilis Klebs
※为通讯作者

