水稻第4号染色体上株型性状相关基因研究进展
刘 丹, 柴永山, 孙玉友, 魏才强, 解 忠, 李洪亮, 张巍巍, 孙国宏
(黑龙江省农业科学院牡丹江分院, 黑龙江 牡丹江157041)
水稻(Oryza Sativa L.)是世界上最重要的粮食作物之一,提高粮食产量是育种家永恒的目标。株型性状是影响水稻产量的重要农艺性状,回顾我国水稻育种史上的几次巨大的转折,无论是矮化育种,还是理想株型育种,其核心问题都是株型育种[1]。因此,开展株型性状的遗传研究,对于提高水稻产量潜力具有重要意义。
近年来,随着分子生物学的迅猛发展,越来越多的株型基因被定位和克隆。根据国家水稻数据中心(http://www.ricedata.cn/gene/)网站上的数据统计,迄今为止已经克隆了252个株型性状相关基因,它们分布于水稻的12条染色体上(表1)。水稻第4号染色体上存在着诸多控制株型性状的基因位点,它们涉及到株高、分蘖、叶片、籽粒以及穗形性状等[2-4],是株型性状遗传调控的热点区域(图1,图2)。因此,本文对水稻第4号染色体上控制株型性状的相关基因进行了总结,旨在明确其在株型调控过程中所起的作用,系统的了解其上株型性状的遗传调控网络,为水稻株型性状遗传改良提供理论指导。
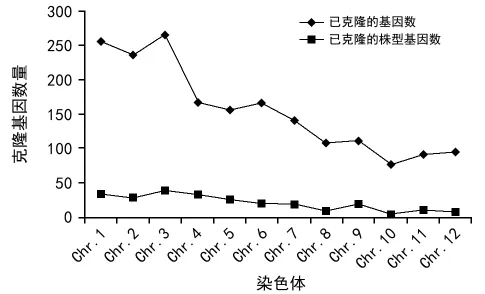
图1 各染色体上已克隆的基因数量
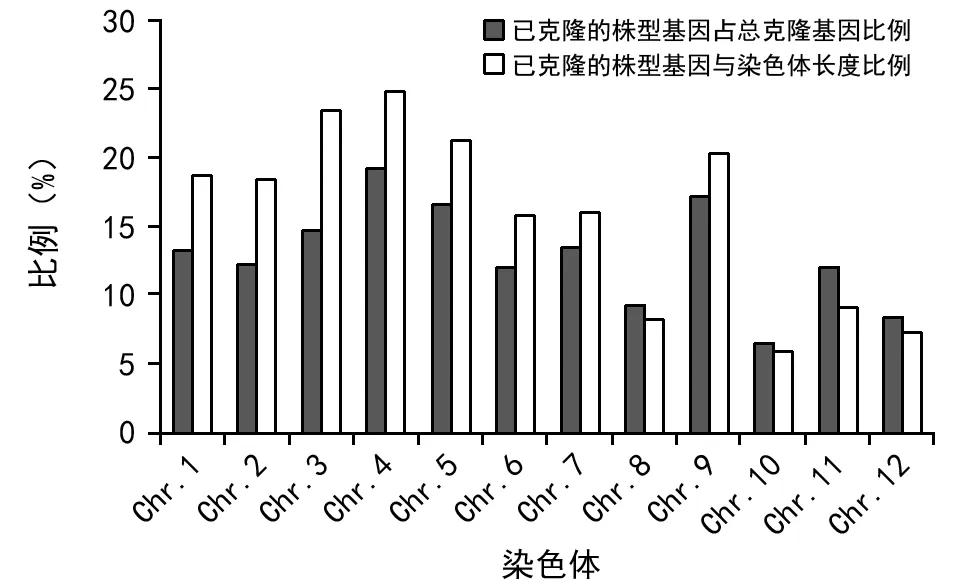
图2 已克隆的基因数量所占各染色体的比例
1 水稻株高性状相关基因
株高是水稻最重要的株型性状之一,矮秆基因sd1的成功利用,被认为是水稻育种史的第1次“绿色革命”。突变体是研究者十分青睐的研究材料,水稻矮秆突变体的挖掘对于阐明株高的遗传机理具有重要意义。至今为止,已经报道了多个新的水稻矮秆突变体材料[5-6],它们为丰富株高的调控机理研究奠定了基础。据报道,株高的遗传调控一般与激素代谢和信号传递途径有关,尤其是赤霉素(Gibberellins,GAs)和油菜素内酯(Brassinosteroids,BRs)调控途径的变化[7]。目前,在水稻第4号染色体上已报道的株高基因中,GA2 ox基因和OsKS2基因均为赤霉素代谢途径异常,d 11基因为油菜素内酯生物合成受阻,而tdd1基因则为IAA 合成受阻[8-11]。此外,还有一些 “一因多效”的调控基因,它们在控制株高矮化的同时还伴随着影响其他的表型,如窄叶性状、籽粒性状以及分蘖等[10-14]。由此可见,水稻第4号染色体对于开展株高遗传改良具有重要意义,通过对这些株高调控基因的遗传分析,将有助于更好地开展株型育种,提高水稻的增产潜力。

表1 已克隆的水稻株型性状相关基因
2 水稻分蘖性状相关基因
分蘖数和分蘖角是水稻分蘖的2个最重要的性状。分蘖数直接决定着水稻的成穗率,分蘖角度又是评价株型性状的重要指标,对水稻产量有着极其重要的影响。目前已克隆的分蘖相关基因并不多,主要有控制分蘖数的MOC1和MOC2基因[15-16]和控制分蘖角的 TAC1和LAZY1基因[17-18]。
目前,在第4号染色体上也克隆了几个涉及调控分蘖的基因,它们均参与分蘖数的形成,如OsGA2 ox 6基因,MIP1基因和OsAFB2基因,其中OsGA2 ox6基因和MIP1基因还与株高矮化性状紧密相关。OsGA2 ox 6基因通过钝化有生物活性的赤霉素(GAs)来调节植物的生长。GA负向调控水稻OSH 1和TB 1这2个参与分生组织的发生和侧芽转录因子,从而抑制分蘖的发生[12]。MIP1基因是MOC1互作蛋白基因,能在体内和体外与MOC1互作,从而导致分蘖数增加[13]。OsAFB2基因是OsmiR393的靶标[19-20],过表达能提高水稻分蘖数和促进早花,并在调节剑叶倾角和以及主根和不定根生长中起作用,这些与分蘖数相关的基因的克隆与功能分析,为深入揭示水稻分蘖性状的遗传机理和调控途径奠定了基础。
3 水稻叶片性状相关基因
叶片是水稻的光合器官,与稻谷产量息息相关。叶片的形态建成受转录因子、激素以及小分子RNA的调控,深入了解水稻叶片发育的遗传机理对开展水稻高光效育种具有十分重要的意义。目前,已经在水稻第4号染色体上定位到了一些参与叶片发育的调控基因。SHO1基因是一个水稻DICER相似蛋白基因。研究表明,SHO基因参与SAM的维持和组织形式,进而对叶片原基的正常发生起关键作用[21]。此外,包括OsBAK 1在内的OsSERK 基因家族等,它们也直接参与影响水稻正常生长和叶的发育[22]。
卷叶和窄叶是水稻叶片两种常见的叶形态,对水稻的产量有着重要的影响。研究表明,卷叶形态通常表现在水稻的不同生育时期。至今为止,至少发现了10个控制卷叶性状的基因。ACL1基因是一个在BY 240中发现的调控叶片外卷表型的基因,它是目前唯一一个已克隆的位于第4号染色体上的卷叶基因。组织学分析发现,在BY 240叶片中泡状细胞的数目和大小增加,表皮细胞扩胀,从而导致叶片近轴面和远轴面的发育不协调,最终使叶片向远轴面卷曲,而抑制ACLs的表达则不导致叶片的异常[23]。Chen等在对水稻矮化突变体Nal 1进行研究的过程中发现其同时具有窄叶的表型,其茎秆维管系统发育也存在缺陷,维管束的数目和排列模式发生了改变。图位克隆和功能分析表明,Nal 1编码一个植物特有的未知蛋白,但深入研究发现,Nal 1基因的突变显著降低了生长素的极性运输活性,在叶片的横向生长中发挥重要作用[24]。
叶夹角大小是株型重要的评价指标。研究表明,叶夹角增大与油菜素内酯含量的变化有关。对叶夹角增大的突变体ILI 1-D进行研究发现,ILI 1基因与拟南芥的PRE1基因同源。过表达ILI 1导致水稻叶夹角增大,而RNAi干扰抑制表达ILI 1导致水稻叶夹角减小。进一步分析发现,水稻和拟南芥中存在BR通过一对作用于BZR 1下游的相互拮抗的bHLH/HLH转录因子调控植物生长发育的保守机制[25]。
此外,第4号染色体上还存在着一些涉及叶色调控的基因,如MPR25基因和Pl基因等。MPR25基因缺失的Tos 17突变体植株在生育早期表现为植株生长迟缓、叶色苍绿、叶绿素含量降低,进一步分析发现 MPR25参与nad 5转录本 C-U 的 RNA 编辑[26]。紫叶基因Pl控制水稻地上部分的紫色,研究表明,Pl负责转运CB基因和A基因产生的花色素,与Pb是同一 基 因 位 点,参 与 花 青 素 的 生 物 合 成[27-28]。OsPORB基因也是维持依赖光的叶绿素合成所必需的,但主要在作用在叶片发育早期[29],而AM1基因则在前几片叶中调控叶绿素生物合成、叶绿体发育和光合作用相关基因表达[30]。
4 水稻穗部性状相关基因
4.1 粒形性状基因
粒形性状是直接影响稻谷产量和稻米品质的重要穗部性状。在水稻第4号染色体上至少已报道了3个涉及到粒形遗传调控的功能基因。GIF1基因在水稻籽粒发育时参与控制蔗糖运输卸载和灌浆,因此对于籽粒大小有着重要影响[31]。An-1是一个碱性螺旋-环-螺旋蛋白基因,在小穗发育阶段An-1基因正向调控芒的伸长和籽粒长度,但是负向调控每穗粒数[32]。flo-2基因位点控制水稻的直链淀粉含量,参与水稻胚乳的直链淀粉含量调控。水稻的胚乳在种子发育过程中积累了大量的淀粉和储藏蛋白,FLO2通过影响胚乳中储藏性物质的积累在籽粒大小和淀粉品质中发挥关键的调节作用[33]。
此外,一些新的籽粒突变体材料的发掘,也为阐明其遗传发育机理提供了保障。壳色是水稻驯化过程中十分重要的一个指标,黄色谷壳是一个受到选择的可见的表型,研究表明控制野生稻黑色谷壳发生的Bh4基因编码一个氨基酸转运蛋白,主要在谷壳中表达。而由于bh4基因在第3外显子上存在一个22bp的缺失,导致功能的丧失,致使栽培水稻谷壳颜色变为黄色[34]。Zhang等[35]分离了一个多重颖壳的新突变体材料,并通过构建F2群体将控制多重颖壳的基因eg3定位在第4号染色体长臂端的64.1kb区域,基因预测发现eg3可能为Os 04g 0387400的新等位基因,与拟南芥中的花同源异型蛋白AP具有相似的结构域和功能,参与花器官的分化调控。
4.2 穗型性状基因
穗是水稻产量的最终体现形式,良好的穗部形态不仅有利于水稻产量的提高,对于水稻品质和抗性的改良也具有重要意义。至今为止,水稻第4号染色体上已经报道了不少控制穗型性状的基因,如散穗、稀穗和秃尖等(图3),其中散穗基因被定位在第4号染色体长臂端的100cM~154cM之间,稀穗基因被定位在RM 471~RM 273之间,而秃尖基因位于S 6685-1-aptn 3之间。
散穗又称伞状穗,是一种极其常见的穗型性状,是研究极早的穗形态之一。研究表明,水稻散穗性状是育种家驯化的重要性状之一[36]。对现已报道的散穗基因进行分析发现,其中有5个散穗基因位于第4号染色体上。spr 1是一个隐性核基因,位于第4号染色体上的100cM~154cM 之间[37];spr 3位于第4号染色体 L 4355和 L 4264之间[4,38];spr 5位于第4号染色体上RM 5879和 RM 255之间[39]。对比分析发现这3个基因均位于第4号染色体长臂端的同一区间,推测可能为同一调控基因。OsLG1是最近报道的位于4号染色体上的参与调控水稻的散穗性状的基因,研究表明OsLG1调控区的碱基差异从而影响OsLG1基因的表达量水平,最终导致穗型的变异[40-41]。sp 受一个显 性 核基因控制,研究者利用一个极小的F2群体初步将其定位于4号染色体长臂端E 3和 RM 17578两个引物之间[42],但是否与前面的基因相同,还有待进一步验证。不难看出,散穗性状的遗传机理较为复杂,不同的散穗材料其基因的调控机理存在差异,有显性核基因控制的,也有隐性核基因控制的,并且调控基因分布于不同的染色体上,但总的来看,水稻第4号染色体上分布的散穗调控基因最多,暗示4号染色体对于散穗性状具有极其广泛的调控网络。
2014年春,在兵师团工会自主创业号召下,余东义联系了七户困难职工家庭,成立了养鹅合作社,利用养鸡圈舍养殖肉鹅2200只,羊700只,牛28头,他要带领更多的职工即会种植,也会养殖,拓宽了致富的路子。
稀穗性状通常表现为穗部二次枝梗较少,籽粒着粒密度较小,是目前研究的较多的穗形态之一。李雪梅等[43]在水稻品种中花11T-DNA 的插入突变体库中发现了3个穗形态突变体,并通过配置杂交组合,采用图位克隆的方法,将PMM1基因定位在第4染色体长臂上的RM 3866-1和X 4标记之间的147kb区域内。任三娟[44]在经60Co-γ射线诱导处理的籼稻品系hp 73中获得了一个小穗退化突变体材料spd-hp73。遗传分析表明,spd-hp73受一对隐性核基因控制,利用突变体与浙7954构建的F2群体将基因初步定位在第4号染色体上RM 471和RM 273之间。Tabuchi等[45]对稀穗基因lax2进行了定位研究,而之后Zhang等也对一个稀穗基因gnp4进行了研究,发现定位到的gnp4与lax2是同一个基因位点,调控水稻腋生分生组织的形成[46]。但进一步分析发现,尽管它们是同一个基因位点,但是调控机理却不相同,Gnp4由于启动子区域CpG岛甲基化导致了突变体表型[45],而lax基因上有3处突变位点,即在第1外显子上的1bp的插入和1bp的缺失,在第3外显子上的1bp的缺失,从而导致了表型变异[46]。刘丹等[47]在籼粳稻杂交后代中发现一个稀穗突变体材料,研究发现定位到的lax基因与上述报道的控制稀穗基因等位。此外,冯志赟[48]在籼粳杂交后代中获得lax-L3,lax-L4,lax-L53个稀穗材料,并利用F2分离群体的突变型单株将lax-L3,lax-L4,lax-L5的目的基因定位在第4染色体长臂上RM 16880和RM 1205两个分子标记之间的120kb区域,与之前发表的LAX2基因在同一区域。测序分析发现lax-L3突变体中缺失50bp的外显子序列和10bp的内含子序列共60bp的碱基序列,暗示发现的lax-L3就是LAX 2。由此可见,目前发现的稀穗突变体材料中,位于第4号染色体上的调控基因都与lax2有关,或者是相同的基因,或者是同一位点的等位基因。
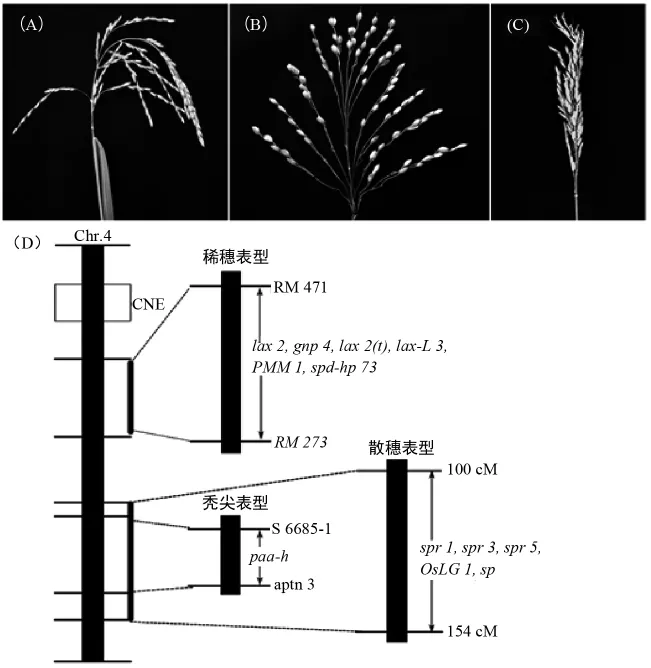
图3 3种常见的水稻穗形突变体及其在第4号染色体上的基因定位
与散穗和稀穗性状相比,秃尖(顶端颖花退化)性状易受环境的影响,因此研究起来相对较为复杂。目前,对秃尖性状的基因定位多分布在第2号和第8号染色体上[49-51]。水稻4号染色体上也存在涉及秃尖性状的调控基因,Akter等[52]利用 N-甲基-N-亚硝基脲处理粳稻品种Hwacheongbyeo获得了穗顶端退化突变体PAA-Hwa,遗传分析表明,PAA受一对隐性核基因控制,并将paa-h基因精细定位在第4号染色体长臂上标记aptn 3和S 6685-1之间的71kb区域,基因预测和序列比对发现,该区域存中LOC_Os 04g 56160中第10外显子上碱基G突变为A,导致编码的甘氨酸突变为谷氨酸导致了秃尖表型。此外,高素伟[53]利用L-05261×IRAT 129的F2群体在第4号染色体上检测到一个控制穗顶端退化的QTL位点qPAA4,也为控制秃尖性状的基因克隆和功能分析奠定了基础。
5 总结与展望
早在2002年,我国科学家就成功的完成了水稻第4号染色体测序工作,并对4号染色体结构和功能进行了分析,共鉴定了4 658个基因,并注释了在染色体上的准确位置[54]。近年来,随着分子生物技术的快速发展,越来越多的重要农艺性状调控基因被鉴定和功能阐释,它们当中很多在水稻第4号染色体上呈簇状分布,诸如稀穗基因和散穗基因等,暗示4号染色体上存在着极其重要的遗传调控网络,为开展水稻分子育种提供了理论基础。
通过对水稻第4号染色体上株型性状调控基因的系统分析,发现水稻第4号染色体上涉及到株型性状的基因包括了株高、分蘖、叶形以及穗型等诸多方面。这些株型基因/QTL的发现,不仅丰富了株型性状的遗传调控机理,而且暗示着水稻第4号染色体上的基因位点对于水稻株型性状的遗传改良至关重要。在今后的研究工作中,可以依赖于分子标记技术,构建水稻第4号染色体片段代换系,并开发相关功能分子标记,有针对性的对4号染色体上调控株型性状的基因所在区段进行代换改良,从而获得较为理想的株型材料,提高育种效率。同时还发现,水稻4号染色体上调控这些株型性状的基因位点很多也与水稻驯化相关,比如颖壳颜色基因Bh4,芒长基因An-1,落粒基因sh4以及散状穗基因spr,这些功能位点在水稻由野生稻驯化到现代栽培稻的过程中均受到人工定向选择,因此,推测水稻第4号染色体在人为驯化过程中受到了育种家的定向选择压的影响较大,这对于深入了解水稻驯化进程具有重要意义。
综上所述,无论是开展理想株型育种,还是了解水稻的驯化历程,水稻第4号染色体都扮演着极其重要的角色。对第4号染色体上的基因进行总结,不仅有助于系统深入的了解株型性状的遗传调控机理,更好的对水稻株型进行遗传改良,而且有助于深入了解水稻重要农艺性状的驯化过程。当然,尽管目前对水稻第4号染色体上相关基因的克隆和功能分析研究取得了一些进展,但由于其遗传机理的复杂性,仍有待于进一步的丰富和完善,如何不断挖掘出新的株型调控基因,依旧是研究者未来面临的主要问题。
[1]徐正进,林晗,马殿荣,等.北方粳稻穗型改良理论与技术研究及应用[J].沈阳农业大学学报,2012,43:650-659.
[2]Zou J H,Chen Z X,Zhang S Y,et al.Characterizations and fine mapping of a mutant gene for high tillering and dwarf in rice(Oryza sativa L.)[J].Planta,2005,222(4):604-612.
[3]Zhang G H,Li S Y,Wang L,et al.LSCHL4from Japonica Cultivar,Which Is Allelic to NAL 1,Increases Yield of Indica Super Rice 93-11[J].Molecular Plant,2014,7(8):1 350-1 364.
[4]Luo J J,Hao W,Jin J,et al.Fine Mapping of Spr 3,a Locus for spreading panicle from african cultivated rice (Oryza glaberrima Steud.)[J].Molecular Plant,2008(1):830-838.
[5]胡静.水稻半矮秆基因sdt 2的克隆研究[D].扬州大学,2007.
[6]梁国华,潘学彪,顾铭洪,等.矮泰引-2中半矮秆基因的分离与鉴定研究[J].中国水稻科学,1995,9(3):189-192.
[7]Huang N,Courtois B,Wang G L.Association of quantitative trait loci for plant height with major dwarfing genes in rice[J].Heredity,1996,77:130-137.
[8]Huang J,Tang D,Shen Y,et al.Activation of gibberellin 2-oxidase 6decreases active gibberellin levels and creates a dominant semi-dwarf phenotype in rice(Oryza sativa L.)[J].J Genet Genomics,2010,37(1):23-36.
[9]Ji S H,Gururani M A,Lee J W,et al.Isolation and charac
terisation of a dwarf rice mutant exhibiting defective gibberellins biosynthesis[J].Plant Biology,2014,16(2):428-439.
[10]Sazuka T,Kamiya N,Nishimura T,et al.A rice tryptophan deficient dwarf mutant,tdd1,contains a reduced level of indole acetic acid and develops abnormal flowers and organless embryos[J].Plant J,2009,60(2):227-241.
[11]Tanable S,Ashikari M,Fujioka S,et al.A novel cytochrome P450is implicated in brassinosteroid biosynthesis via the characterization of a rice dwarf mutant,dwarf11,with reduced seed length[J].Plant Cell,2005,17(3):776-790.
[12]Lo S F,Yang S Y,Chen K T,et al.A Novel Class of Gibberellin 2-Oxidases Control Semidwarfism,Tillering,and Root Development in Rice[J].The Plant Cell,2008,20(10):2 603-2 618.
[13]Sun F,Zhang W,Xiong G,et al.Identification and functional analysis of the MOC 1interacting protein 1[J].J Genet Genomics,2010,37(1):69-77.
[14]Ishiyama K,Inoue E,Tabuchi M,et al.Biochemical background and compartmentalized functions of cytosolic glutamine synthetase for active ammonium assimilation in rice roots[J].Plant Cell Physiol,2004,45(11):1 640-1 647.
[15]Li X Y,Qian Q,Fu Z M,et al.Control of tillering in rice[J].Nature,2003,422(6 932):618-621.
[16]Koumoto T,Shimada H,Kusano H,et al.Rice monoculm mutation moc 2,which inhibits outgrowth of the second tillers,is ascribed to lack of a fructose-1,6-bisphosphatase[J].Plant Biotechnology,2013,30(1):47-56.
[17]Yu B S,Lin Z W,Li H X,et al.TAC 1,a major quantitative trait locus controlling tiller angle in rice[J].The Plant Journal,2007,52(5):891-898.
[18]Li P J,Wang Y H,Qian Q,et al.LAZY 1controls rice shoot gravitropism through regulating polar auxin transport[J].Cell research,2007,17:402-410.
[19]Xia K F,Wang R,Ou X J,et al.OsTIR 1and OsAFB 2 Downregulation via OsmiR 393Overexpression Leads to More Tillers,Early Flowering and Less Tolerance to Salt and Drought in Rice[J].PLoS ONE,2012,7(1):e30 039.
[20]Bian H W,Xie Y K,Guo F,et al.Distinctive expression patterns and roles of the miRNA 393/TIR 1homolog module in regulating flag leaf inclination and primary and crown root growth in rice(Oryza sativa)[J].New Phytologist,2012,196(1):149-161.
[21]Itom J I,Kitano H,Matsuoka M,et al.SHOOT ORGANIZATION Genes Regulate Shoot Apical Meristem Organization and the Pattern of Leaf Primordium Initiation in Rice[J].The Plant Cell,2000,12(11):2 161-2 174.
[22]Park H S,Ryu H Y,Kim B H,et al.A subset of OsSERK genes,including OsBAK 1,affects normal growth and leaf development of rice[J].Molecules and Cells,2011,32(6):561-569.
[23]Li L,Shi Z Y,Li L,et al.Overexpression of ACL1 (abaxially curled leaf 1)Increased Bulliform Cells and Induced Abaxial Curling of Leaf Blades in Rice[J].Molecular Plant,2010,3(5):807-817.
[24]Chen M,Luo J,Shao G,et al.Fine mapping of a major QTL for flag leaf width in rice,qFLW 4,which might be caused by alternative splicing of NAL 1[J].Plant Cell Reports,2011,31(5):863-872.
[25]Zhang L Y,Bai M Y,Wu J,et al.Antagonistic HLH/bHLH Transcription Factors Mediate Brassinosteroid Regulation of Cell Elongation and Plant Development in Rice and Arabidopsis[J].The Plant Cell,2009,21(12):3 767-3 780.
[26]Toda T,Fujii S,Noguchi K,et al.Rice MPR 25encodes a pentatricopeptide repeat protein and is essential for RNA editing of nad5transcripts in mitochondria[J].The Plant Journal,2012,72(3):450-460.
[27]Sakamoto W,Ohmori T,Kageyama K,et al.The Purple leaf(Pl)locus of rice:the Pl(w)allele has a complex organization and includes two genes encoding basic helixloop-helix proteins involved in anthocyanin biosynthesis[J].Plant and Cell Physiology,2001,42(9):982-991.
[28]Hsien S,Chang T.Genic Analysis in Rice.IV.Genes for Purple Pericarp and Other Characters[J].Japanese Journal of Breeding,1964,14(3):141-149.
[29]Sakuraba Y,Rahman ML,Cho SH,et al.The rice faded green leaf locus encodes protochlorophyllide oxidoreductase B and is essential for chlorophyll synthesis under high light conditions[J].The Plant Journal,2013,74(1):122-133.
[30]Sheng P,Tan JJ,Jin MN,et al.Albino midrib 1,encoding a putative potassium efflux antiporter,affects chloroplast development and drought tolerance in rice[J].Plant Cell Reports,2014,33(9):1 581-1 594.
[31]Wang E,Wang J,Zhu X,et al.Control of rice grain-filling and yield by agene with a potential signature of domestication[J].Nature Genetics,2008,40(11):1 370-1 374.
[32]Luo J,Liu H,Zhou T,et al.An-1Encodes a Basic Helix-Loop-Helix Protein That Regulates Awn Development,Grain Size,and Grain Number in Rice[J].The Plant Cell,2013,25(9):3 360-3 376.
[33]She K C,Kusano H,Koizumi K,et al.A Novel Factor FLOURY ENDOSPERM2Is Involved in Regulation of Rice Grain Size and Starch Quality[J].The Plant Cell,2010,22(10):3 280-3 294.
[34]Zhu B F,Si L Z,Wang Z,et al.Genetic Control of a Transition from Black to Straw-White Seed Hull in Rice Domestication[J].Plant Physiology,2011,155(3):1 301-1 311.
[35]Zhang X J,Liu D,Jiang S K,et al.Genetic analysis of extra glume and molecular mapping of eg 3in rice(Oryza sativa L.)using SSR markers.POJ,2014,7(5):369-372.
[36]Grillo M A,Li C,Fowikes A M,et al.Genetic architecture for the adaptive origin of annual wild rice,oryza nivara[J].Evolution,2009,63:870-883.
[37]Kinoshita T,Takamure I.Linkage studies by the use of backcross data in rice.Genetical studies on rice plant,LXXXVIII.J.Fac.Agr.Hokkaido Univ,1986,61:445-455.
[38]Eiguchi M,Sano Y.A gene complex responsible for seed shattering and panicle spreading found in common wild rice[J].Rice Genetics Newsletter,1990(7):105-107.
[39]Xu Y,Zhou J,Hu F,et al.Spr 5(t)a spreading panicle gene from Oryza glaberrima[J].Rice Genetics Newsletter,2008,25:16-17.
[40]Zhu Z F,Tan L B,Fu Y C,et al.Genetic control of inflorescence architecture during rice domestication[J].Nature Communications,2013(4):2200.
[41]Ishii T,Numaguchi K,Miura K,et al.OsLG1regulates a closed panicle trait in domesticated rice[J].Nature Genetics,2013,45(4):462-465.
[42]刘丹,王嘉宇,刘进,等.水稻散状穗突变体sp的遗传分析及基因初定位[J].植物学报,2015,50(2):198-205.
(接上页)
[44]任三娟,孙出,童川,等.水稻小穗退化突变体spd-hp73的遗传分析及基因定位[J].浙江大学学报(农业与生命科学版),2013,39(3):267-273.
[45]Tabuchi H,Zhang Y,Hattori S,et al.LAX PANICLE 2of Rice Encodes a Novel Nuclear Protein and Regulates the Formation of Axillary Meristems[J].The Plant Cell,2011,23(9):3 276-3 287.
[46]Zhang Z Y,Li J J,Yao G X,et al.Fine mapping and cloning of the grain number per-panicle gene(Gnp 4)on chromosome 4in rice(Oryza sativa L.)[J].Agricultural Sciences in China,2011,10(2):1 825-1 833.
[47]刘丹.东北粳稻遗传多样性及穗部性状基因定位[D].沈阳农业大学,2014.
[48]冯志赟.水稻稀穗突变体的鉴定及分析[D].华中农业大学,2012.
[49]李真.水稻穗顶端退化突变体ppa 2突变基因的精细定位[D].中国农业科学院,2014.
[50]Yoshida A,Ohmori Y,Kitano H,et al.Aberrant spikelet and panicle1,encoding a TOPLESS-related transcriptional co-repressor,is involved in the regulation of meristem fate in rice[J].Plant J.2012,70(2):327-339.
[51]王斌,刘贺梅,毛毕刚,等.水稻顶部小穗退化性状的QTL分析[J].中国水稻科学,2011,25(5):561-564.
[52]Akter M B,Piao R H,Kim B,et al.Fine mapping and candidate gene analysis of a new mutant gene for panicle apical abortion in rice[J].Euphytica,2014,197:387-398.
[53]高素伟.水稻穗顶部退化突变体L-05261的遗传分析及qPAA 8的精细定位[D].中国农业科学院,2011.
[54]韩斌.水稻第四号染色体精确测序完成[J].中国科学院院刊,2003(1):3-4.

