多胺对种子萌发生长及成熟的影响
付玉营, 马文广, 曹栋栋, 郑昀晔, 关亚静, 胡 晋
(1.浙江大学农业与生物技术学院种子科学中心, 杭州310029;2.云南省烟草农业科学研究院, 云南 玉溪653100; 3.浙江农科种业有限公司, 杭州310021)
种子是植物体实现天然更新的一个重要环节,其质量关系到种群的繁衍与进化以及农业生产的丰收。通过多种方式可以促进种子萌发、增强作物抗逆性、提高作物产量及品质等。多胺(Polyamines,PAs)是生物代谢过程中产生的、广泛存在于生物体内的具有较高活性的一类低分子脂肪族含氮碱,参与种子萌发、幼苗生长、种子发育以及逆境响应、种子休眠等重要生理过程。高等植物中常见的多胺有腐胺(Putrescine,Put)、亚 精 胺 (Spermidine,Spd)、精 胺 (Spermine,Spm)和鲱精胺(Agmtatine,Agm)等。多胺可以提高植物的抗逆性,特别是亚精胺,可能因为其独特的分子结构而对植物的抗逆境能力作用更为明显。研究在不同阶段进行多胺处理对种子生长发育的影响,阐释多胺调控种子萌发生长及形成过程的机制,将为打破种子休眠、改善种子发芽、增强作物抗逆性、提高作物产量提供理论指导。
1 多胺代谢
植物种子中多胺水平影响种子的萌发生长及发育,多胺水平通过多胺的合成及降解来调节。多胺在植物内部的整个代谢过程如图1所示[1-3]。
1.1 多胺的合成
植物组织内常见的多胺有Put、Spd、Spm三种,其中Put为Spd与Spm的合成前体。生物合成过程中的途径主要有2条:一是精氨酸(Arginine,Arg)在精氨酸脱羧酶(ADC)和水解酶(AIH)作用下脱去一分子CO2生成Agm,后者在水解酶(CPA)作用下生成Put,称为精氨酸途径;二是Arg水解生成鸟氨酸(Ornithine,Orn),后者在鸟氨酸脱羧酶(ODC)作用下生成腐胺,称为鸟氨酸途径。
1.2 多胺的分解
多胺的分解代谢主要由二胺氧化酶(DAO)和多胺氧化酶(PAO)2种酶催化实现。Put在DAO作用下生成氨基醛,然后环化成吡咯啉(PYRR);Spd在DAO和PAO这2种酶作用下均可分解,经DAO催化得到二氨基丙烷(DAP),然后形成β-丙胺酸、氨丙基吡咯啉(1-PYRR),经 PAO 催化得到 DAP 和PYRR;Spm在PAO作用下得到二氨基丙烷和氨丙基吡咯啉[2],后者进一步分解为1,5二氮杂双环壬烷。
植物体内可能存在Spd转化为Put的氧化途径。Claire等采用标记Spd脉冲追踪发现,在植物Limonium tatarium 根中出现了带标记的Put和伽马氨基丁酸(GABA),因此推测植物中存在Spd转化为Put再进一步氧化成GABA这一途径[3]。
2 多胺对种子萌发、生长及成熟的影响
2.1 多胺与种子萌发
在种子萌发早期,内源多胺含量会发生一定的变化,且往往伴随着或先于核酸、蛋白质的合成[4]。Spd诱导鹰嘴豆种子中基因表达和RNA合成[5],诱导水稻种子中蛋白质的合成[6],对种子萌发具有重要的促进作用。因此认为多胺可能在核酸和蛋白质水平促进种子的萌发。且种子萌发过程中遭遇逆境胁迫时内源多胺含量上升,以减轻逆境对种子造成的伤害。在盐逆境条件下,发芽的菠菜 (Spinacia oleracea L.)、莴 苣 (Lactuca sativa L.)、甜瓜(Cucumis melo L.)、辣椒(Capsicum annum L.)、花 椰 菜 (Brassica oleraceae L.var.Italica Plenk.)、甜菜根(Beta vulgaris L.var.crassa (Alef.)J.Helm.)和番茄(Lycopersicon esculentumMill.)种子中内源Spd含量均有所上升以抵御盐胁迫[7]。Zhao等发现,葡萄糖对莲花(Lotus japonicus)种子萌发的抑制作用可以通过施加Spm得到缓解[8]。
2.1.1 多胺浸种对种子萌发的影响
化学浸种法是将种子浸渍在一定浓度的药液中一定时间,然后取出晾干进行播种,从而消灭种子表面和内部所带病原菌或害虫的方法[9]。化学浸种也可以促进种子较早发芽,提高种子的抗逆性,如采用水杨酸、乙烯利、多胺等浸种。多胺浸种处理能够在一定程度上提高种子活力,促进幼苗生长,并有效缓解各种胁迫条件对种子造成的伤害。
适宜浓度范围(0.01~1.00mmol/L)的Spd浸种可能通过提高α-淀粉酶活性促进玉米种子萌发[10]。Spd浸种不仅可以提高水稻种子的活力,还可以缓解盐胁迫对水稻种子产生的毒害作用[11]。Spd浸种还可促进低温胁迫下辣椒种子的萌发,并对低温胁迫下辣椒幼苗根部生长产生积极影响[12]。重金属能抑制蔬菜种子的萌发,通过Spd浸种后蔬菜种子活力上升,并 在 一 定 程 度 上 适 应 重 金 属 的 胁 迫[13]。0.5 mmol/L Spd与Put浸种处理均可诱导内源脯氨酸的积累,显著减轻次适温(较高温及较低温)对种子萌发的不利影响[14]。袁小丽等发现,用0.01mmol/L Put或0.05mmol/L Spm对花生种子进行浸种,可以显著提高种子活力,并促进其幼苗生长[15]。
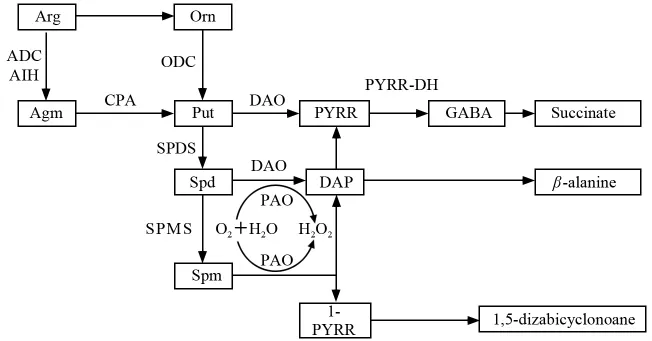
图1 植物中主要多胺的合成与分解途径
2.1.2 多胺引发对种子萌发的影响
种子引发(seed priming)最早由 Heydecker等提出,是一种控制种子缓慢吸水的种子处理技术,其原理为控制种子吸水作用至一定水平,即允许预萌发的代谢作用进行,但防止胚根伸出,控制种子缓慢吸水使其停留在萌发吸胀的第二阶段[16]。有关多胺引发的作用已有较多报道[17-22],多胺引发不仅可以提高种子的发芽能力,促进幼苗的生长,还可增强种子及幼苗的抗逆性。
Spd引发可以缓解低温胁迫对茄子种子萌发和幼苗生长的伤害,促进种子发芽和幼苗生长,并通过提高低温胁迫下茄子幼苗抗氧化酶活性及幼苗脯氨酸和可溶性蛋白质含量,增强幼苗的耐冷能力[17],还可提高玉米种子和黑麦草种子吸胀期间的耐冷性和种子发芽能力[18-19]。Spd引发可显著提高番茄种子的活力及抗氧化酶的活性[20],提升水分胁迫下水稻种子的活力和幼苗的抗旱性[21]。盐胁迫条件下,Spd引发可增加小麦产量,同时,Spd引发处理对幼苗内部离子动态平衡有积极作用,显著降低Na+及Cl-的吸收,降低盐胁迫的伤害[22]。
Spd引发显著提高了玉米不同发育时期种子萌发后胚根尖的4C∶2C比率,增强了DNA的复制速度[23]。在盐碱胁迫条件下,外源Spd预处理番茄种子导致DAO活性上升,PAO活性下降,Spd和Spm含量显著上升,从而诱导S-腺苷蛋氨酸脱羧酶(SAMDC)活性上升,加速Put转化为Spd最终转化为Spm的过程,使盐碱胁迫条件下的种子活力及幼苗素质显著提高[24]。Spd浸种处理使湿涝条件下玉米幼苗小热激蛋白HSP 70和HSP 90表达量上升,且这2种蛋白质富含度显著高于无浸种处理[25]。
2.2 多胺与幼苗生长
在干旱及其他逆境条件下,Put含量上升超过阈值诱导Spd及Spm合成,形成自身保护机制以抵御外界胁迫[26]。在幼苗生长期间喷施适宜浓度的外源多胺后,可以促进幼苗的生长,增加叶片中叶绿素含量,调节植株的多种酶活性,进而减缓逆境胁迫对植株的伤害。
干旱条件下多胺处理能改善苹果幼苗的光合性能,通过促进糖类等有机物质的积累,增加渗透调节物质含量,增强吸水能力,从而提高幼苗的抗旱性[27]。一定浓度的多胺处理可显著提高盐胁迫下黄瓜[28]、大葱[29]、槐叶苹[30]、马来眼子菜[31]等作物叶片叶绿素含量,促进作物光合作用,进而提高作物抗逆性。在渗透胁迫下,外源Spd通过提高脯氨酸代谢关键酶△1-吡咯啉-5-羧酸合成酶(P 5CS)和△1-吡咯啉-5羧酸还原酶(P 5CR)的活性促进脯氨酸的积累,同时提高蔗糖和葡萄糖的含量,维持细胞的渗透势,从而缓解渗透胁迫对小麦的伤害[32]。外源Spd能显著提高低氧胁迫下黄瓜幼苗根系中Spd和Spm含量,降低Put含量,降低根系中乳酸脱氢酶(LDH)、乙醇脱氢酶(ADH)和丙酮酸脱羧酶(PDC)活性,同时提高异柠檬酸脱氢酶(IDH)和琥珀酸脱氢酶(SDH)活性,提高根系有氧呼吸能力,从而缓解低氧胁迫对植株的伤害[33]。Spd能维持淹涝胁迫下玉米根细胞膜透性的稳定,一定程度上抑制乳酸脱氢酶和乙醇脱氢酶活性,降低根尖细胞核DNA的损伤,提高玉米对淹涝的抵抗能力[34]。外源Put促进拟南芥幼苗根系生长,而多胺合成抑制剂D-精氨酸(D-Arg)抑制拟南芥根系的生长发育[35]。外源Spm通过提高水稻幼苗叶片中Put、Spd和Spm含量来增强水稻幼苗的抗渗透胁迫能力[36]。
在逆境胁迫条件下,植物生长受到抑制,叶绿素合成和降解的动态平衡遭到破坏,内部光系统功能紊乱。外源多胺可以保护叶片中的光合色素,稳定光合反应中心的分子结构及功能,促进电子的传递,减轻逆境胁迫条件对光合作用的气孔限制和非气孔限制,缓解外界逆境胁迫对幼苗产生的伤害,促进幼苗的生长。对胁迫条件和外源多胺处理下的番茄幼苗表达蛋白进行分离鉴定,显示这些蛋白参与光合作用、能量代谢、信号转导、蛋白质代谢和氨基酸代谢、氧化还原反应、RNA转录、胁迫防御反应及其他重要生理过程,说明胁迫条件下外源Spd可通过诱导多种代谢途径的协调作用来适应逆境条件[37-38]。Yamaguchi等报道,拟南芥acl 5/spms突变体中不能合成Spm,与野生型相比对盐胁迫比较敏感,原因可能是Spm可以调节Ca2+通道活性,提高细胞质中Ca2+的含量,从而促进了气孔关闭,降低了植物体对Na+、Cl-离子的吸收,降 低 Na+/K+值,进 而 提 高 植 物 耐 盐 性[39-40]。Akiyama等发现,水稻中编码ADC蛋白的基因OsADCl,在冷害胁迫下水稻幼苗中的表达水平显著增加,且同时诱导样品中游离Put产生,这证实了冷胁迫调节了ADC的编码基因,该基因可能影响Put的积累[41]。PAs调节拟南芥转基因幼苗 CYCB 1-GUS的表达,同时盐胁迫对CYCB 1-GUS表达的抑制作用可被外源PAs抵消[42]。
2.3 多胺与种子成熟
多胺对种子发育成熟过程具有重要调控作用。Shiozaki等研究发现,盛花后20~30d有籽葡萄种子中多胺含量均增加,而无籽葡萄则无此现象,游离多胺在种子形成过程中发挥着极为重要的作用,可能通过促进外珠被及胚乳的细胞分化促进葡萄种子的发育[43]。玉米杂交种败育籽粒内源多胺在授粉后4d显著低于正常籽粒,说明多胺可能参与玉米早期胚乳的调控[44]。陈伟等通过研究胚胎发育正常、完全败育及部分胚胎败育的3个荔枝品种的多胺含量,发现Spd、Spm含量低以及在胚珠发育进程中较大的降幅与胚胎败育密切相关[45]。Dongmei等提出,在葡萄胚挽救育种中,通过提高胚珠内源多胺含量或施加外施多胺可促进无核葡萄胚的发育,有利于无核葡萄胚挽救[46]。
经过Spd处理后水稻的灌浆速率大大提高,且喷施Spd显著促进冬小麦籽粒灌浆过程,增加冬小麦粒重,进而提高产量[47]。在大豆种子脱水过程中,酸可溶性共价结合态Spd(fSpd)及酸不溶性共价结合态Spd(AISCCSpd)的含量明显升高,说明Spd在大豆脱水成熟过程中发挥重要作用[48]。杨建昌等研究发现,Spd浓度与谷粒充实率和粒重极显著相关,外源Spd提高水稻籽粒内部Spd含量与胚乳细胞数,可能Spd通过调节DNA、RNA和蛋白质合成,从而促进细胞分裂,进而促进籽粒充实和提高粒重[49]。此外,在超甜玉米种子发育过程中,对母本进行适宜浓度外源Spd处理能促进种子的发育,提高种子活力,并改进种子质量[23]。在种子形成过程中,Spd含量的增加可能促进细胞分裂和同化物在细胞内的积累,最终表现为促进籽粒灌浆,而籽粒灌浆过程也可能对Spd合成有调节作用[50]。
在植物体胚发育过程中,Spd的生物合成有着举足轻重的作用。在拟南芥种子中,当2套编码多胺合成基因spds 1,spds 2同时发生突变时,突变体内Spd含量显著下降,胚形态发育停止在鱼雷期[51]。与此类似的,Urano等利用拟南芥双突变体研究发现,多胺合成相关基因AtADC是正常拟南芥种子的形成所必需[52]。在胚发育前期,ADC基因表达相对增加,ADC酶活性上升,ODC酶活性下降,Spd含量迅速上升[53],说明Spd在胚发育形成过程中发挥重要作用。同时,Cohen等发现,Put参与番茄种子发育早期过程[54]。
2.4 多胺处理与种子休眠
种子休眠(seed dormancy)是指在一定的时间内,具有生活力的种子在适宜发芽的环境因子(温度、湿度、光照、黑暗等)条件下不能萌发的现象[55]。种子内部多胺参与调控种子休眠的过程。Spm通过抑制乙烯合成来维持种子休眠,而Put与Spd则促进种子休眠的破除[56]。活性氧(ROS)可能作为种子休眠破除中氰化物释放的第二信使,在种子萌发过程中扮演重要角色[57],在种子休眠的破除过程中,内源Spd含量明显上升[58],以响应内部ROS的产生。外源Spd对苹果种子休眠的破除具有直接的减轻甚至消除效应,且这种效应可能是种子内部活性氧(ROS)和活性氮(RNS,主要是 NO)产生的响应机制[59-60]。低温层积处理的不同时期,外源Spd处理通过促进种子内部蛋白质合成及不同蛋白质群的出现,打破种子休眠,促进种子的萌发[61]。
3 多胺与其他激素协同对种子萌发生长及成熟的影响
多胺在参与种子萌发生长及成熟的过程中往往不是单独发挥作用,通过与其他激素之间互作来共同调控种子萌发生长及成熟的过程。
生长素(auxin,AUX)参与植物生长发育过程中与多胺代谢联系紧密。10-3M 吲哚乙酸(IAA)使大麦种子在萌发时的ODC活性上升3倍。内源Put及IAA均可延长绿豆根系伸长,吲哚丁酸(IBA)或Put处理提高了内源IAA及腐胺水平,增强了DAO及PAO活性[62],因此认为两者之间可能是相互促进的。α-萘乙酸(NAA)通过降低玉米中胚轴外部组织PAO mRNA和酶蛋白水平,抑制光诱导的PAO活性和暗中PAO的表达,生长素极性运输抑制剂NPA则与NAA表现出相反的效应,说明生长素可能通过抑制PAO的表达阻止多胺氧化降解进而提高内源多胺水平[63]。
赤霉素(gibberellin,GA)在打破种子休眠、叶片生长、性别分化等方面具有重要作用,多胺也参与调控这些过程。GA处理破除种子休眠的过程中,内源Spd、Put含量均上升,ADC活性增强[58]。用 GA3处理大麦糊粉层,在诱导α-淀粉酶的前期,未明显影响多胺水平及ADC和ODC活性,但甲基乙二醛二脒腙(MGBG)明显抑制GA3诱导的α-淀粉酶活性和糊粉层中Spd含量,外源Spd可完全或部分逆转MGBG对α-淀粉酶的抑制作用[64]。
细胞分裂素(cytokinin,CTK)可以促进细胞分裂与扩大,在种子萌发生长过程中发挥重要作用。细胞分裂素可以提高莴苣子叶[65]、黄瓜子叶[66]、大麦种子胚乳[67]内源Put含量,增强ADC活性,而细胞分裂素抑制剂则减少了萝卜子叶[68]中Put积累。玉米中CTK含量高峰的出现与胚乳细胞的快速分裂同步,细胞分裂素诱导营养物质向籽粒中转移,因而促进籽粒充实[69],与多胺促进禾谷类种子成熟过程相似,两者之间可能存在相互促进作用。
脱落酸(abscisic acid,ABA)参与种子发育、果实成熟等过程,多胺与脱落酸之间也有一定的联系。在辣椒子叶不定芽分化伸长过程中,添加Spm(100 μmol/L)或ABA(0.3mg/L)均可提高不定芽的伸长率[70]。ABA能抑制黄瓜子叶生长,使ADC专一活性下降,在水稻上也有类似结果[64]。
乙烯(ethylene,ETH)具有抑制植物生长、促进成熟及衰老的作用,并与逆境胁迫关系密切,同时,乙烯代谢与多胺代谢具有共同的前体物质S-腺苷蛋氨酸(SAM),因此,乙烯与多胺之间的互作关系受到广泛关注。有学者认为,多胺(Spd、Spm)与乙烯含量比值越高,籽粒灌浆速率越快,这一结论在水稻[71]、玉米[72]、拟南芥[73]上均得到证实。因此认为在种子成熟过程中多胺与乙烯之间的作用是拮抗的。在花生种子萌发中Put处理使乙烯释放明显增多,但Spm抑制乙烯释放[15]。
4 展 望
多胺在种子生长发育成熟过程中扮演着重要角色,关于多胺对种子的调控作用也越来越受到人们的重视。然而,种子内部以何种形式感受多胺信号,多胺在种子内部运输方式,多胺参与种子萌发生长及成熟的各个阶段的形式,多胺通过调控哪一个区间的基因、编码何种蛋白质打破种子的休眠、促进种子的萌发、促进幼苗的生长、促进种子的成熟、增强植物的抗逆性等分子机制都还知之甚少。同时,多胺与其他激素之间互作调控种子萌发生长及成熟过程中的分子机制也有待深入。
[1]Kasinathan V.,Wingler A.Effect of reduced arginine decarboxylase activity on salt tolerance and on polyamine formation during salt stress in Arabidopsis thaliana[J].Physiologia Plantarum,2004,121:101-107.
[2]李广敏,檀建新,贾荣革.高等植物的多胺代谢[J].河北农业大学学报,1993,16:86-91.
[3]Claire D.,Guillaume G.,David G.,et al.The conversion of spermidine to putrescine and 1,3-diaminopropane in the roots of Limonium tataricum [J].Plant Science,163:639-647.
[4]HUANG H.T.,VILLANUEVA V.R.Inhibition of polyamine biosynthesis and seed germination in Picea abies[J].Phytochemistry,1992,31:3 353-3 356.
[5]Buenom,Garridod,Matillaa.Gene expression induced by spermine in isolated embryo nicaxes of chick-pea seeds[J].Physiologia Plantarum,1993,87:381-388.
[6]Mukhopadhyaya,Ghoshb.Protein synthesis and loss of viability of rice seed:effect of polyamine on invitro translation[J].Physiologia Plantarum,1986,68:441-445.
[7]Pedro J.Zapata,Maria Serrano,M.Teresa Pretel,et al.Polyamines and ethylene changes during germination of different plant species under salinity[J].Plant Science,2004(167):781-788.
[8]Zhao M.G.,Liu R.J.,Chen L.,et al.Glucose-induced inhibition of seed germination in Lotus japonicus is alleviated by nitric oxide and spermine[J].Journal of Plant Physiology,2009,166:213-218.
[9]毛连纲,颜冬冬,吴篆芳,等.种子处理技术研究进展[M].中国蔬菜,2013(10):9-15.
[10]杜红阳,王进,刘怀攀,等.亚精胺浸种对玉米种子萌发的影响[J].安徽农业科学,2007,35(34):11 009-11 010.
[11]辛树权,高扬,赵骥民,等.盐胁迫下亚精胺浸种对水稻种子萌发的影响[J].北方水稻,2010,6(6):23-25.
[12]姜秀梅,秦勇,郭光照.外源亚精胺对低温胁迫下辣椒种子萌发及幼苗生长的影响[J].新疆农业科学,2013,50(12):2 266-2 273.
[13]刘术新.镉胁迫下亚精胺对蔬菜种子萌发的影响[J].贵州农业科学,2013,39(10):61-63.
[14]Da Silva,J.,Saccini,VAV.,dos Santos,DMM.Temperature stress in accumulation of free proline of pigeonpea seedlings from seeds treated with polyamines[J].SEMINACIENCIAS AGRARIAS,2015,36(1):103-122.
[15]袁小丽,傅家瑞,李卓杰.CaCl2和多胺对萌发花生种子乙烯释放和提高种子活力的影响[J].中山大学学报,1990,29(4):92-99.
[16]Heydecker W.,Higgins J.,Gulliver O.L.Accelerated germination by osmotic seed treatment[J].Nature,1973,246:42-44.
[17]张彦萍,刘海河,申书兴,等.多胺引发处理对茄子种子活力及幼苗耐冷性的影响[J].园艺学报,2010,37(11):1 783-1 788.
[18]郑昀晔,曹栋栋,胡晋,等.多胺对玉米种子吸胀期间耐冷性和种子发芽能力的影响[J].作物学报,2008,34(2):261-267.
[19]Yingfen WANG,Puchang WANG,Jiahai WU,et al.Effect of polyamine priming on chilling tolerance of Lolium perenne drying seed imbibitions[J].Agricultural Science and Technology,2012,13(9):1 859-1 863,1 869.
[20]Afzal,I.,Munir,F.,Ayub,C.M.,et al.Changes in antioxidant enzymes,germination capacity and vigour of tomato seeds in response of priming with polyamines [J].Seed Science and Technology,2009,37(3):765-770.
[21]周小梅,赵运林,文彤,等.亚精胺引发对水分胁迫下水稻种子活力及幼苗生理特性的影响[J].核农学报,2013,27(2):247-252.
[22]M.Iqbal,M.Ashraf.Changes in growth,photosynthetic capacity and ionic relations in spring wheat(Triticum aestivumL.)due to pre-sowing seed treatment with polyamines[J].Plant Growth Regulation,2005,46(1):19-30.
[23]曹栋栋.多胺对超甜玉米种子发育过程种子质量和萌发的调控作用研究[D].浙江大学博士论文,2010.
[24]Xiaohui Hu,Yi Zhang,Yu Shi.Effect of exogenous spermidine on polyamine content and metabolism in tomato exposed to salinity ealkalinity mixed stress[J].Plant Physiology and Biochemistry,2012,57:200-209.
[25]M.Y.Liu,J.Sun,K.Y.Wang,et al.Spermidine enhances waterlogging tolerance via regulation of antioxidant defence,heat shock protein expression and plasma membrane H+-ATPase activity in Zea mays[J].Journal of Agronomy and Crop Science,2014,200(3):199-211.
[26]Teresa Capell,Ludovic Bassie,Paul Christou.Modulation of the polyamine biosynthetic pathway in transgenic rice confers tolerance to drought stress [J].International Congress in the Wake of the Double Helix,2004,101(26):9 909-9 914.
[27]刘彦超,左仲武,胡景江.外源多胺对苹果幼苗生长及抗旱性的影响[J].西北林学院学报,2010,25(1):39-42.
[28]李娜,陈红,裴孝伯.外源亚精胺对盐胁迫下黄瓜幼苗耐盐性的影响[J].热带作物学报,2013,34(7):1 359-1 364.
[29]Yiu J.C.,Liu C.W.,Fang D.Y.,et al.Waterlogging tolerance of Welsh onion (Allium fistulosum L.)enhanced by exogenous spermidine and spermine[J].Plant Physiology and Biochemistry,2009,47(8):710-716.
[30]Xu Q.S.,Shi G.X.,Wang H.X.,et al.Roles of exogenous spermidine in improving Salvinia natans tolerance towards cadmium stress[J].Chinese Journal of Applied Ecology,2008,19(11):2 521-2 526.
[31]Yang H.Y.,Shi G.X.,Qiao X.Q,et al.Exogenous spermidine and spermine enhance cadmium tolerance of Potamogeton malaianus[J].Russian Journal of Plant Physiology,2011,58(4):622-628.
[32]杜红阳,李青芝,杨青华,等.亚精胺对渗透胁迫下小麦幼苗渗透调节物质含量和脯氨酸代谢酶活性的影响[J].麦类作物学报,2014,34(8):1 092-1 097.
[33]李璟,郭世荣,胡晓辉.外源亚精胺对低氧胁迫下黄瓜根系多胺含量和呼吸代谢酶活性的影响[J].西北植物学报,2006,26(1):92-97.
[34]刘丹,刘美艳,俞立璇,等.外源亚精胺对芽涝玉米根系保护作用的研究[J].玉米科学,2013,21(3):61-65.
[35]高红,陈春丽.多胺生物合成抑制剂D-精氨酸对拟南芥幼苗根系生长的影响[J].植物生理学报,2013,49(10):1 082-1 088.
[36]佘丽山,周小梅.渗透胁迫下外源精胺对水稻幼苗多胺含量及抗旱性的影响[J].湖南农业科学,2011(17):33-35,46.
[37]张毅.亚精胺对番茄幼苗盐碱胁迫的缓解效应及其调控机理[D].西北农林科技大学硕士论文,2013.
[38]苏晓琼,王美月,束胜,等.外源亚精胺对高温胁迫下番茄幼苗快速叶绿素荧光诱导动力学特性的影响[J].园艺学报,2013,40(12):2 409-2 418.
[39]Yamaguchi K.,Takahashi Y.,Berberich T,et al.The polyamine spermine protects against high salt stress in Arabidopsis thaliana[J].FEBS Letters,2006,580:6 783-6 788.
[40]Yamaguchi K,Takahashi Y,Berberich T,et al.A protective role for the polyamine spermine against drought stress in Arabidopsis[J].Biochemical and Biophysical Research Communications,2007,352:492-496.
[41]Akiyama T.Jin S.Molecular cloning and characterization of an arginine decarboxylase gene up-regulated by chilling stress in rice seedlings[J].Journal of Plant Physiology,2007,164:645-654.
[42]Ortega-Amaro MA,Rodríguez-Kessler M,Becerra-Flora A,et al.Modulation of Arabidopsis CYCB 1expression patterns by polyamines and salt stress[J].Acta Physiologiae Plantarum,2012,34(2):461-469.
[43]Shuji Shiozaki,Tsuneo Ogata,Shosaku Horiuchi.Endogenous polyamines in the pericarp and seed of the grape berry during development and ripening[J].Scientia Horticulturae,2000,83(1):33-41.
[44]Liang Y.L.,Lur H.S.Conjugated and free polyamine levels in normal and aborting maize kernels[J].Crop Scienee,2002,42(4):1 217-1 224.
[45]陈伟,吕柳新,叶陈亮,等.荔枝胚胎败育与胚珠内源激素关系的研究[J].热带作物学报,2000,21(3):34-38.
[46]TANG Dong-mei,WANG Yue-jin,CAI Jun-she,et al.Effects of exogenous application of plant growth regulators on the development of ovule and subsequent embryo rescue of stenospermic grape (Vitis vinifera L.)[J].Scientia Horticulturae,2009,120(1):51-57.
[47]刘杨,温晓霞,顾丹丹,等.多胺对冬小麦籽粒灌浆的影响及其生理机制[J].作物学报,2013,39(4):712-719.
[48]HU Bingyi.Research on the orange of different types of polyamine in dehydration process of soybean seeds[J].Journal of Anhui Agricultural Sciences,2007,35(12):3 468-3 480.
[49]杨建昌,朱庆森,王志琴.水稻籽粒中内源多胺及其与籽粒充实和粒重的关系[J].作物学报,1997,23(4):385-392.
[50]寇洪萍,王伯伦,王术,等.北方粳稻籽粒多胺合成与灌浆
的关系[J].沈阳农业大学学报,2004,35(4):336-339.
[51]Jaana Vuosku,Anne Jokela,Esa Laara.Consistency of Polyamine Profiles and Expression of Arginine Decarboxylase in Mitosis during Zygotic Embryogenesis of Scots Pine[J].Plant Physiology,2006,142(3):1 027-1 038.
[52]Imai,A.,Matsuyama,T.,Hanzawa,Y.Spermidine synthase genes are essential for survival of Arabidopsis[J].Plant Physiology,2004,135(3):1 565-1 573.
[53]Kaoru Uranoa,Tokunori Hoboa,Kazuo Shinozaki.Arabidopsis ADCgenes involved in polyamine biosynthesis are essential for seed development[J].FEBS LETTERS,2005,579(6):1 557-1 564.
[54]Cohen E.,Arad S.M.,Heimer Y.M.,et al.Participation of ornithine decarboxylase in early stages of tomato fruit development[J].Plant Physiology,1982,70:540-543.
[55]胡晋主编.种子学(第2版)[M].北京:中国农业出版社,2014,2:65-66.
[56]Stanislaw Lewak.Metabolic control of embryonic dormancy in apple seed:seven decades of research[J].Acta Physiol Plant,2011,33:1-24.
[57]Oracz Krystyna,El-Maarouf-Bouteau Hayat,Kranner Ilse,et al.The mechanisms involved in seed dormancy alleviation by hydrogen cyanide unravel the role of reactive oxygen species as key factors of cellular signaling during germination[J].Plant Physiology,2009,150(1):494-505.
[58]N.Béranger-Novat,J.Monin,J., Martin-Tanguyb.Polyamines and their biosynthetic enzymes in dormant embryos of the spindle tree(Euonymus europaeus L.)and in dormancy break obtained after treatment with gibberellic acid[J].Plant Science,1994,102(2):139-145.
[59]SINSKA,I.,LEWANDOWSKA,U.Polyamines and ethylene in the removal of embryonal dormancy in apple seeds[J].Physiologia Plantarum,1991,81(1):59-64.
[60]Urszula Krasuska,Katarzyna Ciacka,Renata Bogatek,et al.Polyamines and nitric oxide link in regulation of dormancy removal and germination of apple(Malus domesticaborkh.)embryos[J].Journal of Plant Growth Regulation,2014,33(3):590-601.
[61]Zo.fia Szczotka,Tomasz Pawlowski,Kazimierz Krawiarz.Proteins and polyamines during dormancy breaking of European beech (Fagus sylvatica L.)seeds[J].Acta Physiologiae Plantarum,2003,25(4):423-435.
[62]Nag,S.,Saha,K.,Choudhuri,M.A.Role of auxin and polyamines in adventitious root formation in relation to changes in compounds involved in rooting[J].Journal of Plant Growth Regulation,2001,20(2):182-194.
[63]CHINNUSAMY V.,GONG Z.Z.,ZHU J.K.Abscisic acidmediated epigenetic processes in plant development and stress responses[J].Journal of Integrative Plant Biology,2008,150(10):1 187-1 195.
[64]朱大恒,韩锦峰,林学梧,等.多胺与植物激素的关系[J].河南农业大学学报,1993,27(1):10-15.
[65]CHO,S.Effect of cytokinins and several inorganic cations on the polyamine content of lettuce cotyledons[J].Plant Cell Physiol.1983,24:27-32.
[66]WALKER,M.,D.ROBERTS,E.DUMBROFF:Effect of cytokinin and light on polyamines during the greening response of cucumber cotyledons[J].Plant Cell Physiology,1988,29:201-205.
[67]HEMANTARANJAN,A.and O.GARG:Effect of cytokinin and several inorganic cations on the polyamine content of barley(Hordeum vulgare L.)endosperm[J].Indian Journal of Experimental Biology,1984,22:379-382.
[68]ISKREN G.SERGIEV,VERA S.ALEXIEVA,EMANUIL N.KARANOV.Cytokinin and anticytokinin effects on growth and free polyamine content in etiolated and green radish cotyledons[J].Journal of Plant Physiology,1995,145:266-270.
[69]李宗霆,周燮.植物激素及其免疫检测技术[M].南京:江苏科学技术出版社,1996:137-151.
[70]杨国顺,谢丙炎,蒋芳玲,等.多胺与脱落酸对辣椒子叶再生的影响[J].园艺学报,2003,30(5):603-605.
[71]王静超.多胺与乙烯对水稻籽粒灌浆的调控作用[D].扬州大学硕士论文,2013.
[72]Hu W.W.,Gong H.,Pua E.C.Modulation of SAMDC expression in Arabidopsis thaliana alters in vitro shoot organogenesis[J].Physiologia Plantarum,2006,128:740-750.
[73]Feng H.Y.,Wang Z.M.,Kong F.N.Roles of carbohydrate supply and ethylene polyamines in maize kernel set[J].Journal of Integrative Plant Biology,2011,53:388-398.

参考文献类型及其标志

