北川花魔芋愈伤组织与试管微球茎离体诱导研究
廖 倩, 胡尚连, 曹 颖, 黄 艳, 冯璐璐
(1.西南科技大学生命科学与工程学院, 四川 绵阳621010;2.四川省生物质资源利用与改性工程技术研究中心, 四川 绵阳621010)
花魔芋(Amorphophallus albus)是栽培面积较广的魔芋品种之一,具有很高的药用和食用价值,其魔芋精粉及衍生物在农业、纺织、建筑、化工等行业得到广泛应用[1-3]。北川花魔芋是四川北川羌族自治县的著名特产,具有与其他地域魔芋产品的不同优异产品特性,获得了农业部颁发的农产品地理标志证书,进入我国农产品地理标志保护行列。北川花魔芋生产上主要依靠半野生种逐步驯化,由于长期连续采挖,野生魔芋资源濒临枯竭[4]。此外,由于缺乏稳定的良种繁育体系,种芋带病且病害逐年加重,种芋的数量和质量已经成为北川花魔芋生产发展的瓶颈[5]。因此,针对北川花魔芋种质资源保存、品种纯化复壮,建立愈伤组织与试管微球茎离体诱导及脱毒繁育体系,对北川花魔芋进一步研究和利用具有重要意义[6-8]。本研究利用组织培养方法,尝试以北川花魔芋的根状茎、嫩叶和叶柄为外植体,建立适合北川花魔芋的愈伤组织诱导和微型试管芋(拟球茎)培养技术,以实现在试管内全年生产种芋,为北川花魔芋良种繁育技术奠定基础。
1 材料与方法
1.1 材 料
北川花魔芋采自于四川省绵阳市北川羌族自治县安昌镇幸福村,以2月龄植株的叶柄、嫩叶、叶脉以及根状茎为外植体。
1.2 方 法
1.2.1 外植体处理及接种
将外植体用自来水冲洗2h后,置于超净台上,用75%乙醇消毒30s,用无菌水清洗3~4次,再用0.1%的升汞溶液处理10min,最后用无菌水冲洗3~5次。将消毒后的叶柄切割成薄片(厚度为2~3mm),叶片切割成1cm2左右的方块,根状茎切成约2cm的小段,叶脉切成厚度为2mm左右的长条,将各外植体接种于相应的培养基上。每个处理接种30瓶,叶柄2块/瓶,根状茎4块/瓶,叶脉10块/瓶,叶片20片/瓶;试验重复3次。
1.2.2 不同外植体对愈伤组织诱导的影响
将不同外植体接种于 MS+1.0mg/L 6-BA+0.1 mg/L NAA+3%蔗糖+0.8%琼脂培养基中,置于25±1℃黑暗培养,观察愈伤组织诱导情况,30d后统计诱导率。愈伤组织诱导率(%)=形成愈伤组织的外植体数/接种外植体总数×100%。
1.2.3 不同激素浓度配比对愈伤组织诱导的影响
以MS+3%蔗糖+0.8%琼脂为基本培养基,附加不同浓度的6-BA(1.0mg/L 和1.5mg/L)和 NAA(0.1mg/L和0.5mg/L),pH 值为5.8;将接种后的外植体置于(25±1)℃黑暗培养,观察愈伤组织诱导情况,30d后统计诱导率。
1.2.4 继代与分化
外植体培养6周后,选取生长良好的魔芋愈伤组织置于25±1℃、弱光条件下(弱散射光强度约500 lx)进行继代培养,培养基为 MS+0.5mg/L 6-BA+0.5mg/L NAA,每30d继代1次。观察并记录愈伤组织变化情况,统计愈伤组织类型比例、增殖系数以及出芽率。增殖频率=继代过程中发生增殖的愈伤组织所占的比例。
1.2.5 魔芋试管微型芋的诱导
继代培养2~3次后,将愈伤组织切成适当大小的小块,转入 MS+2.0mg/L 6-BA+0.5mg/L NAA+5%蔗糖培养基中[9]进行试管微球茎诱导试验。
2 结果与分析
2.1 不同外植体类型对愈伤组织诱导的影响
试验中大多数外植体均不同程度诱导出了愈伤组织,但不同外植体愈伤组织形成的时间、形成位置以及愈伤组织质地和颜色等均有较大差异。如图1所示,在 MS+1.0mg/L 6-BA+0.1mg/L NAA的诱导培养基中,叶柄培养10d后出现卷曲且边缘开始变红(图1a),3周后形成愈伤组织。首先是在切面上会形成许多白色的瘤状小突起,随后瘤状小突起不断变大最后覆盖了整个外植体(图1b),部分叶柄边缘开始变为黑色(图1c)。接种后的叶片增厚膨大,约3周后颜色变淡,边缘切口处变为褐色(图1d)。叶脉接种1周后,体积膨大(图1e),培养2周左右,叶脉切口出现瘤状小突起(图1f),但随后仅极少形成瘤状结构愈伤组织。根状茎在接种后4d左右出现部分变色(图1g),3周之后体积发生膨大,并且部分生长出根状物(图1h),进一步培养后部分根状茎出现粉色或白色的瘤状的愈伤组织,并伴有长满白色毛的根状物(图1i)。从表1中可以看出,不同的外植体形成愈伤组织的能力有明显的不同,从表中可知叶柄外植体(35.0%)和根状茎外植体(32.1%)愈伤组织诱导率明显高于其它类型的外植体。
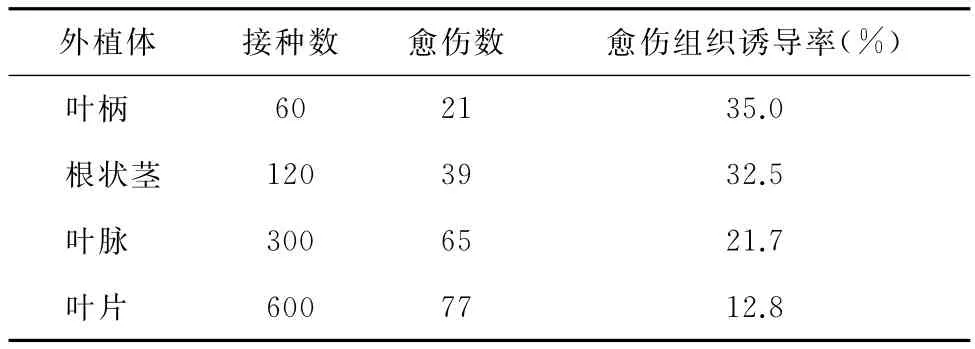
表1 不同类型外植体的愈伤组织诱导率
2.2 不同激素浓度配比对愈伤组织诱导的影响
由表2可见,不同激素组合对魔芋愈伤组织的诱导效果不一,在相同激素配比下,不同外植体诱导效果出现较大差异。就叶柄而言,各培养基中的愈伤组织诱导率均高于另外2种外植体,其中MS+1.0mg/L 6-BA+0.5mg/L NAA 诱导效果最好,诱导率为48.3%,诱导率快,愈伤数多;而在该培养基中,叶脉和叶片愈伤诱导率明显偏低,均低于20%;叶片在MS+1.5mg/L 6-BA+0.5mg/L NAA 培养基上的愈伤诱导效果较好,然而诱导率仅有16.2%;叶脉在MS+1.0 mg/L 6-BA+0.1mg/L NAA培养基上的愈伤诱导效果较好,诱导率为21.7%。

图1 不同外植体在愈伤组织诱导培养基上的培养反应

表2 不同的NAA和BA浓度对魔芋不同外植体愈伤组织诱导的影响
2.3 继代培养过程中愈伤组织类型、增殖频率及其分化能力分析
各种外植体初诱导出的愈伤组织,均结构疏松,而继代2~3次后,愈伤组织会形成3种明显不同的类型(图2,表3)。Ⅰ型为半透明的愈伤组织,没有生长和分化能力,在光照条件下会迅速褐化、坏死(图2a)。Ⅱ型为浅灰褐色、愈伤组织结构疏松状,增殖频率约为63.6%,但不易分化出芽(图2b)。Ⅲ型愈伤组织较白,稍带绿色或者粉色,结构致密、质地坚硬,其表面成球状或瘤状(图2c),该类型的愈伤组织生理状态好,增殖频率较高(90.8%),容易分化出不定芽和微球茎;部分芽直接在愈伤组织上发生,有的则通过拟球茎(其形态与魔芋田间球茎相似)发生,后者长成的植株较健壮。

表3 继代培养3次后魔芋愈伤组织类型
2.4 魔芋微球茎的形成
微球茎诱导情况见图3,将获得的Ⅲ型愈伤组织转入含有5%蔗糖的微球茎诱导培养基后,经过4周培养,愈伤组织开始形成微球茎,继续培养至第8周可见大量生长良好的微球茎,该微球茎表皮浅褐色,带大量芽点,1~2cm大小。可见,5%蔗糖有利于促进微球茎的形成。
3 讨 论
魔芋在离体培养过程中一般需要经历2个过程,即愈伤组织诱导阶段和分化培养阶段。研究表明,分裂素6-BA与生长素NAA配合使用对魔芋愈伤组织诱导与分化具有明显促进作用[10-11]。本试验结果也进一步证实了该结论,不同浓度配比的6-BA与NAA可不同程度地诱导愈伤组织的发生。在诱导过程中,外植体的类型与愈伤组织的诱导率、颜色、质地具有密切联系。庄承纪[10]与谢庆华[12-13]等认为,根状茎是魔芋诱导愈伤组织的最佳外植体,而本研究结果发现,以叶柄为外植体其愈伤组织诱导效果均高于其他器官,包括根状茎。

图2 花魔芋愈伤组织的3种类型

图3 魔芋微球茎
魔芋组织培养过程中器官发生途径主要包括:外植体—愈伤组织—不定芽—生根成苗;外植体—愈伤组织—生根长芽成苗;外植体—愈伤组织—胚状体成苗以及外植体—愈伤组织—小块茎—成苗等[11,14]。由此可见,愈伤组织的状态对器官分化具有重要影响。Hu等认为,魔芋愈伤组织可形成3种不同类型,这3种类型愈伤组织在不同的培养条件下还可以相互转变[15]。本试验结果同样获得3种愈伤类型,即半透明Ⅰ型,浅灰褐色、愈伤组织结构疏松状的Ⅱ型,以及稍带绿色或者粉色,结构致密、质地坚硬的Ⅲ型愈伤组织。Ⅲ型的愈伤组织生理状态好,增殖频率较高,容易分化出不定芽和微球茎。但在培养过程中未发现相互转化现象,Ⅰ型愈伤在继代过程中出现褐化现象并死亡。同时试验表明,北川花魔芋器官发生途径主要为外植体—愈伤组织—不定芽—生根成苗和植体—愈伤组织—小块茎—成苗2种途径,后者中的小块茎即拟球茎,它具有与田间魔芋相同的繁殖方式,独立培养可以产生很多新的小球茎,实现了“器官-器官”的繁殖方式。拟球茎是一种微型变态繁殖器官,具有体积小、可贮运、易长苗、易生根等优点,在魔芋种芋繁殖中有望代替试管苗。
北川花魔芋的组织培养过程中,虽然成功诱导了具有分化能力的愈伤组织以及微球茎,但仍存在很多的问题,如魔芋微球茎诱导率的提高、繁殖过程中病毒、病源菌的脱病率等,尚待进一步的研究。
[1]赵培城,张晶晶,周绪霞,等.魔芋葡甘露聚糖及其衍生物在食品工业中的应用[J].核农学报,2015,29(1):101-105.
[2]Zhang Y Q,Xie B J,Gan X.Advance in the applications of konjac glucomannan and its derivatives[J].Carbohydrate Polymers,2005,60(1):27-31.
[3]马俊,齐颖.魔芋的功能及应用[J].中国食物与营养,2006,12(5):48-49.
[4]覃淑君,陶诗顺,孙建明.四川盆周北部花魔芋资源生育特性研究[J].西南科技大学学报,2005,20(1):56-59.
[5]陈磊,廖甜甜,郭政宏,等.软腐病基因在花魔芋块茎组织中特异表达的研究[J].分子植 物育种,2014,12(6):1 230-1 234.
[6]张云峰,谢庆华,严胜柒,等.魔芋试管微球茎成熟度对其储藏及萌发率的影响[J].种子,2006,25(7):13-15.
[7]刁英,沈远明,瞿桢,等.珠芽魔芋的引种及驯化栽培技术研究[J].种子,2008,27(10):78-81.
[8]牛义,张盛林,王志敏,等.中国魔芋资源的研究与利用[J].西南农业大学学报(自然科学版),2005,27(5):634-638.
[9]胡建斌.魔芋离体形态发生机制及其繁殖技术[D].武汉:华中农业大学,2006.
[10]庄承纪,周建葵.魔芋属植物愈伤组织的诱导和再生植株的研究[J].云南植物研究,1987,9(3):339-347.
[11]黄远新,何凤发,张盛林.魔芋组织培养与快繁技术研究[J].西南农业大学学报(自然科学版),2003,25(4):309-312.
[12]谢庆华,吴毅歆,谢世清,等.花魔芋不同外植体分化及生根条件研究[J].云南农业大学学报,2004,19(6):696-699.
[13]谢庆华,张云峰,严胜柒,等.不同外植体诱导魔芋微球茎的比较研究[J].云南农业学报,2005,20(3):350-355.
[14]黄丹凤,刘佩英.魔芋组织快繁技术的应用研究[J].上海农学院学报,1991,9(2):162-164.
[15]Hu J B,Liu J,Yan H B,et al.Histological observations of morphogenesis in Petiole derived callus of Amorphophallus rivieri Durieu in vitro[J].Plant Cell Rep,2005,24(11):642-648.

