三种牧草对干旱胁迫的生理响应及抗旱性评价
靳军英,张卫华,袁玲
(西南大学资源环境学院,重庆 400715)
三种牧草对干旱胁迫的生理响应及抗旱性评价
靳军英,张卫华,袁玲*
(西南大学资源环境学院,重庆 400715)
摘要:为了解不同牧草对干旱胁迫的响应,筛选抗旱性强的牧草种类,试验选用扁穗牛鞭草、高丹草和拉巴豆为材料,盆栽研究了水分胁迫对牧草生长的影响及其生理反应。结果表明,牧草对干旱的响应因牧草种类和生理指标不同而异。随着旱情加剧,3种牧草的生物量持续降低,最大降幅可比对照降低18.29%(牛鞭草)、31.21%(高丹草)和33.55%(拉巴豆)。但是,轻、中度干旱对牛鞭草和高丹草的根系生长影响较小,根冠比增加。牧草地上部生物量减少有益于降低水分消耗,根冠比增加使相对更多的根系参与水分和养分吸收。干旱导致细胞膜破坏,丙二醛含量提高,胞内物质外渗,电导率增加,叶绿素和根系活力降低,进而抑制牧草生长。在干旱条件下,牧草体内的脯氨酸是对照的1.3~8.1倍,可溶性糖和蛋白质含量显著提高,产生渗透调节。干旱还能诱导激活牧草体内的超氧化物歧化酶、过氧化物酶和过氧化氢酶,促进消除游离氧自由基,减轻干旱危害。采用隶属函数法综合评价牧草的抗旱性表明,扁穗牛鞭草的抗旱性最强,拉巴豆次之,高丹草最差。
关键词:干旱;生理反应;渗透调节;抗旱性
Physiological responses of three forages to drought stress and evaluation of their drought resistance
JIN Jun-Ying, ZHANG Wei-Hua, YUAN Ling*
CollegeofResourcesandEnvironment,SouthwestUniversity,Chongqing400715,China
Abstract:The aim of this study was to evaluate the drought stress responses of various forages and to select forage cultivars with high drought resistance. A pot experiment was carried out to study the effects of drought stress on the growth and physiology of Hemarthria compressa, Sudangrass (a Sorghum hybrid), and Dolichos lab lab. The drought responses, as measured using various physiological indices, differed among the three forages. The biomass of the three forages continuously decreased as the duration of the drought treatment extended. The maximum decrease in biomass under drought, as compared with their respective controls, was 18.29% for H. compressa, 31.21% for Sudangrass, and 33.55% for D. lab lab. Light and medium drought treatments had little effect on the root growth of H. compressa and Sudangrass, but increased their root:shoot ratios. The decrease in shoot biomass under drought reduced water consumption, and the increased root:shoot ratios increased the water and nutrition absorption capacity of the plants. The drought treatments damaged cell membranes and increased the malondialdehyde content, resulting in leakage of intracellular materials, increased relative electric conductivity, reduced chlorophyll content, and lower root activity, all of which inhibited growth of the three forages. Under drought stress, the proline content in tissues of the three forages was 1.3-8.1 times that in their respective controls, and there were significant increases in soluble sugar content and soluble protein content, which aided osmotic adjustment. The drought treatments also promoted the activity of antioxidant enzymes (superoxide dismutase, peroxidase, and catalase) in the three forages. The increased antioxidant enzyme activities helped to eliminate free oxygen radicals to mitigate drought damage. A comprehensive evaluation of the drought resistance of the three forages using the membership function method ranked their drought resistance, from strongest to weakest, as follows: H. compressa>D. lab lab>Sudangrass.
Key words:drought; physiological response; osmoregulation; drought resistance
干旱严重危害植物生产,其持续时间、出现次数、影响范围和造成的损失高居各种自然灾害之首[1-2]。自扁穗牛鞭草(Hemarthriacompressa)、高丹草(SorghumHybrid Sudangrass)和拉巴豆(Dolichoslablab)引进我国之后,现已广泛种植于三峡库区。目前,国内外对上述3种牧草的遗传育种、营养品质、栽培技术和抗逆性进行了大量研究[3-5]。牛鞭草存在二倍体、四倍体和六倍体等,其抗旱性差异显著[6-8]。干旱胁迫使其根系丙二醛(malondialdehyde,MDA)含量升高,过氧化物酶(peroxidase,POD),过氧化氢酶(catalase,CAT),超氧化物歧化酶(superoxide dismutase,SOD)活性增强[9],抗旱性强的品种具有较强的保护酶活性,有益于消除干旱脱水对细胞的破坏作用[10]。高丹草由高粱和苏丹草杂交而成,其抗旱性与亲本特性和配合力密切相关,干旱不同程度降低其光合速率,抑制养分吸收和生长发育[11]。用聚乙二醇(polyethylene glycol,PEG)模拟干旱胁迫,高丹草幼苗在光合速率、渗透调节、矿质养分吸收,根系生长、水分利用等方面产生生理反应,抗旱性也因品种不同而异,人们现已完成了高丹草很多品种的抗旱性评价[12,4],并对抗旱基因进行了QTL定位[13]。此外,施用磷、钾有益于提高牛鞭草和高丹草的抗旱性,降低干旱损失[14-15]。拉巴豆原产于澳大利亚,国内引进较晚,抗旱性研究不多[16-18]。综上所述,牧草抗旱性涉及生理生化过程,是多种复合性状的综合体现[19-20]。但是,人们常用单因素方法评价牧草的抗旱性,且主要是比较同一牧草不同品种的抗旱能力。研究牧草对干旱的不同生理反应,综合评价不同牧草之间的抗旱性,有益于揭示牧草抗旱机理和筛选抗旱性强的牧草种类。
三峡库区属于太平洋季风气候,降雨分布不均,伏旱严重,干旱频繁。此外,当地多为山地丘陵,牧草一般种植于土层浅薄,贮水性差的坡耕地,季节性干旱严重影响牧草生长和产量[14]。因此,研究牛鞭草、高丹草和拉巴豆对水分胁迫的响应,综合评价其抗旱性,对于当地的植被建设、水土保持和畜牧业发展具有重要意义。本研究采用盆栽控水试验,设置不同水分供应,研究了这3种牧草的生长和多种生理反应,并采用模糊隶属函数法综合评价其抗旱性,目的是比较这3种牧草的抗旱能力,为三峡库区宜栽牧草选择,合理布局,以及退耕还草生态工程和草食家畜发展提供科学参考。
1材料与方法
1.1 供试材料
供试土壤:为三峡库区当地典型、具有代表性的灰棕紫泥紫色土,成土母质为侏罗纪肉红色长石石英砂岩,砂壤质地。耕层土壤有机质11.09 g/kg,碱解氮56.73 mg/kg,Olsen磷15.48 mg/kg,速效钾70.00 mg/kg,pH 6.89,最大田间持水量(θf)24.13%。采集0~20 cm耕层土壤,拣去石砾和植株残体等杂物,风干、过2 mm筛备用。
供试牧草:“广益”扁穗牛鞭草、“乐食”高丹草和“润高”拉巴豆均由西南大学畜牧兽医学院提供。试验于2014年5-7月,在西南大学资源环境学院简易温室中进行。取米氏钵(高×直径=16 cm×22 cm)装土5.00 kg,施用基肥0.15 g N/kg土,N∶P2O5∶K2O=1∶0.5∶0.5,分别用尿素、过磷酸钙、硫酸钾提供,肥土混匀。每钵扦插20株长7 cm左右牛鞭草茎条,成活10 d后每盆留10株均匀一致的幼苗;高丹草和拉巴豆的种子在播种前用1%双氧水消毒3 min,去离子水洗净,发芽至露白后播种,出苗10 d后匀苗,每盆留10株均匀一致的幼苗。再继续正常浇水培养5 d,获得供试牧草幼苗备用。
1.2 试验设计
试验设置正常供水(对照,CK)、轻度干旱(LD)、中度干旱(MD)和重度干旱(SD)4种水分处理,用称重法保持每种水分处理的土壤含水量分别为最大田间持水量(θf)的70%~75%(CK)、60%~70%(LD)、50%~60%(MD)和45%~50%(SD)。当土壤含水量降至设定下限时,补充水分至设定上限,且记录加水量。为了防治养分淋失造成差异,每盆下垫一塑料托盘接收下渗溶液,实时返灌,试验设置5次重复,自然温度、湿度与光照。在实施试验处理45 d后,备测有关项目。
1.3 测定项目与方法
1.3.1生物量及水分利用效率记录牧草地上和地下部的生物量(干重),计算水分利用效率(water use efficiency,WUE,单位耗水量获得的生物或经济产量)[21]。
1.3.2生理指标收获植株当日的上午9:00,剪取新鲜的第一、二片完全展开叶,测定叶绿素(80%丙酮浸提比色法)、脯氨酸(水合茚三酮比色法)、可溶性糖(蒽酮法)、丙二醛(MDA,硫代巴比妥酸比色法)、可溶性蛋白含量(考马斯亮蓝G-250染色法)、相对电导率(DDS-11A型电导率仪)、超氧化物歧化酶(SOD,氮蓝四唑法)、过氧化物酶(POD,愈创木酚比色法)和过氧化氢酶(CAT)活性(紫外吸收法);另取新鲜根系,用TTC法测根系活力[22-26]。
1.3.3抗旱性综合评价应用模糊数学中的隶属函数法综合评价3种牧草抗旱能力,其隶属函数值[X(u)]计算方程如下:
X(u)=(X-Xmin)/(Xmax-Xmin)
(1)
X(u)=1-(X-Xmin)/(Xmax-Xmin)
(2)
式中,X为牧草某一指标的测定值;Xmax和Xmin分别为3种牧草该测定指标的最大和最小值。若该指标与牧草耐旱性呈正相关,则采用(1)式计算隶属值;相反,则用(2)式计算。将各指标的隶属值累加后再平均,平均值越大,抗旱性愈强,反之亦然[27-28]。
1.4 数据处理
用Excel 2003对试验数据进行基本计算,SPSS软件进行统计分析。不同处理间的多重比较采用最小显著差异法(least significant difference, LSD),显著水平设置为P<0.05。
2结果与分析
2.1 不同干旱条件下,牧草生长及水分利用效率
干旱显著影响3种牧草的生长、根冠比和水分利用效率(表1)。在轻度干旱条件下,牛鞭草产量与对照无显著差异;但中度和重度干旱条件下,牧草产量分别比对照降低7.49%和18.29%。轻、中及重度干旱均显著降低高丹草及拉巴豆产量,干旱程度越重,牧草产量降幅越大,分别比对照下降5.00%~31.21%(高丹草)和14.44%~33.55%(拉巴豆)。
随着旱情加剧,牛鞭草和高丹草根冠比增加,中度干旱达到峰值,然后降低。但在正常、轻度和中度干旱条件下,拉巴豆的根冠比相似,对照和轻度干旱的根冠比显著高于重度干旱。
从牧草水分利用效率(WUE)看,牧草产量/耗水量(WUE1)和牧草总生物量/耗水量(WUE2)的变化趋势相似。正常供水至中度干旱,3种牧草的WUE增加,中度干旱达到峰值,重度干旱降低。
2.2 牧草对干旱的生理反应
2.2.1叶片水分、电导率、叶绿素、丙二醛及根系活力表2是干旱条件下,叶片水分、电导率、叶绿素、丙二醛及根系活力等。
叶片相对含水量:轻度干旱对3种牧草的叶片相对含水量均无显著影响,但中度和重度干旱显著降低其叶片相对含水量,旱情越重,降幅越大,分别比对照降低4.24%~6.23%(牛鞭草);4.52%~7.74%(高丹草);3.96%~10.91%(拉巴豆)。
电导率:干旱使牧草叶片电导率出现持续上升趋势。轻度干旱对3种牧草叶片电导率均无显著影响,而中度和重度干旱分别比对照增加31.46%~62.65%(牛鞭草);26.24%~40.83%(高丹草);27.91%~41.93%(拉巴豆)。
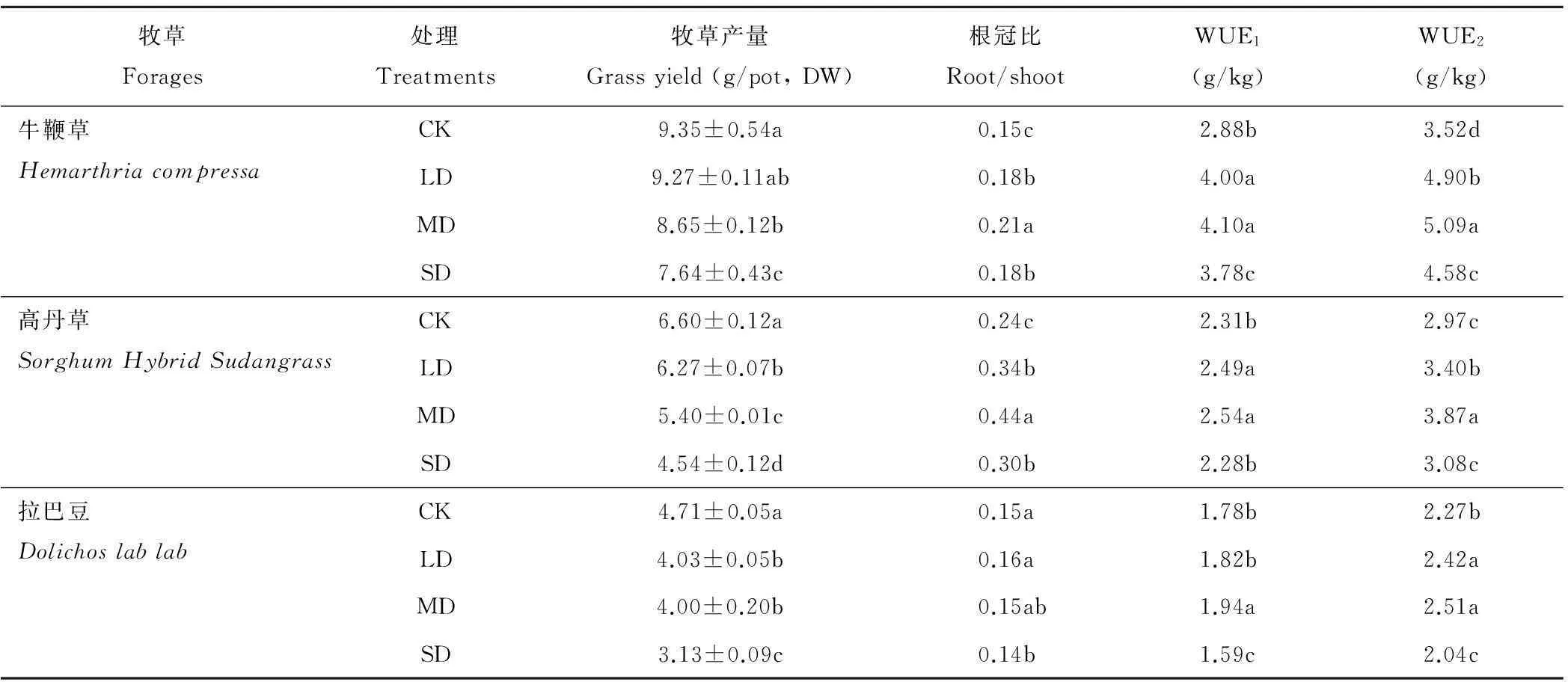
表1 干旱对3种牧草生物量和水分利用效率的影响
注:WUE1=地上生物量/耗水量;WUE2=总生物量/耗水量。CK=正常供水(对照);LD=轻度干旱;MD=中度干旱;SD=重度干旱。不同字母表示差异显著(P<0.05)。下同。
Note: WUE1=shoot biomass/water consumption;WUE2=total biomass/water consumption. CK=normal water supply (the control); LD=light drought; MD=medium drought; SD=severe drought. Data follows by different letters in the same column are significantly different atP<0.05.The same below.
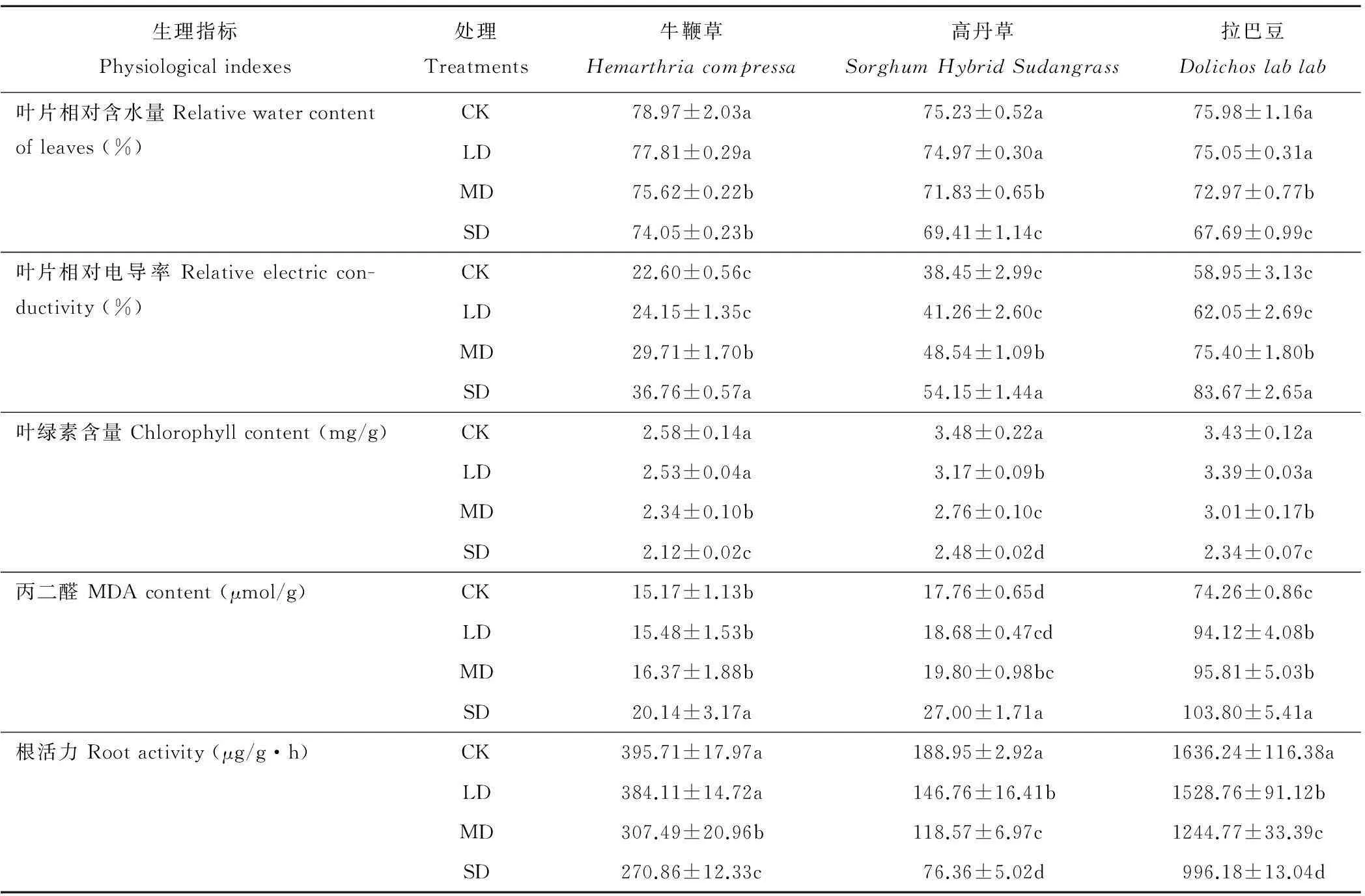
表2 干旱对3种牧草生理特性的影响
叶绿素:轻度干旱对牛鞭草和拉巴豆的叶绿素含量也无显著影响,但中度和重度干旱条件下显著降低,旱情越重,降幅越大,分别比对照降低9.30%~17.83%(牛鞭草)和12.24%~31.78%(拉巴豆);在轻度、中度和重度干旱条件下,高丹草叶绿素含量持续降低。
丙二醛:干旱条件对3种牧草MDA的影响有所不同。轻、中度干旱对牛鞭草MDA含量无显著影响,重度干旱显著提高,比对照增加了32.76%;轻度干旱对高丹草叶片的MDA含量无显著影响,中度和重度干旱显著增加;对拉巴豆而言,轻、中、重度干旱均提高MDA含量,旱情越重,增幅愈大。
根系活力:轻度干旱对牛鞭草根系活力无显著影响,中度和重度干旱显著降低,分别比对照降低22.29%和31.55%;但是,轻、中、重度干旱均显著降低高丹草和拉巴豆的根系活力,随旱情加重,根系活力持续降低。
2.2.2低分子渗透调节物由图1可知,干旱成倍提高3种牧草叶片中的脯氨酸含量,旱情越重,升幅愈大。在轻度至重度干旱条件下,脯氨酸含量分别是对照的2.75~8.05倍(牛鞭草);1.68~2.09倍(高丹草);1.32~2.86倍(拉巴豆)。

图1 干旱对3种牧草渗透调节的影响Fig.1 Effects of drought on the osmoregulation for three forages
在轻度干旱条件下,高丹草的可溶性糖含量无显著变化,而中度及重度干旱使之显著增加,比对照分别提高了8.43%和27.99%;但是,在轻、中、重度干旱条件下,牛鞭草和拉巴豆的可溶性糖含量均持续增加。
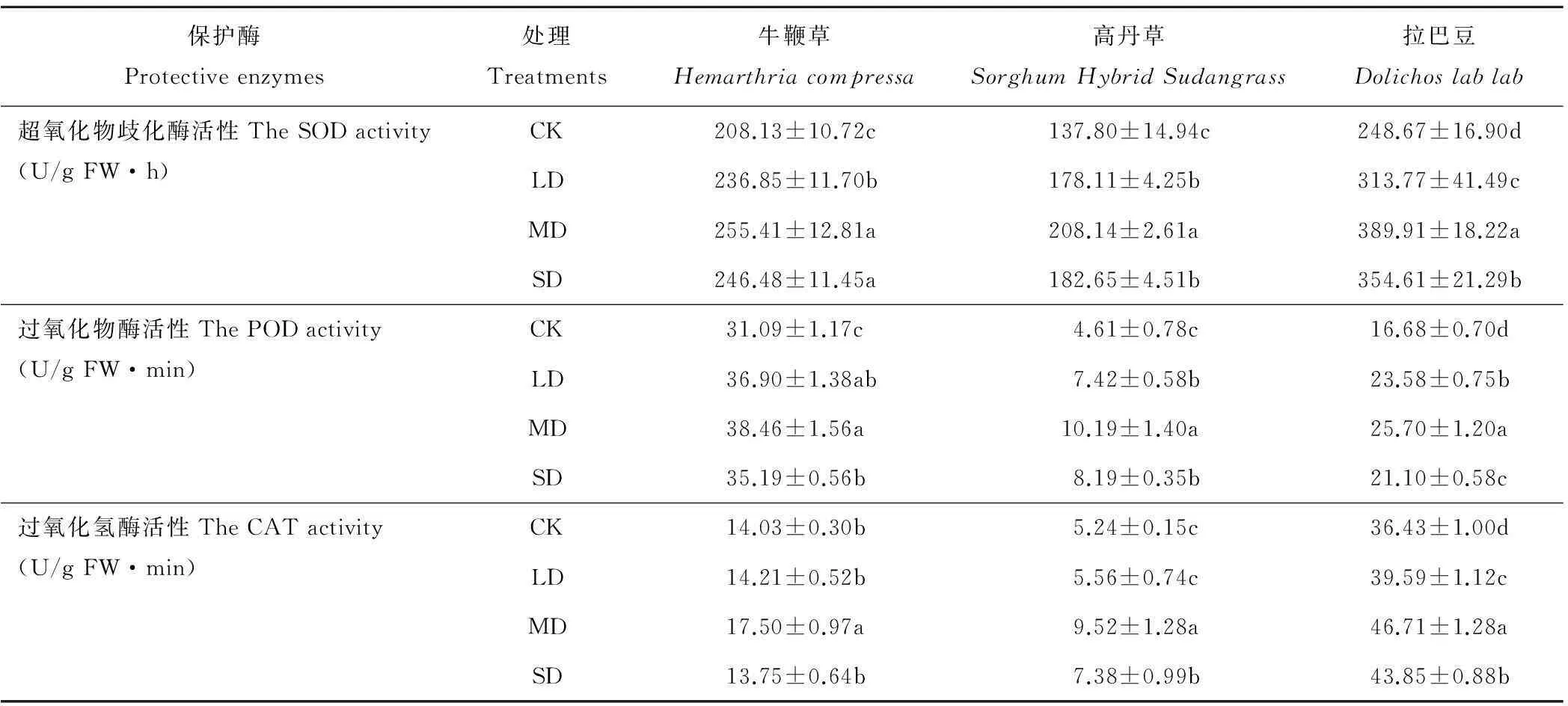
表3 干旱对3种牧草叶片酶活性的影响
干旱对拉巴豆的可溶性蛋白含量无显著影响;而随着干旱程度的增强,牛鞭草和高丹草的可溶性蛋白含量出现了先升高后下降的趋势,在中度干旱时达到峰值。
2.2.3酶活性SOD:从正常供水至中度干旱,SOD活性升至最大,重度干旱则比中度干旱显著降低(牛鞭草除外,降幅未达显著水平,但仍然显著高于对照),牧草种类不同,升降幅度也不一样。与对照相比,牛鞭草的平均升幅(18.32%)显著低于高丹草和拉巴豆(37.62%~41.86%)(表3)。
POD:干旱对POD活性的影响类似SOD,即随着干旱程度的加剧,POD活性增强,中度干旱时达到峰值,然后降低。牧草种类不同,升降幅度也不一样,牛鞭草的升降幅度显著低于高丹草和拉巴豆(表3)。
CAT:在干旱条件下,CAT活性变化趋势与SOD和POD相似,呈单峰曲线变化,中度干旱下达到最大值,牛鞭草的升降幅度显著低于高丹草和拉巴豆(表3)。
2.3 牧草抗旱能力综合评价
应用模糊数学的隶属函数法,对3种牧草的生长、生理和生化指标进行综合评价表明,隶属函数的平均值依次为0.56(扁穗牛鞭草),0.36(高丹草)和0.50(拉巴豆,表4),隶属函数平均值越大,抗旱性愈强,故3种牧草的抗旱性为:牛鞭草>拉巴豆>高丹草。
3讨论
干旱是植物最易遭受的逆境胁迫,也是影响植物生长发育和产量形成的重要自然灾害[29-30]。轻度干旱总体上对牧草生长和生理过程无显著影响;但随着干旱程度加剧,3种牧草的生长量持续降低,并因牧草种类不同产生一系列不同的生理反应。
尽管干旱抑制牧草生长,旱情越重,生物量降幅增大;但轻、中度干旱对牛鞭草和高丹草的根系生长影响相对较小,致使根冠比增加。地上部生物量减少有益于降低水分消耗,根冠比增加表明有相对更多的根系参与水分和养分吸收。因此,轻、中度干旱条件下,3种牧草的水分利用效率增加,类似前人研究[31-34]。在光合作用中,叶绿素参与吸收光能,与光合速率密切相关[35-36]。根系活力影响养分吸收,活力越强,愈有益于养分吸收,反之亦然[37]。在轻度干旱条件下,牧草叶绿素含量和根系活力无显著变化,意味着轻度干旱不影响植株光合速率,这可能是牧草生物量未显著降低的重要原因之一;但随着旱情加剧,植株受到伤害,细胞膜破坏,丙二醛含量提高,胞内物质外渗,电导率增加,叶绿素和根系活力降低,抑制牧草生长。
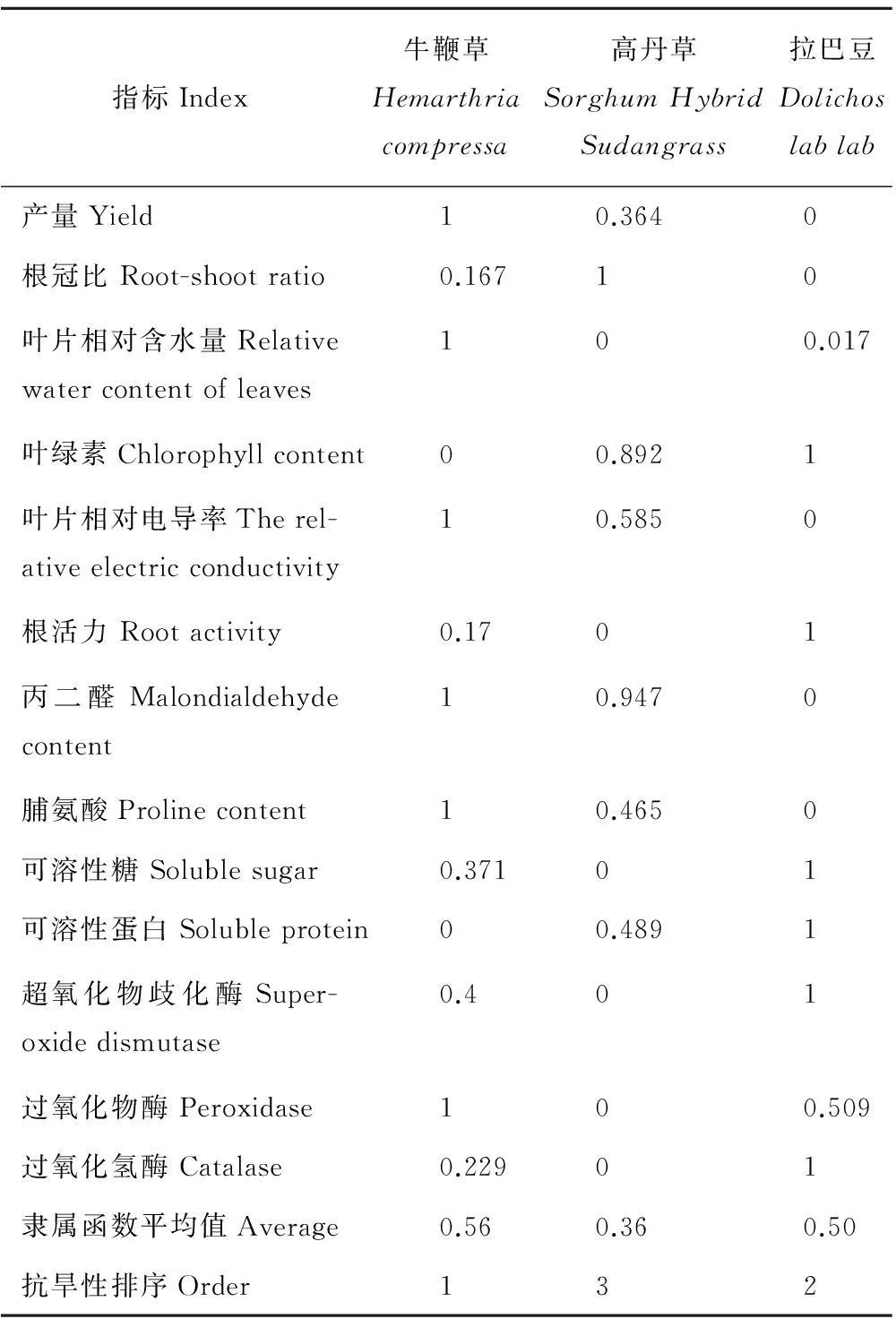
表4 不同牧草抗旱性的隶属函数值
在干旱条件下,植物体内的多糖和蛋白质等大分子物质发生水解,单糖和氨基酸等小分子物质浓度增加,渗透压提高,有益于保持水分,减少蒸腾失水,增强抗旱性[38-39]。在供试3种牧草中,也出现类似现象。但值得注意的是,叶片脯氨酸含量对干旱反应灵敏,支持干旱使植物体内游离脯氨酸含量成倍增加的结论[40-41]。但是,在轻度干旱条件下,牛鞭草生长无显著变化,高丹草和拉巴豆生物量却显著降低,故不能肯定脯氨酸积累是否可以指示牧草抗旱能力强弱。但从脯氨酸的分子结构和生理作用看,大量积累的脯氨酸除了作为植物细胞质内渗透调节物质外,还在稳定生物大分子结构、降低细胞酸性、解除氨毒以及作为能量库调节细胞氧化还原势等方面起重要作用。此外,在水分胁迫条件下,植物体内形成大量的游离氧自由基,产生一系列破坏作用。因此,SOD、POD和CAT活性与植物抗旱性密切相关[42-44]。随着旱情加重,3种牧草的SOD、POD和CAT活性均表现出先升后降的现象,与苜蓿(Medicagosativa)[45]、柽柳(Tamarix)[46],大豆(Glycinemax)和夏玉米(Zeamays)[29]的研究结果相吻合。SOD、POD和CAT活性增强可消除游离氧自由基,减轻干旱危害。
目前,人们主要是研究同一牧草不同品种的抗旱性,且常用单因素方法评价牧草的抗旱性。但是,植物抗旱性涉及许多生理生化过程,是多种复合性状的综合体现[28]。因此,利用多个指标综合评价的抗旱性,使单个指标对评定抗旱性的片面性受到其他指标的弥补与缓和,从而使评定出的结果与实际结果较为接近[19]。本项研究采用模糊数学中的隶属函数法,综合考察各因素的权重及其累计值等,发现3种牧草的抗旱性为:牛鞭草>拉巴豆>高丹草,为三峡库区宜栽牧草品种的选择及合理布局提供了参考。
References:
[1]Liu J P, Luo H Q, You M H,etal. The resistance and utilization ofHemarthiaCompressa. Journal of Sichuan Grassland, 2004, (10): 15-17.
[2]Peng K S, Xu X B, Hu J H,etal. The harm of drought to the west region and its prevention strategy. Journal of Shijiazhuang University of Economics, 2002, 25(3): 257-262.
[3]Wu Y Q, Du Y. Research of Limpograss (Hemarthria R. BR.) as forage. Journal of Sichuan Agricultural University, 1992, 10(2): 260-265.
[4]Li Y, Xie N, Zhao H M,etal. Evaluations of drought resistance among differentSorghumbicolorS.sudanensevarieties. Acta Agrestia Sinica, 2010, 18(6): 891-896.
[5]Yi X F, Lai Z Q, Guan C H,etal. High yield and quality of forageLablabpurpureussweet. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2011, (4): 65.
[6]Schank S G. Chromosome numbers of eleven newHemarthriaintroductions. Crop Science, 1972, 12: 62.
[7]Quesenberry K H, Oakes A J, Jessop D S. Cytologia and geographical characterization ofHemarthria. Euphytica, 1982, 31(2): 409-416.
[8]Chen L Z, Yang C H, Fu X T,etal. Study on the photosynthetic characteristics ofHemarthriacompressa. Journal of Sichuan Agricultural University, 2007, 25(4): 484-488.
[9]Gui S C, Yang F, Zhang B Y,etal. Changes in protective enzyme activities in cells ofHemarthriacompressaunder water stress. Acta Prataculturae Sinica, 2010, 19(5): 278-282.
[10]Yang S T, Huang L K, Zhang X Q,etal. Effects of drought stress on leaf antioxidant system and membrane lipid peroxidation ofHemarthriacompressa. Chinese Journal of Tropical Crops, 2013, 34(11): 2083-2089.
[11]Zhan Q W, Ye S H. The physiological changes ofSorghumbicolorandS.sudanensein response to drought. Seed, 2005, 24(6): 59-60, 67.
[12]Zhao N, Gan Z, Ma Y H,etal. Study on difference of drought resistance and salt tolerance among pacetter varieties at seedling stage. Chinese Journal of Grassland, 2007, 29(3): 39-44.
[13] Lu X P, Yun J F. Genetic mapping and gene localization of main agronomic characters ofSorghumSudan grass. Acta Agrestia Sinica, 2005, 13(3): 262-263.
[14]Jin J Y, Zhang W H, Huang J G. Effects of water stress on growth,nutrition and physiological indices ofHemarthriacompressa. Plant Nutrition and Fertilizer Science, 2011, 17(6): 1545-1550.
[15]Jiao J C, Chen L. Effect of potassium fertilizer on the drought resistance ofLoliumperenne. Pratacultural Science, 2008, 25(8): 139-143.
[16]Liu M H, Gao X Q. The biological characteristics and high yield cultivation technology for mixture sowing of New jade No.18 andDolichoslablab. Agriculture and Technology, 2013, 33(11): 110.
[17]Peng L J. Evaluation of the yield and nutritive value of at different growing stage inDolichoslablab. Modern Agricultural Sciences, 2009, 16(4): 31-32.
[18]Han Y Z, Huang J G, Jin J Y,etal. Effect of different soils on the growth and photosynthetic characteristics ofDolichosLablabL. Journal of Agricultural Mechanization Research, 2012, (10): 130-134.
[19]Guo Y P, Mi F G, Yan L J,etal. Physiological response to drought stresses and drought resistances evaluation of different Kentucky bluegrass varieties. Acta Prataculturae Sinica, 2014, 23(4): 220-228.
[20]Chen Y J, Feng S H, Chen G F,etal. Research status and progress of plant drought-resistance appraise indexes. Quarterly of Forest By-product and Speciality In China, 2005, 6: 62-63.
[21]Sun C Y, Dong W Q, Liu M Y,etal. Research progression on water use efficiency and its difference mechanism of different crop varieties. Chinese Agricultural Science Bulletin, 2009, 25(12): 117-121.
[22]Li H S. The Principle and Technology of Plant Physiology and Biochemistry Experiment[M]. Beijing: Higher Education Press, 2000.
[23]Zhang X Z. The Research Method of Crop Physiology[M]. Beijing: Chinese Agricultural Press, 1992.
[24]Zou Q. Experimental Guidance of Plant Physiology[M]. Beijing: Chinese Agricultural Press, 2003.
[25]Tang Z C. Experimental Guidance of Modern Plant Physiology[M]. Beijing: Science and Technology press, 1999.
[26]Gao J F. The Experiment Technology of Plant Physiology[M]. Xian: World Book Publishing Company, 2000.
[27]Sun Q, Hu J J. The Technology of Plant Physiology[M]. Yangling: Northwest Agriculture and Forestry University Press, 2005.
[28]Li L J, Jiang Z R, Li Z P,etal. Comprehensive evaluation on drought-resistance of three tree species and the choice of drought-resistance indexes. Research of Soil and Water Conservation, 2006, 13(6): 253-254.
[29]Wang Q M. Effects of drought stress on protective enzymes activities and membrane lipid peroxidation in leaves of soybean seedlings. Journal of Agro-Environment Science, 2006, 25(4): 918-921.
[30]Guo W H, Li B, Zhang X S,etal. Architectural plasticity and growth responses ofHippophaerhamnoidesandCaraganaintermediaseedlings to simulated water stress. Arid Environments, 2007, 69: 385-399.
[31]Deng X P. The study of limited irrigation on the winter wheat and water utilization. Research o f Soil and Water Conservation, 1999, 6(1): 41-46.
[32]Annandale J G, Campbell G S, Olivier F C,etal. Predicting crop water uptake under full and deficit irrigation: An example using pea (PisumsativumL.cv.Puget). Irrigation Science, 2000, 19: 65-72.
[33]Saeed I A M, EI-Nadi A H. Forage sorghum yield and water use efficiency under variable irrigation. Science, 1998, 18: 67-71.
[34]Givnish T J. Adaptation to sun and shade: a whole plant perspective. Australian Journal of Plant Physiology, 1988, 15: 63-92.
[35]Gao T P, Fang X W, Li J H,etal. Effect of water on photosynthetic parameters and osmotic solute of sprouting and its intact plants ofCaragnakorshinskii. Pratacultural Science, 2009, 26(5): 103-109.
[36]Han R H, Lu X S, Gao G J,etal. Photosynthetic physiological response of alfalfa (Medicagosativa) to drought stress. Acta Ecological Sinica, 2007, 27(12): 5229-5237.
[37]Han J Q, Wang X F, Zhang Z G. Effects of surface soil drought on root spatial distribution and activity of white clovers. Chinese Agricultural Science Bulletin, 2007, 23(3): 458-461.
[38]Shao Y J, Shan L, Li G M. Comparison of osmotic regulation and antioxidation between sorghum and maize seedlings under soil drought stress and water recovering conditions. Chinese Journal of Eco-Agriculture, 2006, 14(1): 68-70.
[39]Kang J M, Yang Q C, Fan F C. Effects of drought stress on induced protein in the different drought resistance alfalfa leaf. Acta Agrestia Sinica, 2005, 13(3): 199-202.
[40]Manivannan P, Jaleel C A, Somasundaram R,etal.Osmo regulation and antioxidant metabolism in drought stressedHelianthusannuusunder triadimefon drenching. Comptes Rendus Biologies, 2008, 331: 418-425.
[41]Wang Q, Sun J X, An Y. The effect of the population properties and stress-tolerance physiological characteristics ofZoysiagrass under water stresses. Acta Prataculturae Sinica, 2009, 18(2): 33-38.
[42]Scandalios J G. Oxygen stress and superoxide dismutases. Plant Physiology, 1993, 101: 7-15.
[43]Griffiths H, Parry M A J. Plant responses to water stress. Annals of Botany, 2002, 89: 801-802.
[44]Qi J, Xu Z, Wang H Q,etal. Physiological and biochemical analysis of the leaves ofElymusunder dry farming conditions. Acta Prataculturae Sinica, 2009, 18(1): 39-45.
[45]Li Z Z. A study on drought resistance of ten alfalfa cultivar seedlings. Grassland of China, 1991, (3): 1-3.
[46]Wang X, Hou P, Yi L K,etal. Effect of soil moisture stress on the membrane protective enzyme and the membrane liquid peroxidation of Tamarix. Arid Zone Research, 2002, 19(3): 17-21.
参考文献:
[1]刘金平, 罗红权, 游明鸿, 等. 扁穗牛鞭草的抗性与利用途径. 四川草原, 2004, (10): 15-17.
[2]彭珂珊, 徐宣斌, 胡晋辉, 等. 干旱是西部地区生态系统受损的关键因素. 石家庄经济学院学报, 2002, 25(3): 257-262.
[3]吴颜奇, 杜逸. 牛鞭草的研究. 四川农业大学学报, 1992, 10(2): 260-265.
[4]李源, 谢楠, 赵海明, 等. 不同高丹草品种对干旱胁迫的响应及抗旱性评价.草地学报, 2010, 18(6): 891-896.
[5]易显凤, 赖志强, 关常欢, 等. 高产优质豆科牧草拉巴豆. 上海畜牧兽医通讯, 2011, (4): 65.
[8]陈灵鹫, 杨春华, 傅鲜桃, 等. 扁穗牛鞭草光合特性研究. 四川农业大学学报, 2007, 25(4): 484-488.
[9]桂世昌, 杨峰, 张宝艺, 等. 水分胁迫下扁穗牛鞭草根系保护酶活性变化. 草业学报, 2010, 19(5): 278-282.
[10]杨盛婷, 黄琳凯, 张新全, 等. 干旱胁迫对扁穗牛鞭草叶片抗氧化系统及膜脂过氧化的影响. 热带作物学报, 2013, 34(11): 2083-2089.
[11]詹秋文, 叶泗洪. 高粱与苏丹草及其杂交种对干旱胁迫的生理响应. 种子, 2005, 24(6): 59-60, 67.
[12]赵娜, 于卓, 马艳红, 等.高丹草幼苗抗旱和耐盐性的品种间差异. 中国草地学报, 2007, 29(3): 39-44.
[13]逯晓萍, 云锦凤. 高丹草遗传图谱构建及农艺性状基因定位研究. 草地学报, 2005, 13(3): 262-263.
[14]靳军英, 张卫华, 黄建国. 干旱对扁穗牛鞭草生长、营养及生理指标的影响. 植物营养与肥料学报, 2011, 17(6): 1545-1550.
[15]焦晋川, 陈琳. 钾肥对多年生黑麦草抗旱性的影响. 草业科学, 2008, 25(8): 139-143.
[16]刘美华, 高贤强. 新饲玉18号与拉巴豆混播的生物特性及高产栽培技术. 农业与技术, 2013, 33(11): 110.
[17]彭丽娟. 拉巴豆不同生长时期的产量与营养价值评定. 现代农业科学, 2009, 16(4): 31-32.
[18]韩玉竹, 黄建国, 靳军英, 等. 不同土壤对拉巴豆生长及光合特性的影响. 农机化研究, 2012, (10): 130-134.
[19]郭郁频, 米福贵, 闫利军, 等. 不同早熟禾品种对干旱胁迫的生理响应及抗旱性评价. 草业学报, 2014, 23(4): 220-228.
[20]陈雅君, 冯淑华, 陈桂芬, 等. 植物抗旱性鉴定指标的研究现状与进展. 中国林副特产, 2005, 6: 62-63.
[21]孙昌禹, 董文琦, 刘孟雨, 等. 作物不同品种间水分利用效率差异机理的研究进展. 中国农学通报, 2009, 25(12): 117-121.
[22]李合生.植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[23]张宪政. 作物生理研究方法 [M]. 北京: 中国农业出版社, 1992.
[24]邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2003.
[25]汤章城. 现代植物生理学实验指导[M]. 北京: 科技出版社, 1999.
[26]高俊凤. 植物生理学实验技术[M]. 西安: 世界图书出版社, 2000.
[27]孙群, 胡景江. 植物生理学研究技术[M]. 杨凌: 西北农林科技大学出版社, 2005.
[28]李禄军, 蒋志荣, 李正平, 等. 3树种抗旱性的综合评价及其抗旱指标的选取. 水土保持研究, 2006, 13(6): 253-254.
[29]王启明. 干旱胁迫对大豆苗期叶片保护酶活性和膜脂过氧化作用的影响. 农业环境科学学报, 2006, 25(4): 918-921.
[31]邓西平. 渭北地区冬小麦的有限灌溉与水分利用研究. 水土保持研究, 1999, 6(1): 41-46.
[35]高天鹏, 方向文, 李金花, 等. 水分对柠条萌蘖株和未平茬株光合参数及调渗物质的影响. 草业科学, 2009, 26(5): 103-109.
[36]韩瑞宏, 卢欣石, 高桂娟, 等. 紫花苜蓿(Medicagosativa)对干旱胁迫的光合生理响应. 生态学报, 2007, 27(12): 5229-5237.
[37]韩建秋, 王秀峰, 张志国. 表土干旱对白三叶根系分布和根活力的影响. 中国农学通报, 2007, 23(3): 458-461.
[38]邵艳军, 山仑, 李广敏. 干旱胁迫与复水条件下高粱、玉米苗期渗透调节及抗氧化比较研究. 中国生态农业学报, 2006, 14(1): 68-70.
[39]康俊梅, 杨青川, 樊奋成. 干旱对苜蓿叶片可溶性蛋白的影响. 草地学报, 2005, 13(3): 199-202.
[41]王齐, 孙吉雄, 安渊. 水分胁迫对结缕草种群特征和生理特性的影响. 草业学报, 2009, 18(2): 33-38.
[44]祈娟, 徐柱, 王海清, 等. 旱作条件下披碱草属植物叶的生理生化特征分析. 草业学报, 2009, 18(1): 39-45.
[45]李慥哲.10种苜蓿品种幼苗抗旱性的研究. 中国草地, 1991, (3): 1-3.
[46]王霞, 侯平, 尹林克, 等. 土壤水分胁迫对柽柳体内膜保护酶及膜脂过氧化的影响. 干旱区研究, 2002, 19(3): 17-21.
http://cyxb.lzu.edu.cn
靳军英,张卫华,袁玲. 三种牧草对干旱胁迫的生理响应及抗旱性评价. 草业学报, 2015, 24(10): 157-165.
JIN Jun-Ying, ZHANG Wei-Hua, YUAN Ling. Physiological responses of three forages to drought stress and evaluation of their drought resistance. Acta Prataculturae Sinica, 2015, 24(10): 157-165.
通讯作者*Corresponding author. E-mail:lingyuanh@hotmail.com
作者简介:靳军英(1974-),女,河北沙河人,副高,博士。E-mail:junyingjin@126.com
基金项目:西南大学基本科研业务费专项资金项目(XDJK2013C018)和国家水体污染控制与治理科技重大专项(2012ZX07104-003)资助。
收稿日期:2014-12-08;改回日期:2015-02-11
DOI:10.11686/cyxb2014505

