双糖保护剂对胰岛素活性结构稳定性的影响
孙 旭, 李代禧, 郭柏松
(1.上海理工大学 医疗器械与食品学院,上海 200093; 2.上海东富龙科技股份有限公司,上海 201108)
双糖保护剂对胰岛素活性结构稳定性的影响
孙 旭1, 李代禧1, 郭柏松2
(1.上海理工大学 医疗器械与食品学院,上海 200093; 2.上海东富龙科技股份有限公司,上海 201108)
采用微量热分析法并结合分子动力学模拟,研究了不同双糖保护剂对胰岛素的保护效果.结果表明,通过区域选择性吸附,双糖保护剂可以在胰岛素表面产生保护作用,提高胰岛素的热稳定性.在4种双糖保护剂中,吸附作用越强的保护剂对胰岛素热稳定性的提升效果越好.随着保护剂质量分数的增加,胰岛素的热稳定性呈先增强后稳定的趋势.进一步分析了保护剂与水分子之间的相互作用,得出双糖保护剂与胰岛蛋白之间的直接相互作用可能是提高其热稳定性的主要原因.
双糖; 胰岛素; 热稳定性; 分子模拟; 微量热
蛋白质类药物具有药理活性高、生物功能明确、有利于临床应用等特点,但其在分离、纯化、贮存及运输过程中极易变性失活[1].如何提高蛋白质类药物的稳定性一直是生物制药领域的重要研究课题.目前,提高蛋白质稳定性的常用方法是在药物生产处方中添加有机小分子保护剂[2].海藻糖作为一种糖类保护剂,化学性质非常稳定,它具有不同于其他双糖的优良特性,即海藻糖可以有效减弱一些外界因素对蛋白质产生的不利影响,起到保护蛋白质药物活性的作用,增强蛋白质抵抗热变性的能力[3].因此,海藻糖常作为蛋白质药物、酶等生物大分子的高效稳定剂.
虽然海藻糖已广泛应用于蛋白质保护研究领域,但相较于其他几种常见的双糖而言,海藻糖的结构优势及糖类保护剂稳定蛋白质活性结构的作用机理仍在研究和探讨之中.一种观点认为有机小分子可以“络合”到大分子基团上作为配体,产生直接相互作用,从而稳定蛋白质的活性结构.也有研究者认为,有机分子的加入改变了水溶液的特性[4],间接保护蛋白质的分子结构.
为此,本文以热敏性蛋白药物胰岛素[5]作为研究对象,选择4种双糖保护剂:海藻糖、蔗糖、乳糖和麦芽糖,通过纳瓦级高灵敏差示扫描量热仪[6](differential scanning calorimeter,Nano-DSC)及分子动力学模拟方法[7](molecular dynamics,MD),研究不同双糖保护剂对蛋白质药物结构的保护作用与规律,深入分析双糖分子与蛋白质分子之间的相互作用,从分子层面解析海藻糖作为一种优良保护剂的保护机理,为蛋白药物辅料配方的筛选及处方优化提供一定的指导.
1 材料与方法
1.1 实 验
1.1.1 试剂与仪器
试剂药品:α-D-海藻糖(Trehalose),β-D-乳糖(Lactose),α-D-麦芽糖(Maltose)和α-D-蔗糖(Sucrose),均为分析纯.
猪胰岛素:批号为1506A04,徐州万邦金桥制药有限公司,白色结晶性干粉,为市售分析纯.
仪器:分析天平(METTLER,XS205),纳瓦级高灵敏差示扫描量热仪(TA Instrument,USA).
1.1.2 实验方法
将保护剂溶解于质量分数为20.000%的醋酸溶液中,配制成质量分数为10.000%保护剂溶液,通过二倍稀释法,配制成质量分数为0.625%,1.250%,2.500%,5.000%的保护剂溶液.准确称量一定量的猪胰岛素粉末,溶解于不同质量分数的保护剂溶液中,空白组是胰岛素直接加入到20.000%醋酸溶液中,均配制成质量分数为1 mmol/L的胰岛素单体溶液[8].热分析前,保护剂溶液及胰岛素溶液均在真空度大于-56.66 kPa条件下脱气20 min.首先将参比池和样品池中均注入保护剂溶液,扫描温度范围为25.00~100.00 ℃,升温速率为1.00 ℃/min.扫描结束清洗后,再将参比池注入保护剂溶液,样品池注入胰岛素溶液,采用相同的条件进行升温扫描.所有的数据均用TA DSC Run软件记录,数据的进一步分析处理采用TA Nano Analyze 3.4.0.软件的数据分析模型two-state scaled model,分析热变性温度Tm[9]所选取的置信区间为95%.
1.2 模拟部分
本文中的胰岛素分子结构从PDB数据库获取[10],其晶体结构(PDBID:3inc)由X射线衍射得到,分辨率为0.2 nm,如图1所示.4种双糖分子的初始结构均取自于ChEBI数据库[11],化学结构如图2所示(见下页),并利用Gaussian 09软件包进行双糖结构优化[12].

图1 胰岛素三维结构
分子模拟均利用GROMACS 5.0.5分子动力学模拟软件[13],胰岛素采用Amber99sb-ildn全原子力场[14],保护剂分子采用Amber通用力场[15],选用Tip4p水分子模型[16].本次模拟中时间步长设定为2 fs,范德华相互作用利用Lenard-Jones函数计算[17],截断设定为1.0 nm,用于范德华分子间相互作用长程矫正的近邻列表半径设定为1.0,每10步更新一次近邻列表.静电相互作用的长程矫正采用粒子网格埃瓦德统计方法(particle mesh ewald,PME)[18],静电相互作用的截断设定为1.0 nm.压力控制采用Berendsen法[19],压力耦合常数为0.5 ps.Velocity Rescale方法[20]用于温度控制,时间常数设为0.1 ps.
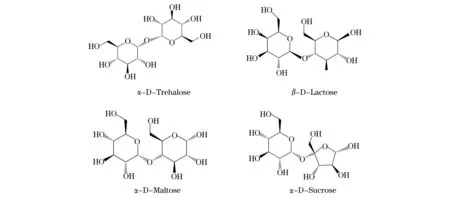
图2 双糖结构式
将胰岛素单体放在10 nm×10 nm×10 nm的周期性体系中心,然后按比例随机添加一定量的双糖分子及水分子,表1为模拟体系的详细信息.首先采取最速下降法[21]和共轭梯度法[22]对体系进行能量最小化,接着固定胰岛素的结构和坐标位置,进行10 ns的限制性动力学计算,然后进行40 ns的常规分子动力学模拟.选取最后5 ns的模拟轨迹进行数据分析.所有MD模拟均在等温等压系综下进行,温度为300 K,压力为1.01×105Pa.Ф代表双糖的质量分数;NP,NS,NW分别代表胰岛素、双糖和水分子的数目;Pr为预平衡时间;Eq为平衡时间.
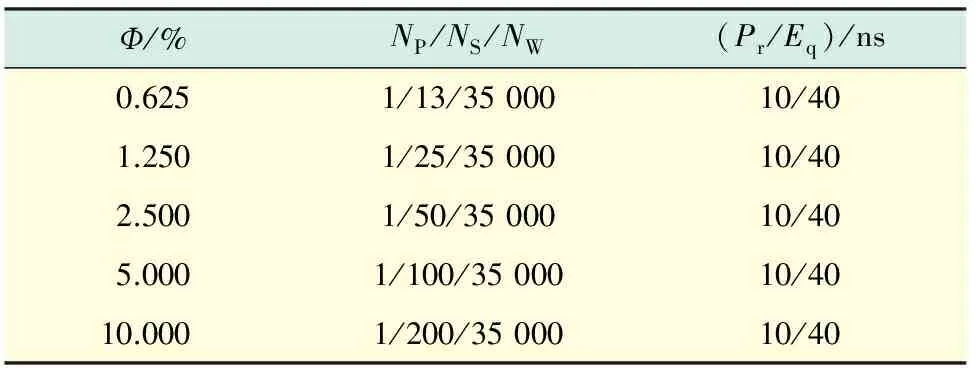
表1 模拟体系的组成
2 结果与讨论
2.1 胰岛素在不同体系中的稳定性
Nano DSC可以测定蛋白质药物的Tm值,分析其在不同体系中的热稳定性[9].Tm越高,表明蛋白质的热稳定性越好.图3描述了不同体系内胰岛素的Tm,从图中可以看出,与未添加保护剂的体系相比,溶液中加入双糖保护剂确实能够提升胰岛素的Tm.说明双糖类保护剂能在一定程度上提高蛋白质的热稳定性.对比4种双糖保护剂溶液中胰岛素的Tm发现,对胰岛素的保护效果从强到弱依次是海藻糖、乳糖、麦芽糖、蔗糖.从图3中还可以看出,随着保护剂质量分数的不断增加,胰岛素的Tm呈现先升高后逐渐趋于稳定的趋势,说明双糖保护剂达到一定质量分数,即临界质量分数时,保护剂对蛋白药物热稳定性的提升作用不再明显.
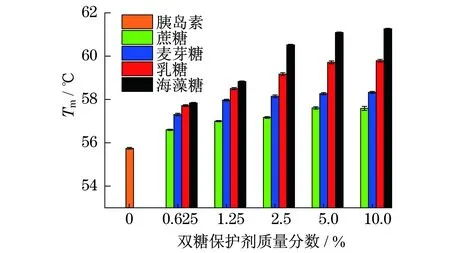
图3 不同双糖保护剂中胰岛素的变性温度值
2.2 保护剂分子在胰岛素表面的吸附作用
经过40 ns的分子动力学模拟,胰岛素双糖保护剂混合体系达到平衡状态,此时,双糖分子会吸附到胰岛素表面,发挥其保护蛋白质结构的功能[23].由于分子动力学计算过程中静电相互作用和范德华相互作用的截断半径均设为1.0 nm,因此,统计了各个体系中距离胰岛素表面1.0 nm范围内的保护剂分子数目,结果如图4所示.
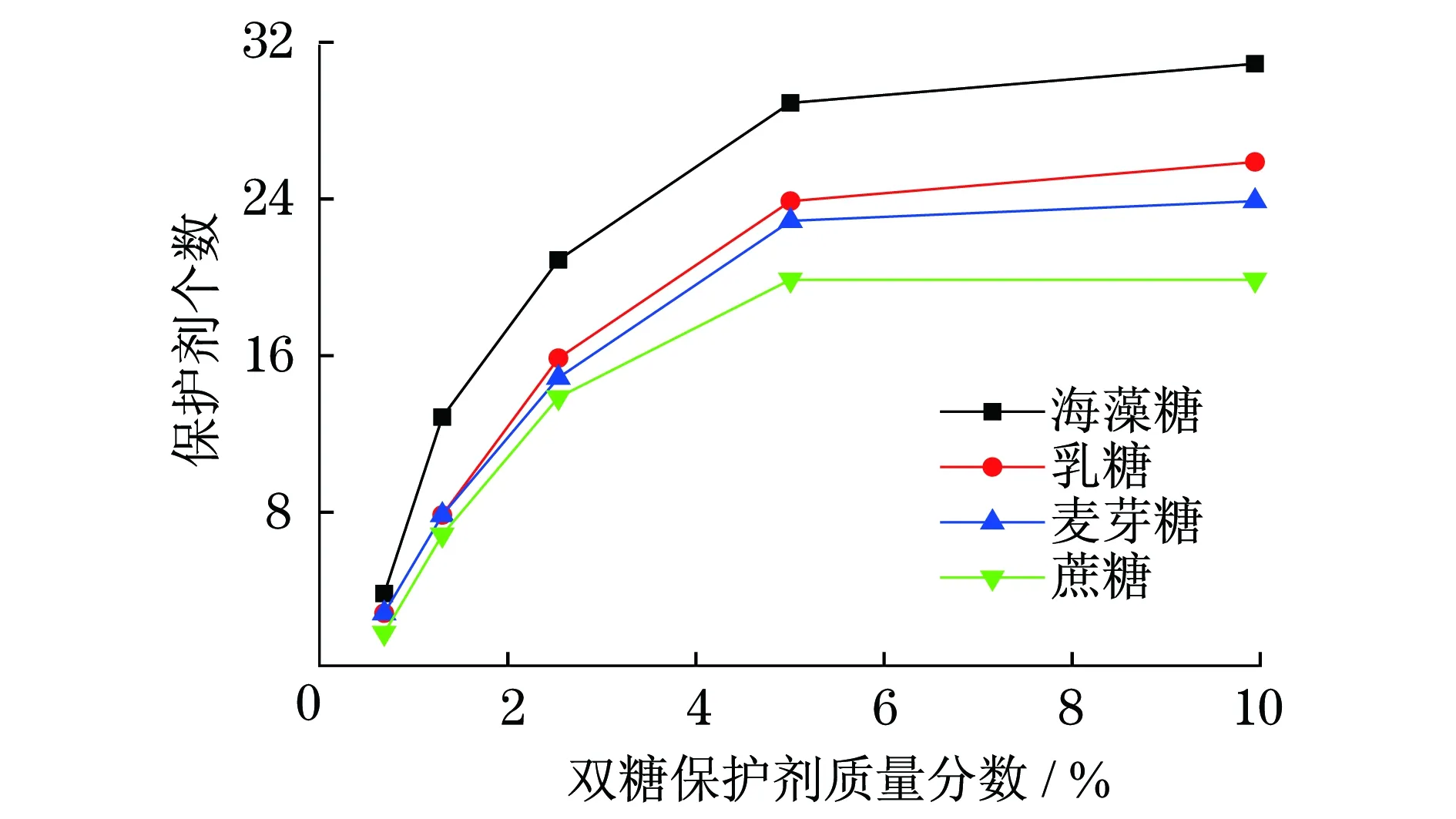
图4 胰岛素表面1.0 nm范围内吸附的保护剂个数
从图4中可以看出,在厚度为1.0 nm保护层内的保护剂分子数目随着保护剂质量分数的增加呈先增大后稳定的趋势,说明胰岛素周围1.0 nm范围内吸附的特定保护剂个数是有限的.相比较其他3种双糖保护剂而言,胰岛素表面1.0 nm范围内吸附的海藻糖数目更多,这可能是海藻糖保护效果优于其他3种双糖保护剂的原因.
因为,不同双糖保护剂的吸附状态类似,只在吸附量上有差异,所以,图5中仅列出了海藻糖在胰岛素表面的吸附情况.从图5中可以看出,海藻糖可以直接或间接地吸附在胰岛素表面.随着海藻糖质量分数的增加,保护剂在胰岛素表面的吸附面积会不断增加(图5(a)~5(d)),当添加的保护剂较多时,海藻糖分子会在蛋白质部分表面产生聚集,并不会完全覆盖整个表面(图5(d)和5(e)),说明双糖保护剂在蛋白质表面的吸附作用是有区域选择性的.
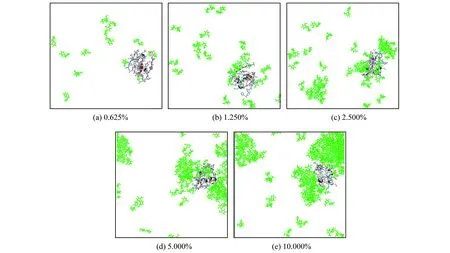
图5 海藻糖在胰岛素表面的区域选择性吸附
图5中的绿色部分代表海藻糖.为了更清楚地展示胰岛素与海藻糖之间的相互作用情况,移除了体系中的水分子.
为了进一步阐明双糖保护剂种类和质量分数与蛋白质稳定性之间的关系,分析了胰岛素与双糖保护剂分子之间的非键相互作用,结果如图6所示(见下页).
观察图6(a)可知,随着保护剂质量分数的升高,双糖分子与胰岛素之间的氢键数目不断增大,当保护剂质量分数达到临界质量分数时,两者之间的氢键个数并没有随着保护剂质量分数的持续增加而大幅度增多.这是因为保护剂分子在蛋白质表面的吸附作用是具有区域选择性的(如图5所示),持续加入的双糖分子并没有全部吸附在胰岛素表面并与其形成氢键.对比分析不同质量分数的4种双糖保护剂溶液中保护剂分子与胰岛素之间的氢键数目(图6(a))及相互作用能(图6(b))发现,在相同质量分数下,胰岛素与双糖保护剂之间的非键相互作用能由强到弱的顺序为海藻糖、乳糖、麦芽糖、蔗糖,表明保护剂与胰岛素之间氢键数目越多,范德华及库伦相互作用能亦越大.结合微量热分析结果,说明与胰岛素之间相互作用越强的保护剂分子对胰岛素的热稳定性提升效果越明显.
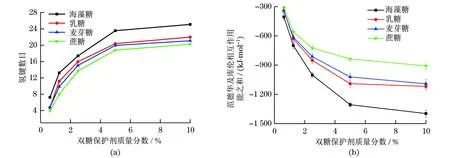
图6 不同体系中胰岛素与双糖保护剂之间的非键相互作用
综上所述,双糖分子可以通过非键相互作用吸附在胰岛素表面,从而达到稳定胰岛素活性结构的目的.蛋白质表面吸附保护剂分子数目越多,两者之间的相互作用亦越强,保护剂对胰岛素的热稳定性的提升效果也越明显.虽然保护剂与胰岛素之间的吸附作用是一种非特异性的结合方式,但是,这种结合作用是有区域选择性的,并不会随着保护剂的增多而不断地增强.这可能是双糖保护剂质量分数达临界值时,胰岛素的热稳定性并不随着保护剂质量分数的增加而显著增强的原因.
2.3 水分子与胰岛素之间的相互作用
水分子在稳定生物大分子的结构和功能方面具有关键作用[24].然而,蛋白质周围可以起到稳定蛋白质结构的水分子层非常薄,厚度只有1~3个分子层,所能起到的稳定作用非常有限[25].相比较水分子而言,保护剂稳定生物大分子结构的能力相对较强,可以替代一部分水分子与生物大分子之间产生相互作用,从而增强生物大分子的结构稳定性.
为了分析在保护剂质量分数不断增加的体系中水分子和胰岛素之间的氢键相互作用与胰岛素稳定性之间的关系,统计了不同质量分数双糖体系中,胰岛素内部氢键数目及胰岛素与水分子之间的氢键数目,结果如图7所示.
随着保护剂质量分数的不断增加,胰岛素内部氢键数目呈升高趋势(图7(a));相反地,胰岛素与水分子之间的氢键数目明显降低(图7(b)).这说明保护剂质量分数较低时,主要是水分子在发挥稳定蛋白质结构的作用,但是,这种稳定作用很弱.双糖保护剂的质量分数升高后,保护剂分子会吸附在胰岛素表面,减少了胰岛素与水分子之间的氢键数目,说明保护剂分子替换掉一部分与胰岛素之间产生相互作用的水分子,增强胰岛素的二级结构稳定性,使得体系平衡时胰岛素内部氢键可以维持在一个较高的水平.但当其质量分数达到临界值时,随着保护剂质量分数的增加,双糖保护剂替换蛋白质表面水分子的数目不再增加,胰岛素内部的氢键个数也不再发生明显变化,此时胰岛素的结构处于一种相对稳定的状态,这与保护剂在胰岛素表面吸附作用的结果相吻合.
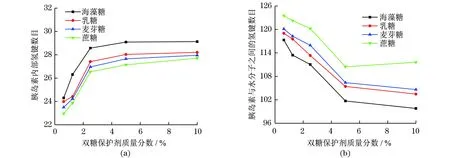
图7 不同体系中的氢键数目
2.4 保护剂与水分子之间的相互作用
为了分析保护剂与水分子之间的相互作用与胰岛素稳定性之间的联系,计算了不同质量分数体系中保护剂与水分子之间的氢键个数及两者之间的相互作用能(图8).从图8中可以看出,随着保护剂质量分数的不断增加,双糖保护剂与水分子之间的氢键个数不断增多,相互作用能也不断增强.但通过胰岛素的Tm值测定结果可知,胰岛素的热稳定性并不是随着保护剂质量分数的增加而不断增强,表明保护剂分子对水溶液特性的改变并不是影响胰岛素热稳定性变化的主要因素,结合上述胰岛素与双糖保护剂之间相互作用的讨论可知,胰岛素与双糖保护剂之间相互作用的变化趋势与胰岛素热稳定性的变化趋势一致,说明双糖保护剂对胰岛素热稳定性的提升效果可能主要来源于保护剂与胰岛素之间的直接相互作用.

图8 不同体系中保护剂与水分子之间非键相互作用
3 结 论
利用微量热分析法考察不同质量分数的双糖保护剂对胰岛素热稳定性的影响,并通过分子动力学计算分析双糖保护剂与胰岛素之间的相互作用.结果表明,双糖保护剂均能提高胰岛素的热稳定性,但4种双糖对胰岛素热稳定性的提升能力之间存在差异,在相同质量分数条件下,胰岛素表面吸附的保护剂数目越多,保护剂与胰岛素之间的非键相互作用越强,对胰岛素热稳定性的提升作用亦越明显.随着保护剂质量分数的增加,保护剂与蛋白质之间的相互作用不断增强,但当保护剂质量分数超过临界质量分数时,两者之间的相互作用强度不再显著增加,而保护剂与水分子之间的相互作用仍大幅度增强,表明双糖保护剂与胰岛素之间的直接相互作用可能是提高其热稳定性的主要原因.
[1] 任勇,丁东平,渠刚,等.蛋白质类药物的稳定性研究进展[J].华南国防医学杂志,2006,20(4):31-33.
[2] JAIN N K,ROY I.Effect of trehalose on protein structure[J].Protein Science,2009,18(1):24-36.[3] SOLA-PENNA M,MEYER-FERNANDES J R.Stabilization against thermal inactivation promoted by sugars on enzyme structure and function:why is trehalose more effective than other sugars?[J].Archives of Biochemistry and Biophysics,1998,360(1):10-14.
[4] CINELLI S,ONORI G,SANTUCCI A.Effect of aqueous alcohol solutions on the thermal transition of lysozyme:a calorimetric study[J].The Journal of Physical Chemistry B,1997,101(40):8029-8034.
[5] RICHTER B,NEISES G.Human insulin versus animal insulin in people with diabetes mellitus[J].Cochrane Database of Systematic Reviews,2003(3):1469-1493.
[6] GILL P,MOGHADAM T T,RANJBAR B.Differential scanning calorimetry techniques:applications in biology and nanoscience[J].Journal of Biomolecular Techniques,2010,21(4):167-193.
[7] KRÜGER P,STRASSBURGER W,WOLLMER A,et al.The simulated dynamics of the insulin monomer and their relationship to the molecule’s structure[J].European Biophysics Journal,1987,14(8):449-459.[8] ZHANG Y S,WHITTINGHAM J L,TURKENBURG J P,et al.Crystallization and preliminary crystallographic investigation of a low-pH native insulin monomer with flexible behaviour[J].Acta Crystallographica,2002,58(1):186-187.
[9] CUETO M,DORTA M J,MUNGUA O,et al.New approach to stability assessment of protein solution formulations by differential scanning calorimetry[J].International Journal of Pharmaceutics,2003,252(1/2):159-166.
[11] DEGTYARENKO K,DE MATOS P,ENNIS M,et al.ChEBI:a database and ontology for chemical entities of biological interest[J].Nucleic Acids Research,2008,36(1):344-350.
[12] 李代禧,刘亿淑,张建民,等.扑热息痛与β-环糊精包合物的热分解动力学和包合结构的研究[J].上海理工大学学报,2007,29(4):373-377.
[13] ABRAHAM M J,MURTOLA T,SCHULZ R,et al.GROMACS:high performance molecular simulations through multi-level parallelism from laptops to supercomputers[J].Softwarex,2015,1:19-25.[14] ALIEV A E,KULKE M,KHANEJA H S,et al.Motional timescale predictions by molecular dynamics simulations:case study using proline and hydroxyproline sidechain dynamics[J].Proteins:Structure,Function,and Bioinformatics,2014,82(2):195-215.
[15] HORNAK V,ABEL R,OKUR A,et al.Comparison of multiple Amber force fields and development of improved protein backbone parameters[J].Proteins:Structure Function,and Bioinformatics,2006,65(3):712-725.
[16] ABASCAL J L F,VEGA C.A general purpose model for the condensed phases of water:TIP4P/2005[J].The Journal of Chemical Physics,2005,123(23):234505.
[17] VAN DER SPOEL D,VAN MAAREN P J.The origin of layer structure artifacts in simulations of liquid water[J].Journal of Chemical Theory and Computation,2006,2(1):1-11.
[18] DARDEN T,YORK D,PEDERSEN L.Particle mesh ewald:anN-log(N) method for ewald sums in large systems[J].The Journal of Chemical Physics,1993,98(12):10089.
[19] WAICHMAN K,BARMASHENKO B D,ROSENWAKS S.Comparing modeling and measurements of the output power in chemical oxygen-iodine lasers:a stringent test of I2dissociation mechanisms[J].Journal of Chemical Physics,2010,133(8):084301.
[20] BUSSI G,DONADIO D,PARRINELLO M.Canonical sampling through velocity rescaling[J].The Journal of Chemical Physics,2007,126(1):014101.[21] RENTENIER A,MORETTO-CAPELLE P,BORDENAVE-MONTESQUIEU D,et al.Analysis of fragment size distributions in collisions of monocharged ions with the C60 molecule[J].Journal of Physics B:Atomic,Molecular and Optical Physics,2005,38(7):789-806.
[22] PAYNE M C,TETER M P,ALLAN D C,et al.Iterative minimization techniques for ab initio total-energy calculations:molecular dynamics and conjugate gradients[J].Reviews of Modern Physics,1992,64(4):1045-1097.
[23] 吴亚卿,李代禧,李保国,等.饱和水溶液法制备磺胺甲噁唑的β-环糊精包合物研究[J].上海理工大学学报,2007,29(4):315-320.
[24] TAREK M,TOBIAS D J.Single-particle and collective dynamics of protein hydration water:a molecular dynamics study[J].Physical Review Letters,2002,89(27):275501.
[25] DASTIDAR S G,MUKHOPADHYAY C.Structure,dynamics,and energetics of water at the surface of a small globular protein:a molecular dynamics simulation[J].Physical Review E,2003,68(2):021921.
(编辑:石 瑛)
Bioactive Structural Stability of Insulin in Disaccharides Solutions
SUN Xu1, LI Daixi1, GUO Baisong2
(1.SchoolofMedicalInstrumentandFoodEngineering,UniversityofShanghaiforScienceandTechnology,Shanghai200093,China; 2.ShanghaiTofflonScienceandTechnologyCo.,Ltd.,Shanghai201108,China)
The approaches of microcalorimetry and molecular dynamic simulation were adopted to investigate the protective effect caused by adding protectants.The results indicate that disaccharide protectants are able to maintain the molecular structure of insulin and contribute to the thermal stability of insulin due to the regional selective adsorption of protectants on the surface of insulin.Among four disaccharide protectants,the protectant with stronger adsorption ability conducts better performance in stabilizing the molecular structure of protein.With increasing the concentration of protectants,the thermal stability of insulin changes from increasing to gradually stable state.A further analysis upon the interaction between protectants and water reflects that increasing the thermal stability of insulin is attributed mainly to the interaction between insulin and disaccharides.
disaccharides;insulin;thermalstability;molecularsimulation;microcalorimetry
1007-6735(2016)06-0598-07
10.13255/j.cnki.jusst.2016.06.016
2016-10-10
上海市重点学科建设资助项目(T0503,P0502);上海市自然科学基金资助项目(12ZR1420400);上海市“创新行动计划”国际科技合作项目(12430702000);上海市联盟计划项目(11XSY23)
孙 旭(1991-),男,硕士研究生.研究方向:计算生物学.E-mail:sunxujiayou@126.com
李代禧(1975-),男,副教授.研究方向:计算生物学.E-mail:dxli75@126.com
O 6-39
A

