犬骨髓间充质干细胞体外分离培养及分化鉴定
蒲超,张珊珊,李伟,吴青霞,吴辉
(1.川北医学院第二临床学院·南充市中心医院骨科;2.川北医学院第二临床学院·南充市中心医院神经内科,四川 南充 637000)
犬骨髓间充质干细胞体外分离培养及分化鉴定
蒲超1,张珊珊2,李伟1,吴青霞1,吴辉1
(1.川北医学院第二临床学院·南充市中心医院骨科;2.川北医学院第二临床学院·南充市中心医院神经内科,四川 南充 637000)
目的:建立犬骨髓间质干细胞(dog bone mesenehymal stem cells,dBMSCs)的体外分离、培养、纯化及鉴定的方法。方法:采用密度梯度离心法结合贴壁筛选法分离dBMSCs,并通过不断传代进行纯化和扩增培养。诱导dBMSCs向成骨、成脂细胞分化,并分别以矿化(钙)结节茜素红染色、油红O染色鉴定。结果:dBMSCs 在体外分离培养扩增,形态呈长梭形成纤维细胞样,通过成骨、成脂诱导分化鉴定其为dBMSCs。结论:密度梯度离心法结合贴壁筛选法能有效的获取dBMSCs,所分离培养的dBMSCs同时具有多向分化潜能,是组织工程研究中理想的种子细胞。
组织工程;骨髓间充质干细胞;分离;培养;诱导;分化
骨髓间充质干细胞(bone mesenehymal stem cells,BMSCs)具有较强的增殖能力,多向分化的潜能,而且取材方便、细胞移植后无明显的移植物抗宿主反应,体外基因转染率高,能稳定高效的表达转染基因,被认为是理想的组织工程种子细胞[1-5]。但其在成熟的骨髓中占比例很小,仅占有核细胞的0.001%~0.606%[4],体外培养不易获得纯化的BMSCs。本实验建立一种操作简便、费用低廉、高效分离培养BMSCs的方法,并成功诱导其向成骨、成脂细胞分化。
1 资料与方法
1.1 实验动物
清洁级杂交犬3只,由川北医学院动物中心提供,30~34周龄,雌雄不限,体重(18±2.2)kg,实验过程中对动物的处置符合动物伦理学标准。
1.2 主要试剂
Percoll犬淋巴细胞分离液(密度1.073 g/mL),天津TBD公司;低糖-DMEM(L-DMEM)培养基,美国Sigma公司;胎牛血清,澳大利亚PAA公司;胰酶,美国Sigma公司;EDTA,美国Sigma公司;DMSO,美国Sigma公司。
1.3 dBMSCs的体外分离
以3%戊巴比妥钠(1 mL/kg)腹腔内麻醉杂交犬,用内含1 mL肝素钠(3 000 U/mL)的26号骨髓穿刺针刺入髂后上棘,分2~3点抽取骨髓5~8 mL。
1.4 dBMSCs原代培养
上述骨髓标本沿离心管壁缓慢注入到已含4 mL淋巴细胞分离液的2个离心管中,3 000 r/min,离心30 min,缓慢小心吸取中间界面乳白色云雾状单个核细胞层,加入37 ℃,10 mL PBS液洗2次(2 000 r/min,离心5 min),加入含10%FBS L-DMEM培养基,以1×108/L密度接种于培养瓶中,37 ℃、5% CO2细胞孵育箱中培养,48 h 后半量换液,72 h后弃去培养基和未贴壁细胞,PBS清洗2次,全量换液,以后每3 d换液1次。
1.5 dBMSCs传代扩增培养
原代细胞接近80%~90%汇合时,用0.25%胰蛋白酶(含0.03% EDTA )于37 ℃消化90 s,待细胞形态开始皱缩、细胞间隙开始增大时,加入含10%FBS的L-DMEM培养液1.5~2 mL终止消化,并加入3~5 mL PBS,吸管轻轻吹打培养瓶壁,使细胞充分脱落,细胞悬液移入离心管,1 000 r/min,离心3 min,弃上清,沉淀含10%FBS的L-DMEM培养液,按1∶2比例传代培养,细胞汇合至80%~90%汇合时再次传代培养。
1.6 dBMSCs形态学观察
原代及传代培养的细胞,用倒置相差显微镜观察细胞生长、增殖情况及形态特征。
1.7 dBMSCs的冻存与复苏
取已汇合达80%~90%的第2代dBMSCs,经消化、离心、收集,用含10%FBS的 L-DMEM培养液调整细胞密度为6×109/L。将细胞冻存液(DMSO∶FBS=1∶3)缓慢滴入同体积的含dBMSCs的上述细胞悬液中,摇匀,DMSO的终浓度为12.5%,dBMSCs的终密度为3×109/L。
dBMSCs的冻存及复苏应慢冻快融,置于-4 ℃冰箱2 h,置-30 ℃冰箱2 h,置-80 ℃冰箱过夜后取出冻存管直接放入液氮中保存;复苏时将冻存管从液氮或-80 ℃冰箱中取出,立即置37 ℃水浴并轻轻摇动,1~2 min内迅速解冻。复苏后的dBMSCs用含10%FBS的L-DMEM培养液培养,观察其存活情况及形态变化。
1.8 dBMSCs向成骨细胞诱导分化及鉴定
取第3代状态良好的dBMSCs,以1×104/cm2
接种于24孔板,培养1 d后将培养液更换成含成骨诱导剂的L-DMEM诱导培养液(含100 nM地塞米松,β-甘油磷酸钠10 mmol/L、维生素C 50 μg/mL)培养,每3天换液, 21 d后行培养板的矿化(钙)结节茜素红染色:PBS缓冲液洗2遍,4 ℃95%乙醇固定10 min,PBS洗3次后,加入0.1%茜素红-Tris-HCL染液(pH8.3)1 mL,于37 ℃染色30 min,再用PBS洗3次,自然干燥后肉眼及镜下观察。
1.9 dBMSCs向成脂肪细胞诱导分化及鉴定
将第3代dBMSCs以1×104/cm2接种于24孔板,待细胞贴壁生长、融合达90%时,加入用成脂诱导液(5%FBS的L-DMEM培养基,100 nM地塞米松,0.5 mM IBMX,50 mM吲哚美辛,0.01 mg/mL胰岛素,50 μg/mL抗坏血酸)诱导培养两周,每4 d换液1次。两周后倒置显微镜下观察脂滴形成情况,2.5%戊二醛固定15 min后行油红O染色,倒置显微镜下观察拍照。
2 结果
2.1 dBMSCs原代及传代培养
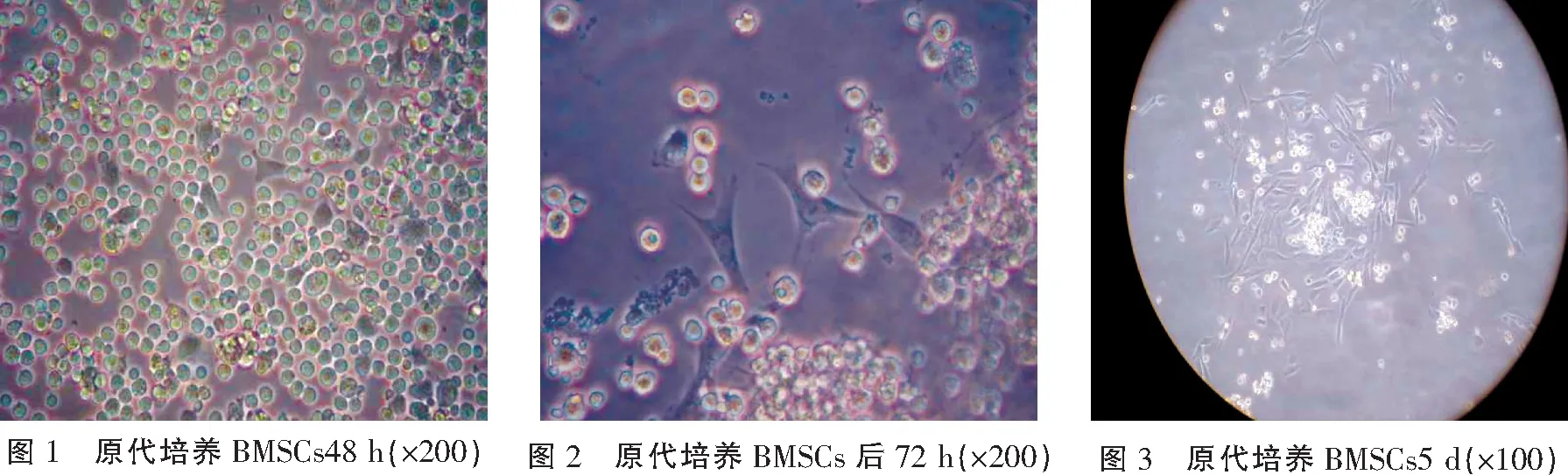
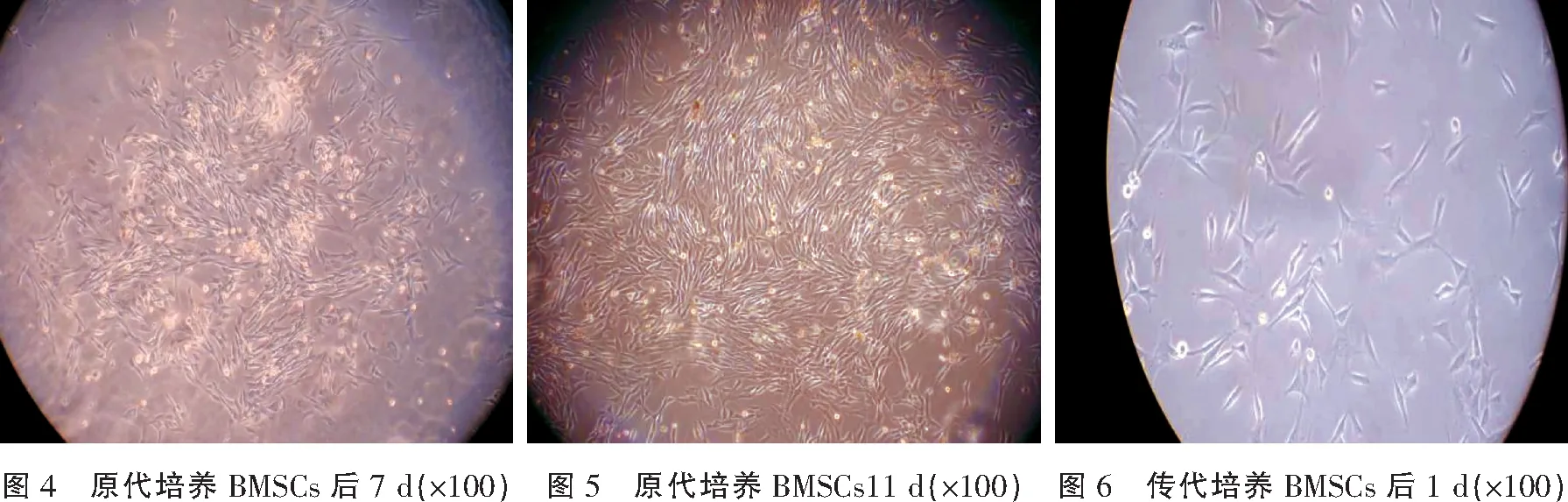
犬dBMSCs原代培养细胞48 h,倒置显微镜下观察,在绝大多数圆形细胞的背景中出现出现少许变形细胞,呈椭圆形伴有胞质突起(图1)。培养第72 h,镜下见稀疏的略呈梭形细胞、多角形,胞体变大,视野内单个核细胞漂浮生长,密度减小(图2)。培养第5天,镜下见形态一致的长梭形细胞,呈群落状生长(图3)。培养第7天,可见细胞开始增殖呈集落生长,漩涡状排列明显,细胞群落增大,群落中央细胞排列整齐,外围逐渐稀疏(图4)。培养第11天,整个培养瓶底见形态一致的长梭形细胞,可观测到多个漩涡(图5)。传代培养后1 d,细胞多数呈梭形,少数呈多角形生长,分布一致,均匀铺满瓶底(图6),未见原代细胞培养时出现的集落样生长,传代后细胞增殖速度明显加快,汇合达80%~90%需5~6 d。悬浮生长的单个核细胞、血细胞随多次换液而逐渐被去除。
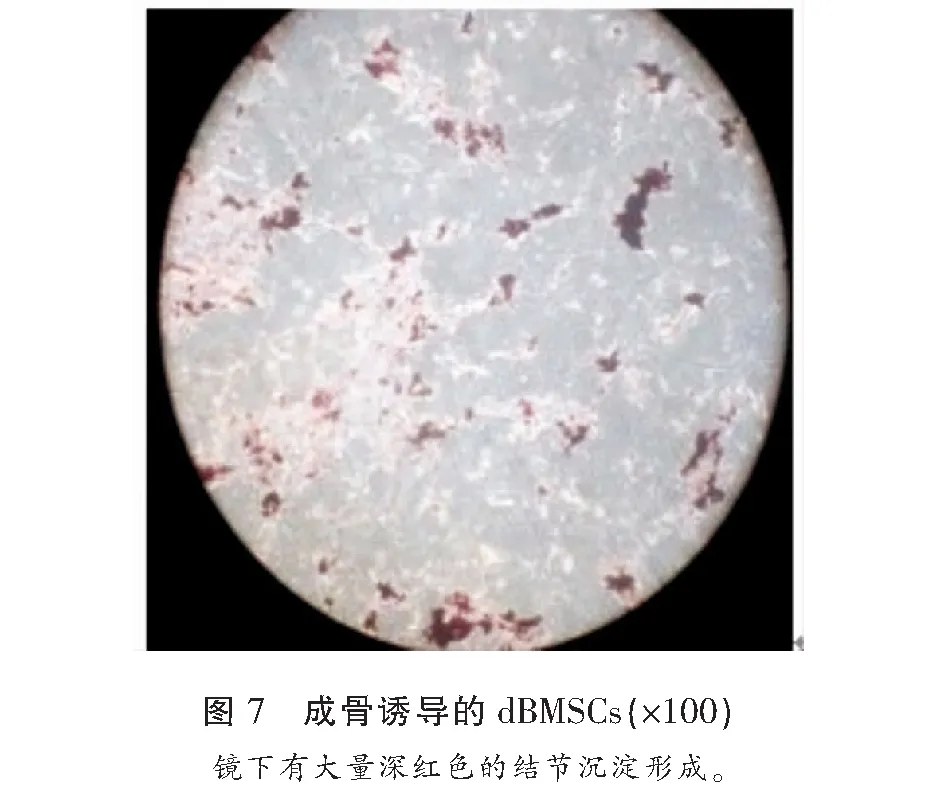
2.2 成骨诱导培养21 d后行培养板的矿化(钙)结节茜素红染色
成骨诱导培养21 d后行培养板的矿化(钙)结节茜素红染色,镜下显示深红色矿化结节(图7)。
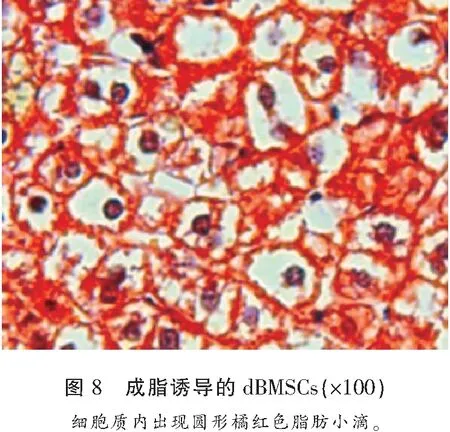
2.3 成脂诱导后行油红O染色
镜下细胞形态呈类圆形,体积变大,细胞质内出现圆形橘红色脂肪小滴,浅蓝色胞核被挤于细胞一侧或中央(图8)。
3 讨论
目前对BMSCs的分离纯化和扩增方法有:(1)全骨髓贴壁筛选法:根据BMSCs在塑料培养材质上贴壁生长的特性,通过定期换液除去不贴壁细胞,实现BMSCs的分离、纯化;(2)密度梯度离心法:根据骨髓中各细胞成分比重的不同,使用淋巴细胞分离液提取单个核细胞,再进行贴壁培养而分离、纯化BMSCs;(3)流式细胞仪分选法:根据BMSCs的细胞表面标记,利用相应的荧光素标记抗体进行筛选;(4)免疫磁珠法:利用BMSCs的细胞表面抗原与连接有磁珠的特异性单抗相结合,在磁场作用下分离细胞;(5)细胞筛选法:即根据细胞大小从骨髓中筛选BMSCs。目前比较公认的BMSCs鉴定标识是不表达造血细胞系的表面抗原,如CD14、CD34 CD38 CD45 等,也不表达淋巴细胞的表面抗原,如CD11a、CD11b等,而在不同的生长阶段表现出不同的基质细胞表面抗原及细胞因子受体,如SH2、SH3、CD29、CD44、CD166。但由于目前仍未找到BMSCs特异性的细胞表面标记,故利用流式细胞仪分选法以及免疫磁珠法分离鉴定BMSCs缺乏特异性,鉴定困难,且这两种方法存在对细胞活性影响大,甚至可以导致细胞完全失活,存在纯化后培养困难,实验条件要求高、费用贵、需要骨髓量大等缺点,目前应用较少。BMSCs在全骨髓中比例很低,细胞筛选法效率低。贴壁法是BMSCs最初的分离培养方法,是由Friedenstein在19世纪70年代中期建立的,至今该方法仍是一种得到广泛应用的经典途径[6]。密度梯度离心法不影响细胞活性,但不能排除混杂的成纤维细胞、单核/巨噬细胞等非目的细胞。密度梯度离心结合贴壁培养法,以密度梯度离心有效地除去绝大部分造血细胞,获得纯度较高的单个核细胞,然后根据BMSCs与血系细胞贴壁性能的差异,培养过程中多次更换培养液可去除悬浮生长的血细胞等杂质,最终得到贴壁生长的BMSCs[7-8]。此法操作简便、费用低廉、效果切实可靠,为一种高效的分离培养BMSCs选择,在BMSCs的分离、纯化过程中被广泛采用。试验表明密度梯度离心结合贴壁培养法获得的BMSCs可传十多代,仍能保持旺盛的生长和增殖能力。吴胜东等[9]报道采用密度梯度离心结合贴壁培养的方法分离BMSCs纯度可达97.7%。
目前BMSCs鉴定方法主要是通过在培养过程中出现分化表型,然后逆推得知是否为BMSCs。多向分化潜能被认为是BMSCs最重要的生物学特征,而决定分化方向的关键就是诱导分化的条件,在不同的诱导条件下可向骨细胞、脂肪细胞、神经细胞、肌细胞和内皮细胞等多种细胞系转化[10]。诱导分化的机制和条件目前尚未明确,多数观点认为,BMSCs分化方向与微环境密切相关,不同组织的细胞微环境具有不同的诱导因子,这可能是进入不同组织的BMSCs获得靶组织的表型,向不同细胞谱系分化的主要原因之一[11-13]。目前,BMSCs体外分化诱导的方法主要有两种:一是用抗氧化剂作为诱导剂如一巯基乙醇、二甲基亚砜、丁羟醚等[14-15];二是用生长因子作为诱导剂,如血小板衍生生长因子、表皮细胞生长因子、胰岛素样生长因子等[16-17]。BMSCs具有强大的分化潜能,通过体外培养及诱导分化的方法,由BMSCs可以获得大量的组织工程种子细胞,满足临床治疗需要的干细胞来源。
BMSCs有着广泛的应用前景,但是目前还存在着有待解决的问题:(1)进一步改进BMSCs的分离提取方法,以提高其纯度[18];(2)BMSCs在不同的生长阶段变现出不同的标志性抗原,缺乏特异性,鉴定困难;(3)因为BMSCs具有三系分化潜能,其应用需实现精确、高效的诱导分化;(4)BMSCs随着传代次数的增多易于失去分化潜能;(5)随着细胞传代次数的增加,细胞分化增值潜能下降。因此,建立高效、精确的BMSCs体外分离、培养、诱导分化方法,以及延缓细胞衰老是今后的研究重点。
[1] Hagmann S,Moradi B,Frank S,etal.Different culture media affect growth characteristics,surface marker distribution and ehondrogenic differentiation of human bone marrow-derived mesenchymal stromal cells[J].Bmc Musculoskelet Disord,2013,14(1):1-11.
[2] Kar S,Mitra S,Banerjee ER.Isolation and Culture of Embryonic Stem Cells,Mesenchymal Stem Cells,and Dendritic Cells from Humans and Mice[J].Methods Mol Biol,2016,1516:145-152.
[3] Kim N,Cho SG.Clinical applications of mesenchymal stem cells[J].Korean J intern Med,2013,28(4):387-402.
[4] Boregowda SV,Krishnappa V,Phinney DG.Isolation of Mouse Bone Marrow Mesenchymal Stem Cells[J].Methods Mol Biol,2016,1416:205-223.
[5] Li H,Ghazanfari R,Zacharaki D,etal.Isolation and characterization of primary bone marrow mesenchymal stromal cells[J].Ann N Y Acad Sci,2016,1370(1):109-118.
[6] 刘康,白亦光,陈竹,等.兔骨髓间充质干细胞的分离培养及鉴定[J].川北医学院学报,2013,28(2):103-106.
[7] 王英慧,郑瑞,陈莉.密度梯度离心及贴壁分离筛选相结合分离培养大鼠骨髓问充质干细胞[J].中国组织工程研究,2014,18(28):4463-4468.
[8] 闰峰,张越林,刘宁,等.全骨髓贴壁法分离骨髓间充质干细胞并诱导其定向神经元样细胞的分化[J].细胞与分子免疫学杂志,2014,30(11):1162-1165.
[9] 吴胜东,葛建军.犬骨髓间充质干细胞的分离、培养、纯化及鉴定[J].武警医学院学报,2009,18(1):15-19.
[10]Martin TJ.Bone biology and anabolic therapies for bone:Current status and future prospects[J].Bone Metab,2014,21(1):8-20.
[11]Brien CA,Nakasima T,Takayanagi H.Osteocytecontrol of osteoclas togenesis[J].Bone,2013,54(2):258-263.
[12]Rossini M, Gatti D,Adami S.Involvement of WNT/be-ta-catenin signaling in the treatment of osteoporosis[J].Calcif Tissue Int,2013,93(2):121-132.
[13]Zhang R,Oyajobi BO,Harris SE,etal.Wnt/β-catenin signaling activates bone morphogenetic protein 2 expression inosteoblasts[J].Bone,2013,52(1):145-156.
[14]Coaes Y,Ojeda M,Araya D,etal.Isolation and multilineage differentiation of bone marrow mesenchymal stem ceils from abattoirderived bovine fetuses[J].BMC Vet Res,2013,9(1):133-146.
[15]Aliborzi G,Vahdati A,Mehrabani D,etal.Isolation,Characterization and Growth Kinetic Comparison of Bone Marrow and Adipose Tissue Mesenchymal Stem Cells of Guinea Pig[J].Int J Stem Cells,2016,9(1):115-123.
[16]Lin Z,Wang JS,Lin L,etal.Effects of BMP2 and VEGF165 on the osteogenic differentiation of rat bone marrowderived mesencbymal stem cells[J].Exp Ther Med,2014,7(3):625-629.
[17]Kwon SH,Lee TJ,Park J,etal.Modulation of BMP-2 induced chondrogenic versus osteogenic differentiation of human mesenchymal stem cells by cell-specific extracellular matrices[J].Tissue Eng Part A,2013,19(1/2):49-58.
[18]Gardner OF,Alini M,Stoddart MJ.Mesenchymal Stem Cells Derived from Human Bone Marrow[J].Methods Mol Biol,2015,1340:41-52.
(学术编辑:敬保迁)
Isolation,culture,differentiation and identification of dog mesenehymal stem cells in vivo
PU Chao1,ZHANG Shan-shan2,LI Wei1,WU Qing-xia1,WU Hui1
(1.DepartmentofOrthopaedics;2.DepartmentofNeurology,NanchongCentralHospital,SecondClinicalMedscalCollegeofNorthSichuanMedicalCollege,Nanchong637000,Sichuan,China)
Objective:To establish a method for isolation,culture,differentiation and identification of bone mallow mesenchymal stem cells(BMSCs) from dog. Methods:dBMSCs were isolated by combination of gradient centrifugation and adherent wall culture,and induced their differentiation into osteoblasts and adipocytes which were identified by histoehemistry staining and oil red staining.Results:The cultured adherent cells showed spindle and polygonal shape.The identification of dBMSCs was carried out by alizarin red staining after induction of osteoblasts and alkaline phosphatase staining after induction of adipocytes.Conclusion:dBMSCs were isolated and cultured successfully from dog ilium bone marrow by combination of gradient centrifugation and adherent wallculture,which possess multi-directional differentiation potential,is the ideal seed cells in tissue engineering research.
Tissue engineering;Bone mesenehymal stem cells;Isolation;Culture;Induce;Differentiation
10.3969/j.issn.1005-3697.2016.06.001
川北医学院科研发展计划项目(CBY11-A-QN09)
2016-08-13
蒲超(1984-),男,硕士,主治医师。E-mail:puchao3310@sina.com
李伟,E-mail: subjwdice@126.com
时间:2017-1-3 22∶01
http://www.cnki.net/kcms/detail/51.1254.R.20170103.2201.002.html
1005-3697(2016)06-0782-04
R332
A

