丹参酮ⅡA对大鼠肺纤维化细胞TGF-β1/Smads信号通路的影响
邵 笑祝 骥赵峻峰许颖龄张颖颖杨建清卢德赵
丹参酮ⅡA对大鼠肺纤维化细胞TGF-β1/Smads信号通路的影响
邵 笑1祝 骥1赵峻峰1许颖龄2张颖颖2杨建清2卢德赵2
目的观察丹参酮ⅡA对TGF-β1诱导大鼠肺成纤维细胞TGF-β1/Smads信号通路的影响,探讨丹参酮ⅡA干预肺纤维化的机制。方法体外培养大鼠肺成纤维细胞(HFL-1),选取生长状态良好的对数期细胞分为正常组、TGF-β1组及丹参酮ⅡA低(L)、中(M)、高(H)剂量组。除正常组外,余四组予以10ng/mL TGF-β1诱导HFL-1纤维化24h,同时丹参酮ⅡA低、中、高剂量组分别予2μmol/L、5μmol/L和10μmol/L丹参酮ⅡA处理24h,ELISA法测定各组细胞中TGF-β1受体表达,荧光定量PCR法及免疫印迹法检测Smad2、Smad7表达情况。结果与正常组比较,HLF-1细胞经10ng/mL TGF-β1诱导后细胞TGF-β1受体和Smad2表达量增加[(0.19±0.23)比(1.41± 0.12)、(1.00±0.12)比(1.90±0.12),P<0.01],Smad7表达量降低[(1.00±0.15)比(0.57±0.09),P<0.01];与TGF-β1组比较,10μmol/L丹参酮ⅡA处理后TGF-β1受体和Smad2的表达量均有下降趋势[(1.90±0.23)比(1.53±0.12),(1.90±0.12)比(1.38±0.06),P<0.01],Smad7表达量升高[(0.57±0.08)比(0.74±0.11),P<0.01]。结论丹参酮ⅡA可以抑制TGF-β1诱导的大鼠肺成纤维细胞增殖和Smad2 及TGF-β1受体表达,增强抑制性信号蛋白Smad7的表达,从而发挥抑制肺纤维化的作用。
大鼠;肺纤维化;HFL-1;丹参酮ⅡA;转化生长因子β
肺纤维化(pulmonary fibrosis,PF)是一个复杂的病理过程,包括慢性炎症反应、成纤维细胞增殖以及异常的胶原沉积所导致的损伤过度修复,至今发病机制不明,且没有理想的治疗方法[1-3]。目前认为转化生长因子β(transforming growth factor beta1,TGF-β1)是导致纤维化的关键性细胞因子,其介导的Smad通路是纤维化发生的可能机制之一[4]。Smad家族中的Smad2是TGF-β/Smads信号通路活化蛋白,而其正常表达与肺纤维化的形成直接相关[5],而Smad7是其抑制性信号。丹参是常见的活血化瘀中药,丹参酮ⅡA是其最主要的有效成分之一。近年许多研究[6-7]表明,丹参酮ⅡA具有抗纤维化作用,但其具体机制尚未明确。本研究旨在观察丹参酮ⅡA对TGF-β1诱导的大鼠肺成纤维细胞TGF-β1/Smads信号通路的影响,阐明丹参酮ⅡA干预肺成纤维细胞纤维化的机制。
1 材料与方法
1.1 材 料 HFL-1细胞株购于中国科学院上海细胞库;丹参酮ⅡA(批号14031278)购于安徽甙尔塔公司;RPMI1640培养基(批号14051103)、胎牛血清(批号1414876)购自杭州四季青生物工程材料研究所;氯化镉(批号10005416)购于国药集团化学试剂有限公司;Smad2(批号3103S)、Smad7(批号YHN0211061)、actin(批号0017150S)一抗均购于SANTA CRUZ公司。Elisa试剂盒(批号E12010503)购于上海ELISA生物科技有限公司。蛋白浓度测定试剂盒(批号00071501)购于康为世纪有限公司。
1.2 细胞培养及细胞增殖活力检测 HLF-1细胞培养于含10%胎牛血清的RPMI1640培养基中,每2~3天传代1次,将生长状态良好的对数期细胞以1×104个/孔浓度传代培养于96孔板中,并加入不同剂量的丹参酮ⅡA,使其终浓度为0、2、4、6、7、8、10、12、16μmol/L,每个浓度设6个重复,5%CO2的培养箱中培养24h后,利用MTT法在波长490nm处检测各组样品吸光度值(A490)。
1.3 细胞分组处理 选取生长状态良好的对数期细胞5瓶,分为五组,正常组:HFL-1细胞正常境况24h;TGF-β1组:10ng/mL TGF-β1处理HFL-1细胞24h;丹参酮ⅡA(L):10ng/mL TGF-β1+2μmol/L丹参酮ⅡA处理细胞24h;丹参酮ⅡA(M):10ng/mL TGF-β1+5μmol/L丹参酮ⅡA处理细胞24h;丹参酮ⅡA(H):10ng/mL TGF-β1+10μmol/L丹参酮ⅡA处理细胞24h,提取细胞总RNA及总蛋白质,定量后置于-20℃保存。
1.4 Elisa检测TGF-β1受体表达 用Elisa试剂盒,将标准品、待测样品各50μL于反应孔立即加入50μL的生物素标记的抗体。盖上膜板,轻轻振荡混匀,37℃温育45min。清洗4次,每孔加入100μL的亲和链酶素-HRP,轻轻振荡混匀,37℃温育30 min。清洗4次后,每孔加入底物A、B各50μL,轻轻振荡混匀,37℃避光温育5min,迅速加入50μL终止液,在450nm波长处测定各孔的OD值。
1.5 荧光定量PCR法检测Smad2、Smad7 mRNA表达 细胞孵育后,收集各实验组细胞,按TRIZOL试剂盒说明书提取细胞总RNA并将总RNA逆转录合成cDNA。取产物以β-actin为内参照进行定量PCR扩增。Actin引物:上游5-CCGTAAAGACCTCTATGCCAACA-3,下游:5-CGGACTCATCGTACTCCTGCT-3,扩增产物长度为230bp;Smad2引物:上游5-TTTGCGGAATAATCGTGT-3,下游5-AAGGTGCTTTAATTGATGAGAC-3,PCR扩增产物长度为414bp;Smad7引物序列:上游:5-TTTTGAGGTGTGGTGGGT-3,下游:5-GAGGCAGTAAGACAGGGATGA-3,扩增产物长度为478bp。反应结束后进行软件分析。
1.6 Western blot检测Smad2、Smad7蛋白质表达蛋白质样品先用8%SDS-PAGE凝胶进行分离,后用湿转法将蛋白转移到PVDF膜上,再将膜进行封闭,β-actin(1:600)兔抗鼠的一抗孵育,1:1000羊抗兔的二抗孵育、Smad7(1:250)、Smad2(1:600)鼠抗人的一抗孵育,1:1000兔抗鼠的二抗孵育及ECL显色。
2 结果
2.1 丹参酮ⅡA对HFL-1细胞增殖活力的影响MTT法检测丹参酮ⅡA对HLF-1细胞增殖活力的影响,≤10μmol/L丹参酮ⅡA对细胞增殖活力没有显著影响(P>0.05),12μmol/L丹参酮ⅡA可以显著抑制HLF-1细胞的增殖(P<0.01)。见表1。
2.2 丹参酮ⅡA对TGF-β1诱导的HFL-1细胞TGF-β1受体表达的影响 与正常级比较,10ng/mL TGF-β1处理HFL-1细胞后,TGF-β1受体表达量显著增加(P<0.05),10μmol/L丹参酮ⅡA能明显降低TGF-β1受体的表达,并有一定的量效关系,见表2。
2.3 丹参酮ⅡA对TGF-β1诱导的HFL-1细胞Smad2和Smad7 mRNA表达的影响 与正常组比较,TGF-β1诱导HFL-1细胞24h后,细胞中Smad2 mRNA增加,而Smad7 mRNA含量显著减少。经5、10μmol/L丹参酮ⅡA处理后,Smad2 mRNA含量降低,而Smad7 mRNA含量相对增加,见表3。
表1 丹参酮ⅡA对HFL-1细胞增殖活力的影响(±s)

表1 丹参酮ⅡA对HFL-1细胞增殖活力的影响(±s)
注:与丹参酮ⅡA零浓度比较,**P<0.01;HFL-1细胞:大鼠肺成纤维细胞
丹参酮ⅡA浓度(μmol/L) 孔数0 2 4 6 8 1 0 12 16 6 6 6 6 6 6 6 6细胞相对增殖情况(OD490)0.34±0.012 0.35±0.023 0.36±0.017 0.39±0.015 0.37±0.009 0.36±0.021 0.26±0.022** 0.22±0.015**
表2 四组大鼠HFL-1细胞TGF-β1诱导后TGF-β1受体表达比较(±s)
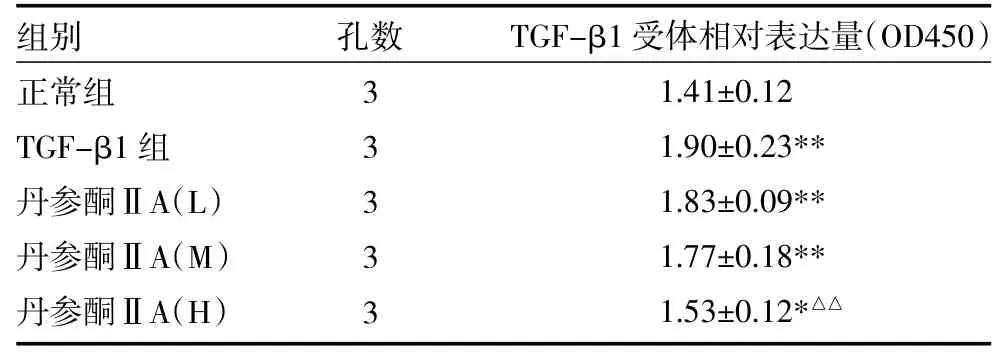
表2 四组大鼠HFL-1细胞TGF-β1诱导后TGF-β1受体表达比较(±s)
注:与正常组比较,*P<0.05,**P<0.01;与TGF-β1组比较,△△P<0.01;HFL-1细胞:大鼠肺成纤维细胞;TGF-β1:转化生长因子
组别正常组TGF-β1组丹参酮ⅡA(L)丹参酮ⅡA(M)丹参酮ⅡA(H)孔数3 3 3 3 3 TGF-β1受体相对表达量(OD450)1.41±0.12 1.90±0.23** 1.83±0.09** 1.77±0.18** 1.53±0.12*△△
表3 四组大鼠HFL-1细胞TGF-β1诱导后HFL-1细胞Smad2和Smad7 mRNA表达比较(±s)
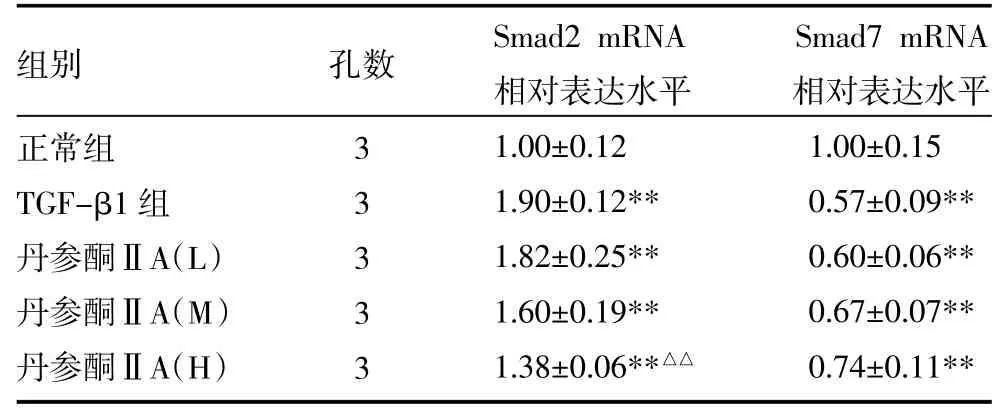
表3 四组大鼠HFL-1细胞TGF-β1诱导后HFL-1细胞Smad2和Smad7 mRNA表达比较(±s)
注:与正常组比较,**P<0.01;与TGF-β1组比较,△△P<0.01;HFL-1细胞:大鼠肺成纤维细胞;TGF-β1:转化生长因子
组别正常组TGF-β1组丹参酮ⅡA(L)丹参酮ⅡA(M)丹参酮ⅡA(H)孔数3 3 3 3 3 Smad2 mRNA相对表达水平1.00±0.12 1.90±0.12** 1.82±0.25** 1.60±0.19** 1.38±0.06**△△Smad7 mRNA相对表达水平1.00±0.15 0.57±0.09** 0.60±0.06** 0.67±0.07** 0.74±0.11**
2.4 丹参酮ⅡA对TGF-β1诱导的HFL-1细胞Smad2和Smad7蛋白质表达的影响 TGF-β1诱导HFL-1细胞24h后,细胞中Smad2蛋白质表达增加,Smad7蛋白质表达下降。丹参酮ⅡA可以下调Smad2蛋白质表达,提高Smad7蛋白质表达,见图1。

图1 丹参酮ⅡA对TGF-β1诱导的HFL-1细胞Smad2和Smad7蛋白质表达的影响
3 讨论
肺纤维化是一种原因不明、以弥漫性肺泡炎症和肺泡结构紊乱最终导致肺间质纤维化为特征的疾病[8]。转化生长因子β(transforming growth factor beta,TGF-β)被公认为纤维化形成与发展的启动枢纽,是关键性细胞因子,能启动成纤维细胞的增殖分裂,导致胶原蛋白的大量合成,最终形成肺间质的胶原沉积等纤维化的组织病理学改变。TGF-β1发挥生物学调节功能依赖于其在细胞膜表面的特异性受体,Smad家族蛋白介导了TGF-β1对基因表达的调控。TGF-β1首先与相应的TβRⅡ相结合,再连接TβRⅠ共同形成复合物。接着磷酸化激活R-Smads某一成员,该成员再和Co-Smads结合形成复合物转入核内调节下游基因的转录。Smad蛋白有8种,分为3个亚型:(1)膜受体激活型Smad(R-Smads),主要包括Smad2、Smad3。(2)共同通路型Smad(Co-Smads),主要是Smad4,可同R-Smads结合,是TGF-β1信号传导必需的中转分子。(3)抑制性Smad(I-Smads),包括Smad6,Smad7。可与R-Smads竞争TGF-β1受体,对信号传递起负调控作用。Smad2、Smad3是纤维化疾病的重要介导者,大量事实表明,TGF-β1介导的细胞外基质(ECM)的表达上升是Smads依赖性的过程[9-10]。Smad7为TGF-β/Smad信号通路的抑制分子,可与R-Smads竞争性结合受体,阻止R-Smads磷酸化而阻断TGF-β的信号传递。因此,调控TGF-β/Smad通路各分子的表达成为肺纤维化治疗的一种新途径[11]。
丹参酮ⅡA(Tanshinone IIA)是从丹参中提取出的脂溶性成分之一,是近年来国内外学者对中药单体中研究较多的活性成分,其在丹参酮中含量最高,也是最为稳定的有效活性成分,其具有明确的分子结构。已有实验证实[12-13],丹参酮ⅡA不仅具有清除氧自由基和抗炎的作用,还具有抗肿瘤等多种药学活性。同时,丹参酮ⅡA磺酸钠对急性坏死性胰腺炎大鼠肺损伤具有保护作用[14]。然而,目前关于丹参酮ⅡA如何作用于肺间质纤维化,其相关的具体生物学机制尚不十分清楚。
我们采用TGF-β1诱导大鼠肺成纤维细胞纤维化,正常组HLF-1细胞梭形或扁的星状,胞质透明,胞核较大,可见核仁。经TGF-β1诱导后细胞伸出多个突起,并连接成网状,细胞密集成放射状分布。Elisa检测显示TGF-β1受体浓度上升,定量PCR和免疫印迹法检测显示丹参酮ⅡA可以降低Smad2表达,并提高Smad7的表达量。
综上所述,TGF-β1可以上调TGF-β1受体和Smad2表达,并下调Smad7,促进肺纤维化;丹参酮ⅡA可能通过调节TGF-β1/Smads信号传导通路,缓解成纤维细胞的纤维化,从而起到防治肺纤维化作用。
[1]Feng YZ,Zhang YS,Cao ZF,et al.Prevention of combination of Hirsntella sinensis and Panax notoginseng extracts on Bleomycin-induced pulmonary fibrosis in mice[J].Chin Herb Med,2010,2(2):118-124.
[2]Montes E,Ruiz V,Checa M,et al.Renin is an angiotensinindependent profibrotic mediator:role in pulmonary fibrosis [J].EurRespir J,2012,39(1):141-148.
[3]Santos-Silva MA,Pires KM,Trajano ET,et al.Redox imbalance and pulmonary function in bleomycin-induced fibrosis in C57BL/6,DBA/2,and BALB/c mice[J].Toxicol Pathol,2012,40(5):731-741.
[4]Sun XE,Zhang XQ,Liu MM.Effect of bone marrow mesenchymal stem cells on the TGF-β1/Smad signaling pathway of hepatic stellate[J].Genet Mol Res,2015,14(3):8744-8754.
[5]Li LC,Li DL,Xu L,et al.High-mobility group box 1 mediates epithelial-to-mesenchymal transition in pulmonary fibrosis involving transforming growth factor-β1/Smad2/3 signaling[J].J Pharmacol Exp Ther,2015,354(3):302-309.
[6] Wu H,Li Y,Wang Y,et al.TanshinoneⅡA attenuates bleomycin-induced pulmonary fibrosis via modulating angiotensin-converting enzyme2/angiotensin-(1-7)axis in rats [J].Int J Med Sci,2014,11(6):578-586.
[7]Xu M,Cao F,Liu L,et al.TanshinoneⅡA-induced attenuation of lung injury in endotoxemic mice isassociated with reduction of hypoxia-inducible factor lalpha expression[J]. Am Jrespir Cell Mol Biol,2011,5(5):1028-1035.
[8]Cottin V,Wuyts W.Insights into idiopathic pulmonary fibrosis in the real world[J].Eur Respir J,2015,46(1):16-18.
[9]朱剑萍,姚宏伟,陈季强.TGF-β1诱导肺切片纤维化模型的建立[J].中国药理学通报,2006,22(4):501-504.
[10]石亮亮,刘明东,朱浩,等.丹参酮ⅡA磺酸钠对急性坏死性胰腺炎大鼠肺损伤的抗炎作用及其机制研究[J].胃肠病学,2014,19(6):332-335.
[11] Gharaee-Kermani M,Hu B,Phan SH,et al.Recent Advances in Molecular Targets and Treatment of Idiopathic Pulmonary Fibrosis:Focus on TGF-β Signaling and the Myofibroblast[J].Current Medicinal Chemistry,2009,16 (11):1400-1417.
[12]Teng YH,Lu DZ,Fan CL,et al.Proteomic Study on the Protective Effect of Tanshinone IIA Against Oxidative Injury to Human Umbilical Vein Endothelial Cells by Hydrogen Peroxide[J].Current Proteomics,2013,10(4):312-321.
[13]李超.丹参酮ⅡA对非小细胞肺癌患者的疗效及P糖蛋白表达的影响[J].中国民康医学,2015,27(12):50-51.
[14]Shi XM,Huang L,Xiong SD,et al.Protective effect of transhinone IIA on lipopolysaccharide-induced lung injury in rats[J].Chin J Integr Med,2007,13(2):137-140.
(收稿:2015-08-20 修回:2015-11-19)
Effect of TanshinoneⅡA on TGF-β1/Smads Signaling Pathway in Pulmonary Fibrosis Cellsof Rats
SHAO Xiao1,ZHU Ji1,ZHAO Junfeng1,XU Yingling2,ZHANG Yingying2,YANG Jianqing2,LU Dezhao2. 1 Clinical Laboratory,Third Affiliated Hospital of Zhejiang Chinese Medical University,Hangzhou(310005),China;2 College of Life Science,Zhejiang Chinese Medical University,Hangzhou(310053),China
ObjectiveTo investigate the protection effect of tanshinoneⅡA on transform growth factor(TGF)-β1/Smads pathway in pulmonary fibrosis cells of rats.MethodsHLF-1 cells were cultivated in vitro and induced to pulmonary fibrosis cells with 10ng/mL TGF-β1,then the cells were treated with 2μmol/L,5μmol/L and 10μmol/ L tanshinoneⅡA,respectively,for 24h.The method of Elisa was used to measure the expression of TGF-β1 receptors.The expression of Smad 2 and Smad 7 was determined with the method of fluorogenic quantitative PCR and Western Blotting.Results10ng/mL TGF-β1increased the expression of TGF-β1 receptors(1.41±0.12 vs 0.19± 0.23)and Smad 2(1.90±0.12 vs 1.00±0.12),and decreased the expression of Smad 7(0.57±0.09 vs 1.00±0.15)in the HLF-1 cells(all P<0.05).When the cells were treated withtanshinoneⅡA,TGF-β1 receptors(1.53±0.12)and Smad 2(1.38±0.06)expressed with a downward trend while the expression of Smad 7(0.74±0.11)was increased (all P<0.05).ConclusionTGF-β1 can promote pulmonary fibrosis through upregulating the expression of TGF-β1 receptors and Smad 2 and downregulatingthe expression of Smad 7.TanshinoneⅡA can regulate the TGF-β1/ Smads signaling pathway,which plays a preventive role in pulmonary fibrosis.
Rats;Pulmonary fibrosis;HFL-1;TanshinoneⅡA;Transform growth factor β
国家自然科学基金项目(No.81102841,81403133);浙江省自然科学基金项目(No.LY13H270005,No.LQ14H280004);中国博士后科学基金(No.2013M541800)
1浙江中医药大学附属第三医院检验科(杭州 310005);2浙江中医药大学生命科学学院(杭州 310053)
卢德赵,Tel:13588769151;E-mail:ludezhao@126.com

