达肝素钠和肝素钠对小鼠毒性的比较
张 媛,纳 涛,吴彦霖,游赣花,刘 倩,贺 庆,高 华
(中国食品药品检定研究院1.药理室,2.细胞资源保藏研究中心,北京 100050;3.贵州食品药品检验所药理室,贵州贵阳 550004)
达肝素钠和肝素钠对小鼠毒性的比较
张 媛1,纳 涛2,吴彦霖1,游赣花3,刘 倩1,贺 庆1,高 华1
(中国食品药品检定研究院1.药理室,2.细胞资源保藏研究中心,北京 100050;3.贵州食品药品检验所药理室,贵州贵阳 550004)
目的 比较达肝素钠和肝素钠对小鼠毒性的差异。方法 采用半数致死量(LD50)法测定两药对小鼠的急性毒性,达肝素钠设6个剂量组,最低剂量为2.54×105U·kg-1;肝素钠设5个剂量组,最低剂量为2.05×105U·kg-1;剂量间距均为1.25;达肝素钠和肝素钠干预L-929细胞48 h,CCK-8法检测细胞存活率并计算半数抑制浓度(IC50),达肝素钠设7个浓度,最低浓度为0.78×105U·L-1,肝素钠设6个浓度,最低浓度为0.39×105U·L-1;剂量间距均为2;采用碘化丙啶染色用流式细胞仪对L-929细胞进行细胞周期分析。结果达肝素钠和肝素钠对小鼠的LD50分别为4.44×105和3.68×105U·kg-1;对L-929细胞的IC50分别为1.42×106和3.54×105U·L-1。L-929细胞经达肝素钠处理后,G2/M期细胞百分率增加137.6%(P<0.01);经肝素钠处理后,G0/G1期细胞百分率增加33.8%(P<0.01)。结论 达肝素钠对小鼠及L-929细胞的毒性均小于肝素钠,达肝素钠和肝素钠对细胞周期的影响分别阻滞在G2/M期和G0/G1期。
达肝素钠;肝素钠;急性毒性;细胞毒性;细胞周期
普通天然肝素是从哺乳动物肠黏膜或肺等组织中提取的硫酸氨基葡聚糖,由糖醛酸和葡糖胺的衍生物构成的约32种二糖单位连接而成,属于多糖类物质。由于各种取代基的位置和数量不同,肝素的分子质量大小不一,5~30 ku。因此,普通天然肝素又称为未分级肝素[1]。未分级肝素于1916年被Mclean在肝组织中首次发现,自1935年开始作为抗凝血药物应用于临床,至今已近一个世纪。但普通天然肝素存在一个主要缺陷,在用药过多的情况下可致自发性出血,临床应用肝素注射液时,需监测活化部分凝血活酶时间[2]。
低分子肝素是上世纪70年代发展起来的一种新型抗凝血药物,是普通肝素的短链剂,由普通肝素经物理、化学或生物方法将其分级或降解,得到的具有较低相对分子质量的组分或片段,平均为3~8 ku。根据低分子肝素的来源、生产工艺和末端结构的不同,欧洲药典和美国药典对低分子肝素进行了分级,分为达肝素钠(dalteparin sodium)、依诺肝素钠(enoxaparin sodium)和那屈肝素钙(nadroparincalcium)等,它们的相对分子质量及其分布、硫酸化程度和抗凝活性均不相同。其中,达肝素钠是一种临床广泛使用的低分子肝素,系由猪肠黏膜制备的肝素钠通过可控亚硝酸解聚作用而产生的低分子肝素钠,平均为5.6~6.4 ku。达肝素钠与普通肝素钠相比具有更大的抗Ⅹa/抗Ⅱa值、更长的半衰期和更高的生物利用度等优势,因而二者在药理学及药代动力学等方面均存在一定的差异[3-4]。但目前国内有关达肝素钠的报道更多地集中在药效学,对二者的毒性比较研究未见报道。本研究将通过体内外方法对达肝素钠和普通肝素钠的毒性进行比较。
1 材料与方法
1.1 动物、细胞、试剂和主要仪器
SPF级KM小鼠,雌雄各半,体质量18~22 g,购于中国食品药品检定研究院实验动物资源中心,动物生产许可证号SCXK(京)2009-0017。小鼠饲养于该研究院实验动物房,实验动物饲养环境许可证号:SYXK(京)2011-0008,自然照明,12 h昼夜交替,温度为22~24℃,湿度为45%~60%,自由进食饮水。本研究所有实验动物操作均参照《中国食品药品检定研究院动物伦理法规》进行。L-929小鼠成纤维细胞,购于美国模式培养物寄存库(ATCC)。
达肝素钠和肝素钠由国内A厂家(因涉及厂家利益,此处隐去厂家名称,以A代号代替)提供,效价分别为1.38×105和2.02×105U·g-1;CCK-8试剂盒,北京盛世前尘生物科技有限公司;1640培养基、胎牛血清和0.25%胰酶-EDTA,美国Gibco公司;PBS,美国Hyclone公司;碘化丙啶(propidium iodide,PI)和RNA酶A,美国Sigma公司。FACS Calibur流式细胞仪,美国BD公司;3141CO2培养箱,美国Thermo公司;synergy HT酶标仪,美国BioTeK公司;CX41-32C02倒置显微镜,日本Olympus公司;AE240电子分析天平,瑞士Mettler公司;HFF-584电子天平,日本Tanita公司。
1.2 半数致死量法测定达肝素钠和肝素钠对小鼠的急性毒性
小鼠按体质量随机分6~7组,每个剂量组10只,雌雄各半。达肝素钠设6个剂量组,最低剂量为2.54×105U·kg-1,剂量间距为1.25;肝素钠设5个剂量组,最低剂量为2.05×105U·kg-1,剂量间距为1.25。正常对照组iv给予相应体积0.9%氯化钠溶液。达肝素钠和肝素钠组单次静脉注射给药,给药体积为20mL·kg-1。采用概率单位法(Bliss法)计算LD50[5-6]。
各组小鼠静脉注射受试物后4 h内严密观察小鼠毒性反应和死亡情况,每天上、下午各观察1次,连续观察14 d。观察指标包括小鼠外观、行为、分泌物、排泄物和死亡情况等。给药前及实验结束活杀小鼠前各称重1次,记录小鼠体质量变化。实验结束时,所有小鼠经吸入CO2活杀,进行大体解剖[7-8]。
1.3 CCK-8法测定L-929细胞存活及IC50的计算
达肝素钠设7个浓度,最低浓度为0.78× 105U·L-1,剂量间距为2.0;肝素钠设6个浓度,最低浓度为0.39×105U·L-1,剂量间距为2.0。将生长旺盛的L-929细胞消化后,调至1.5×107L-1细胞,接种到96孔板,每孔200 μL,置于37℃,5%CO2条件下培养。24 h后,弃去原培养基,加入含各浓度受试物(达肝素钠:0.78×105,1.56×105,3.12×105,6.25× 105,1.25×106,2.50×106和5.00×106U·L-1;肝素钠:0.39×105,0.78×105,1.56×105,3.12×105和6.25×105,1.25×106U·L-1)的培养基200 μL,继续培养48 h。每孔加入20 μL CCK-8溶液,37℃孵育4 h,使用酶标仪测定450 nm处各孔吸光度(absor⁃bance,A),计算细胞存活率。计算公式如下:细胞存活率(%)=给药组A450nm/正常对照组A450nm×100%,重复4次。采用Bliss法计算两种受试物的IC50[5-6]。
1.4 流式细胞仪测定细胞周期
生长旺盛的L-929细胞消化后,接种于直径60 mm的培养皿中,置于37℃,5%CO2条件下培养。24 h后,弃去原培养基,加入含达肝素钠(5.00×106U·L-1)或肝素钠(1.25×106U·L-1)的1640培养基,正常对照组加入完全培养基。继续培养24 h,收集细胞,逐滴加入无水乙醇固定细胞,置于-20℃过夜。细胞固定后,750×g离心5 min,弃上清,挥发乙醇。加入300 mL PBS重悬细胞,加入15 mL RNA酶A,使其终浓度为1 g·L-1,置37°C水浴锅中孵育1 h。最后加入200 mL PBS,混匀后加入PI 0.5 mL,使其终浓度为50 mg·L-1,30 min内使用流式细胞仪进行检测。
1.5 统计学分析
小鼠急性毒性实验和细胞毒性实验均使用SAS软件计算LD50和IC50;细胞毒性试验IC50采用配对t检验分析,P<0.05表示差异具有统计学意义;细胞周期实验结果以x±s表示,采用方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 达肝素钠和肝素钠对小鼠的急性毒性
如表1所示,分别给予相应剂量肝素钠和达肝素钠后,各组小鼠均出现相似的毒性反应,包括竖毛、震颤、呼吸急促、自主活动减少、翻正反射消失、二便失禁、抽搐和部分小鼠死亡。给予肝素钠或达肝素钠后,小鼠死亡的发生可持续至给药后4~5 d。死亡小鼠经大体解剖检查,可见胸腔和/或腹腔出血。存活至实验结束的各组小鼠体质量无显著性差异;大体解剖肉眼未见异常。Bliss法计算半数致死量(LD50),达肝素钠为4.44×105U·kg-1(3.22 g·kg-1),肝素钠3.68×105U·kg-1(1.82 g·kg-1),表明达肝素钠的小鼠体内毒性小于肝素钠。

Tab.1 LD50of dalteparin sodium and heparin sodium in mice
2.2 达肝素钠和肝素钠对L-929细胞存活的影响
各浓度达肝素钠和肝素钠处理L-929细胞48h后的细胞存活率如图1所示,经Bliss法计算,达肝素钠和肝素钠对L-929细胞的IC50分别为1.42×106U·L-1和3.54×105U·L-1,达肝素钠处理细胞的IC50显著高于肝素钠(P<0.01)。提示达肝素钠对L-929的细胞毒性低于达肝素钠。
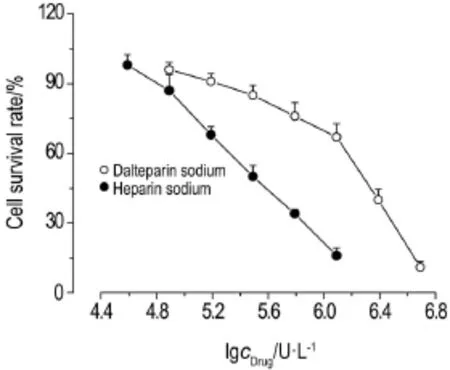
Fig.1 Effect of dalteparin sodium and heparin sodium on survival rate of L-929 cells.L-929 cells were treated with dalteparin sodium or heparin sodium for 48 h.±s,n=4.
2.3 达肝素钠和肝素钠对L-929细胞周期分布的影响
PI染色法测定细胞周期结果(表2)表明,与正常对照组比较,达肝素钠作用于L-929细胞后,G2/M期细胞百分率增加137.6%(P<0.01),G0/G1期及S期细胞百分率分别减少49.9%(P<0.01)和15.1%(P<0.05)。肝素钠作用于L-929细胞后,G0/G1期百分率较正常对照组增加33.8%(P<0.01),S期及G2/M期细胞百分率分别减少21.5%(P<0.01)和27.3%(P<0.01)。
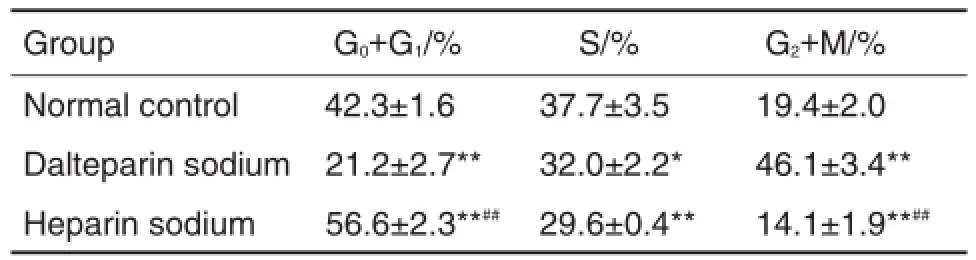
Tab.2 Effect of dalteparin sodium and heparin sodium on percentage of cells at different cycle phases of L-929 cells detected by PI flow cytometry
3 讨论
体内急性毒性实验结果表明,达肝素钠的毒性小于肝素钠。急性毒性实验死亡小鼠经大体解剖可见胸腔和腹腔出血。因而,推测达肝素钠的低毒性与其降低出血风险相关。达肝素钠与肝素钠毒性比较结果及其可能原因,均与预期一致,亦符合其药物特性。
两药处理小鼠成纤维细胞L-929结果显示,达肝素钠的IC50显著高于肝素钠,表明达肝素钠的体外细胞毒性低于肝素钠,与体内急性毒性的实验结果一致。细胞的存活是通过细胞周期的运行来实现的,细胞周期包括G0/G1期(细胞分裂间期/DNA合成前期)、S期(DNA合成期)及G2/M期(DNA合成后期/分裂期);G0/G1期细胞比例主要反映处于分裂间期的细胞,S期和G2/M期细胞比例主要反映处于分裂增殖期的细胞。流式细胞仪细胞周期检测结果显示,两药均对细胞周期产生影响。达肝素钠干预L-929细胞后,G2/M期细胞显著增多,G0/G1期及S期细胞均不同程度减少,表明达肝素钠将细胞阻滞于G2/M期;肝素钠干预L-929细胞后,G0/G1期细胞显著增多,表明肝素钠将细胞阻滞于G0/G1期;二者通过影响细胞周期的不同阶段阻止了细胞的正常分裂过程。分析其原因可能与它们的结构、细胞半衰期及生物利用度的差异有关,但仍需进一步探讨。
虽然,普通肝素在临床使用已>50年,但由于可导致自发性出血这一严重缺陷,临床应用受到限制。由于达肝素钠相对普通肝素而言具有更高抗Ⅹa和抗Ⅱa活性比,抗血栓作用较强、抗凝作用较弱,因而临床使用达肝素钠可减少潜在出血及诱发血小板减少症的风险,因而其临床应用日益增多,且更为安全有效[3,9-10]。本研究通过小鼠体内实验和细胞实验对两药的毒性进行比较,为了解毒性提供参考,亦可为达肝素钠的临床安全用药提供毒理学理论依据。
[1]Ji SL,Sang Q,Zhang TM.The research progress in heparin source,control,structure analysis and relationship between structure and biological activity[J].Chin Pharm J(中国药学杂志),2012,47(9):660-663.
[2]Xiong LH.Low molecular weight heparin technology platform,varieties and market prospect[J].Mod Bus Trade Ind(现代商贸工业),2012,24:235-236.
[3]Pei F.Clinical application of low molecular weight heparin[J].Clin Medication J(临床药物治疗杂志),2009,7(4):40-44.
[4]Li J,Wang Y,Li YY,Fan HH.Quality specification study of low molecular weight heparin[J].Chin Pharm J(中国药学杂志),2014,49(24):2210-2218.
[5]Zhou HJ,Shen YR,Li JS.Statistical methods for biological assays[M]//Zhou HJ.Biological Assays for Drug(药品生物检定).Beijing:People′s Medical Publishing House,2005:148-151.
[6]Tan DJ,Liu T,Qin L,Hu JT.Calculation of 50% reaction dosage and effect comparison[M]//Tan DJ,Ma SC.Statistic Applications in Biopharma⁃ceutical Regulatory Science(药品监督与检定中的统计学应用).Beijing:China Science and Technol⁃ogy Press,2011:420-435.
[7]Zhao P,Xu J,Chen XB,Huang HL.Acute toxicity of(E)-4-(2-(4-chlorophenoxy)-2-methylpropanoyloxy)-3-methoxyphenyl acrylic acid in mice and longterm toxicity in rats[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2011,25(4):391-396.
[8]Lou XW,Luan Y,Jiang BH,Chen XY,Zhong DF. Acute toxicity of sodium houttuyfonate in BALB/c mice and its injury to cells[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2012,26(5):653-657.
[9] Zhang Z.The structural characterization of low molecular weight heparin[J].Chin J new drug(中国新药杂志),2014,23(8):901-905.
[10] Sang Q,Cui HF,Ji SL.Research progress in heparin anticoagulants optimizing[J].ChinJ Biochem Pharm(中国生化药物杂志),2012,33(2):188-191.
Comparison of toxicity of dalteparin sodium and heparin sodium of mice in vivo and in vitro
ZHANG Yuan1,NA Tao2,WU Yan-lin1,YOU Gan-hua3,LIU Qian1,HE Qing1,GAO Hua1
(1.Pharmacology Division,2.Cell Collection and Research Center,National Institute for Food and Drug Control,Beijing 100050,China;3.Pharmacology Division,Guizhou Institute for Food and Drug Control,Guiyang 550004,China)
OBJECTIVE To investigate the toxicity of dalteparin sodium and heparin sodiumin vitroandin vivo.METHODS The median lethal dose(LD50)of these two drugs in mice was determined.The proliferation activity of L-929 cells treated with dalteparin sodium(0.78×105-5.00×106U·L-1)or heparin sodium(0.39×105-1.25×106U·L-1)for 48 h was detected by CCK8 kit.The half maximal inhibitory concen⁃tration(IC50)of L-929 cells was calculated.The cell cycle was analyzed by flow cytometry.RESULTS LD50of mice with acute toxicity induced by dalteparin sodium or heparin sodium was 4.44×105and 3.68× 105U·kg-1,respectively.IC50of L-929 cells treated with them was 1.42×106and 3.54×105U·L-1,respec⁃tively.The percentage of G2/M-phase(137.6%,P<0.01)and G0/G1-phase(33.8%,P<0.01)cells was significantly increased after the treatment with dalteparin sodium or heparin sodium.CONCLUSION The toxicity of dalteparin sodiumin vivoandin vitrois not so strong as that of heparin sodium.Dalteparin sodium and heparin sodium arrest L-929 cells at G2/M-phase and G0/G1-phase,respectively.
dalteparin sodium;heparin sodium;acute toxicity;cytotoxicity;cell cycle
GAO Hua,E-mail:huag55@163.com,Tel:(010)67095231,Fax:(010)67058426
R99
A
1000-3002-(2016)11-1172-04
10.3867/j.issn.1000-3002.2016.11.007
2015-07-22接受日期:2016-06-17)
(本文编辑:贺云霞)
张 媛,女,副研究员,药理学硕士,主要从事药检和药理学研究。
高 华,E-mail:huag55@163.com,Tel:(010)67095231,Fax:(010)67058426

